Биодеградация цефтриаксона в процессе биологической очистки сточных вод
Автор: Мащенко Зинаида Евгеньевна, Шафигулин Роман Владимирович, Шаталаев Иван Федорович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Промышленная экология
Статья в выпуске: 1-8 т.13, 2011 года.
Бесплатный доступ
В работе представлены данные о биодеструкции цефтриаксона микроорганизмами активного ила в зависимости от концентрации и времени инкубации в аэробно-анаэробных условиях. Установлена закономерность трансформации Z-изомер цефтриаксона в сопутствующую примесь (Е-изомер) с течением времени.
Цефтриаксон, активный ил, биодеструкция
Короткий адрес: https://sciup.org/148199969
IDR: 148199969 | УДК: 615.33:574.522
Текст научной статьи Биодеградация цефтриаксона в процессе биологической очистки сточных вод
В конце 1990-ых годов в зарубежной литературе большое внимание уделялось проблеме обнаружения фармацевтических препаратов в окружающей среде. Во многих странах мира лекарственные вещества были найдены в сточных водах, поступающих на городские очистные сооружения [5, 7]. В процессе очистки сточных вод лекарственные средства удаляются неэффективно и при поступлении в природные водоисточники могут негативно влиять на состояние живых организмов [8]. В этой связи в последние годы проводится много исследований, связанных с изучением деструкции фармацевтических препаратов под действием различных факторов. В качестве способов воздействия применяют физико-химические методы (хлорирование, ультроз-вук, УФ-облучение, озонирование), а также методы биологической очистки [9, 11]. Установлено, что многие виды микроорганизмов способны переработать лекарственные вещества. Диклофенак, напроксен и карбамазепин были полностью удалены из опытных образцов двумя видами грибов Bjerkandera sp. R1 and Phanerochaete chrysosporiu, а актинобактерии рода Rhodococcus утилизировали лекарственные средства, производные ароматических углеводородов и гетероциклических азотсодержащих соединений [1, 10]. Однако не все группы лекарственных веществ могут быть удалены в процессе биологической очистки.
Особую проблему представляют антибиотики, фармакологическое действие которых проявляется как противомикробное. Так, в процессе биологической очистки содержание макролидов
уменьшилось на 90%, а тетрациклинов – на 75% [4, 6].
Цель исследования: определение возможности биодеструкции цефтриаксона микроорганизмами активного ила в процессе биологической очистке сточных вод.
Материалы и методы исследования. Объектом исследования служил антибиотик группы цефалоспоринов – цефтриаксон. Выбранный антибиотик является цефалоспорином третьего поколения широкого спектра действия, химическое строение которого представлено на рисунке 1.
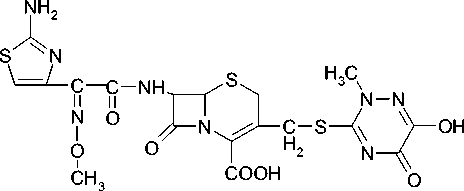
Рис. 1. Химическая структура цефтриаксона
В экспериментах использовали активный ил регенератора первой секции аэраторов городской станции МП «Самараводоканал». Инкубацию осуществляли в течение трех часов при температуре 200С в аэробно-анаэробных условиях; отбор проб проводили через каждый час. Концентрацию цефтриаксона варьировали в количестве 10, 30, 50 и 70 мг/г биомассы. Содержание цефтриаксона устанавливали методом обращено-фазовой высокоэффективной жидкостной хроматографии на «Милихром -1» с УФ-детектором с рабочей длиной волны 254 нм. Использовали колонку Ultrasep ES 100 RР18 (длина 120 мм), заполненную сорбентом С18 с размером частиц 4 мкм. В качестве подвижной фазы применяли ацетонитрил/вода/ацетат аммония в соотношении 10/88/2 об.%. Для обработки результатов использовали программу «МультиХром» 3,0v (Ampersand LTd). В качестве контроля применяли водные растворы антибиотика с такими же концентрациями. Контрольные образцы служили для того, чтобы подтвердить отсутствие пассивного гидролиза или фотолиза цефтриаксона. Изменение содержания цефтриаксона и его примеси рассчитывали как процентное отношение площади пиков определяемых изомеров на хроматограмме опытной пробы к площади пиков на хроматограме контрольной пробы.
Результаты и их обсуждение. Примеры ВЭЖХ-хроматограмм образцов активного ила с различными концентрациями антибиотика через определенные промежутки времени представлены на рис. 2. На полученных хроматограммах были идентифицированы 2 пика: 1 – Е-изомер цефриаксона (примесь), 2 – цефтриаксон (Z-изомер).
А (1 час)
А (2 часа)
mV
10 2
5 1
ch1 i I i h i i i i i i i i i i i i i
0ch11 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 min
А (3 часа)
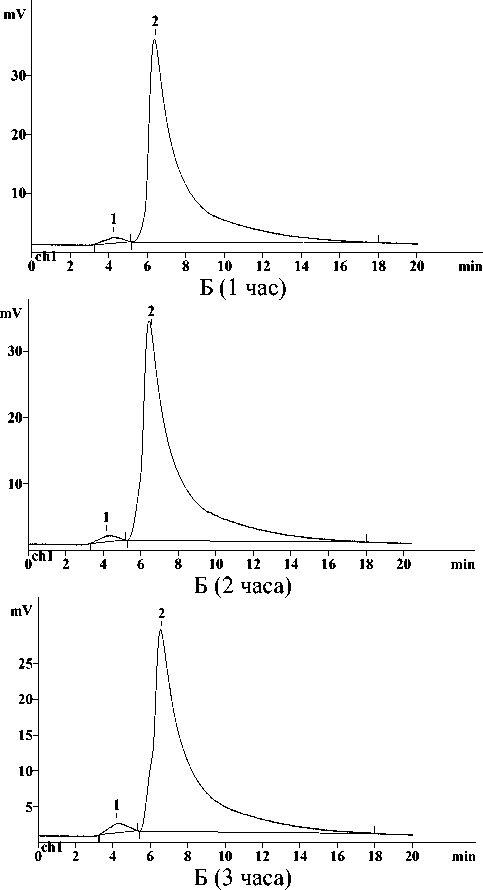
Рис. 2. Хроматограммы ВЭЖХ-анализа образцов активного ила с концентрацией цефтриаксона 10 мг/г (А) и 70 мг/г биомассы (Б)
Динамика изменения содержания Z- и Е-изомеров цефтриаксона в процессе биологической очистки приведена в таблице 1 и 2 соответственно. В течение первого часа инкубации отмечали уменьшение содержания цефтриаксона во всех исследуемых пробах в среднем на 30%. Двухчасовая экспозиция образцов с концентрацией 30, 50 и 70 мг/г биомассы приводила к усилению процессов биодеструкции антибиотика. Продолжение инкубации сопровождалось устойчивым снижением содержания исследуемого вещества во всех опытных пробах. Во всех пробах наблюдали повышение содержания Е-изомера в течение всего времени инкубации. Значительное увеличение концентрации оказалось в образцах с содержанием цефтриаксона 10 мг/г биомассы.
Таблица 1. Изменение содержания Z-изомера, в %
|
Концентрация антибиотика, мг/г биомассы |
Время инкубации, час |
||
|
1 |
2 |
3 |
|
|
10 |
-37,96 |
-34,82 |
-53,62 |
|
30 |
-29,11 |
-39,59 |
-41,53 |
|
50 |
-27,85 |
-32,03 |
-43,00 |
|
70 |
-34,22 |
-35,97 |
-41,51 |
Таблица 2. Изменение содержания Е-изомера, в %
|
Концентрация антибиотика, мг/г биомассы |
Время инкубации, час |
||
|
1 |
2 |
3 |
|
|
10 |
598,78 |
797,08 |
968,32 |
|
30 |
123,76 |
317,11 |
319,26 |
|
50 |
208,35 |
345,32 |
495,33 |
|
70 |
244,67 |
329,62 |
407,37 |
В соответствии с требованиями нормативной документации на фармацевтическую субстанцию содержание Е-изомера не должно превышать 0,5% [3]. В контрольных образцах при различных концентрациях на протяжении всего времени инкубации содержание Е-изомера варьировало 0,25-0,55%, тогда как в пробе (10 мг/г) количество Е-изомера увеличивалось от 6,27% (1 час) до 7,17% (2 часа) и 10,37% (3 часа), а в пробе (70 мг/г) – от 1,86% (1 час) до 1,70% (2 часа) и 2,54% (3 часа).
Выводы. Проведенные эксперименты показали положительную динамику биодеструкции цефтриаксона водными микроорганизмами. Одним из механизмов биологической очистки является изомеризация – трансформация Z-изомера в менее активную форму (Е-изомер). При увеличении концентрации антибиотика процесс изомеризации замедляется, на это также свидетельствует уменьшение активности ферментов микроорганизмов активного ила [2]. Полученные результаты указывают на возможность и целесообразность биологической очистки воды, содержащей цефтриаксон, на городских станциях аэрации.
Список литературы Биодеградация цефтриаксона в процессе биологической очистки сточных вод
- Вихарева, Е.В. Биодеструкция парацетамола актинобактериями рода Rhodococcus sensustricto/Е.В. Вихарева, И.Б. Ившина, Л.А. Чекрышкина и др.//XI Рос. нац. конгр.: Человек и лекарство. -М., 2004. С. 16-17.
- Мащенко, З.Е. Влияние цефтриаксона на функциональное состояние микросообществ модельных гидроэкосистем/З.Е. Мащенко, Р.В. Шафигулин, И.Ф. Шаталаев//Известия Самарского научного центра Российской академии наук. 2011. Т. 13, №1(6). С. 1164-1466.
- ФСП 42-9078-08. Цефтриаксона натрия субстанция -порошок стерильный.
- Arikan, O.A. Degradation and metabolization of chlortetracycline during the anaerobic digestion of manure from medicated calves/O.A. Arikan, J. Hazard// Mater. 2008. № 158. Р. 485-490.
- Buser, H-R. Occurrence of the pharmaceutical drug clofibric acid and the herbicide mecoprop in various Swiss Lakes and in the North Sea/H-R Buser, M.D. Müller, N. Theobald//Environ. Sci. Technol. 1998. Vol. 32. № 1. Р. 188-192.
- Chelliapan, S. Performance of an up-flow anaerobic stage reactor (UASR) in the treatment of pharmaceutical wastewater containing macrolide antibiotics/S. Chelliapan, T. Wilby, P.J. Sallis//Water Res. 2006. № 40. Р. 507-516.
- Holm, J.V. Occurrence and distribution of pharmaceutical organic compounds in the groundwater downgradient of a landfill (Grinsted, Denmark)/J.V. Holm, K. Rügge, P.L. Bjerg et al.//Environ. Sci. Technol. 1995. Vol. 29, № 5. Р. 1415-1420.
- Huber, M.M. Oxidation of pharmaceuticals during ozonation of municipal wastewater effluents: Apilot study/M.M. Huber, A. Yobel, A. Joss et al.//Environ. Sci. and Technol. 2005. Vol. 39, № 11. Р. 4290-4299.
- Jatindra, N.B. Degradation of Antibiotics (Trimethoprim and Sulphamethoxazole) Pollutants Using UV and TiO2 in Aqueous Medium/N.B. Jatindra, M. Yukihiro/Modern Applied Science. 2009. Vol. 3, №. 2. Р. 3-13.
- Rodarte-Morales, A.I. Evaluation of two fungal strains for the degradation of pharmaceutical and personal care products (PPCPs)/A.I. Rodarte-Morales, M.T. Moreira, G. Feijoo et al.//http://www.aidic.it/ibic2010/webpapers/51Rodarte-Morales.pdf
- Weilin, G. Sonochemical degradation of the antibiotic cephalexin in aqueous solution/G. Weilin, W Hongzhi, S. Yahui et al./Water SA. 2010. Vol. 36, No. 5. Р. 651-654.


