Биодеградируемый сосудистый протез, модифицированный RGD-пептидами: экспериментальное исследование
Автор: Кривкина Е.О., Сильников В.Н., Миронов А.В., Великанова Е.А., Сенокосова Е.А., Глушкова Т.В., Акентьева Т.Н., Кудрявцева Ю.А., Антонова Л.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 т.34, 2019 года.
Бесплатный доступ
Цель исследования: изучить эффективность модифицирования RGD-пептидами биодеградируемых сосудистых протезов малого диаметра в зависимости от вида линкера и конфигурации RGD.Материал и методы. Изготовлены трубчатые каркасы диаметром 1,5 и 4,0 мм методом электроспининга из полигидроксибутирата/валерата (PHBV) и поликапролактона (PCL). Проведена модификация графтов PHBV/PCL RGD-пептидами. В экспериментах in vitro исследованы степень гемолиза эритроцитов и адгезия тромбоцитов и эндотелиальных клеток при контакте с модифицированной поверхностью. Изучены физико-механические свойства и структура поверхности графтов до и после модифицирования. Сосудистые протезы PHBV/PCL и PHBV/PCL/RGD имплантированы в брюшную аорту крыс сроком на 1 и 3 мес. Проведено изучение эксплантированных образцов с помощью конфокальной микроскопии и гистологических методов исследования.Результаты. Результаты физико-механических испытаний показали статистически значимое снижение прочностных свойств PHBV/PCL/RGD графтов относительно немодифицированных аналогов. Обнаружено статистически значимое повышение уровня агрегации тромбоцитов на модифицированных графтах. Уровень адгезии эндотелиальных клеток на поверхности модифицированных матриксов был больше, чем на немодифицированных. Краткосрочная имплантация графтов на 1 и 3 мес. показала, что модифицированные графты обладали более высокой проходимостью и меньшей склонностью к кальцификации в сравнении с немодифицированными аналогами. Иммунофлуоресцентное исследование определило явное превосходство модифицированных сосудистых графтов в плане стимулирования формирования зрелого эндотелиального монослоя. Выявлено, что более длинный линкер 4,7,10-триокса-1,13-тридекандиамин увеличивает биодоступность RGD-пептидов, а использование для модифицирования поверхности графтов RGDK и c[RGDFK] стимулирует раннюю эндотелизацию внутренней поверхности имплантатов и снижает склонность к кальцификации стенки протезов, что в совокупности повышает проходимость имплантированных протезов.Заключение. В ходе краткосрочной имплантации биодеградируемых сосудистых протезов, модифицированных RGD-пептидами, графты с RGDK и с[RGDFK], прикрепленными к поверхности протезов через линкер 4,7,10-триокса-1,13-тридекандиамин, показали лучшие результаты в плане адгезии и поддержания жизнеспособности эндотелиальных клеток in vitro и эндотелизации in vivo, обладали высокой проходимостью после имплантации в сосудистое русло мелких лабораторных животных и меньшей склонностью к кальцификации.
Биодеградируемые сосудистые протезы, электроспиннинг, rgd-пептиды
Короткий адрес: https://sciup.org/149125289
IDR: 149125289 | УДК: 616.13/14-089.844:60-7:57.089.67 | DOI: 10.29001/2073-8552-2019-34-2-129-137
Текст научной статьи Биодеградируемый сосудистый протез, модифицированный RGD-пептидами: экспериментальное исследование
С каждым годом в мире возрастает распространенность сердечно-сосудистых заболеваний [1]. Отсутствие протезов для замещения артерий малого диаметра является одной из нерешенных проблем в кардиохирургии. Тканевая инженерия многообещающее направление медицины для изготовления протезов малого диаметра, объединяющее в себе подходы биоинженерии и клеточной биологии [2, 3]. С помощью данных подходов можно создать функционально активный биодеградируемый сосудистый протез малого диаметра, обладающий высокой проходимостью, атромбогенностью и биосовместимостью, способный со временем замещаться клетками и тканями пациента, формируя на своей основе новый сосуд. Раннее формирование полноценного эндотелиального монослоя на внутренней поверхности графта определяет долгосрочную проходимость сосудистого протеза. В последние годы разработан ряд стратегий для придания внутренней поверхности сосудистых графтов способности адгезировать на своей поверхности эндотелиальные клетки [4].
Одним из перспективных способов модифицирования полимерных каркасов для увеличения их биосовместимости является иммобилизация на поверхности каркасов RGD-пептидов [5]. Последовательность аргинин-глицин-аспарагиновая кислота (RGD) представляет собой сайт клеточной адгезии, присутствующий на многих белках экстрацеллюлярного матрикса [6] и является лигандом для интегринов рецепторов, ответственных за клеточную адгезию, миграцию, пролиферацию, дифференцировку и выживание [79].
Цель исследования: изучить эффективность модифицирования RGD-пептидами биодеградируемых сосудистых протезов малого диаметра в зависимости от вида линкера и конфигурации RGD.
Материал и методы
Сосудистые графты Ø 1,5 и 4 мм изготавливали методом электроспининга на аппарате Nanon-01A (MECC CO) из смеси полигидроксибутирата/валерата (PHBV, Sigma Aldrich, США) и поликапролактона (PCL, Sigma Aldrich, США) в трихлорметане (МиниМед, Россия). Модифицирование RGD-пептидами проводили в несколько этапов.
Для модифицирования поверхности нетканых матриксов в качестве линкера использовали амины (Sigma Aldrich, США): гексаметилендиамин - (A1) или 4,7,10-trioxa-1,13-тридеканди-амин - (A2), а также глутаровый альдегид, нингидрин, аскорбиновую кислоту.
Модифицирование поверхности PHBV/PCL графтов осуществляли RGD содержащими пептидами, синтезированными в ООО НаноТех-С (Россия): RGDK – P1; AhRGD – P2; циклический пептид c[RGDFK] – P3. Аминолиз графтов проводили в течение 60 мин для А1 и 30 мин для А2. Далее графты отмывали смесью изопропанол:вода 1:1, бидистиллированной водой, 0,1%-ым раствором тритон Х-100, бидистиллированной водой. После этого образцы обрабатывали 2%-ым раствором глутарового альдегида (Sigma Aldrich, США) в воде в течение 3 ч при 24 °С, отмывали бидистиллированной водой, помещали в раствор 0,2 мг/мл одного из пептидов (P1, P2 или P3) в 50 мМ карбонатном буфере (рН=8,5), содержащем 2,5 мМ цианоборгидрид натрия, выдерживали в течение 4 ч при 24 °С. После присоединения пептида графты отмывали 0,1%-ым раствором тритон Х-100 и затем бидистиллированной водой.
Качество проведенного модифицирования оценивали с помощью нингидринового теста и посредством определения аргинин-содержащего пептида [9, 10].
Таким образом, было получено 6 видов графтов с разной модификацией: A1P1, А1Р2, А1Р3, А2Р1, А2Р2, А2Р3.
Оценка физико-механических свойств
Изучение физико-механических свойств сосудистых графтов PHBV/PCL и PHBV/PCL/RGD проводили в условиях одноосного растяжения в соответствии с ГОСТ 270-75. В качестве контроля использовали нативную внутреннюю грудную артерию человека (a.mammaria). Испытания проведены на универсальной испытательной машине серии Z (Zwick/Roell, Германия).
Для анализа гемосовместимости полимерных каркасов была проведена оценка гемолиза эритроцитов, адгезии и агрегации тромбоцитов, адгезии и жизнеспособности колониеформирующих эндотелиальных клеток.
Оценка гемолиза эритроцитов
Для изучения степени гемолиза эритроцитов использовали свежую донорскую кровь, добавляя в нее цитрат натрия. Образцы помещались в бюксы с физиологическим раствором, которые ставили в термостат при 37 °С. Для положительного и отрицательного контроля применяли физиологический раствор и дистиллированную воду. После инкубации в бюксы добавляли цитратную кровь и снова помещали в термостат при 37 °С. После инкубации производили отбор растворов из бюксов в соответствующие пробирки с последующим центрифугированием с целью осаждения эритроцитов. Оптическую плотность полученных растворов измеряли на спектрофотометре GENESYS 6 (Thermo SCIENTIFIC, США).
Степень гемолиза Н (%) определяли по следующей формуле:
D -D
Н= —--—x^F, , Dp,,-D„ где Dt - оптическая плотность пробы, инкубируемой с исследуемым материалом; Dne - оптическая плотность положительного контроля; Dрe – оптическая плотность пробы после 100%-го гемолиза.
За полное отсутствие гемолиза принимали среднее значение показателя оптической плотности при измерении физиологического раствора с кровью (положительный контроль), которое было равно 0. За 100%-й гемолиз принимали среднее значение оптической плотности прибора при измерении дистиллированной воды с кровью (отрицательный контроль).
Оценка агрегации тромбоцитов
Исследование агрегации тромбоцитов после контакта с исследуемым материалом проводили согласно стандарту ISO 10993.4. Для этого использовали свежую донорскую кровь, в которую добавляли цитрат натрия. С целью получения обогащенной тромбоцитами плазмы (ОТП) проводили центрифугирование крови. Бедную тромбоцитами плазму (БТП) получали при помощи повторного центрифугирования ОТП. БТП использовали для калибровки прибора. В качестве положительного контроля использовали интактную ОТП. Измерения осуществляли в спонтанном режиме без индукторов агрегации. Для восстановления уровня ионов Са+2 в цитратной крови применяли раствор СаС12 с молекулярной массой 0,025 М, после чего производили измерения. Соотношение пробы и реагента составило 250 мкл ОТП + 25 мкл СаС12. Время контакта исследуемых образцов с ОТП составило 3 мин [11– 13]. Измерение максимума агрегации тромбоцитов крови проводили с помощью полуавтоматического 4-канального анализатора агрегации тромбоцитов АРАСТ 4004 (LABiTec, Германия).
Оценка адгезии и жизнеспособности колониеформирующих эндотелиальных клеток
Для культивирования на поверхности биодеградируемых нетканых матриксов использованы колониеформирующие эндотелиальные клетки человека (КФЭК), полученные по оригинальному протоколу [14].
Образцы стерильных матриксов PHBV/PCL и PHBV/PCL/RGD фиксировали на дно стерильных 24-луночных культуральных планшетов внутренней поверхностью вверх. На образцы матриксов вносили по 2,5x10 5 клеток и культивировали в течение 3 суток. Смену среды проводили ежедневно.
Абсолютное количество клеток на 1 мм2 поверхности, относительное содержание живых и погибших клеток на матриксах оценивали с помощью флуоресцентной микроскопии на инвертированном микроскопе Axio Observer Z1 (Carl Zeiss, Германия), предварительно окрашивая клетки на матриксах ядерными красителями этидиумом бромидом (Sigma Aldrich, США; оранжевое окрашивание ядер погибших клеток) и Hoechst 33342 (Sigma Aldrich, США; синее окрашивание ядер всех адгезированных клеток). Относительное количество мертвых клеток высчитывали по формуле: абс. кол-во мертвых клеток 100% / абс. кол-во всех адгезированных клеток. Относительное количество живых клеток определяли путем вычитания доли мертвых клеток из 100% адгезированных клеток.
Изучение адгезии тромбоцитов к поверхности матриксов методом сканирующей электронной микроскопии (СЭМ)
Метод оценки степени адгезии тромбоцитов крови к поверхности исследуемых материалов основан на визуальной оценке степени трансформации адгезированных тромбоцитов, а также их количественной оценке [15].
Образцы полимерных графтов размером 0,5 см2 инкубировали в обогащенной тромбоцитами плазме, полученной из свежей цитратной донорской крови посредством центрифугирования. После инкубирования образцы промывали фосфатно-солевым буферным раствором (PBS, pH-7,4) для удаления неадсорбированных компонентов плазмы. Далее образцы фиксировали в 2%-ом растворе глутарового альдегида, промывали PBS и обезвоживали в серии спиртов с восходящей концентрацией от 30 до 100% (30, 50, 70, 80 и 100%). После обезвоживания образцы досушивали при комнатной температуре. Далее образцы монтировали на специальные столики с помощью углеродного скотча, после чего на их поверхности формировали токопроводящее золото-палладиевое покрытие при помощи вакуумной установки Emitech SC 7640 (Quorum Technologies, Англия). Оценку степени адгезии тромбоцитов осуществляли с помощью сканирующего электронного микроскопа S-3400N (Hitachi, Япония) при увеличении x2000. Адгезивную способность поверхности материалов оценивали по индексу деформации тромбоцитов, который рассчитывали по формуле:
Индекс деформации = (Количество типа I × 1 + количество типа II x 2 + количество типа III х 3 + количество типа IV x 4 + количество типа V × 5) / общее количество тромбоцитов.
Изучение адгезии эндотелиальных клеток к поверхности матриксов методом СЭМ
Пробоподготовка клеточно-заселенных образцов графтов включала фиксацию образцов в 1%-ом растворе глутарового альдегида (Sigma Aldrich, США) с последующей постфиксацией в растворе 1%-го тетраоксида осмия (Serva Electrophoresis, Германия). Далее осуществляли дегидратацию образцов в спиртах восходящей концентрации от 50 до 90%. После процесса досушивания в термостате при температуре 37 °С образцы монтировали на специальные столики и методом ионного распыления формировали на их поверхности токопроводящее (золото-палладиевое) покрытие толщиной до 30 нм, используя вакуумный пост Emitech SC 7640 (Quorum Technologies, Англия). Исследование поверхности образцов проводили на сканирующем электронном микроскопе S-3400N (Hitachi, Япония).
Оценка проходимости сосудистых графтов, имплантированных в брюшную аорту крыс
Для выявления наиболее действенного сочетания амина и RGD-содержащего пептида, использованных для модифицирования полимерных графтов, сосудистые протезы PHBV/PCL 0 1,5 мм, немодифицированные и модифицированные различными RGD-пептидами, имплантировали в брюшную часть аорты самцов крыс популяции Wistar массой тела 400–450 г сроком на 1 и 3 мес. Опыты проводили с соблюдением принципов гуманного обращения с животными, регламентированных требованиями Европейской конвенции (Страсбург, 1986). Крыс содержали при свободном доступе к пище и воде на рационе питания. Введение животных в наркоз осуществляли 3%-ым изофлураном, операцию проводили при ингаляционном наркозе 1,5%-ым изофлураном. Сосудистые протезы PHBV/PCL ( n =12) и PHBV/PCL/RGD [(A1P1 ( n =12); A1P2 ( n=1 2); A1P3 ( n =12); A2P1 ( n=12 ); A2P2 ( n =12); A2P3 ( n =12)] диаметром 1,5 мм и длиной 10 мм имплантировали в брюшную часть аорты по принципу «конец в конец». Для наложения анастомозов использовали нить Prolene 8-0. Для ушивания мягких тканей передней брюшной стенки применяли Лавсан 4/0.
По истечении срока имплантации проведено гистологическое исследование срезов эксплантированных сосудистых протезов с прилежащими участками аорты. Окрашивание срезов осуществляли гематоксилином и эозином (BioVitrum, Россия), по Ван-Гизону (BioVitrum, Россия), орсеином (BioVit-rum, Россия), ализариновым красным С (ЛенРеактив, Россия) и ядерным флуоресцентным красителем Dapi (Sigma, США).
Иммунофлуоресцентное исследование графтов проводили методом сканирующей лазерной микроскопии на микроскопе LSM 700 (Carl Zeiss, Германия) с предварительной окраской специфическими флуоресцентными антителами на CD 34, CD 31, vWF, collagen I и IV типа.
Результаты и обсуждение
Результаты физико-механических испытаний показали статистически значимое снижение прочностных свойств графтов после модификации RGD вне зависимости от вида использованного линкера и пептида (табл. 1). Снижение прочностных свойств относительно немодифицированных аналогов наблюдали как по силе, так и по напряжению. Прочность сосудистых графтов с A1 снижалась в среднем в 4,1 раза относительно не-модифицированных аналогов и в 2,6 раза - относительно прочности a.mammaria (p<0,05). Прочность графтов с A2 снизилась в 3,2 раза относительно немодифицированных аналогов и в 2 раза - относительно прочности a.mammaria (p<0,05). Сила, приложенная к образцу до начала его разрушения, снизилась в графтах с A1 в среднем в 3,2 раза, с A2 – в среднем в 2,4 раза относительно немодифицированных аналогов, но статистически значимо не отличалась от значений a.mammaria. В графтах с A2 сила, приложенная к образцу до начала разрушения, была в 2,4 раза ниже, чем в немодифицированных аналогах (p<0,05), но статистически значимо не отличалась от a.mammaria.
Жесткость полимерных графтов, выраженная через модуль Юнга, не менялась после проведенного модифицирования и была почти в 9 раз выше, чем у a.mammaria (табл. 1).
Таблица 1. Физико-механические свойства полимерных графтов
Table 1. Physico-mechanical properties of polymer grafts
|
Вид образца |
n |
Предел прочности, MPa М (25-75%) min-max |
Сила, приложенная к образцу до начала разрушения, Н М (25-75%) min-max |
Относительное удлинение, % М (25-75%) min-max |
Емод, MPa М (25-75%) min -max |
|
A.mammaria |
6 |
2,48 (1,36-3,25) 1,07-6,52 |
0,92 (0,59-1,72) 0,39-2,82 |
29,72 (23,51-39,62) 22,0-50,88 |
2,42 (1,87-3,19) 1,53-3,34 |
|
PHBV/PCL |
6 |
3,85 (2,88-4,54) 2,38-4,62 |
3,05 (2,59-3,34) 2,30-3,69 # |
102,7 (79,37-106,3) 74,92-119,23 # |
21,8 (19,2-25,2) 18,2-27,5 # |
|
А1Р1 |
6 |
1,29 (0,65-1,42) 0,51-1,58* |
1,49 (0,67-1,59) 0,53-1,74* |
127,39 (31,5-135,52) 17,23-182,52 |
21,4 (10,2-24,8) 8,46-25,3 # |
|
А1Р2 |
6 |
0,81 (0,77-1,1) 0,68-1,2* # |
0,69 (0,67-1,15) 0,61-1,21* |
83,76 (81,2-132,8) 31,47-154,3 # |
11,8 (11,1-17,5) 9,64-18,3* # |
|
А1Р3 |
6 |
0,72 (0,45-0,89) 0,3-1,0* # |
0,64 (0,42-0,9) 0,28-0,97* |
84,0 (17,26-99,83) 9,19-148,9 |
8,11 (6,86-12,4) 5,05-12,7* # |
|
А2Р1 |
6 |
1,2 (1,14-1,22) 1,1-1,56* |
1,33 (1,29-1,49) 1,16-1,68* |
65,73 (65,03-121,46) 27,53-155,63 # |
22,1 (21,5-24,6) 20,7-24,9 # |
|
А2Р2 |
6 |
1,21 (1,21-1,23) 1,14-1,26* |
1,26 (1,25-1,27) 1,24-1,39* |
109,93 (93,28-127,23) 86,47-132,54 # |
22,9 (21,1-23,1) 21,0-23,3 # |
|
А2Р3 |
6 |
1,18 (1,03-1,6) 1,02-1,79 * # |
1,26 (1,13-1,74) 1,11-1,76* |
136,74 (84,43-181,15) 76,32-198,09 # |
19,4 (18,6-24,5) 17,9-27,6 # |
Примечание: * р <0,05 относительно PHBV/PCL; # р <0,05 относительно a.mammaria.
Note:* р <0,05 relative to PHBV / PCL; # p <0.05 relative to a.mammaria.
Степень гемолиза эритроцитов после контакта с модифицированными и немодифицированными графтами во всех группах не превышала 2%, что свидетельствует о высокой гемосовместимости материала.
Вне зависимости от линкера между графтами с различной конфигурацией RGD статистически значимых различий по степени гемолиза не установлено.
При проведении СЭМ поверхности нетканых матриксов после контакта с тромбоцитами выявлено, что вне зависимости от конфигурации RGD на поверхности графтов A1 определяли наибольшее количество тромбоцитов относительно остальных исследуемых образцов. Активация тромбоцитов после контакта с поверхностью графтов, модифицированных RGD, превалировала на нетканых матриксах A1Р1, А1Р2, А1Р3 (табл. 2).
|
Таблица 2. Индекс деформации тромбоцитов и процентное распределение типов тромбоцитов Table 2. Platelet deformation index and percentage distribution of platelet types |
||||||
|
Вид графта |
Соотношение типов тромбоцитов, % |
Индекс деформации |
||||
|
I II |
III |
IV |
V |
М (25-75%) |
||
|
PHBV/PCL |
0 |
15.4 |
73.1 |
9.6 |
1.9 |
2,7 (1,0-3,0) |
|
А1Р1 |
5.6 |
36.1 |
25 |
30.6 |
2.8 |
2,5 (2,0-3,0) |
|
А1Р2 |
1.5 |
11.4 |
50 |
31.4 |
5.7 |
3,31 (3,0-3,7)* |
|
А1Р3 |
0 |
10.8 |
43.1 |
30.7 |
15.4 |
3,7 (3,4-4,5)* |
|
А2Р1 |
3.1 |
31.3 |
28.1 |
15.6 |
21.9 |
2,6 (1,0-3,7) |
|
А2Р2 |
0 |
65.5 |
24.2 |
3.4 |
6.9 |
1,3 (0,0-2,2) |
|
А2Р3 |
4.8 |
28.6 |
40.5 |
7.1 |
19.0 |
2,9 (2,5-4,0) |
Примечание: * p <0,05 относительно значений немодифицированного PHBV/PCL графта.
Note:* p <0,05 relative to the values of unmodified PHBV/PCL graft.
Спустя трое суток культивирования на поверхности образцов A2P3 эндотелиальных клеток было в 6 раз больше, чем на других матриксах. Доля погибших клеток на немодифициро-ванных матриксах составила 76,5%, на модифицированных RGD она варьировала от 0 до 8,9%. При этом на поверхности RGD модифицированных матриксов жизнеспособными оставались
90%, тогда как на поверхности немодифицированных аналогов не более 20% клеток.
Сканирующая электронная микроскопия образцов после культивирования с эндотелиальными клетками показала, что вне зависимости от вида линкера (A1 или A2) модификация Р3 имела более выраженный эффект в плане клеточной адгезии (рис. 1).
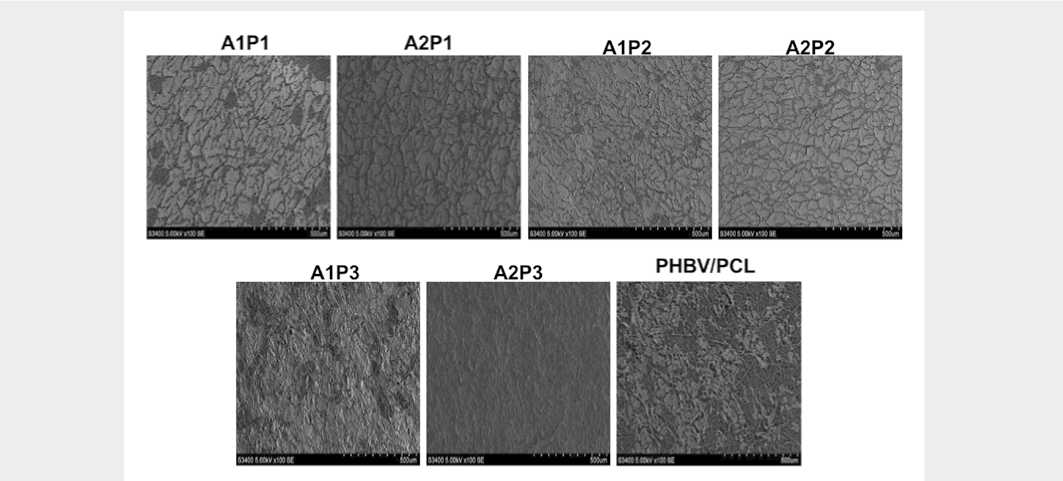
Рис. 1. СЭМ: адгезия колониеформирующих эндотелиальных клеток после 3 суток культивирования на поверхности немодифицированных и модифицированных RGD-пептидами нетканых матриксов
Fig. 1. SEM: adhesion of colony-forming endothelial cells after 3 days of cultivation on the surface of unmodified and modified RGD-peptides non-woven matrices
По результатам гистологического и иммунофлуоресцент-ного исследований эксплантированных сосудистых протезов выявлено, что спустя 1 мес. имплантации два из шести графтов PHBV/PCL оказались с обтурирующим тромбом (33,3%). В оставшихся 66,7% проходимых графтов клеточность стенки умеренная. Кальций не обнаружен. Спустя 3 мес. имплантации процент проходимых немодифицированных графтов по-прежнему составлял 66,7%. При этом в половине проходимых графтов определены отложения кальция под неоинтимой (табл. 3).
По результатам гистологического исследования экспланти-рованных графтов установлено, что графты A2P1 и A2P3 были проходимы в 100% случаев как через 1 мес., так и через 3 мес. имплантации. При этом графты A2P1 и A2P3 демонстрировали 100%-ю проходимость, качественную эндотелизацию, клеточ-ность стенки и меньшую склонность к кальцификации.
Иммунофлуоресцентное исследование определило явное превосходство сосудистых графтов с длинным линкером A2 в плане стимулирования формирования зрелого эндотелия и отложения коллагена IV типа (рис. 2).
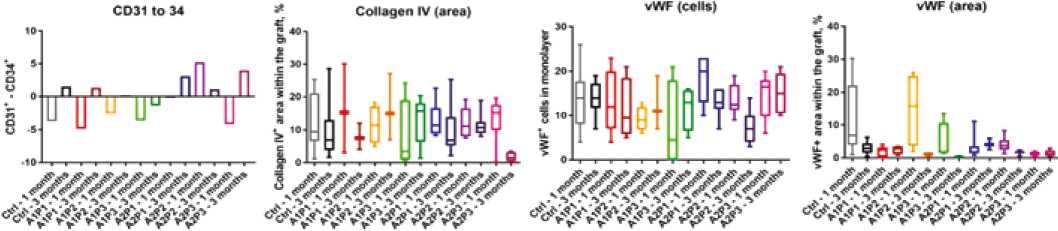
Рис. 2. Количественный анализ изображений конфокальной микроскопии эксплантированных образцов сосудистых графтов, окрашенных на CD31, CD34, внутриклеточный и субэндотелиальный фактор фон Виллебранда vWF, коллаген IV типа
Fig. 2. Quantitative analysis of images of confocal microscopy of explanted vascular grafts samples stained with CD31, CD34, intracellular and subendothelial von Willebrand factor vWF, type IV collagen
Таблица 3. Наличие/отсутствие кальция в стенке графтов на разных сроках имплантации, %
Table 3. The presence/absence of calcium in the wall of grafts at different periods of implantation, %
|
Графт |
1 мес. |
3 мес. |
|
PHBV/PCL |
0/100 |
50/50 |
|
A1P1 |
33,3/66,7 |
33,3/66,7 |
|
A1P2 |
33,3/66,7 |
50/50 |
|
A1P3 |
0/100 |
50/50 |
|
A2P1 |
0/100 |
33,3/66,7 |
|
A2P2 |
50/50 |
50/50 |
|
A2P3 |
0/100 |
33,3/66,7 |
Выводы
Таким образом, биодеградируемые сосудистые протезы PHBV/PCL/RGD по прочности и силе, приложенной к образцу до начала разрушения, больше соответствовали a.mammaria , чем их немодифицированные аналоги. Более длинный линкер 4,7,10-триокса-1,13-тридекандиамин значимо увеличил биодоступность RGD-пептидов. Сосудистые протезы с вариантами модифицирования A2P1 и A2P3 демонстрировали лучшие результаты в плане адгезии и поддержания жизнеспособности эндотелиальных клеток in vitro , обладали высокой проходимостью после имплантации в сосудистое русло мелких лабораторных животных и качественной эндотелизацией внутренней поверхности, меньшей склонностью к кальцификации.
Полученные результаты определяют пригодность модифицирования пептидами RGDK или c[RGDFK] поверхности биодеградируемых сосудистых протезов малого диаметра.
Список литературы Биодеградируемый сосудистый протез, модифицированный RGD-пептидами: экспериментальное исследование
- Бокерия Л.А., Милевская Е.Б., Кудзоева З.Ф., Прянишников В.В. Сердечно-сосудистая хирургия -2017. Болезни и врожденные аномалии системы кровообращения. М.: НМИЦССХ им. А.Н. Бакулева МЗ РФ; 2018:252.
- Taggart D.P. Current status of arterial grafts for coronary artery bypass grafting. Annals of Cardiothoracic Surgery. 2013;2(4):427-430. DOI: 10.3978/j.issn.2225-319X.2013.07.21
- Fisher M.B., Mauck R.L. Tissue engineering and regenerative medicine: recent innovations and the transition to translation. Tissue Engineering Part B Reviews. 2013;19(1):1-13. DOI: 10.1089/ten.TEB.2012.0723
- Ren X., Feng Y., Guo J., Wang H., Li Q., Yang J., et al. Surface modification and endothelialization of biomaterials as potential scaffolds for vascular tissue engineering applications. Chemical Society Reviews. 2015;44(15):5680-5742. DOI: 10.1039/c4cs00483c
- Wang F., Li Y., Shen Y., Wang A., Wang S., Xie T. The functions and applications of RGD in tumor therapy and tissue engineering. International Journal of Molecular Sciences. 2013;14(7):13447-13462. DOI: 10.3390/ijms140713447
- Aye S.S., Li R., Boyd-Moss M., Long B., Pavuluri S., Bruggeman K., et al. Scaffolds formed via the non-equilibrium supramolecular assembly of the synergistic ECM peptides RGD and PHSRN demonstrate improved cell attachment in 3D. Polymers. 2018;10(7):690.
- DOI: 10.3390/polym10070690
- Harburger D.S., Calderwood D.A. Integrin signaling at a glance. J. Cell Sci. 2009;122(2):159-163.
- DOI: 10.1242/jcs.018093
- Liu H., Li X., Niu X., Zhou G., Li P., Fan Y. Improved hemocompatibility and endothelialization of vascular grafts by covalent immobilization of sulfated silk fibroin on poly (lactic-co-glycolic acid) scaffolds. Biomacromolecules. 2011;12(8):2914-2924.
- DOI: 10.1021/bm200479f
- Gabriel M., van Nieuw Amerongen G.P., van Hinsbergh V.W., Amerongen A.V., Zentner A. Direct grafting of RGD-motif-containing peptideon the surface of polycaprolactone films. J. Biomater. Sci. Polym. Ed. 2006;17(5):567-577.
- Lin H.B., Cooper S.L. Synthesis and Cell-Adhesion Properties of Polyurethanes Containing Covalently Grafted RGD-Peptides. Advanced Biomaterials in Biomedical Engineering and Drug Delivery Systems. 1996:198-202.
- Parniak M.A., Lange G., Viswanatha T. Quantitative determination of monosubstituted guanidines: a comparative study of different procedures. J. Biochem. Biophys. Methods. 1983;7(4):267-276.
- Arimura S., Kawahara K., Biswas K.K., Abeyama K., Tabata M., Shimoda T., et al. Hydroxyapatite formed on/in agarose gel induces activation of blood coagulation and platelets aggregation. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2007;81(2):456-461.
- Jung F., Braune S., Lendlein A. Haemocompatibility testing of biomaterials using human platelets. Clin. Hemorheol. Microcirc. 2013;53(12):97-115.
- DOI: 10.3233/CH-2012-1579
- Matveeva V., Khanova M., Sardin E., Antonova L., Barbarash O. Endovascular interventions permit isolation of endothelial colony-forming cells from peripheral blood. International Journal of Molecular Sciences. 2018;19(11):34-53.
- DOI: 10.3390/ijms19113453
- Shen X., Su F., Dong J., Fan Z., Duan Y., Li S. In vitro biocompatibility evaluation of bioresorbable copolymers prepared from L-lactide, 1, 3-trimethylene carbonate and glycolide for cardiovascular applications. Journal of Biomaterials Science, Polymer Edition. 2015;26(8):497-514.
- DOI: 10.1080/09205063.2015.1030992


