Биофункционализация RGD-пептидами и сосудистым эндотелиальным фактором роста - эффективный способ ранней эндотелизации биодеградируемых сосудистых графтов малого диаметра
Автор: Кривкина Евгения Олеговна, Антонова Лариса Валерьевна, Севостьянова Виктория Владимировна, Великанова Елена Анатольевна, Миронов Андрей Владимирович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.32, 2017 года.
Бесплатный доступ
Решением проблемы дефицита сосудистых протезов для проведения шунтирующих операций является создание тканеинженерного кровеносного сосуда. Цель исследования: сравнительная оценка in vivo ремоделирования сосудистой ткани на основе графтов малого диаметра из полигидроксибутирата/валерата и поликапролактона (ПГБВ/ПКЛ), немодифицированных и модифицированных сосудистым эндотелиальным фактором роста (VEGF) и RGD-пептидами. Материал и методы. ПГБВ/ПКЛ и ПГБВ/ПКЛ/VEGF-графты изготавливали методом электроспиннинга. Графты имплантировали в брюшную часть аорты крыс на 1, 3, 6, 9 и 12 мес. Далее проводили гистологический и иммунофлуоресцентный анализ эксплантированных графтов. Результаты. Модификация ПГБВ/ПКЛ-графтов VEGF и RGD-пептидами способствовала эндотелизации 75% графтов спустя 12 мес. имплантации, при этом частота тромбообразования снизилась на 25%. Высокопористая структура стенки графтов в совокупности с хемоаттрактантным и адгезивным эффектом модифицирующих агентов привели к активному привлечению из кровотока CD34+ прогениторных эндотелиальных клеток уже через 1 мес. имплантации, которые в последующем формировали полноценный эндотелиальный монослой и базальную мембрану на внутренней поверхности графтов.
Тканевая инженерия, сосудистый графт, rgd-пептиды, сосудистый эндотелиальный фактор роста, эндотелизация
Короткий адрес: https://sciup.org/14920189
IDR: 14920189 | УДК: 616.1
Текст научной статьи Биофункционализация RGD-пептидами и сосудистым эндотелиальным фактором роста - эффективный способ ранней эндотелизации биодеградируемых сосудистых графтов малого диаметра
Реконструктивная хирургия является традиционным способом лечения ишемической болезни сердца и заболеваний периферических артерий. В качестве сосудистых шунтов широко применяют аутологичные вены и артерии. В то же время у значительного числа пациентов отсутствуют сосуды подходящего качества. Невозможность использования синтетических сосудистых протезов для шунтирования артерий малого диаметра доказана во многих исследованиях, поэтому создание функционально активных биодеградируемых сосудистых графтов малого диаметра может решить данную проблему. С целью повышения адгезии эндотелиальных клеток к внутренней поверхности сосудистых графтов был разработан ряд стратегий [1]. Большинство из них включает в себя иммобилизацию белков клеточной адгезии или биоактивных пептидов на внутренней поверхности [1]. Биоактивные пептиды более стабильны и имеют более простую структуру в сравнении с белками. RGD-трипептид широко распространен в структуре белков экстрацеллюлярного матрикса и является важнейшим лигандом для ин-тегринов – рецепторов, ответственных за клеточную адгезию, пролиферацию, выживаемость, миграцию и дифференцировку [2, 3]. Инкорпорирование факторов роста в полимерные каркасы – другая популярная стратегия повышения клеточной адгезии и инфильтрации сосудистых графтов [1, 4]. Среди ряда доступных факторов роста нами был выбран сосудистый эндотелиальный фактор роста (VEGF), так как он является наиболее мощным стимулятором ангиогенеза и васкулогенеза [5]. В дополнение к множеству других эффектов, VEGF индуцирует пролиферацию, выживаемость, миграцию и дифференцировку эндотелиальных клеток [6, 7].
Цель работы: сравнительная оценка in vivo ремоделирования сосудистой ткани на основе графтов малого диаметра из полигидроксибутирата/валерата и поликапролактона, немодифицированных и модифицированных VEGF или RGD-пептидами.
Материал и методы
Немодифицированные сосудистые графты диаметром 2 мм (n=32) на основе ПГБВ/ПКЛ (Sigma, США) были изготовлены методом электроспиннинга на аппарате NANON-01А (MECC, Япония). Половина графтов (n=16) в дальнейшем была подвергнута модификации RGD-пептидами по следующей схеме: предварительная активация поверхности, последующая обработка линкерным раствором, конъюгация с RGD-пептидами. Сосудистые ПГБВ/ ПКЛ-графты диаметром 2 мм, содержащие VEGF (n=16), были изготовлены методом двухфазного электроспиннинга. Конечная концентрация VEGF (Sigma, США) составила 500 нг на 1 мл полимерного раствора. Все графты имплантированы в брюшную часть аорты крыс линии Wistar на 1, 3, 6 и 12 мес. После эксплантации сосудистых графтов проведен гистологический анализ образцов с окраской гематоксилин-эозином и иммунофлуоресцен-тный анализ с использованием следующих специфических антител: CD31 – маркер зрелых эндотелиальных клеток (Millipore, США), CD34 – маркер прогениторных клеток гемопоэтического происхождения (Abcam, США), коллагены I и IV типа (Abcam, США). Ядра клеток в толще стенок графтов докрашивали ядерным красителем Dapi (Sigma, США).
Вследствие небольшой выборки (по 4 графта на точку вывода) данные представлены в виде процентного соотношения. Остальные результаты имели качественный характер и не подвергались статистической обработке.
Результаты
Все прооперированные животные дожили до предполагаемого срока вывода из эксперимента, все имплантированные графты оставались проходимыми и не меняли своей формы и длины на всех сроках эксперимента (рис. 1).
При проведении гистологического исследования в 75% эксплантированных немодифицированных графтов на всех временных точках выявлены пристеночные тромбы (рис. 2). Напротив, 75% графтов, модифицированных RGD-пептидами (рис. 3) или VEGF (рис. 4), были первично проходимы. Более того, на их внутренней поверхности обнаружен вероятный монослой эндотелиальных клеток.
Немодифицированные графты содержали на внутренней поверхности единичные дезорганизованные эндотелиальные клетки, что не характерно для нормальной сосудистой сети (рис. 5а), в то время как на внутренней поверхности RGD- и VEGF-модифицированных графтов уже через 1 мес. имплантации выявлен монослой клеток с переходным фенотипом CD31+, CD34+ (рис. 5b, с). Через 3 мес. эксперимента эндотелиальные клетки в графтах, модифицированных RGD-пептидами или VEGF, приобрели удлиненную форму, что характерно для эндотелиальной выстилки сосудов, и имели фенотип CD31+, CD34–, соответствующий зрелым эндотелиальным клеткам (рис. 5b, с). Таким образом, данные результаты отражают формирование монослоя эндотелиальных клеток и улучшенную эндотелизацию графтов, модифицированных RGD-пептидами или VEGF.

До имплантации Через 12 мес. имплантации
Рис. 1. Вид ПГБВ/ПКЛ-графтов до и после имплантации
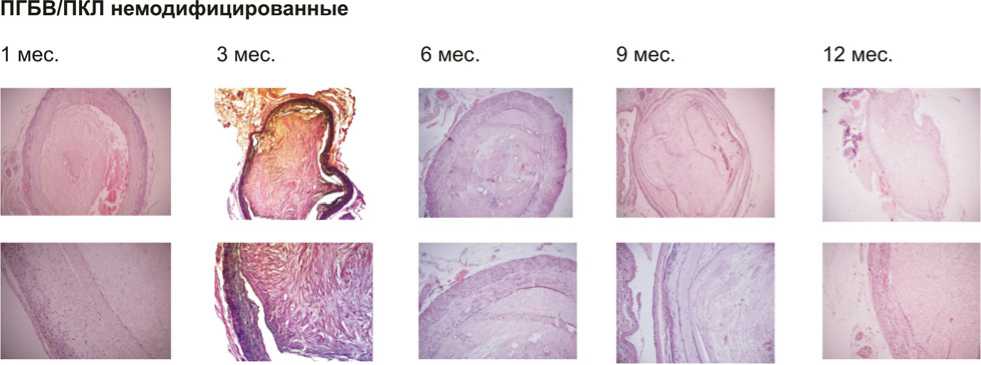
Рис 2. Результаты имплантации немодифицированных ПГБВ/ПКЛ-графтов, окраска гематоксилин-эозином, ув. х50 и х200
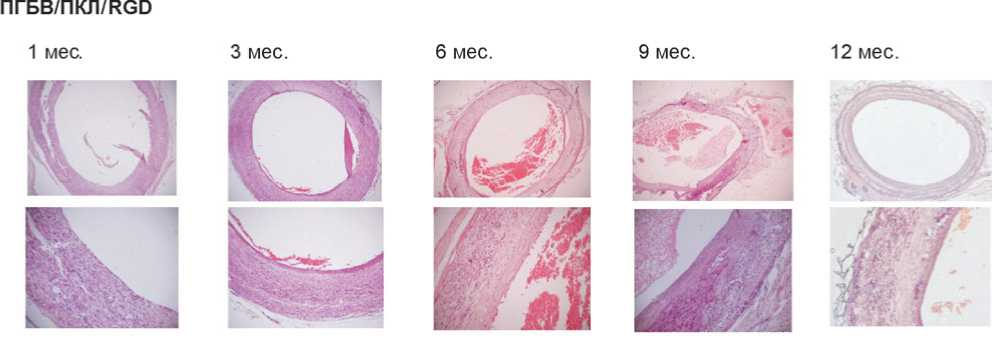
Рис. 3. Результаты имплантации ПГБВ/ПКЛ/RGD-графтов, окраска гематоксилин-эозином, ув. х50 и х200
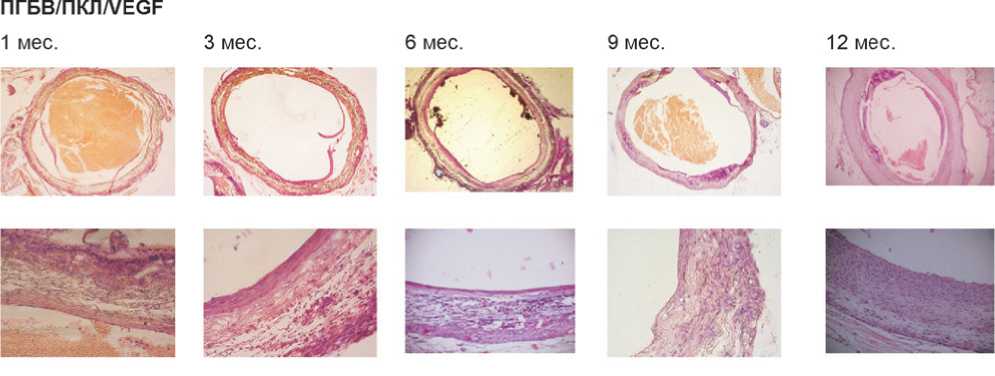
Рис. 4. Результаты имплантации ПГБВ/ПКЛ/VEGF-графтов, окраска гематоксилин-эозином, ув. х50 и х200
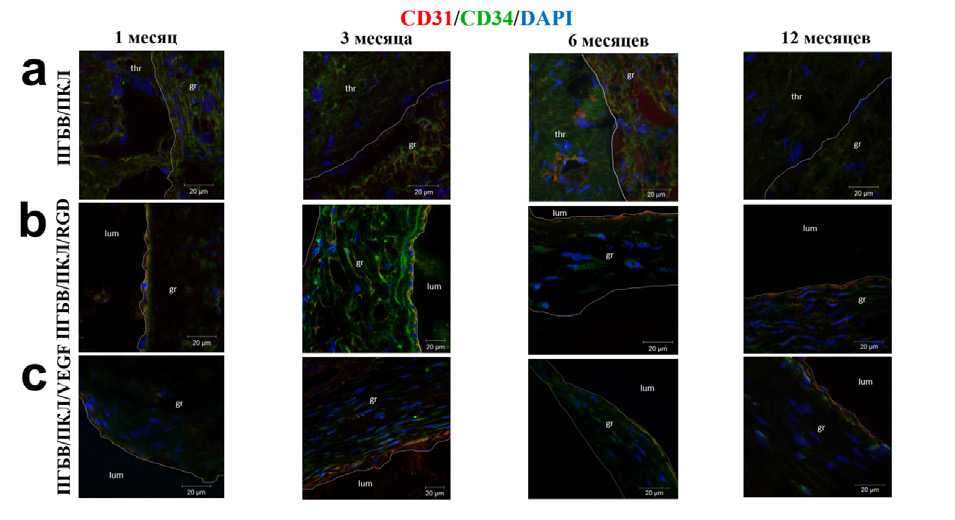
Рис. 5. Сочетанное окрашивание антителами к CD31 (красный цвет), CD34 (зеленый цвет) и DAPI (синий цвет): a – немодифици-рованные графты; b – ПГБВ/ПКЛ/RGD-графты; c – ПГБВ/ПКЛ/VEGF-графты. Thr – тромб, gr – графт, lum – просвет сосуда
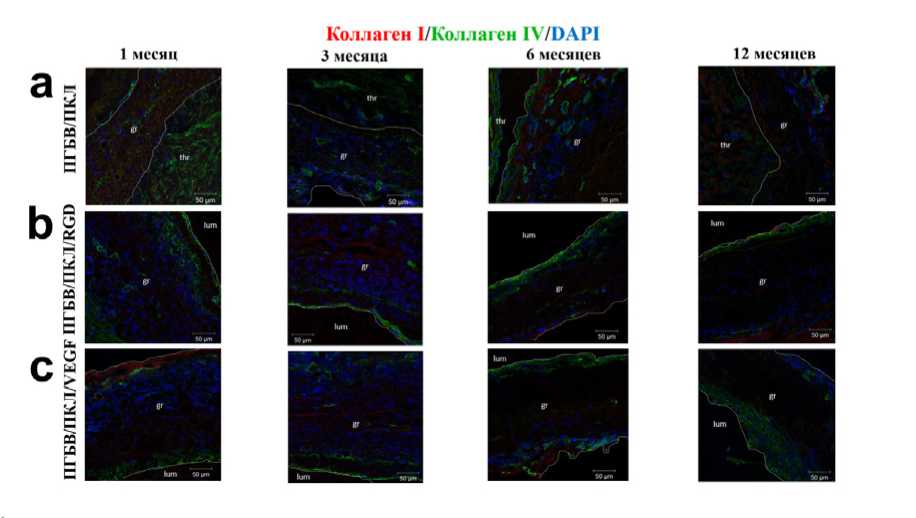
Рис. 6. Сочетанное окрашивание антителами к коллагену I типа (красный цвет), IV типа (зеленый цвет) и DAPI (синий цвет): (a) – контрольные графты; (b) – ПГБВ/ПКЛ/RGD-графты; (c) – ПГБВ/ПКЛ/VEGF-графты. Thr – тромб, gr – графт, lum – просвет сосуда
Образование базальной мембраны требует отложения цепей коллагена I и IV типа [8]. Чтобы понять, способен ли выявленный монослой эндотелиальных клеток синтезировать коллаген для создания базальной мембраны, мы провели двойное иммуноокрашивание на коллагены I и IV типа. Как и ожидалось, на всех временных точках под эндотелиальными клетками на внутренней поверхности графтов, конъюгированных с RGD-пептидами или с инкорпорированным VEGF, выявлен слой положительно окрашенных волокон коллагена IV типа. Ничего подобного в немодифицированных графтах не наблюдалось (рис. 6). Таким образом, мы показали, что эндотелиальные клетки, прикрепившиеся к внутренней поверхности RGD- и VEGF-модифицированных графтов, формируют аналог базальной мембраны.
Обсуждение
Ранее нами было обнаружено, что конъюгация с RGD-пептидами и инкорпорирование VEGF улучшают биофизические свойства, способствуют эндотелизации и повышают первичную проходимость графтов малого диаметра из ПГБВ/ПКЛ на ранних сроках имплантации [9, 10]. Кроме того, модификация VEGF статистически значимо снижала средний диаметр волокон и среднюю площадь пор в сравнении с модификацией RGD-пептидами [9, 10]. Таким образом, структура графтов с VEGF была более схожа с нативным экстрацеллюлярным матриксом [11, 12]. Более того, эластичность, жесткость и характер кривой “растяжение–деформация” у графтов с VEGF были более схожими с таковыми внутренней грудной артерии в сравнении с графтами, модифицированными RGD-пептидами [9, 10].
В данной работе мы провели кратко- и долговременное тестирование сосудистых графтов малого диаметра из ПГБВ/ПКЛ in vivo, включая графты с конъюгированными RGD-пептидами и инкорпорированным VEGF. Нам удалось подтвердить, что модификации RGD-пептидами и VEGF способствуют эндотелизации и повышают первичную проходимость на ранних и поздних сроках имплантации биодеградируемых сосудистых графтов малого диаметра из ПГБВ/ПКЛ. Как RGD-пептиды, так и VEGF привлекали CD31-положительные, т.е., зрелые, и CD34-положительные, т.е. прогениторные эндотелиальные клетки к внутренней поверхности с 1-го по 12-й мес. имплантации. Указанные эндотелиальные клетки синтезировали коллаген IV типа.
Таким образом, как конъюгирование с RGD-пептидами, так и инкорпорирование VEGF приводит к раннему формированию функционального эндотелиального монослоя на внутренней поверхности биодеградируемых сосудистых графтов, что обеспечивает краткосрочную и долгосрочную проходимость сосудистых графтов в эксперименте in vivo.
Список литературы Биофункционализация RGD-пептидами и сосудистым эндотелиальным фактором роста - эффективный способ ранней эндотелизации биодеградируемых сосудистых графтов малого диаметра
- Ren X., Feng Y., Guo J. et al. Surface modification and endothelialization of biomaterials as potential scaffolds for vascular tissue engineering applications//Chem. Soc. Rev. -2015. -Vol. 44, No. 15. -P. 5680-5742.
- Wang F., Li Y., Shen Y. et al. The functions and applications of RGD in tumor therapy and tissue engineering//Int. J. Mol. Sci. -2013. -Vol. 14, No. 9. -P. 13447-13462.
- Harburger D.S., Calderwood D.A. Integrin signalling at a glance//J. Cell Sci. -2009. -Vol. 122, No. 2. -P. 159-163.
- Ingavle G.C., Leach J.K. Advancements in electrospinning of polymeric nanofibrous scaffolds for tissue engineering//Tissue Eng. Part B Rev. -2014. -Vol. 20, No. 4. -P. 277-293.
- Антонова Л.В., Мухамадияров Р.А., Миронов А.В. и др. Оценка биосовместимости биодеградируемого сосудистого графта малого диаметра из полигидроксибутирата/валерата и поликапролактона: морфологическое исследование//Гены & клетки. -2015. -Т. 10, № 2. -С. 71-77.
- Azimi-Nezhad M. Vascular endothelial growth factor from embryonic status to cardiovascular pathology//Rep. Biochem. Mol. Biol. -2014. -Vol. 2, No. 2. -P. 59-69.
- Thanigaimani S., Kichenadasse G., Mangoni A.A. The emerging role of vascular endothelial growth factor (VEGF) in vascular homeostasis: lessons from recent trials with anti-VEGF drugs//Curr. Vasc. Pharmacol. -2011. -Vol. 9, No. 3. -P. 358-380.
- Kalluri R. Basement membranes: structure: assembly and role in tumour angiogenesis//Nat. Rev. Cancer. -2003. -No. 3. -P. 422-433.
- Antonova L.V., Seifalian A.M., Kutikhin A.G. et al. Bioabsorbable bypass grafts biofunctionalised with RGD have enhanced biophysical properties and endothelialisation tested in vivo//Front. Pharmacol. -2016. -Vol. 7. -P. 136.
- Antonova L.V., Sevostyanova V.V., Kutikhin A.G. et al. Vascular endothelial growth factor improves physico-mechanical properties and enhances endothelialization of poly(3-hydroxybutyrate-co-3-hydroxyvalerate)/poly(е-caprolactone) small-diameter vascular grafts in vivo//Front. Pharmacol. -2016. -Vol. 7. -P. 230.
- Rim N.G., Shin C.S., Shin H. Current approaches to electrospun nanofibers for tissue engineering//Biomed. Mater. -2013. -Vol. 8, No. 1. -P. 014102.
- Zhang X., Tsukada M., Morikawa H. et al. Production of silk sericin/silk fibroin blend nanofibers//Nanoscale Res. Lett. -2011. -Vol. 6. -P. 510.


