Биогенные полиамины как модуляторы активности Quorum sensing системы и биопленкообразования Vibrio harveyi
Автор: Нестерова Лариса Юрьевна, Негорелова Елизавета Вадимовна, Ткаченко Александр Георгиевич
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2019 года.
Бесплатный доступ
Изучено влияние биогенных полиаминов на ростовые характеристики, биопленкообразование и функционирование системы Quorum sensing бактерии Vibrio harveyi. Показана способность V. harveyi синтезировать путресцин, кадаверин и спермидин, транспортировать из среды и накапливать в клетке спермин. Установлено, что присутствие полиаминов в среде культивирования оказывает стимулирующее влияние на активность аутоиндукторов 1 и 2 системы Quorum sensing, а также на формирование бактериальных биопленок. Во всех случаях наибольшее действие оказывал спермин. Эффект полиаминов на формирование бактериальных биопленок может быть обусловлен их стимулирующим влиянием на продукцию аутоиндукторов.
Аутоиндуктор 1, аутоиндуктор 2, биопленкообразование, полиамины
Короткий адрес: https://sciup.org/147227092
IDR: 147227092 | УДК: 579.22 | DOI: 10.17072/1994-9952-2019-3-300-308
Текст научной статьи Биогенные полиамины как модуляторы активности Quorum sensing системы и биопленкообразования Vibrio harveyi
Известно, что в естественной среде обитания до 99% всех микроорганизмов находятся в виде биопленок [Николаев, Плакунов, 2007]. Такая форма существования обеспечивает им значительные преимущества по сравнению с изолированными клетками. В биопленочных сообществах бактерии приобретают повышенную способность к выживанию под действием различных неблагоприятных условий, в том числе в присутствии антибактериальных препаратов, могут обмениваться генами резистентности, в результате чего становятся невосприимчивыми к антибиотикам, воздействию компонентов иммунной системы хозяина и другим факторам [Salyers, Amabile-Cuevas, 1997; Stickler, 1999; Mah, 2012]. Биопленкообразование и связанное с ним возрастание антибиотикорезистент-ности клинически значимых микроорганизмов, является острой проблемой современной микробиологии и медицины. В связи с этим существует необходимость изучения причин, которые приводят к образованию биопленок, а также поиска новых способов воздействия на их формирование и регуляцию этого процесса.
Формирование биопленки контролируется системами межклеточной коммуникации Quorum Sensing (QS). Системы QS являются особым типом регуляции экспрессии генов у бактерий, зависящим от плотности их популяции. Бактерии продуцируют и выделяют во внешнюю среду низкомолекулярные сигнальные молекулы различной природы – аутоиндукторы (АИ), концентрация которых зависит от количества клеток [Bettenworth et.al., 2019]. По мере роста популяции бактерий достигается минимальная стимулирующая концентрация АИ, которые взаимодействуют с соответствующими регуляторными белками, что приводит к резкой активации экспрессии определенных ге-
нов [Miller, Bassler, 2001; Zhao et al., 2018]. Многочисленные исследования в этой области указывают на то, что межклеточная коммуникация посредством сигнальных молекул может осуществляться не только между бактериями, принадлежащими к одному виду, роду или семейству, но и между таксономически далекими друг от друга микроорганизмами [Suga, Smith, 2003; Federle, Bassler, 2003]. QS позволяет бактериям взаимодействовать и регулировать экспрессию генов, а следовательно, координировать «поведение» всего сообщества. Некоторые исследователи отмечают, что при реализации данного механизма в популяции бактерий проявляются черты сходства с многоклеточными организмами [Waters, Bassler, 2005; Николаев, Плакунов, 2007]. Грамположительные и грамотрицательные микроорганизмы используют системы QS для регуляции разнообразных физиологических процессов, таких как биолюминесценция, подвижность, вирулентность, синтез пигментов и антибиотиков, конъюгативный перенос плазмид, споруляция, биопленкообразование и др. [Gospodarek, Bogiel, Zalas-Wiecek 2009; Haque et al., 2018; Jiang et al., 2019]. В зависимости от природы молекулы АИ различают несколько видов систем QS. Наиболее распространена система QS 1 типа, которая характерна для грамотрицательных бактерий, и 2 типа, которая используется как гра-мотрицательными, так и грамположительными бактериями [Miller, Bassler 2001]. В системе QS 1 (LuxI-LuxR) типа аутоиндукторами являются различные гомосеринлактоны, в то время как в качестве АИ 2 типа выступают вещества фурановой природы [Federle, Bassler 2003].
Известно, что на процессы биопленкообразо-вания некоторых микроорганизмов могут оказывать влияние биогенные полиамины (ПА) – клеточные поликатионы, которые в миллимо-лярных количествах содержатся в клетках как про, так и эукариот [Michael, 2016] и выполняют регуляторные и защитные функции при адаптации бактерий к различным неблагоприятным воздействиям [Tkachenko, Nesterova, Pshenichnov, 2001; Rhee, Kim, Lee, 2007; Kanjee, Gutsche, Alexopoulo, et al., 2011]. Показано также, что ПА могут принимать участие в регуляции экспрессии генов, которые объединяют в «полиаминовый модулон» [Igarashi, Kashiwagi, 2011], и список этих генов постоянно пополняется.
Цель настоящей работы – изучение влияния биогенных полиаминов на формирование бактериальных биопленок и функционирование системы Quorum sensing 1 и 2 типов грамотрицательных бактерий.
Материалы и методы исследования
Стилевое В качестве объектов исследования в работе использованы изогенные штаммы люми-несцирующих бактерий Vibrio harveyi: ВВ120 – дикий тип (продуцент АИ-1 и АИ-2), ВВ170 – инсерция транспозона Tn5 в ген luxN (сенсор 1-, сенсор 2+) [Bassler, Wright, Richard, 1993], ВВ886 – инсерция транспозона Tn5 в ген luxQ (сенсор 1+, сенсор 2-) [Bassler, Wright, Stiverman, 1994], любезно предоставленные проф. B.L. Bassler, Princeton University (USA).
Перед экспериментом штаммы, сохраняемые на скошенном LBS-агаре (LB-агар («Sigma», США) с добавкой 2% NaCl), высевали на LBS-бульон (LB-бульон («Amresco», США) с добавкой 2% NaCl). Затем пробирки с культурой помещали в термостатируемый шейкер (GLF-1092, Германия) и культивировали при температуре 30 ° С в течение 12 ч. при 120 об/мин. Сенсорные штаммы V. harveyi ВВ170 и V. harveyi ВВ886 перед экспериментом культивировали в термостатируемом шейкере в колбе Эрленмейера (50 мл) 12 ч. на среде АВ [Greenberg, 1979] при температуре 30 ° С и перемешивании 120 об/мин.
Эксперименты по изучению биопленкообра-зования проводили с использованием дикого штамма V. harveyi ВВ120. Ночную культуру доводили до оптической плотности 0.1 при длине волны 600 нм, затем разводили в 10 раз добавлением питательной среды и использовали в качестве инокулята. Инокулят вносили по 100 мкл в лунки 96-луночных полистироловых, плоскодонных планшетов (МиниМед, Россия). Путресцин, кадаверин, спермидин и спермин вносили в лунки планшета в конечной концентрации 0.05; 0.1; 1 и 5 мМ непосредственно перед добавкой инокулята до конечного объема 200 мкл.
Планшеты культивировали в течение 48 ч. в термостате при 30 ° С, после чего измеряли оптическую плотность при длине волны 625 нм с использованием мультимодального планшетного ридера «Tecan Infinity M200» (Австрия). Далее из планшетов удаляли культуру, лунки дважды промывали дистиллированной водой, биопленки подсушивали и окрашивали в течение 30 мин. 0.1%-ным раствором генцианвиолета. После пятикратного промывания водой и полного высыхания краситель экстрагировали из биопленок 200 мкл 96%-ным этанолом в течение 1 ч. Интенсивность биопленкообразования оценивали путем измерения оптической плотности окрашенного экстракта при длине волны 570 нм [O`Toole, Kotler, 1998].
Для количественной оценки способности полиаминов оказывать влияние на формирование биопленок использовали показатель стимуляции биопленкообразования, который рассчитывали по формуле: (SBFПА*100/SBFК)-100, где SBFПА – удельное биопленкообразование (Specific biofilm formation) в присутствии полиаминов; SBFК –-удельное биопленкообразование без полиаминов. Расчет удельного биопленкообразования (SBF) проводили по формуле (ОП570– ОПК)/ОП625, где ОП570 и ОПК – оптическая плотность культуры и контрольной лунки при длине волны 570 нм, соответственно; ОП625 – оптическая плотность культуры при длине волны 625 нм после культивирования в планшете [Naves et al.,2008].
В качестве продуцентов внеклеточных АИ-1 и АИ-2 использовался штамм V. harveyi ВВ120. Ночную культуру доводили до ОП600 0.1 и культивировали в колбах Эрленмейера (50 мл) и в течение 6 ч. на LBS-бульоне с добавлением каждого из исследуемых ПА: путресцина, кадаверина, спермидина и спермина – в двух концентрациях (1 и 5 мМ). Культивирование проводили в термостатируемом шейкере с перемешиванием (120 об/мин) при температуре 30 ° С, 6 ч. Бесклеточные супернатанты получали после осаждения клеток центрифугированием (10 000 об/мин, 5 мин.) и фильтрования надосадочной жидкости через шприцевой фильтр (размер пор 0.22 мкм) Chromafil (Германия). До проведения анализа супернатанты хранили при -20 ° С.
Для анализа активности АИ-1 и АИ-2 использовали сенсорные штаммы V. harveyi ВВ886 и V. harveyi ВВ170, соответственно. Ночную культуру сенсора V. harveyi , выращенную в колбе на среде АВ, доводили до ОП600 = 1.5, разводили той же средой в 5 х 103 раз и вносили в 96-луночные полистироловые плоскодонные белые планшеты (SPL Life Sciences Co., Корея) в объеме 90 мкл с добавлением 10 мкл бесклеточного супернатанта культуры штамма-продуцента аутоиндуктора в необходимых вариациях. В контрольные лунки вносили 10 мкл среды (отрицательный контроль). Анализ активности АИ проводили биолюминес-центным методом [Surette et al., 1998] с использованием мультимодального планшетного ридера «Tecan Infinity M200» с датчиком люминесценции. Результаты представляли в виде индекса стимуляции свечения, который вычисляли по формуле (IO-IK)/IK x 100%, где IO и IK -удельная биолюминесценция контроля и опыта, соответственно (в пересчете на количество колониеобразующих единиц) [Пшеничнов, Масленникова, Никитина, 2010].
Концентрацию полиаминов определяли методом тонкослойной хроматографии их дансил-производных [Чудинов, Чудинова, Коробов, 1984].
Статистическую обработку результатов исследований проводили с использованием пакета стандартных программ Statistica 6.0. На графиках отражены средние значения (4–10 экспериментов), вертикальными отрезками обозначены величины стандартной ошибки среднего. Оценка статистической значимости различий произведена с использованием t-критерия Стьюдента. Различия считали значимыми при р ≤ 0.05.
Результаты
Большое разнообразие, низкое содержание в клетках и среде, а также нестабильность химической структуры аутоиндукторов затрудняет разработку и использование прямых аналитических методов их количественного определения [Vilchez et al., 2007]. Поэтому функциональную активность QS систем принято оценивать по уровню выраженности одного из контролируемых ими фенотипических признаков, которые легко поддаются детекции. Чаще всего это синтез пигмента ( Chromobacterium violaceum, Pseudomonas aeruginosa ) или люминесценция (бактерии рода Vibrio ). Известно, что бактерии V. harveyi имеют три механизма QS-регуляции оперона свечения: первый представлен LuxM-зависимым аутоиндуктором АИ-1 и сенсором LuxN; второй состоит из LuxS-зависимого аутоиндуктора АИ-2 и сенсора LuxPQ; компонентами третьей системы являются CqsA – зависимый аутоиндуктор и сенсор CqsS [Henke, Bassler, 2004].
С этой целью в данной работе использованы изогенные штаммы V. harveyi, у которых количество аутоиндуктора в среде культивирования определяет интенсивность люминесценции, а модификации в различных генах, кодирующих компоненты QS-системы, позволяют дифференцированно оценить зависимость ее активности от метаболических факторов.
Известно, что многие грамотрицательные микроорганизмы, в том числе Escherichia coli , способны синтезировать ПА путресцин, кадаверин и спермидин, в то время как спермин преимущественно продуцируется эукариотическими организмами, но может транспортироваться и накапливаться в клетках прокариот [Igarashi, Kashiwagi, 1999; Tabor, Tabor, 1985]. Присутствуя повсеместно, полиамины могут оказывать влияя-ние на жизнедеятельность свободноживущих бактерий, а также симбионтов и паразитов животных и человека. Поскольку в доступной литературе нет сведений о содержании полиаминов в клетках V. harveyi , одной из задач исследования является изучение способности данного микроорганизма к синтезу и транспорту биогенных полиаминов.
Результаты проведенных исследований показали, что рост V. harveyi ВВ120 на LBS бульоне сопровождается синтезом и накоплением путресцина, кадаверина и спермидина в клетках. При этом содержание путресцина и спермидина после 24 ч. культивирования без перемешивания было практически одинаково и составляло 5.32(±1.60) и
5.40(±1.48) мкмоль/мг сырой биомассы соответственно, в то время как концентрация кадаверина была на порядок выше и составляла 53.81(±5.25) мкмоль/мг сырой биомассы.
Образования спермина клетками V. harveyi не обнаружено, однако их культивирование в присутствии этого полиамина сопровождалось его транспортом из среды и накоплением в клетках пропорционально времени экспозиции (таблица).
Накопление спермина в клетках V. harveyi
|
Концентрация спермина в среде |
Содержание спермина (мкмоль/мг сырой биомассы) |
||
|
2 ч |
4 ч |
6 ч |
|
|
0,1 мМ |
0.66±0.37 |
6.96±2.08 |
5.15±1.32 |
|
1 мМ |
10.81±3.12 |
17.33±4.26 |
19.11±2.56 |
Примечание. Значения представлены в виде среднего ± ст. отклонение.
Таким образом, V. harveyi способен к синтезу и накоплению биогенных полиаминов (путресцин, кадаверин и спермидин) в миллимолярных концентрациях. Как и большинство микроорганизмов, V. harveyi не может самостоятельно синтезировать спермин, но способен к его активному транспорту из среды и накоплению в клетках.
Хотя сведения о влиянии полиаминов на биопленкообразование, представленные в разных источниках, довольно противоречивы, становится очевидным, что их эффект на процесс перехода бактериальных клеток от планктонной формы существования к биопленкообразованию характеризуется видоспецифичностью [Karatan, Duncan, Watnick, 2005; Kolodkin-Gal et al., 2012; Hobley et al., 2017].
Поскольку в литературе отсутствуют сведения о влиянии ПА на биопленкообразование V. harveyi , одной из задач данной работы является изучение влияния путресцина, кадаверина, спермидина и спермина на процесс перехода этого микроорганизма от планктонного образа жизни к формированию биопленок.
Показано, что присутствие в среде культивирования ПА повышало уровень биопленкообразова-ния V. harveyi . Хотя концентрационно зависимый стимулирующий эффект наблюдался в присутствии в среде всех исследованных полиаминов, наибольшее действие оказывал спермин в концентрации 5мМ (рис. 1).
Известно, что в организме животных и человека ПА спермин и спермидин содержатся в миллимолярных количествах [Jänne et al., 1973; Pegg, McCann, 1982]. Некоторые грамотрица-тельные микроорганизмы синтезируют и экспортируют в среду такие же концентрации кадаверина и путресцина [Igarashi, Kashiwagi, 1999; Tabor, Tabor, 1985]. Поскольку ПА в больших количествах образуются в окружающей среде при расщеплении органических остатков и в значительных концентрациях присутствуют в тканях человека, животных и растений, свободноживущие бактерии, наряду с симбионтами и паразитами организма хозяина, постоянно контактируя с ПА, могут быть подвержены сущеественному изменению процессов их жизнедеятельности под действием этих соединений.
Показано, что спермин и спермидин при некоторых условиях могут подавлять рост грампо-ложительных и некоторых грамотрицательных бактерий [Yohannes еt аl., 2005; Peng et al., 2017; Yao, Lu, 2014].
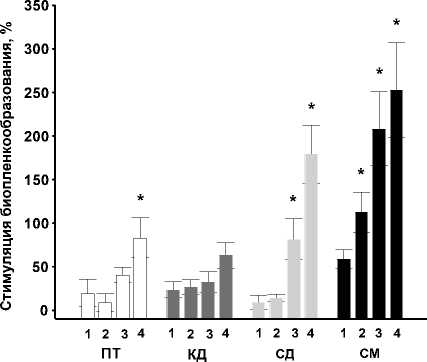
Рис. 1 . Влияние полиаминов на биопленкообразование V. harveyi ВВ120: ПТ – путресцин, КД – кадаверин, СД – спермидин, СМ – спермин. 1 – 0.05мМ; 2 – 0.1мМ; 3 – 1мМ; 4 – 5мМ
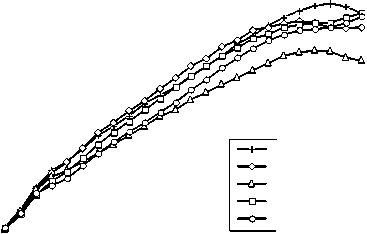
Исходя из этого, можно сделать допущение, что переход от планктонного образа жизни к формированию биопленки может быть частично обусловлен адаптацией к стрессу, вызванному токсическим действием полиаминов. Учитывая это, исследовано влияние физиологических концентраций биогенных полиаминов на ростовые характеристики V. harveyi и показано, что ПА при добавке в среду культивирования в концентрациях от 0.1 до 5 мМ не оказывали существенного действия на рост бактериальной культуры. Небольшое снижение оптической плотности в конце экспоненциальной фазы наблюдалось только в присутствии кадаверина (рис. 2). Таким образом, полиамины оказывают влияние на процесс формирования биопленок V. harveyi не за счет их токсического действия.
Известно, что при переходе E. coli от планктонной формы к существованию в составе биопленки, в клетках происходят значительные фенотипические трансформации, обусловленные изменением их генно-экспрессионного профиля [Beloin et al., 2004]. В настоящее время описано множество генетически детерминированных программ, регулирующих процессы биопленкообразования на разных его стадиях. Кроме того, показана существенная роль в формировании бактериальных биопленок большого числа факторов, в том числе биологически активных соединений.
0,81
о
0,1
I 0,7
0,6 ■I
0,51
о
о
0,41
0,3 1
0,2 1
Время (ч.)
Контроль Путресцин Кадаверин Спермидин Спермин
2 4 6 8 10 12 14 16 18 20 22 24
Рис. 2 . Влияние биогенных полиаминов (5мМ) на рост культуры V. harveyi
Хотя на сегодняшний день нет достоверных сведений о том, каким образом биогенные полиамины могли бы повлиять на этот процесс, известно, что образование биопленок находится под контролем QS системы межклеточной коммуникации [Saxena et al., 2019], и есть единичные работы, приписывающие ПА функции сигнальных молекул [Karatan, Duncan, Watnick, 2005].
Исходя из этого, мы предположили, что влияние этих соединений на биопленкообра-зование может быть связано с их воздействием на процесс QS регуляции, ключевым моментом которого является синтез молекул АИ. Основываясь на этом предположении, мы исследовали влияние полиаминов на синтез аутоиндукторов 1го (АИ-1) и 2-го (АИ-2) типа клетками V. harveyi . Источником сигнальной молекулы 1-го типа служил штамм V. harveyi ВВ120, в качестве сенсора использовался штамм V. harveyi ВВ886, способный реагировать только на АИ-1. Показано, что супернатанты, полученные из культуры, выращенной в присутствии ПА, обладали более высокой активностью, чем в их отсутствии (рис. 3). Наибольший стимулирующий эффект на продукцию АИ-1 оказывал спермин в концентрации 5 мМ. В этом случае свечение сенсора АИ-1 возрастало в 6 раз по сравнению с контролем (рис 3).
Исследование роли биогенных полиаминов в продукции бактериальными клетками АИ-2 показало, что супернатанты, полученные из культуры, выращенной с добавками ПА, сильнее стимулировали свечение сенсорного штамма. Наибольший положительный эффект и в этом случае оказывал спермин в концентрации 5 мМ, который более чем в 4 раза повышал свечение по сравнению с контролем (рис. 4).
Таким образом, полиамины, не оказывая в физиологических концентрациях значительного влияния на рост культуры, стимулировали продукцию АИ 1 и АИ 2 клетками V. harveyi и способствовали повышению уровня биопленкообразования.
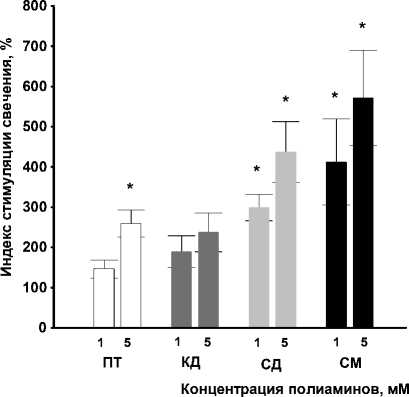
Рис. 3 . Влияние полиаминов на продукцию АИ-1 в культуре V. harveyi :
ПТ – путресцин, КД – кадаверин, СД – спермидин, СМ – спермин
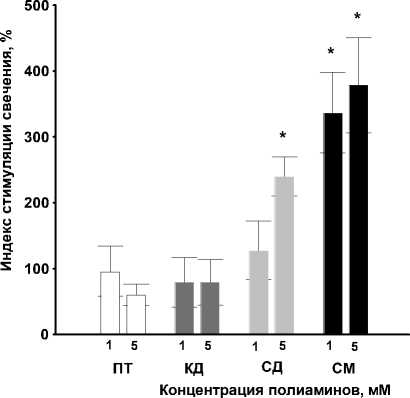
Рис. 4. Влияние полиаминов на продукцию АИ-2 в культуре V. harveyi :
ПТ – путресцин, КД – кадаверин, СД – спермидин, СМ – спермин
Заключение
Известно, что биогенные ПА принимают участие в регуляции многих жизненно важных процессов в бактериальных клетках. Нами показано, что ПА оказывают стимулирующее влияние на формирование биопленок V. harveyi, что совпадает с данными, полученными на других грамотрицательных микроорганизмах [Nesse, Berg, Vestby, 2015]. При этом установлено, что V. harveyi синтезирует путресцин, кадаверин и спермидин в значительных количествах и способен транспортировать спермин из среды. Таким образом, как экзогенные, так и эндогенные ПА могут принимать участие в регуляции биопленко-образования.
Поскольку известно, что биопленкообразование находится под контролем системы QS, было сделано предположение о возможном влиянии полиаминов на формирование бактериальных биопленок, опосредованном их эффектом на функционирование системы синтеза аутоиндукторов, которое нашло экспериментальное подтверждение. Показано, что биогенные ПА Действительно способны оказывать стимулирующее действие на продукцию сигнальных молекул АИ-1 и АИ-2, при этом наибольшим эффектом обладал спермин, синтезируемый преимущественно эукариотическими клетками.
Роль полиаминов в основных физиологических процессах во многом определяется особенностями их молекулярной структуры. При физиологических значениях pH ПА протонированы по атомам азота и несут положительный заряд. Через ионные взаимодействия они способны связываться с отрицательно заряженными компонентами клетки, в частности, нуклеиновыми кислотами, принимая участие в регуляции экспрессии адаптивных генов [Igarashi, Kashiwagi, 2011; Tkachenko, Nesterova, Pshenichnov, 2001]. Одной из причин действия ПА на продукцию сигнальных молекул QS систем, по-видимому, является их способность оказывать действие на экспрессию генов, регулирующих синтез аутоиндукторов. Тот факт, что различные ПА действуют на биопленкообразование и продукцию АИ сходным образом, и в обоих случаях максимальный эффект оказывает спермин, подтверждает предположение о том, что влияние ПА на формирование биопленок является опосредованным через регуляцию активности QS системы.
Таким образом, эффект полиаминов на формирование бактериальных биопленок, по меньшей мере частично, может быть обусловлен их стимулирующим влиянием на продукцию аутоиндукторов системы QS 1 и 2 типа, что не исключает возможность участия в этом процессе других механизмов, требующих дальнейшего изучения.
Работа выполнена в рамках госзадания, номер госрегистрации темы 01201353249.
Список литературы Биогенные полиамины как модуляторы активности Quorum sensing системы и биопленкообразования Vibrio harveyi
- Николаев Ю.А., Плакунов В.К. Биопленка - "город микробов" или аналог многоклеточного организма? // Микробиология. 2007. Т. 76, № 2. С. 149-163.
- Пшеничнов Р.А., Масленникова И.Л., Никитина Н.М. Экзометаболическая регуляция роста и свечения бактерий Vibrio harveyi BB170 при разной плотности популяции // Вестник Пермского университета. Сер. Биология. 2010. Вып. 2. С. 15-18.
- Чудинов А.А., Чудинова Л.А., Коробов В.П. Метод определения низкомолекулярных олигоаминов в различном биологическом материале // Вопросы медицинской химии. 1984. № 4. C. 127-132.
- Bassler B.L. et al. Intercellular signalling in Vibrio harveyi: sequence and function of genes regulating expression of luminescence // Molecular Microbiology. 1993.Vol. 9. P. 773-786.
- Bassler B.L., Wright M., Silverman M.R. Multiple signaling systems controlling expression of luminescence in Vibrio harveyi: sequence and function of genes encoding a second sensory pathway // Molecular Microbiology. 1994. Vol. 13. P. 273-286.
- Beloin C. et al. Global impact of mature biofilm lifestyle on Escherichia coli K-12 gene expression // Molecular Microbiology. 2004. Vol. 51. № 3. P. 659-674.
- Bettenworth V. et al. Phenotypic heterogeneity in bacterial quorum sensing systems // Journal of Molecular Biology. 2019.
- Federle M.J., Bassler B.L. Interspecies communication in bacteria // Journal of Clinical Investigation. 2003. № 112. Р. 1291-1299.
- Gospodarek E., Bogiel T., Zalas-Wiecek P. Communication between microorganisms as a basis for production of virulence factors // Polish Journal of Microbiology. 2009. Vol. 58, № 3. Р. 191-198.
- Greenberg E.P., Hastings J.W., Ulitzer S. Induction of luciferase synthesis in Beneckea harveyi by other marine bacteria // Archives of Microbiology. 1979. Vol. 179. Р. 87-91.
- Haque S. еt аl. Developments in strategies for Quorum Sensing virulence factor inhibition to combat bacterial drug resistance // Microbial Pathogenesis. 2018. Vol. 121. Р. 293-302.
- Henke J.M., Bassler B.L. Three parallel quorum sensing regulate gene expression in Vibrio harveyi // Journal of Bacteriology. 2004. Vol. 186. P. 6902-6914.
- Hobley L. еt аl. Spermidine promotes Bacillus subtilis biofilm formation by activating expression of the matrix regulator slrR // Journal of Biological Chemistry. 2017. Vol. 212, № 92. Р. 12041-12053
- Igarashi K., Kashiwagi K. Polyamine transport in bacteria and yeast // Biochemical Journal. 1999. Vol. 344, № 3. P. 633-642.
- Igarashi K., Kashiwagi K. Characterization of genes for polyamine modulon // Methods in Molecular Biology. 2011. Vol. 720. P. 51-65.
- Jänne J. еt аl. Polyamines and polyamine metabolizing enzyme activities in human semen // Clinica Chimica Acta. 1973. Vol. 48, № 4. P. 393-401.
- Jiang O. et al. Quorum Sensing: a prospective therapeutic target for bacterial diseases // BioMed Research International. 2019.
- Karatan E., Duncan T.R., Watnick P.I. NspS, a predicted polyamine sensor, mediates activation of Vibrio cholerae biofilm formation by norspermidine // Journal of Bacteriology. 2005. Vol. 187, № 21. P. 7434-7443.
- Kanjee U. еt аl. Linkage between the bacterial acid stress and stringent responses: the structure of the inducible lysine decarboxylase // The EMBO Journal. 2011. Vol. 30, № 5. P. 931-944.
- Kolodkin-Gal I. et al. A self-produced trigger for biofilm disassembly that targets exopolysaccharide // Cell. 2012. Vol. 149, № 3. P. 684-692.
- Mah T.F. Biofilm-specific antibiotic resistance // Future Microbiology. 2012. Vol. 7, № 9. P. 1061-1072.
- Michael A.J. Polyamines in Eukaryotes, Bacteria, and Archaea // Journal of Biological Chemistry. 2016. Vol. 291, № 29. Р. 14896-14903.
- Miller M.B., Bassler B.L. Quorum sensing in bacteria // Annual Review of Microbiology. 2001. Vol. 55. P. 165-199.
- Naves P. et al. Correlation between virulence factors and in vitro biofilm formation by Escherichia coli strains // Microbial Pathogenesis. 2008. Vol. 45, № 2. P. 86-91.
- Nesse L.L., Berg K., Vestby L.K. Effects of norsper-midine and spermidine on biofilm formation by potentially pathogenic Escherichia coli and Salmonella enterica wild-type strains // Environmental Microbiology. 2015. Vol. 81, № 6. Р. 2226-2232.
- O'Toole G. A., Kolter R. Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development // Molecular Microbiology. 1998. Vol. 30, № 2. Р. 295-304.
- Peng Y.C. et al. Induction of the pho regulon and polyphosphate synthesis against spermine stress in Pseudomonas aeruginosa // Molecular Microbiology. 2017. Vol. 104, № 6. Р. 1037-1051.
- Pegg A.E., McCann P.P. Polyamine metabolism and function // American Journal of Physiology-Cell Physiology. 1982. Vol. 243, № 5. P. 212-221.
- Rhee H.J., Kim E.J., Lee J.K. Physiological polyamines: simple primordial stress molecules // Journal of Cellular and Molecular Medicine. 2007. Vol. 11, № 4. P. 685-703.
- Salyers A.A., Amabile-Cuevas C.F. Why are antibiotic resistance genes so resistant to elimination? // Antimicrobial Agents and Chemotherapy. 1997. Vol. 41, № 11. P. 2321-2325.
- Saxena P. et al. Biofilms: architecture, resistance, Quorum Sensing and control mechanisms // Journal of Microbiology. 2019. Vol. 59, № 1. P. 3-12.
- Stickler D. Biofilms // Current Opinion in Microbiology. 1999. Vol. 2, № 3. Р. 270-275.
- Suga H., Smith K.M. Molecular mechanisms of bacterial quorum sensing as a new drug target // Current Opinion in Chemical Biology. 2003. Vol. 7, № 5. Р. 586-591.
- Surette, M.G. Bassler B.L. Quorum sensing in Escherichia coli and Salmonella typhimurium // PNAS.USA. 1998. Vol. 95. P. 7046-7050.
- Tabor C.W., Tabor H. Polyamines in micrioorganisms // Clinical Microbiology Reviews. 1985. Vol. 40, № 1. P. 81-99.
- Tkachenko A.G., Nesterova L.Yu., Pshenichnov M.R. The role of natural polyamine putrescine in defense against oxidative stress in Escherichia coli // Archives of Microbiology. 2001. Vol. 176. P. 155-157.
- Vilchez R. et al. Analysing traces of autoinducer-2 requires standardization of the Vibrio harveyi bioassay // Analytical and Bioanalytical Chemistry. 2007. Vol. 387, № 2. Р. 489-496.
- Waters C., Bassler B. Quorum sensing: cell-to-cell communication in bacteria // Annual Review of Cell and Developmental Biology. 2005. Vol. 21. P. 319-346.
- Yao X., Lu C.D. Characterization of Staphylococcus aureus responses to spermine stress // Current Microbiology. 2014. Vol. 69, № 3. Р. 394-403.
- Yohannes E. et al. Polyamine stress at high pH in Escherichia coli K-12 // BMC Microbiology. 2005. №. 5. P. 59.
- Zhao W. еt аl. Antagonism toward the intestinal microbiota and its effect on Vibrio cholerae virulence // Science. 2018. № 359. P. 210-213.


