Биохимическая и молекулярно-биологическая характеристика культуры дермальных фибробластов крыс при гипоксии
Автор: Пономаренко Елена Алексеевна, Диатроптова Марина Анатольевна, Мхитаров Владимир Аршакович, Золотова Наталья Александровна, Михайлова Лилия Петровна, Артемьева Ксения Александровна, Богданова Ирина Марковна, Макарова Ольга Васильевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.30, 2022 года.
Бесплатный доступ
Культура клеток дермальных фибробластов является удобной моделью для исследования различных воздействий на клетки, включая гипоксию. Фибробласты, кроме продукции коллагена, способны синтезировать биогенные амины, гормоны, нейропептиды и нейротрансмиттеры, идентичные таковым в центральной нервной и эндокринной системе, что позволяет использовать их для исследования клеточных нарушений при различных заболеваниях. Цель исследования - с помощью биохимических и молекулярно-биологических методов оценить функциональные изменения культуры дермальных фибробластов в условиях гипоксии. В клетках культуры фибробластов при нормоксии (воздух и 5% СО2 в условиях инкубатора) и гипоксическом воздействии (смесь газов - 95% N2 и 5% СО2) продолжительностью 1 и 3 часа с помощью биохимических методов определяли активность аспартатаминотрансферазы (АсАТ), аланинаминотрансферазы (АлАT), гамма-глутамилтрансферазы (ГГТ), лактатдегидрогеназы (ЛДГ), уровень глюкозы, концентрации АТФ, АДФ, АМФ, а также методом полимеразной цепной реакции уровень экспрессии мРНК фактора индуцируемого гипоксией Hif-1a и нуклеарного фактора Nf-κb. Показано, что при гипоксическом воздействии в течение 1 часа в культуре фибробластов снижаются жизнеспособность клеток, уровень глюкозы и активность ЛДГ, АлАТ, АсАТ, уменьшается количество АТФ, через 3 часа отмечается тенденция к нормализации всех показателей. Адаптационные механизмы позволяют нормализовать функционирование клеток в условиях гипоксии от 1 до 3 часов. Результаты, полученные при оценке метаболических изменений в разные сроки гипоксического воздействия (1 и 3 часа) в культуре фибробластов крыс, свидетельствуют о высоких адаптационных возможностях клеток соединительной ткани - фибробластов при недостатке кислорода. Исследование внутриклеточных показателей при гипоксии, определение критических точек в зависимости от времени воздействия позволит определить направления дальнейшего изучения механизмов адаптации клеток, что, возможно, дополнит тактику компенсаторных воздействий при ишемии тканей различного генеза. Выявленные изменения отражают адаптивную реакцию культуры фибробластов в ответ на гипоксическое воздействие.Культура клеток дермальных фибробластов является удобной моделью для исследования различных воздействий на клетки, включая гипоксию. Фибробласты, кроме продукции коллагена, способны синтезировать биогенные амины, гормоны, нейропептиды и нейротрансмиттеры, идентичные таковым в центральной нервной и эндокринной системе, что позволяет использовать их для исследования клеточных нарушений при различных заболеваниях. Цель исследования - с помощью биохимических и молекулярно-биологических методов оценить функциональные изменения культуры дермальных фибробластов в условиях гипоксии. В клетках культуры фибробластов при нормоксии (воздух и 5% СО2 в условиях инкубатора) и гипоксическом воздействии (смесь газов - 95% N2 и 5% СО2) продолжительностью 1 и 3 часа с помощью биохимических методов определяли активность аспартатаминотрансферазы (АсАТ), аланинаминотрансферазы (АлАT), гамма-глутамилтрансферазы (ГГТ), лактатдегидрогеназы (ЛДГ), уровень глюкозы, концентрации АТФ, АДФ, АМФ, а также методом полимеразной цепной реакции уровень экспрессии мРНК фактора индуцируемого гипоксией Hif-1a и нуклеарного фактора Nf-κb. Показано, что при гипоксическом воздействии в течение 1 часа в культуре фибробластов снижаются жизнеспособность клеток, уровень глюкозы и активность ЛДГ, АлАТ, АсАТ, уменьшается количество АТФ, через 3 часа отмечается тенденция к нормализации всех показателей. Адаптационные механизмы позволяют нормализовать функционирование клеток в условиях гипоксии от 1 до 3 часов. Результаты, полученные при оценке метаболических изменений в разные сроки гипоксического воздействия (1 и 3 часа) в культуре фибробластов крыс, свидетельствуют о высоких адаптационных возможностях клеток соединительной ткани - фибробластов при недостатке кислорода. Исследование внутриклеточных показателей при гипоксии, определение критических точек в зависимости от времени воздействия позволит определить направления дальнейшего изучения механизмов адаптации клеток, что, возможно, дополнит тактику компенсаторных воздействий при ишемии тканей различного генеза. Выявленные изменения отражают адаптивную реакцию культуры фибробластов в ответ на гипоксическое воздействие.
Фибробласты, культура клеток, гипоксия, ферменты, крысы
Короткий адрес: https://sciup.org/143179727
IDR: 143179727 | DOI: 10.20340/mv-mn.2022.30(4).720
Текст научной статьи Биохимическая и молекулярно-биологическая характеристика культуры дермальных фибробластов крыс при гипоксии
Ponomarenko EA, Diatroptova MA, Mkhitarov VA, Zolotova NA, Mikhaylova LP, Artem’eva KA, Bogdanova IM, Makarova OV. Biochemical and molecular biological characterization of rat’s dermal fibroblast culture in hypoxia. Morfologicheskie Vedomosti – Morphological newsletter. 2022;30(4):720. (4).720
Введение. Культура клеток фибробластов является уникальной моделью для изучения реакции клеток на адаптивные и повреждающие воздействия, включая гипоксию [1]. Фибробласты, кроме продукции коллагена, способны синтезировать биогенные амины, гормоны, нейропептиды и нейротрансмиттеры, идентичные таковым в центральной нервной и эндокринной системе, что позволяет использовать их для исследования нарушений на клеточном уровне при различных заболеваниях. Например, было обнаружено, что фибробласты кожи пациентов с болезнью Паркинсона по сравнению со здоровыми лицами продуцируют в несколько раз больше пептида Аβ42 и α-синуклеина, что наблюдается и в нейронах черной субстанции головного мозга [2]. Культуру клеток фибробластов применяют при изучении заживления кожных ран. Так, на стадии раневого воспаления запускается каскад реакций между кератиноцитами и фибробластами. После повреждения кожи фибробласты синтезируют провоспалительные цитокины, в частности, интерлейкин-1. При раневом воспалении вслед за повышением экспрессии интерлейкина-1 возрастает экспрессия генов фактора роста кератиноцитов, интерлейкина-6, эндотелина-1, гепарин-связывающего фактора и гранулоцитарномакрофагального колониестимулирующего фактора роста, что приводит к активации пролиферации и дифференцировки кератиноцитов. Моделирование этого взаимодействия в культуре клеток позволяет исследовать основные механизмы заживления, эпителизации ран и формирования гипертрофического рубца [3-4].
В эксперименте на культуре дермальных фибробластов больных склеродермией условия гипоксии моделировали с помощью смеси газов или применении хлорида кобальта (CoCl2), химического индуктора фактора, индуцируемого гипоксией (Hypoxia-Inducible Factor - HIF-1α). Авторы установили, что активация HIF-1α приводит к повышению экспрессии фактора роста соединительной ткани (Connective Tissue Growth Facto - CTGF), стимулирующего образование коллагена в дерме [5]. При гипоксии в клетках активируется гликолиз и снижается синтез АТФ, изменяется их синтетическая активность [6-8]. Так, например, было выявлено, что в культуре фибробластов при гипоксическом воздействии в течение 1 часа продукция эластина и коллагена не изменялась, а при гипоксии длительностью 12 часов отмечалось угнетение их синтеза [1]. Таким образом, культивирование фибробластов в системе in vitro позволяет в динамике оценивать функциональные изменения клеток при гипоксии разной длительности.
Цель исследования : с помощью биохимических и молекулярнобиологических методов оценить функциональные изменения культуры дермальных фибробластов в условиях гипоксии.
Материалы и методы исследования. В работе использовали 10 самцов крыс Вистар в возрасте 8–10 недель и массой тела 160–180 г, полученных из филиала «Столбовая» Научного центра биомедицинских технологий Федерального медико-биологического агентства России. На проведение исследования было получено разрешение биоэтической комиссии НИИ морфологии человека имени академика А.П. Авцына (протокол № 12 от 19.09.2021). Животных выводили из эксперимента методом цервикальной дислокации под эфирным наркозом. Для получения культуры фибробластов у крыс проводили забор кожного лоскута размерами 1×1 см в области спины, удаляли эпидермис и подкожную клетчатку. Кожу измельчали и помещали в среду с коллагеназой II типа (Gibco № 17101-015, США) в концентрации 5 мг/мл на 2 ч в СО2- инкубатор. Клетки ресуспендировали в полной питательной среде и помещали в чашку Петри [9-10]. В течение 10 дней формировался полный монослой клеток. Исследовали три группы культур: фибробласты, культивируемые при нор-моксии (контроль, n=10) и гипоксии в течение 1 часа (n=10) и 3 часа (n=10).
Моделирование условий гипоксии выполняли с помощью герметичной камеры с установленным датчиком концентрации кислорода. В камеру помещали культуры клеток при 37°С на 1 и 3 часа и заполняли смесью газов (95% N 2 , 5% СО 2 ) до конечной нулевой концентрации О 2 [8]. Дермальные фибробласты контрольной группы культивировали в стандартных условиях СО 2 -инкубатора (воздух с 5% содержанием СО 2 , при 37°С). В работе использовали клетки 4-го пассажа. Жизнеспособность клеток определяли с помощью окрашивания трипановым синим и эозином. К 200 мкл 0,1% трипанового синего и 200 мкл 0,1% эозина («Биохиммак», Россия) добавляли суспензию клеток в объеме 100 мкл.
В культуре фибробластов крыс методом ПЦР в режиме реального времени определяли уровень экспрессии мРНК Hif-1a, Nf-κb. Выделение РНК проводили на колонках с применением набора «Био-лабмикс». Обратную транскрипцию выполняли с помощью набора «MMLV RT Kit» («Евроген»). С использованием смеси для ПЦР qPCRmix-HS SYBR («Евроген») определяли уровень экспрессии мРНК Hif-1α, Nf-κb относительно уровня экспрессии мРНК β2-микроглобулина (β2m) на приборе «DTprime» фирмы «ДНК-Технология». Использовали праймеры «Евроген»: Hif-1α f — GAGCCTTAA CCTATCTGTCA, r - CACAATCGTAACTG-GTCAGC; Nf-κb f — GACGATCCTTTCGG-AACTG, r — GC ATATGCCGTCCTCACAG; B2m f —CTCGCTCGGTGACCGTGAT, r — GGACA GATCTGACATCTCGA. Относительную концентрацию мРНК указанных генов рассчитывали методом прямого сравнения данных по формуле: [А]0/[В]0 =EΔС(Т), где [А]0 — начальная концентрация мРНК гена в ПЦР-смеси, [В]0 — начальная концентрация мРНК β2m в ПЦР-смеси, E — эффективность реакции (принимали равной 1,98), ΔС(Т) — разность пороговых циклов β2m и искомого гена в программе «REST 2009» [11]. Количество клеток на пробу для биохимического исследования различалось, но объем раствора Дульбекко составлял 500 мкл. Далее клетки разрушали путем последовательного трехкратного замораживания и размораживания при –70°С, центрифугировали и надосадочную жидкость переносили в пробирки. Измерения проводили с помощью автоматического анализатора «Mindray BS-120» (Mindray, Китай). Измеряли активность ферментов аспартатаминотрансферазы (далее АсАТ), аланинаминотрансферазы (далее АлАТ), гамма-глутамилтрансфера-зы (далее - ГГТ), лактатдегидрогеназы (далее - ЛДГ), уровень глюкозы – глюкозоок-сидазным методом, белка – пирогаллоловым методом, используя наборы реактивов «Human Diagnostics GmbH» (Human, Германия). Результаты нормировали на 1×106 клеток. Содержание АТФ, АДФ, АМФ определяли в клетках методом высокоэффективной жидкостной хроматографии. Суспензию клеток с их известным количеством центрифугировали, к осадку для экстракции АТФ, АДФ, АМФ добавляли 475 мкл 70% HClO4 (258 мкл HClO4, 20 мкл 0,5М Na2EDTA, доводили до 10 мл водой) и тщательно пипетировали. Затем раствор нейтрализовали добавлением 85 мкл 2М KOH. Суспензию центрифугировали при 14000g, 10 мин при 4°С. Пробы надосадочной жидкости замораживали и хранили при –70°С в течение 1 месяца [12]. Анализ проводили на жидкостном хроматографе Prominence-I LC-2030C 3D Plus с диодноматричным детектором (Shimadzu, Япония) с использованием колонки 125х4 мм, 3µм (Purospher STAR RP-18 endcapped, Merck, Германия).
Подвижная фаза «А»: 0,2М KH 2 PO 4 (pH=5,0), подвижная фаза «В»: смесь вода-ацетонитрил-метанол (50:25:25). Градиентное элюирование: 1 мин 1% «В», далее увеличивали до 35% в течение 3 мин, затем снова уменьшали до 1% за 2 мин и далее элюировали в таком же режиме до 8 мин перед следующим измерением. Условия проведения хроматографии: температура колонки – 30°С, скорость потока 1 мл/мин, длина волны детектирования –
254 нм, объем пробы – 5µл. Результаты представляли в мкмоль/л в объеме пробы 560 мкл, затем их стандартизировали на количество клеток 1×106.
Непрерывные количественные данные описывали медианой и квартилями (Q25% и Q75% или Q1;Q3). Дисперсионный анализ проводили с использованием критерия Краскела–Уоллиса. При наличии статистической разницы применяли попарное сравнение групп. При множественном сравнении групп применяли поправку Бонферрони. Нулевая гипотеза отвергалась при ошибке первого рода менее 5% с учетом эффекта множественного сравнения для трех групп на уровне p<0,017.
Результаты исследования и их об- суждение. В эксперименте нами использованы клеточные культуры дермальных фибробластов в фазе плато, морфологическая характеристика фибробластов в зависимости от времени воздействия гипоксии представлена на рисунках 1А, 1В, 1С. Культура клеток фибробластов после воздействия гипоксии в течение 1 часа характеризуется уменьшением размеров клеток, их очертания приобретают вытянутую форму с множеством извитых отростков с неровными, фестончатыми краями. По сравнению с контролем, в цитоплазме некоторых клеток определяется множество вакуолей. При воздействии гипоксии на культуру фибробластов в течение 3 часов каких-либо морфологических отличий не выявлено.
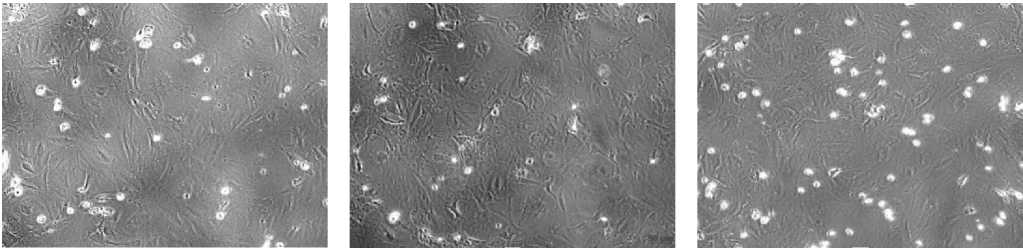
А В С
Рис. 1. Микрофото культуры дермальных фибробластов крысы. Обозначения: А – контроль В, С – воздействие гипоксии (В – 1 час, С – 3 часа). Фазово-контрастная микроскопия. Ув.: х200
Базовым показателем любого воздействия на клетки, в том числе и гипоксии, является их жизнеспособность. При воздействии гипоксии на культуру дермальных фибробластов крыс отмечалось снижение жизнеспособности клеток через 1 час культивирования по сравнению с контролем, статистически значимых различий не выявлено (р=0,66), а через 3 часа – повышение показателей по сравнению с 1 часом культивирования в условиях гипоксии (р=0,0005). Между показателями контрольной группы и 3 часами культивирования в условиях гипоксии отмечалась тенденция к статистически значимому увеличению жизнеспособности клеток на уровне р=0,06 (табл. 1).
В культуре клеток фибробластов проведено определение уровня экспрессии мРНК Hif-1a, Nf-kb (табл. 2). При ана- лизе уровня Hif-1a в разные сроки воздействия гипоксии выявлено, что экспрессия этого гена при гипоксии не отличалась от контроля, а при воздействии гипоксии в течение 3 часов показатель снижался, но статистически значимых различий по сравнению с контролем не установлено. Экспрессия Nf-κb в культуре клеток дермальных фибробластов, подвергшихся гипоксии в течение 1-го и 3-х часов, по сравнению с контролем статистически значимо не изменялась.
Результаты определения биохимических показателей представлены в табл. 3. Установлено, что через 1 час культивирования дермальных фибробластов животных в условиях гипоксии уровень глюкозы достоверно не изменялся по сравнению с контролем (р=0,14), а через 3 часа возрастал (р=0,08).
Таблица 1
Жизнеспособность дермальных фибробластов крыс в культуре при нормоксии и гипоксии продолжительностью 1 час и 3 часа, Ме(Q1;Q3)
|
Показатель |
Группы наблюдений |
|||
|
Контроль (*n=8) |
Гипоксия |
**p= |
||
|
1 час (*n=10) |
3 часа (*n=10) |
|||
|
Жизнеспособность (%) |
97(96;97) |
95(93;97) |
99(98;100) |
0,0006 |
Примечания: * - число образцов, ** - уровень достоверности различий по критерию Краскела—Уоллиса
Таблица 2
Уровень экспрессии м-РНК Hif-1a и Nf-κb в культуре дермальных фибробластов крыс при нормоксии и гипоксии продолжительностью 1 час и 3 часа, Ме(Q1;Q3)
|
Показатели |
Группы наблюдений |
|||
|
Контроль (*n=8) |
Гипоксия |
**р= |
||
|
1 час (*n=9) |
3 часа (*n=10) |
|||
|
Экспрессия Nf-кЬ |
0,007(0,005;0,06) |
0,007(0,006;0,012) |
0,005(0,004;0,006) |
0,26 |
|
Экспрессия Hif-1a |
0,02(0,007;0,04) |
0,03(0,01;0,03) |
0,009(0,008;0,013) |
0,34 |
Примечания: *-, **- см. примечания к таблице 1
Активность ЛДГ в клетках падала через 1 час при культивировании в условиях гипоксии по сравнению с контрольной группой (p=0,01) и возрастала через 3 часа (р=0,37) по сравнению с одночасовым гипоксическим воздействием. Выявлялось уменьшение активности АлАТ в клетках культуры дермальных фибробластов при гипоксическом воздействии в течение 1 часа по сравнению с контрольной группой (р=0,02), через 3 часа гипоксии отмечалось увеличение активности фермента, но статистических различий по сравнению с гипоксией в течение 1 часа не обнаружено. Также снижалась активность АсАТ при культивировании культуры в течение 1 часа в условиях гипоксии (р=0,02). Статистических различий показателей активности АсАТ в течение 1-го или 3-х часов гипоксии в клетках культуры фибробластов не обнаружено (р=0,62). Различия изменений показателей активности ГГТ были статистически не значимыми. Количество АТФ статистически значимо снижалось в клетках культуры дермальных фибробластов при гипоксии в течение 1 часа (р=0,02), а при гипоксии продолжительностью 3 часа отмечалась тенденция к увеличению показателя количества АТФ по сравнению с 1 часом гипоксии (р=0,06).
При измерении АДФ определялось уменьшение его в клетках культуры фибробластов при гипоксии продолжительностью 1 и 3 часа по сравнению с контрольной группой, но статистически значимо эти показатели не различались (р=0,07 и р=0,39, соответственно). Уровень АМФ в группах исследования не различался (табл. 4). Через 1 час гипоксического воздействия отмечается снижение жизнеспособности клеток, уровня глюкозы и АТФ и активности ферментов ЛДГ, АлАТ, АсАТ. При гипоксическом воздействии в течение 3 часов жизнеспособность клеток была выше, чем в контроле, но различия были статистически не значимыми, наблюдали тенденцию к восстановлению уровня глюкозы в клетках. Уровни активности ферментов ЛДГ, АлАТ и АсАТ также демонстрировали процессы восстановления. Уровень АТФ повышался по сравнению с 1 часом культивирования при гипоксии. Культура дермальных фибробластов, как и кожа в целом, характеризуется низкой чувствительностью к гипоксии [13]. В связи с этим, инкубация дермальных фибробластов в условиях гипоксии не вызывала повышения уровня экспрессии индуцируемого гипоксией Hif-1a и сопряженного с ним нуклеарного фактора Nf-кЬ.
Таблица 3
Биохимические показатели культуры дермальных фибробластов крыс при нормоксии и гипоксии продолжительностью 1 час и 3 часа, Ме(Q1;Q3)
|
Показатели, ед. изм. |
Группы наблюдений |
|||
|
Контроль (*n=8) |
Гипоксия |
**р= |
||
|
1 час (*n=10) |
3 часа (*n=10) |
|||
|
Глюкоза, ммоль/л |
0,21(0,14;0,41) |
0,07(0,01;0,15) |
0,56(0,06;0,66) |
0,04 |
|
ЛДГ, ед/л |
39(14;60) |
9(6;12) |
17(9;30) |
0,017 |
|
Белок, г/л |
0,38(0,24;0,46) |
0,22(0,18;0,38) |
0,25(0,21;0,32) |
0,32 |
|
АлАТ, ед/л |
3,0(1,0;7) |
0(0;0,3) |
0,3(0;1,6) |
0,01 |
|
АсАТ, ед/л |
15,6(8;34,5) |
1,8(0;3,8) |
3,8(1,2;19,2) |
0,02 |
|
ГГТ, ед/л |
3,9(3,5;4,8) |
3,8(2,8;4,9) |
5,2(3,6;6) |
0,49 |
Примечания: *-, **- см. примечания к таблице 1
Таблица 4
Концентрация АТФ, АДФ, АМФ в культуре дермальных фибробластов крыс при нормоксии и гипоксии продолжительностью 1 час и 3 часа, Ме(Q1;Q3)
|
Концентрация (мкмоль/ л) |
Группы наблюдений |
|||
|
Контроль (*n=6) |
Гипоксия |
**р= |
||
|
1 час (*n=5) |
3 часа (*n=6) |
|||
|
АТФ |
7,7(6,7;8,2) |
4,7(4,4;4,8) |
7,7(6,0;8,3) |
0,01 |
|
АДФ |
1,9(1,6;2,2) |
1,2(1,0;1,3) |
1,4(1,2;2,3) |
0,07 |
|
АМФ |
7,4(6,7;7,8) |
7,8(7,1;7,9) |
5,8(4,5;7,9) |
0,51 |
Примечания: *-, **- см. примечания к таблице 1
Заключение. Таким образом, нами установлено, что в культуре фибробластов при гипоксии в период до 1 часа происходит замедление всех метаболических реакций. Адаптационные механизмы позволяют нормализовать функционирование клеток в условиях гипоксии от 1 часа до 3 часов. Результаты, полученные при оценке метаболических изменений в разные сроки гипоксического воздействия (1 час и 3 часа) в культуре фибробластов крыс, свидетельствуют о высоких адаптационных возможностях клеток соединительной ткани - фибробластов при недостатке О 2 .
Исследование внутриклеточных показателей при гипоксии, определение критических точек в зависимости от времени воздействия, позволит определить направления дальнейшего изучения механизмов адаптации клеток, что, возможно, дополнит тактику компенсаторных воздействий при ишемии тканей различного генеза.
Исследование выполнено в рамках исполнения государственного задания Российского научного центра хирургии имени академика Б.В. Петровского, НИ-ОКТР № 122030200530-6.
Список литературы Биохимическая и молекулярно-биологическая характеристика культуры дермальных фибробластов крыс при гипоксии
- Kuz'micheva VI, Volova LT, Gil'miyarova FN i dr. Fibroblasty kak ob'ekt izucheniya proliferativnoy aktivnosti in vitro. Nauka i innovatsii v meditsine. 2020;5(3):210-215. In Russian. https://doi.org/10.35693/2500-1388-2020-5-3-210-215
- Zuev VA, Dyatlova AS, Lin'kova NS et al. Skin fibroblasts as the object for clinical diagnosis of Parkinson's disease in persons of different ages. Bull Exp Biol Med. 2019;167(1):177-181. https://doi.org/10.1007/s10517-019-04485-1
- Werner S, Krieg T, Smola H. Keratinocyte-fibroblast interactions in wound healing. J Invest Dermatol. 2007;127(5):998-1008. https://doi.org/10.1038/sj.jid.5700786
- Stunova A, Vistejnova L. Dermal fibroblasts-A heterogeneous population with regulatory function in wound healing. Cytokine Growth Factor Rev. 2018;39:137-150. https://doi.org/10.1016/j.cytogfr.2018.01.003
- Hong KH, Yoo SA, Kang SS et al. Hypoxia induces expression of connective tissue growth factor in scleroderma skin fibroblasts. Clin Exp Immunol. 2006;14(2):362-70. https://doi.org/10.1111/j.1365-2249.2006.03199.x
- Luk'yanova LD. Signal'nye mekhanizmy gipoksii. Moskva: RAN, 2019.- 215s. In Russian
- Bozo IYa, Deev RV, Pinaev GP. «Fibroblast” - spetsializirovannaya kletka ili funktsional'noe sostoyanie kletok mezenkhimal'nogo proishozhdeniya? Tsitologija. 2010;52(2):99-109. In Russian
- Aptekar' IA, Kostolomova EG, Suhovey YuG. Izmenenie funktsional'noy aktivnosti fibroblastov v protsesse modelirovaniya kompressii, giperkapnii i gipoksii. Rossiysky osteopatichesky zhurnal. 2019;1-2:72-84. In Russian. https://doi.org/10.32885/2220-0975-2019-1-2-72
- Rittié L, Fisher GJ. Isolation and culture of skin fibroblasts. Methods Mol Med. 2005;117:83-98. https://doi.org/10.1385/1-59259-940-0:083
- Ponomarenko EA, Diatroptova MA, Artem'eva KA, Shelkov AYu. Optimizatsiya protokola polucheniya kul'tury dermal'nykh fibroblastov krys. Klinicheskaya i eksperimental’naya morfologiya. 2021;10(2):62-69. In Russian. https://doi.org/10.31088/CEM2021.10.2.62-69
- Dzhalilova DS, Diatroptov ME, Tsvetkov IS et al. Expression of Hif-1α, Nf-κb, and Vegf Genes in the Liver and Blood Serum Levels of HIF-1α, Erythropoietin, VEGF, TGF-β, 8-Isoprostane, and Corticosterone in Wistar Rats with High and Low Resistance to Hypoxia. Bull Exp Biol Med. 2018;165(6):742-747. https://doi.org/10.1007/s10517-018-4264-x
- Menegollo M, Tessari I, Bubacco L, Szabadkai G. Determination of ATP, ADP, and AMP Levels by Reversed-Phase High-Performance Liquid Chromatography in Cultured Cells. Methods Mol Biol. 2019;1925:23-232. https://doi.org/10.1007/978-1-4939-9018-4_19
- Zarubina IV. Sovremennye predstavleniya o patogeneze gipoksii i ee farmakologicheskoy korrektsii. Obzory po klinicheskoy farmakologii i lekarstvennoy terapii. 2011;9(3):31-48. In Russian


