Биохимические аспекты применения дополнительной фармакотерапии при лечении психозов позднего возраста
Автор: Бокша Ирина Сергеевна, Шешенин Владимир Сергеевич, Савушкина Ольга Константиновна, Терешкина Елена Борисовна, Прохорова Татьяна Андреевна, Почуева Валерия Витальевна, Воробьева Елена Анатольевн, Бурбаева Гульнур Шингожиевна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Психофармакотерапия
Статья в выпуске: 2 (115), 2022 года.
Бесплатный доступ
Актуальность. Психотические расстройства, формирующиеся в результате взаимного влияния биологических, психофизиологических, психологических и социально-средовых факторов - частое явление в пожилом возрасте. Неоспорима связь между нарастающей динамикой психоза и высокой заболеваемостью и смертностью в контингенте пожилых пациентов, несмотря на различную этиологию и разнообразие клинических проявлений психотических состояний. Антипсихотическую медикаментозную стратегию терапии следует использовать, пунктуально соблюдая меры предосторожности, с целью оптимизации конечных результатов. С позиций системного подхода к повышению результативности комплексной персонализированной терапии больных геронтопсихиатрического профиля не вызывает сомнений необходимость поиска наиболее оптимальных лекарственных средств, назначаемых дополнительно к психотропной терапии пациентам с психозами позднего возраста (ППВ). Подключение дополнительной терапии обусловлено высокой частотой развития нежелательных симптомов, связанных с проявлением побочного действия психотропных препаратов и гетерогенностью клинических и биохимических параметров пожилых пациентов с ППВ. Цель: выделить клинические критерии назначения дополнительной антиоксидантной/антигипоксической терапии больным с ППВ и определить биохимические параметры крови, которые являются специфичными ферментативными признаками для этой категории пациентов. Материал и методы. С использованием непараметрических методов статистики проведен сравнительный анализ терапевтической эффективности в трех клинических группах пациентов с ППВ. пролеченных по стандартным алгоритмам нейролептической и антидепрессивной терапии. Группа 1 - пациенты, не получавшие дополнительной терапии, кроме основной психотропной (Гр1, n=16). Группа 2 - пациенты, получавшие дополнительно к психотропной терапии 2-этил-6-метил-3-гидроксипиридина сукцинат (мексидол, Гр2, n=20), обладающий антиоксидантным, антигипоксическим и мембранопротекторным действием. Группа 3 - пациенты, получавшие дополнительно к психотропной терапии другие нейрометаболические препараты (Гр3, n=22). Вспомогательная терапия назначалась для устранения/снижения риска развития нежелательной побочной симптоматики в результате действия психотропных препаратов. До и после курса лечения у пациентов с ППВ проводили оценку психического состояния (баллы) с использованием психометрических шкал и определяли биохимические показатели крови (активность ферментов метаболизма глутамата и глутатиона в тромбоцитах и эритроцитах). Ферментативную активность определяли также в контрольной группе, уравненной по возрасту и численности представителей каждого пола (n=38). Результаты. По данным сравнительного анализа установлено, что активность эритроцитарной глута-тионредуктазы (ГР) снижена до и после курса лечения во всех трех клинических группах пациентов при сопоставлении с контрольной группой. В отличие от Гр1 и Гр3, в Гр2 зарегистрировано статистически значимое снижение исходной активности тромбоцитарных глутаматдегидрогеназы (ГДГ) и глутатион-S-трансферазы (ГСТ). После курса сочетанной терапии показатели ГДГ и ГСТ в Гр2 достигли значений, соответствующих значениям в контрольной группе. Вместе с тем в Гр1 показатели ГДГ и ГСТ продемонстрировали ещё большее снижение относительно исходного уровня после психотропного лечения без присоединения антиоксидантной/антигипоксической терапии. Между биохимическими параметрами и количественной балльной оценкой по психометрическим шкалам установлены различные статистически значимые связи во всех трех клинических группах пациентов с ППВ, причем некоторые из них могут выступать в роли прогностических предикторов эффективности лечения.
Пациенты с диагностированными психозами позднего возраста, основная психофармакотерапия (нейролептики и антидепрессанты), дополнительная антиоксидантная/антигипоксическая фармакотерапия, мексидол, нейрометаболические препараты
Короткий адрес: https://sciup.org/142236313
IDR: 142236313 | УДК: 616.895.87-055.1-055.2,465х45х78,:615.214:632.95.026.4:616 | DOI: 10.26617/1810-3111-2022-2(115)-64-75
Текст научной статьи Биохимические аспекты применения дополнительной фармакотерапии при лечении психозов позднего возраста
Терапевтический эффект препаратов, содержащих янтарную кислоту (ЯК), основан на её биологическом действии. ЯК может выступать в роли специфического лиганда орфанных рецепторов (SUCNR1, GPR91), расположенных на цитоплазматической мембране клеток и сопряженных с G-белками (Gi/Go и Gq). В результате связывания с этими рецепторами ЯК проявляет гормоноподобное действие в различных органах и тканях [1]: при активации этих рецепторов повышается давление крови, увеличивается реабсорбция фосфатов и глюкозы, стимулируется глюконеогенез посредством непрямого усиления образования ренина.
В механизме реакции нейрональных стволовых клеток при трансплантации в мышиной модели рассеянного склероза на внеклеточную ЯК участвует модуляция нейровоспаления с высвобождением противовоспалительного простагландина E2 [2], что снижает повреждение нейронов и выраженность моторных нарушений. Антиги-поксический и ряд других системных эффектов ЯК могут основываться на её способности влиять на концентрацию белка hypoxia-inducible factor 1-alpha (HIF-1α). Отметим, что в отличие от кислорода, активирующего пролилгидроксилазные реакции, ответственные за убиквитин-зависимый протеолиз HIF-1α, ЯК ингибирует их, способствуя тем самым накоплению HIF-1α в ядре. Механизм регуляции экспрессии HIF-1α посредством ЯК был выяснен в экспериментах на лабораторных животных, при проведении которых обнаружены следующие факты. Вызванная гипоксией немедленная экспрессия HIF-1 α в коре головного мозга регулируется ЯК, продуцируемой как в цикле Кребса, так и в челночной реакции ГАМК, а также индуцируется препаратами, содержащими ЯК, т.е. регулируется ЯК эндогенного и экзогенного происхождения [3]. Эти факты доказывают существование зависимой от ЯК сигнальной регуляции, вовлеченной в немедленную и отсроченную молекулярную адаптацию и повышение устойчивости к дефициту кислорода, где ЯК выступает в качестве сигнальной молекулы. Обнаружено, что интенсивность этого процесса различается в организмах животных с низкой и высокой устойчивостью к гипоксии. Индуцированный гипоксией HIF-1α действует как основной регулятор кислородного гомеостаза и активирует экспрессию белков, участвующих в адаптации к измененной оксигенации тканей. Выявлено более сотни HIF-1α-контролируемых генов, продукты которых участвуют в транспорте и метаболизме глюкозы, ангиогенезе, сосудистом тонусе, эритропоэзе, клеточном цикле, клеточной дифференцировке. Из-за нарушения регуляции
HIF-1α происходит сбой в формировании защитных приспособительных механизмов при гипоксии, повышается риск канцерогенеза [3]. HIF-1α опосредует индукцию генетического аппарата, ответственного за формирование структурной основы долговременной адаптации к гипоксии, и регулирует экспрессию генов, кодирующих белки, участвующие в базовом функционировании клетки. В экспериментальных исследованиях показано, что влияние HIF-1α на исходы ишемии может зависеть от продолжительности гипоксии-ишемии, возраста и вида животных. Предполагается, что дальнейшее исследование отношения ЯК к сигнальному пути PI3K/Akt может расширить понимание потенциальных мишеней для лечения заболеваний, сопровождающихся гипоксией-ишемией [4]. Таким образом, накоплены фактические материалы, доказательно обосновывающие существование зависимой от ЯК сигнальной регуляции, вовлеченной в немедленную и отсроченную молекулярную адаптацию и повышение устойчивости к дефициту кислорода, в которой ЯК выступает в качестве сигнальной молекулы [3].
Опубликованы также результаты клинических испытаний ЯК. Например, в исследовании, проведенном на группе из 8 пациентов с черепномозговой травмой, показано, что снижение соотношения лактат/пируват у пациентов после перфузии ЯК статистически значимо коррелировало с увеличением соотношения фосфокреатин/АТФ. Данные результаты свидетельствуют, что соотношение лактат/пируват связано с энергетическим состоянием мозга, а также что ЯК может поддерживать энергетический метаболизм головного мозга у пациентов с острой ЧМТ, страдающих митохондриальной дисфункцией [5]. Эти факты являются основанием для клинического применения препаратов, содержащих ЯК, при заболеваниях мозга человека.
Одним из таких лекарственных веществ является 2-этил-6-метил-3-гидроксипиридина сукцинат (мексидол). Действительно, этот препарат влияет на церебральный митохондриогенез в молодом возрасте и при старении [6], ингибирует нейрональную эксайтотоксичность in vitro [7] и успешно применяется в комплексной терапии в неврологии (при ишемических поражениях головного мозга), инфекционной патологии (в комплексной реабилитации после COVID-19) [8, 9], а также в психиатрии (в том числе при лечении шизофрении) [10, 11] и в геронтопсихиатрии [12, 13]. Увеличение частоты осложнений психофармакотерапии по мере старения больных определяет приоритетность и актуальность проблемы предотвращения и адекватной коррекции побочных эффектов терапии в позднем возрасте.
Именно поэтому не прекращается поиск препаратов, в том числе обладающих антиоксидантными и нейропротективными свойствами, улучшающих переносимость психотропной терапии и снижающих выраженность соматоневрологиче-ских осложнений в пожилом возрасте [14].
Когнитивные нарушения, встречающиеся при психозах позднего возраста, могут отражать как собственно влияние возрастного фактора, демонстрируя формирование начальной стадии развития нейродегенеративного процесса, так и быть результатом нежелательного действия антипсихотиков. Именно с этими факторами связано дополнительное назначение препаратов с антиоксидантными и нейропротективными свойствами при ППВ. 2-этил-6-метил-3-гидроксипиридина сукцинат хорошо переносится пациентами, отмечается его способность предотвращать или ослаблять побочные эффекты нейролептиков, такие как поздняя дискинезия [11]. Однако его применение при шизофрении, особенно при ППВ, в некоторых случаях должно быть ограничено, поскольку препарат может оказывать некоторое стимулирующее действие на ЦНС. Вместе с тем его применение может оказать пользу определенной категории пациентов. Несомненно, больные шизофренией, особенно с ППВ, основательно различаются по клиническим и биохимическим параметрам и могут быть стратифицированы в соответствии с биохимическими параметрами крови, связанными с антиоксидантным и глутаматным метаболизмом [15]. Такая стратификация могла бы помочь более прицельно и эффективно использовать фармакотерапию, дополнительную к антипсихотическим препаратам.
В настоящей работе с целью ретроспективного и проспективного анализа биохимических данных пациентов с ППВ изучена активность ферментов крови, связанных с глутаматным и антиоксидантным глутатионовым метаболизмом, с учетом предыдущего опыта использования этих параметров при стратификации пожилых пациентов психиатрического профиля [13].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Выделить клинические критерии назначения дополнительной антиоксидантной / антигипоксиче-ской терапии больным с ППВ и определить биохимические параметры крови, которые являются специфичными ферментативными признаками для этой категории пациентов.
Цель сформулирована для проверки гипотезы об эффективности применения 2-этил-6-метил-3-гидроксипиридина сукцината как дополнительной составляющей в реализации комплексной терапии, снижающей побочные эффекты психотропных средств и повышающей её переносимость у пациентов с ППВ, имеющих определенные био- химические параметры крови. Для проверки нашего предположения прослежена динамика изменения биохимических показателей крови у пациентов с ППВ, получавших помимо основной антипсихотической или антидепрессивной терапии дополнительно курсовую терапию препаратами с антиок-сидантными/антигипоксическими и нейрометабо-лическими/нейропротекторными свойствами.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования, пациенты, клинические оценки, обоснование выбора терапии
База исследования: стационарное геронтологическое отделение клиники ФГБНУ НЦПЗ. Длительность исследования: 28 дней. Сроки исследования: 2020-2022 гг.
В исследовательскую выборку вошли пациенты с диагнозами по МКБ-10: шизофрения параноидная (F20.0), поздняя парафрения (F22.0), шизоаффективное расстройство (F25), органическое бредовое (шизофреноподобное) расстройство (F06.2). В клинической выборке преобладали пациенты с ППВ женского пола (55 женщин и 3 мужчины) в возрасте от 45 до 78 лет (дебют после 40 лет) [16, 17]. Длительность заболевания колебалась в пределах от 0,5 года до 29 лет.
Исследование было открытым, нерандомизированным. Критерий исключения: наличие синдрома деменции, тяжёлые или декомпенсированные соматические заболевания.
Все больные получали психофармакотерапию (нейролептики, антидепрессанты и транквилизаторы по необходимости). Выбор препаратов осуществлялся с учетом оценки психопатологических и неврологических проявлений. Общая выборка пациентов (n=58) была разделена на три группы. Группа 1 – пациенты, не получавшие дополнительной терапии, кроме основной психотропной (Гр1, n=16). Группа 2 – пациенты, получавшие дополнительно к психотропной терапии 2-этил-6-метил-3-гидроксипиридина сукцинат (мексидол, Гр2, n=20), обладающий антиоксидантным, антигипоксическим и мембранопротекторным действием, в дозе 200-300 мг/сутки внутривенно, 10-14 процедур. Группа 3 – пациенты, получавшие дополнительно к психотропной терапии другие препараты (Гр3, n=22) с нейрометабо-лическим спектром действия (цитиколин, цереб-ролизин, кортексин, холина альфосцерат).
Выраженность психотической симптоматики оценивали в динамике по шкале позитивных и негативных синдромов (PANSS), степень тяжести депрессии – по рейтинговой шкале депрессии Гамильтона (HAMD-17), тяжесть психического состояния – по шкале общего клинического впечатления (CGI), когнитивное функционирование – по мини-тесту психического состояния MMSE (Mini Mental State Examination).
Таблица 1. Сравнительное распределение демографических и клинико-динамических показателей психодиагностического тестирования в общей выборке пациентов (n=58)
|
Параметр |
Клиническая группа пациентов |
||
|
Гр1 (n=16) |
Гр2 (n=20) |
Гр3 (n=22) |
|
|
Средний возраст, лет |
63 [56; 71] |
65 [59; 70] |
70 [61; 80] |
|
Средняя длительность заболевания, лет |
10 [2; 14] |
6 [2; 19] |
9 [5; 17] |
|
Средний возраст начала заболевания, лет |
50 [45; 63] |
57 [45; 67] |
57 [45; 74] |
|
Показатели по психодиагностическим шкалам на начало терапии (среднее суммарное количество баллов) |
|||
|
PANSS-Pos |
27 [24; 33] |
24 [17; 26] |
26 [21; 29] |
|
PANSS-Neg |
23 [18; 27] |
17 [14; 25] |
21 [17; 24] |
|
PANSS-Psy |
49 [45; 59] |
50 [44; 55] |
50 [45; 56] |
|
PANSS |
99 [87; 120] |
93 [85; 101] |
95 [86; 110] |
|
CGI |
5 [4; 6] |
5 [4; 5] |
5 [4; 6] |
|
HAMD-17 |
19 [15; 24] |
19 [14; 26] |
22 [19; 25] |
|
MMSE |
27 [24; 28] |
25 [23; 28] |
24 [22; 27] |
|
Показатели по психодиагностическим шкалам после терапии (среднее суммарное количество баллов) |
|||
|
PANSS-Pos |
17 [12; 20] |
13 [10; 15] |
15 [14; 18] |
|
PANSS-Neg |
18 [13; 22] |
13 [11; 18] |
17 [14; 20] |
|
PANSS-Psy |
36 [34; 43] |
32 [28; 37] |
34 [30; 41] |
|
PANSS |
72 [56; 81] |
62 [52; 68] |
67 [59; 78] |
|
CGI |
3 [2; 4] |
2 [1; 3] |
3 [2; 3] |
|
HAMD-17 |
9 [3; 11] |
6 [3; 10] |
8 [5; 11] |
|
MMSE |
29 [28; 29] |
28 [25; 30] |
26 [24; 28] |
П р и м е ч а н и е. В таблице приведены медианы (минимальное и максимальное значение ‒ 25% и 75%-квартили). Между клиническими группами пациентов не обнаружено статистически значимых различий ни по одному из параметров.
В персонализированных терапевтических программах использовались типичные и атипичные антипсихотики, назначавшиеся в низких и средних терапевтических дозах, принятых в геронтопсихиатрической практике. Наиболее часто рекомендованными нейролептиками были оланзапин (n=29) и галоперидол (n=18). При выраженной депрессивной симптоматике в структуре психоза проводилась антидепрессивная терапия (преимущественно СИОЗС), в большинстве (65%) случаев препаратом выбора был флувоксамин.
По психометрическим шкалам (PANSS, CGI, HAMD, MMSE) и биохимическим показателям крови (активность глутаматдегидрогеназы, глута-тионредуктазы, глутатион-S-трансферазы в тромбоцитах и эритроцитах) проводили клиникодинамическое наблюдение (две контрольные точки: до и после курса лечения). Полученные результаты заносили в электронную базу данных для последующего анализа и интерпретации массива данных.
Образцы крови собирали и обрабатывали по стандартным методикам, описанным ранее [18]. Выделение тромбоцитов и определение ферментативной активности проводили следующим образом. Забор крови для исследования активности ферментов ГДГ, ГР и ГСТ проводили однократно в контрольной группе и дважды в клинических группах пациентов с ППВ: до начала и после окончания курсовой терапии. Образцы крови со- бирали в вакутейнеры с 3,2% цитратом натрия и обрабатывали в течение 2 часов после забора крови. Цельную кровь центрифугировали 15 минут при 200 g и 20°C с получением обогащенной тромбоцитами плазмы (PRP) и осадка, содержащего эритроциты. PRP центрифугировали 20 минут при 2000 g и 4°C, осадок ресуспендировали в 0,1 М цитратном буфере с 0,1 М глюкозой (pH 5,7) и центрифугировали 20 минут при 2000 g, 4°C. Содержащий тромбоциты осадок ресуспен-дировали в 0,05 М трис-HCl-буфере, рН 7,0, с 50% глицерином и хранили при -20°С. Непосредственно перед определением ферментативной активности к образцам тромбоцитов добавляли 50 мМ К-фосфатный буфер, рН 7,4, содержащий до-децил-β-D-мальтозид, до конечной его концентрации 1%, лизис проводили 10 минут при 25°С, затем образцы центрифугировали 10 минут при 9000 g, 4°С. Полученный супернатант разбавляли в 5 раз 50 мМ К-фосфатным буфером, рН 7,4. Осадок с эритроцитами разбавляли тремя объемами 0,9%-ного раствора NaCl, перемешивали переворачиванием и центрифугировали 20 минут при 400 g, 4°С. Удаляли супернатант (захватывая слой лимфоцитов). Процедуру повторяли дважды. Отмытые эритроциты делили на аликвоты и хранили при -80°С. Непосредственно перед определением ферментативной активности эритроциты оттаивали и лизировали в 10 объемах холодной дистиллированной воды.
Активность всех ферментов определяли спектрофотометрическими кинетическими методами с использованием планшетного спектрофотометра xMark (Bio-Rad).
Определение биохимических показателей крови
Активность ГДГ, ГР, ГСТ в экстрактах клеток крови измеряли спектрофотометрическими методами, как описано ранее [18, 19]. Во всех случаях активность эритроцитарных ферментов далее приведена с указанием типа клеток (эритроцитарная), а активность тромбоцитарных ферментов для краткости ‒ без указания типа клеток.
Активность ГДГ определяли (только в тромбоцитах) по скорости снижения поглощения НАД•Н при 340 нм по методу Фишера [20] согласно ранее предложенным модификациям [21]. Активность ГР определяли по скорости окисления НАДФ•Н в реакции восстановления окисленного глутатиона [22]. Активность ГСТ определяли по скорости образования хромогенных конъюгатов между глутатионом и 1-хлор-2,4-динитробензолом [23]. Концентрацию белка определяли по методу Лоури, используя набор для определения концентрации белка Bio-Rad DC Protein Assay (США) и бычий сывороточный альбумин (Sigma-Aldrich, США) в качестве белкового стандарта. После определения концентрации белка рассчитывали удельную активность каждого фермента (Ед/мг).
Активности ферментов крови оценивали также в контрольной группе, уравненной по численности представителей каждого пола и возрасту (n=38), состоящей из добровольцев без психиатрической или неврологической патологии.
Для статистического анализа базы данных с результатами обследования актуального психического состояния пациентов и измерения активности ферментов использовали модуль «непараметрический анализ» программы Statistica 8.0 (StatSoft). Для оценки значимости различий, изменений параметров и связей применяли U-критерий Манна‒Уитни, метод парных сравнений Вилкоксона, расчет коэффициентов ранговой корреляции Спирмена, критерий Краске-ла‒Уоллиса. Различия и корреляционные зависимости были статистически значимы при р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Набор больных для включения в группу 2, клинико-психопатологическая оценка состояния пациентов и биохимические показатели крови
Перед проведением курса психотропной терапии больного относили к Гр2 (с назначением мек-сидола) по результатам оценки предшествующего медикаментозного опыта лечения пациентов пожилого возраста с психическими расстройствами. Препарат назначали при наличии побочных эффектов предыдущей психотропной терапии. К побочным действиям психофармакотерапии отнесены неврологические нежелательные явления (лекарственный паркинсонизм, дизартрия, тремор, акатизия), сердечно-сосудистые и вегетативные нарушения разной степени тяжести (гипотония, головокружения, сухость во рту). В Гр2 выявлена более низкая выраженность психоза, чем в Гр1 и Гр3, но различия исходной суммарной количественной оценки тяжести состояния по PANSS между группами не имели статистической значимости (табл. 1). В то же время балльная оценка по пунктам подшкалы PANSS-Pos (галлюцинации, бред величия и подозрительность) и по двум пунктам подшкалы PANSS-Neg (притупленный аффект и бедный раппорт) в Гр2 оказались статистически значимо (p<0,05) ниже, чем в Гр1. В структуре психотического состояния пациентов ГР2 были более выражены следующие симптомы: ипохондрия, стойкие жалобы на физическое состояние (с учетом возрастного фактора объективного характера), соматическая озабоченность. У всех пациентов Гр2 по данным компьютерной томографии головного мозга обнаружена атрофия мозжечка (признаки атрофических изменений мозжечка фиксировали однократно, до курса терапии). Проявлениями мозжечковой атаксии являются нарушения походки, координации движений и равновесия, частые падения.
Сравнительной анализ биохимических показателей крови в Гр1, Гр2 и Гр3
Проведено сравнительное изучение уровней ферментативной активности тромбоцитарной ГДГ, тромбоцитарных и эритроцитарных ГР и ГСТ в клинических группах и контрольной группе с помощью теста Краскела‒Уоллиса (табл. 2).
Т а б л и ц а 2. Результаты сравнения ферментативной активности глутаматдегидрогеназы, глутатионредуктазы и глутатион-S-трансферазы в тромбоцитах и эритроцитах у пациентов клинических групп и лиц контрольной группы согласно критерию Краскела‒Уоллиса
|
Ферментативная активность |
До лечения |
После лечения |
||
|
H |
р |
H |
р |
|
|
Глутаматдегидрогеназа (ГДГ) |
7,51 |
0,057 |
9,61 |
0,022 |
|
Глутатионредуктаза (ГР) |
2,82 |
0,420 |
4,68 |
0,197 |
|
Глутатион-S-трансфераза (ГСТ) |
7,60 |
0,055 |
8,77 |
0,033 |
|
Эритроцитарная глутатионредуктаза |
9,65 |
0,022 |
10,78 |
0,013 |
|
Эритроцитарная глутатион-S-трансфераза |
0,76 |
0,862 |
0,91 |
0,823 |
П р и м е ч а н и е. Выявленные статистически значимые различия выделены жирным шрифтом.
На приведённых далее рисунках 1, 2 и 3 представлены показатели ферментативной активности тромбоцитарных ГДГ и ГСТ и эритроцитарной ГР, измеренные в двух точках исследования (до и после лечения), у пациентов Гр1, Гр2, Гр3 и условно здоровых лиц контрольной группы.
По сравнению с контрольной группой эритроцитарная ГР оказалась статистически значимо (p<0,01) сниженной до и после лечения во всех трех группах пациентов (по U-критерию Манна-Уитни для каждой группы). Однако по другим биохимическим показателям обнаружены и определенные межгрупповые различия. Так, в отличие от Гр1 и Гр3, исходные показатели активности
ГДГ и ГСТ в Гр2 были статистически значимо (p<0,005) ниже относительно таковых значений в контрольной группе (это касается попарного сравнения клинических групп с контрольной группой). После курсового лечения антипсихотическими препаратами и мексидолом показатель активности ГДГ в Гр2 характеризовался возвратом к значениям нормы и отсутствием различий (р>0,05) при сравнении с контрольной группой здоровых. Однако в Гр1 после психотропной терапии без включения нейрометаболических препаратов зафиксировано статистически значимое (р<0,002) снижение показателя активности ГДГ по сравнению с контрольной группой.
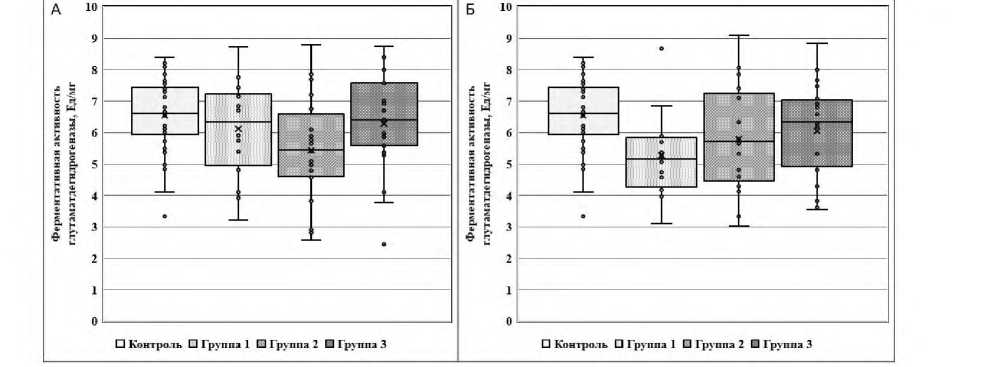
Рисунок 1. Ферментативная активность глутаматдегидрогеназы до (А)
и после лечения (Б) у пациентов Гр1, Гр2 и Гр3 и условно здоровых лиц контрольной группы
Примечание. Исходная активность ГДГ статистически значимо (p<0,005) снижена в Гр2 по сравнению с контрольной группой по U-критерию Манна-Уитни.
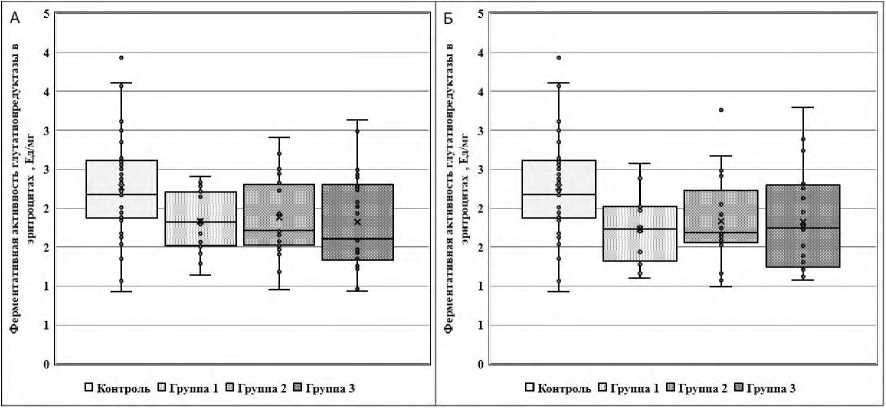
Рисунок 2 . Ферментативная активность эритроцитарной глутатионредуктазы до (А)
и после лечения (Б) у пациентов Гр1, Гр2 и Гр3 и условно здоровых лиц контрольной группы
П р и м е ч а н и е. Активность глутатионредуктазы статистически значимо (p<0,01) снижена во всех трех группах пациентов до и после лечения по сравнению с контрольной группой по U-критерию Манна-Уитни.
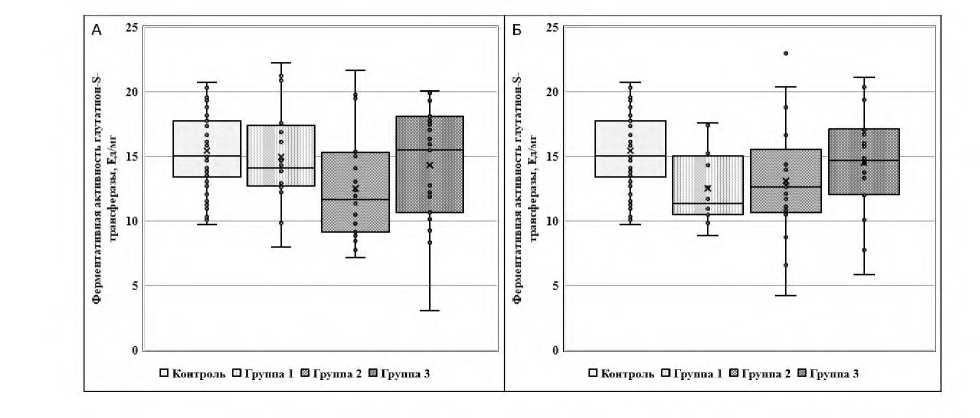
Рисунок 3. Ферментативная активность тромбоцитарной глутатион-8-трансферазы до (А) и после лечения (Б) у пациентов Гр1, Гр2 и Гр3 и условно здоровых лиц контрольной группы
П р и м е ч а н и е. Активность глутатион-S-трансферазы статистически значимо (p<0,005) снижена у пациентов Гр2 до лечения по сравнению с контрольной группой по U-критерию Манна‒Уитни.
Сравнительный анализ динамики биохимических показателей (на момент поступления и после лечения) продемонстрировал статистически значимое (p<0,006) снижение активности ГСТ в Гр1 после основной психотропной терапии без назначения дополнительного курса лечения согласно оценке с применением критерия парных сравнений Вилкоксона. Как следствие, показатель активности ГСТ после антипсихотической терапии в Гр1 имел статистически значимое (p<0,02) более низкое значение по сравнению с контрольной группой по U-критерию Манна‒Уитни.
По результатам исследования зарегистрированы корреляционные взаимосвязи между биохимическими показателями крови и актуальным психическим состоянием пациентов. Биохимические показатели и количественная оценка психопатологической симптоматики по психометрическим шкалам PANSS, HAMD и CGI имели корреляционные взаимосвязи во всех группах пациентов клинической выборки.
В Гр1 обнаружены положительные статистически значимые взаимосвязи между исходным уровнем ГДГ и оценкой психотического состояния после психотропной терапии – количественная суммарная балльная оценка по шкале PANSS (R=0,6, p<0,03) и подшкале PANSS-Pos (R=0,8, p<0,001). Исходный уровень эритроцитарной ГСТ характеризовался статистически значимой положительной корреляционной взаимосвязью с первоначальной (при поступлении) количественной суммарной балльной оценкой по шкале PANSS (R=0,6, p<0,01) и по двум подшкалам ‒ PANSS-Neg негативных расстройств и PANSS-Psy общей психопатологии (R=0,5, p<0,03, R=0,6, p<0,01 со- ответственно), а также по шкале CGI (R=0,5, p<0,03). Кроме того, установлены положительные статистически значимые корреляционные взаимосвязи между исходным уровнем активности ГДГ и суммарным количеством баллов по психодиагностическим шкалам HAMD и CGI после курса антипсихотической терапии (R=0,7, p<0,02 для каждого параметра).
В Гр2 отмечалась статистически значимая отрицательная корреляционная взаимосвязь между исходным уровнем ГДГ и суммарным количеством баллов после лечения по стандартизованной оценке PANSS (R=-0,4, p<0,05), причем характер взаимосвязи был диаметрально противоположен положительной корреляционной связи между теми же параметрами в Гр1. В Гр2, так же как и Гр1, обнаружена статистически значимая положительная корреляционная взаимосвязь между зафиксированным на момент поступления показателем эритроцитарной ГСТ и двумя стартовыми (при поступлении) показателями ‒ количественной суммарной балльной оценкой по шкале PANSS (R=0,6, p<0,01) и суммарной балльной оценкой по подшкале PANSS-Psy (R=0,5, p<0,02). В отличие от двух других клинических групп, в Гр2 зафиксирована статистически значимая положительная корреляционная взаимосвязь между уровнем эритроцитарной ГСТ на момент первичного обследования и количественной суммарной балльной оценкой по подшкале PANSS-Psy (R=0,45, p<0,05) и количественной суммарной балльной оценкой по шкале CGI (R=0,5, p<0,04), выставленной после курса сочетанной (антипсихотической и антиоксидантной) терапии.
В Гр3 были выявлены две статистически значимые корреляционные взаимосвязи (положительные и отрицательные): 1) между исходным уровнем активности ГР и первоначальной (при поступлении) количественной суммарной балльной оценкой психотического состояния по подшкале PANSS-Pos (R=0,5, p<0,01); 2) между уровнем активности ГР на момент поступления и суммарной количественной оценкой тяжести депрессивной симптоматики (в баллах) по шкале HAMD-17 по окончании комбинированной терапии, включающей психотропные и нейрометабо-лические препараты (R=-0,5, p<0,01).
ЗАКЛЮЧЕНИЕ
При манифестирующих в позднем возрасте психозах преимущественно назначают антипсихотическую (с меньшей частотой – антидепрес-сивную) терапию, что определяет предрасположенность пожилых людей к повышенному риску резкого обострения множественной соматической патологии в связи с морфофункциональными преобразованиями в процессе возрастных изменений. В широкий перечень таких соматических заболеваний входят метаболический синдром, заболевания опорно-двигательного аппарата, почек, двигательных и судорожных расстройств [24]. Побочные эффекты психотропной терапии представляют собой актуальную проблему в психиатрии, особенно в геронтопсихиатрии, в том числе речь идет о низкой приверженности пациентов к соблюдению режима лечения. Поскольку клиническая эффективность недавно одобренных методов фармакотерапии поздней дискинезии доказательно не аргументирована [25], новые подходы к решению этой проблемы могут быть полезны в курации пациентов, страдающих от побочных эффектов применения нейролептиков.
В ряде исследований отечественных авторов приводятся доказательства, констатирующие обоснованность применения 2-этил-6-метил-3-гидроксипиридина сукцината в терапии больных шизофренией [10, 11].
Результаты нашего исследования подтверждают целесообразность включения в общую схему антипсихотической или антидепрессивной терапии в качестве составляющей компоненты антиоксидантных (мексидол) или метаболических препаратов, что позволяет добиться снижения побочных эффектов психотропной терапии в некоторых клинических группах пациентов с ППВ.
Предпринятое нами исследование представляет собой первую попытку стратифицированного подхода к пациентам, распределенным по отдельным группам в зависимости от наличия или отсутствия дополнительной терапии, помимо стандартного алгоритма психотропной терапии, назначаемой при ППВ.
Согласно итоговым результатам исследования в группах больных позднего возраста определены: 1) характерные особенности клинических проявлений психотических расстройств, 2) отличительные признаки биохимических параметров крови, с последующей рекомендацией дополнительного включения при необходимости препаратов с антиоксидантным и метаболическим спектром действия. Антиоксидантный и антигипокси-ческий препарат 2-этил-6-метил-3-гидрокси-пиридина сукцинат пациентам с ППВ, проходивших стационарное лечение в геронтологическом отделении ФГБНУ НЦПЗ, назначался в виде внутривенных инъекций. Кроме того, мексидол может применяться путем перорального приема, что расширяет потенциальный контингент нуждающихся в оказании психиатрической помощи (амбулаторные больные).
Определение необходимых биохимических параметров не требует использования специального дорогого оборудования и реагентов. Лабораторное исследование простое и безопасное, малозатратное по времени и стоимости, но при этом информативный метод, представляющий ценность при стратификации пациентов для оценки вероятности снижения побочных (нейромотор-ный, возбуждающий, седативный и пр.) эффектов антипсихотиков. В геронтопсихиатрической практике динамическое изучение биохимических показателей крови (активность ферментов метаболизма глутамата и глутатиона в тромбоцитах и эритроцитах) расширит стандартизованную количественную оценку психического состояния по данным психометрических шкал. Информированность врача-психиатра о биохимических параметрах в совокупности с объективными сведениями об актуальном психическом состоянии может не только содействовать в дифференциальном отборе пациентов для назначения дополнительных лекарственных средств, но и иметь прогностическое значение. Так, исходный уровень ГДГ статистически значимо связан с показателями по шкале PANSS, измеренными после курса лечения (установленные корреляционные связи: положительная ‒ в Гр1, отрицательная ‒ в Гр2). Следовательно, исходный уровень ГДГ может служить прогностическим маркером в Гр1 и Гр2. Помимо того, исходные уровни ферментативной активности ГР и ГСТ эритроцитов могут иметь прогностическое значение в Гр2, поскольку статистически значимо связаны с оценками по шкалам PANSS и CGI по окончании лечения. Заключительные результаты могут стать основой для изучения эффективности включения других веществ природного происхождения, в том числе антиоксидантов, с целью сокращения частоты и тяжести побочных эффектов психотропной терапии.
Список литературы Биохимические аспекты применения дополнительной фармакотерапии при лечении психозов позднего возраста
- Peruzzotti-Jametti L, Bernstock JD, Vicario N, Costa ASH, Kwok CK, Leonardi T, Booty LM, Bicci I, Balzarotti B, Volpe G, Mallucci G, Manferrari G, Donegà M, Iraci N, Braga A, Hallenbeck JM, Mur-phy MP, Edenhofer F, Frezza C, Pluchino S. Macro-phage-Derived Extracellular Succinate Licenses Neural Stem Cells to Suppress Chronic Neuroin-flammation. Cell Stem Cell. 2018 Mar 1;22(3):355-368.e13. doi: 10.1016/j.stem.2018.01.020. Epub 2018 Feb 22. PMID: 29478844; PMCID: PMC5842147.
- Kokaia Z, Lindvall O. Sensors of Succinate: Neural Stem Cell Grafts Fight Neuroinflammation. Cell Stem Cell. 2018 Mar 1;22(3):283-285. doi: 10.1016/j.stem.2018.01.019. PMID: 29499143.
- Лукьянова Л.Д., Кирова Ю.И., Германова Э.Л. Роль сукцината в регуляции срочной экспрессии HIF-1 при гипоксии. Бюллетень экспериментальной биологии и медицины. 2017. Т. 164, № 9. С. 273-279. Lukyanova LD, Kirova YI, Germanova EL. The role of succinate in regulation of immediate HIF-1α expression in hypoxia. Bull Exp Biol Med. 2018;164(3):298-303. doi: 10.1007/s10517-018-3976-2 (in Russian).
- Zhang Z, Yao L, Yang J, Wang Z, Du G. PI3K/Akt and HIF-1 signaling pathway in hypoxia-ischemia (Review). Mol Med Rep. 2018 Oct;18(4):3547-3554. doi: 10.3892/mmr.2018.9375. Epub 2018 Aug 9. PMID: 30106145; PMCID: PMC6131612.
- Stovell MG, Mada MO, Helmy A, Carpenter TA, Thelin EP, Yan JL, Guilfoyle MR, Jalloh I, Howe DJ, Grice P, Mason A, Giorgi-Coll S, Gallagher CN, Murphy MP, Menon DK, Hutchinson PJ, Carpenter KLH. The effect of succinate on brain NADH/NAD+ redox state and high energy phosphate metabolism in acute traumatic brain injury. Sci Rep. 2018 Jul 24;8(1):11140. doi: 10.1038/s41598-018-29255-3. PMID: 30042490; PMCID: PMC6057963.
- Кирова Ю.И., Шакова Ф.М., Германова Э.Л., Романова Г.А., Воронина Т.А. Влияние Мексидола на церебральный митохондриогенез в молодом возрасте и при старении. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020. Т. 120, № 1. С. 62-69. Kirova YuI, Shakova FM, Germano-va EL, Romanova GA, Voronina TA. The effect of Mexidol on cerebral mitochondriogenesis at a young age and during aging. S.S. Korsakov Journal of Neu-rology and Psychiatry. 2020;120(1):62-69. doi: 10.17116/jnevro202012001162 (in Russian).
- Щулькин А.В. Влияние мексидола на развитие феномена эксайтотоксичности нейронов in vitro. Журнал неврологии и психиатрии им. С.С. Кор-сакова. 2012. Т. 112, № 2. С. 35-39. Shchulkin AV. Effect of mexidol on the development of the phe-nomenon of the neuronal excitotoxicity in vitro. S.S. Korsakov Journal of Neurology and Psychiatry. 2012;112(2):35-39 (in Russian).
- Тихонова Е.О., Ляпина Е.П., Шульдяков А.А., Сатарова С.А. Использование препаратов, содержащих сукцинат, в клинике инфекционных болезней. Терапевтический архив. 2016. Т. 88, № 11. С. 121-127. Tikhonova EO, Lyapina EP, Shuldyakov AA, Satarova SA. The use of drugs con-taining succinate in the clinic of infectious diseases. Therapeutic Archive. 2016;88(11):121-127. doi: 10.17116/terarkh20168811121-127 (in Russian).
- Воронина Т.А. Антиоксиданты/антигипоксанты ‒ недостающий пазл эффективной патогенетической терапии пациентов с COVID-19. Инфекцион-ные болезни. 2020. Т. 18, № 2. С. 97-103. Voronina TA. Antioxidants/antihypoxants: the missing puzzle piece in effective pathogenetic therapy for COVID-19. Infectious Diseases. 2020;18(2):97-102. doi: 10.20953/1729-9225-2020-2-97-102 (in Russian).
- Шамрей В.К., Курасов Е.С., Нечипоренко В.В., Колчев А.И., Цыган Н.В. Возможности применения Мексидола в комплексной терапии психических расстройств. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020. Т. 120, № 5. С. 160‑164. Shamrey VK, Kurasov ES, Nechiporenko VV, Kolchev AI, Tsygan NV. Possibilities of us-ing Mexidol in the complex therapy of mental disorders. S.S. Korsakov Journal of Neurology and Psy-chiatry. 2020;120(5):160-164. doi: 10.17116/jnevro2020120051160 (in Russian).
- Дьяконов А.Л. Мексидол в качестве дополнительной терапии у больных непрерывной параноидной шизофренией при наличии поздней дискинезии. Психиатрия и психофармакотерапия им. П.Б. Ганнушкина. 2011. № 4. С. 28-32. Dyakonov AL. Mex-idol as additional therapy for the patient with continu-ous paranoid type of schizophrenia in the presence of a late dyskinesia. P.B. Gannushkin Psychiatry and Psychopharmacotherapy. 2011;13(4):28-32. https://medi.ru/info/490 (in Russian).
- Воронина Т.А. Геропротективные эффекты этилметилгидроксипиридина сукцината в экспериментальном исследовании. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020. Т. 120, № 4. С. 81‑87. Voronina TA. Geroprotective effects of ethylmethylhydroxypyridine succinate in an experimental study. S.S. Korsakov Journal of Neurology and Psychiatry. 2020;120(4):81-87. doi: 10.17116/jnevro202012004181 (in Russian).
- Савушкина О.К., Бокша И.С., Шешенин В.С., Терешкина Е.Б., Прохорова Т.А., Почуева В.В., Воробьева Е.А., Бурбаева Г.Ш. Применение пре-парата с антиоксидантными свойствами в качестве дополнительной терапии при поздно мани-фестирующих психозах шизофренического спектра. Неврологический вестник. 2021. Т. 53, № 4. С. 40-50. Savushkina OK, Boksha IS, Sheshenin VS, Tereshkina EB, Prokhorova TA, Pochueva VV, Vo-robyeva EA, Burbaeva GS. The use of antioxidant medicine as an adjunctive therapy in late-onset schizophrenia spectrum disorders. Neurology Bulletin. 2021;53(4):40-50. doi: 10.17816/nb87427 (in Russian).
- Черкасов Н.С., Шешенин В.С., Савина М.А. Неврологические нежелательные явления анти-психотической терапии. Психиатрия. 2019. Т. 17, № 3. С. 75-86. Cherkasov NS, Sheshenin VS, Sav-ina MA. Antipsychotic-induced neurological adverse events. Psychiatry. 2019;17(3):75-86. doi: 10.30629/2618-6667-2019-17-3-75-86 (in Russian).
- Савушкина О.К., Бокша И.С., Прохорова Т.А., Терешкина Е.Б., Сафарова Т.П., Яковлева О.Б., Корнилов В.В., Шипилова Е.С., Воробьева Е.А., Бурбаева Г.Ш. Выделение подгрупп пациентов с депрессиями позднего возраста на основе определения активности ферментов энергетического, глутаматного и глутатионового обмена в крови. Российский психиатрический журнал. 2021. № 5. С. 29-39. Savushkina OK, Boksha IS, Prokhorova TA, Tereshkina EB, Safarova TP, Yakovleva OB, Kornilov VV, Shipilova ES, Vorobyeva EA, Bur-baeva GSh. Revealing subgroups of patients with late-onset depression basing on measurements of blood energy-, glutamate- and glutathione metabo-lism enzymatic activities. Russian Journal of Psychi-atry. 2021;5:29-39. doi: 10.47877/1560-957x-2021-10504 (in Russian).
- Pearman A, Batra A. Late-Onset Schizophrenia: a review for clinicians. Clinical Gerontologist. 2012;35(2):126-147. doi: 10.1080/07317115.2011.642943
- Suen YN, Wong SMY, Hui CLM, Chan SKW, Lee EHM, Chang WC, Chen EYH. Late-onset psychosis and very-late-onset-schizophrenia-like-psychosis: an updated systematic review. Int Rev Psychiatry. 2019 Aug-Sep;31(5-6):523-542. doi: 10.1080/09540261.2019.1670624. Epub 2019 Oct 10. PMID: 31599177.
- Терешкина Е.Б., Савушкина О.К., Бокша И.С., Прохорова Т.А., Воробьева Е.А., Омельченко М.А., Помыткин А.Н., Каледа В.Г., Бурбаева Г.Ш. Глутатионредуктаза и глутатион-S-трансфераза в форменных элементах крови при шизофрении и расстройствах шизофренического спектра. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019. Т. 119, № 2. С. 61-65. Tereshkina EB, Savushkina OK, Boksha IS, Prokhorova TA, Voro-byeva EA, Omel'chenko MA, Pomytkin AN, Kaleda VG, Burbaeva GSh. Glutathione reductase and gluta-thione-S-transferase in blood cells in schizophrenia and schizophrenia spectrum disorders. S.S. Korsakov Journal of Neurology and Psychiatry. 2019;119(2):61-65. doi: 10.17116/jnevro201911902161 (in Russian).
- Boksha IS, Omel'chenko MA, Savushkina OK, Prokhorova TA, Tereshkina EB, Vorobyeva EA, Burbaeva GS. Links of platelet glutamate and gluta-thione metabolism with attenuated positive and nega-tive symptoms in depressed patients at clinical high risk for psychosis. Eur Arch Psychiatry Clin Neuro-sci. 2022 Mar 15. doi: 10.1007/s00406-022-01396-7. Epub ahead of print. PMID: 35292857.
- Fisher HF. L-Glutamate dehydrogenase from bovine liver. Methods Enzymol. 1985;113:16-27. doi: 10.1016/s0076-6879(85)13006-5. PMID: 4088065.
- Savushkina OK, Tereshkina EB, Prokhorova TA, Boksha IS, Burminskii DS, Vorobyeva EA, Moro-zova MA, Burbaeva GS. Platelet glutamate dehydro-genase activity and efficacy of antipsychotic therapy in patients with schizophrenia. J Med Biochem. 2020 Jan 10;39(1):54-59. doi: 10.2478/jomb-2019-0018. PMID: 32549778; PMCID: PMC7282235.
- Worthington DJ, Rosemeyer MA. Glutathione re-ductase from human erythrocytes. Catalytic proper-ties and aggregation. Eur J Biochem. 1976 Aug 1;67(1):231-8. doi: 10.1111/j.1432-1033.1976.tb10654.x. PMID: 9277.
- Keen JH, Habig WH, Jakoby WB. Mechanism for the several activities of the glutathione S-transferases. J Biol Chem. 1976 Oct 25;251(20):6183-8. PMID: 977564.
- Correll CU, Detraux J, De Lepeleire J, De Hert M. Effects of antipsychotics, antidepressants and mood stabilizers on risk for physical diseases in people with schizophrenia, depression and bipolar disorder. World Psychiatry. 2015 Jun;14(2):119-36. doi: 10.1002/wps.20204. PMID: 26043321; PMCID: PMC4471960.
- Stroup TS, Gray N. Management of common ad-verse effects of antipsychotic medications. World Psychiatry. 2018 Oct;17(3):341-356. doi: 10.1002/wps.20567. PMID: 30192094; PMCID: PMC6127750.


