Биохимия протеогликанов синовиальной жидкости в динамике развития остеоартроза
Автор: Русова Татьяна Васильевна, Байтов Владислав Сергеевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2009 года.
Бесплатный доступ
В синовиальной жидкости больных остеартрозом разной стадии аналитически определяли содержание гликозаминогликанов (ГАГ) и комплексы протеогликанов (ПГ) методом электрофореза в геле агарозы. На ранних стадиях заболевания количество ГАГ в синовиальной жидкости возрастает, а на поздних - снижается, что отражает динамику изменений в суставном хряще. Количество ГАГ, их качественный состав и структурная агрегированность ПГ может служить диагностическим тестом риска возникновения и динамики развития остеоартроза.
Остеоартроз, синовиальгная жидкость, протеогликаны
Короткий адрес: https://sciup.org/142121228
IDR: 142121228 | УДК: 577.112.853:
Текст научной статьи Биохимия протеогликанов синовиальной жидкости в динамике развития остеоартроза
Остеоартроз (ОА) – болезнь суставов, которая характеризуется разрушением и изменением метаболических процессов во внутрисуставных тканях, и в первую очередь - в хряще. Наиболее признанный метод оценки повреждения суставов косвенный – измерение ширины внутреннего пространства сустава на рентгеновских снимках. Для надежного диагноза прогрессирования заболевания требуется до 2 лет непрерывного наблюдения, поскольку изменения ширины внутрисуставной щели достаточно малы по сравнению с ошибкой измерения. Ясно, что для выявления пациентов с высоким риском возникновения деструктивного ОА и контролирования эффекта лекарственного лечения нужны более чувствительные методы исследования, чем рентгеноскопия. Альтернативные биохимические методы включают определение специфических и чувствительных биохимических маркеров, отражающих отклонения метаболизма хрящевой ткани. Они могут быть также полезны для исследования и контроля течения ОА.
Структура основного количества протеогликанов (ПГ) синовиальной жидкости (СЖ) пол- ностью аналогичны ПГ хряща и поступают из хрящевой ткани без изменения белкового кора [1, 2]. Часть ПГ, имеющие более малые молекулярные размеры, вероятно, являются продуктами влияния протеолиза. Эти ПГ свободно диффундируют из хряща в СЖ [1, 2]. При ОА ткани суставов, особенно суставной хрящ, подвергаются значительным дегенеративным изменениям, выраженным в различной степени. Метаболизм компонентов внеклеточного матрикса (коллаген, ПГ и неколлагеновые белки матрикса) сильно модифицируются в процессе болезни, и продукты извращенного метаболизма поступают в СЖ [3, 4, 5]. Этот физиологический механизм допускает поиск биохимических маркеров, отражающих течение патологического процесса с целью использования их в диагностических целях. Мы исследовали изменения качественного и количественного состава ПГ/ГАГ синовиальной жидкости больных идиопатическим ОА в динамике развития болезни с целью установить возможности использования методов аналитической биохимии в диагностике ранних и последующих стадий заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
Мы провели биохимические исследования СЖ 65 пациентов (30-47 лет), проходивших лечение по поводу идиопатического остеоартроза (ОА) 1-III степени. Контрольную группу составил посмертный материал хряща коленного сустава от 5 внезапно погибших людей в возрасте 25-47 лет без дегенеративных изменений хряща.
ПГ/ГАГ синовиальной жидкости после обработки раствором папаина (0,2 мг папаина на миллилитр жидкости с добавлением 0,01М ЭДТА и 0,005 М цистеина в буфере 0,2 M ацетата натрия рН 5,8, 60 ºС, 18 час). Экстракты обрабатывали хлороформом, диализовали против буфера 50 мМ ацетата натрия с 0,01М ЭДТА рН 5,8 (+4 ºС, 24 часа). Белки осаждали хлорной кислотой (0,5 н) и удаляли центрифугированием (9000 g, 2 ºC, r = 8 см). После повторного диализа ПГ осаждали тремя объемами этанола в присутствии 4 % ацетата калия (-18 ºС, 12 час), осадок отделяли центри- фугированием, промывали этанолом, ацетоном и растворяли в воде. Для выделения сульфатированных ПГ/ГАГ в раствор добавляли 10 % цетил-пиридиний хлорид (ЦПХ) до насыщения. Аналитически определяли содержание моносахаров, характеризующих отдельные виды ГАГ (хондроитинсульфат (ХС), кератансульфат (КС)), сульфатированные ГАГ (СГАГ) в этом осадке и в не осаждаемом пуле. Аналитические методы исследования ГАГ/ПГ (уроновые кислоты, гексозы, гексо-замины, сульфатированные ГАГ) описаны в работе Т.В. Русовой и др. [6]. Для характеристики протеогликанов использовали метод электрофореза в 1,2 % геле агарозы в 0,1М трис-ацетатном буфере рН 7,3. Количество моносахаров выражали в микрограммах чистого вещества на миллилитр жидкости. Результаты обрабатывали программой “STATISTICA”, используя среднее значение “М”, ошибку среднего “m” и t-критерий Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В таблице 1 приведено общее количество химических компонентов ГАГ в СЖ, которое меняется по мере развития дегенеративных изменений в хряще. На ранних стадиях заболевания количество ГАГ в СЖ возрастает (уроновые кислоты и СГАГ), но не столь значительно, как количество галактозы (примерно, в 1,5 раза относительно контрольных значений). В дальнейшем количество СГАГ и уроновых кислот (УК) снижается, но значительно возрастает количество галактозы и общего белка. У больных со 2-й стадией заболевания, подтвержденной рентгенографически, снижены все определяемые компоненты цепей ГАГ. Это достаточно уникальная стадия заболевания, поскольку разброс полученных аналитических результатов минимален. На поздней (3-й) стадии у подавляющего большинства обследованных (около 75 %) отмечено дальнейшее снижение содержания УК и СГАГ, но у 40 % больных повышено количество галактозы, в некоторых случаях почти на порядок по сравнению с контролем. Примерно у 20 % обследованных в СЖ обнаружено высокое содержание УК. Таким образом, на самой поздней стадии заболевания количество аналитических параметров ГАГ существенно варьирует.
Использования метода осаждения ГАГ из раствора с помощью четвертичного аммонийного основания - ЦПХ позволяет разделить общий пул
ПГ на 2 части - содержащий сульфатированные и низкосульфатированные ГАГ, практически гликопротеиды. Как видно из таблицы, с прогрессированием заболевания увеличивается относительное количество осаждаемых С ГАГ (табл. 1). Одновременно в неосаждаемом пуле растет количество галактозы и уроновых кислот. Методом ионообменной хроматографии на ДЕАЕ А-25 установили, что в этом пуле у больных на поздних стадиях заболевания в СЖ содержится до 90 % общего количества галактозы, гиалуроновая кислота, не связанная с ПГ, и небольшое количество низко-сульфатированных ХС-АС и КС. Известно, что количество неосаждаемых низкосульфатирован-ных ГАГ и нейтральных олигосахаридов возрастает в хряще на поздних стадиях АО [6]. Увеличение количества этого пула происходит параллельно процессам ремоделирования суставных тканей. Кроме того, в этот период хондроциты синтезируют модифицированные ГАГ – ХС и КС, в которых снижено содержание сульфатных групп из-за нарушения активности сульфотрасфераз, участвующих в элонгации цепей ГАГ [6, 7, 8]. Вероятно, накопление таких измененных ГАГ связано с особенностью патологического процесса в суставе – с потерей гиалинового хряща и прогрессирующим фиброзом внутрисуставных тканей, в том числе синовиальной оболочки.
Таблица 1
Количество гликозаминогликанов и белка в СЖ (в расчете мкг чистого вещества на 1 мл жидкости, СГАГ – в мкг хондроитинсульфата С)
|
n |
Стадия ОА |
Уроновые кислоты |
Галактоза |
С ГАГ |
Кол-во осаждаемых СГАГ (в % от общего) |
Белок |
|
5 |
норма |
1070,4±88,9 |
730,4±66,2 |
96,2±10,1 |
57,4±4,32 |
18,8±1,32 |
|
16 |
1 |
1273,5±160,2 |
1040,6±126,65 |
136,7±17,2 |
68,6±5,98 |
23,4±2,69 |
|
18 |
2 |
401,8±36,8 |
268,1±32,12 |
65,0±5,6 |
74,9±8,23 |
34,6±2,82 |
|
56 |
3 |
503,75±75,2 |
1533,05±286,23 |
50,34±5,17 |
84,5±8,02 |
46,7±5,36 |
В норме структура СЖ определяется содержанием высокополимерной гиалуроновой кислоты и большим протеогликаном-аггреканом, который синтезируется хондроцитами суставного хряща и поступает в СЖ в виде достаточно больших фрагментов [1]. Этот ПГ обладает участком белка, способным связываться с ГК, благодаря чему образуются большие надмолекулярные агрегаты. Период полужизни аггрекана в СЖ человека составляет около 8 час. В суставе с развивающейся патологией скорость обмена ПГ увеличивается еще больше из-за активации ферментов, участвующих в деградации этого ПГ - аггреканазы. Увеличение концентрации ГАГ в СЖ в начале заболевания является результатом ускорения нормальной деградации и активации анаболических процессов в суставе [8-11]. Это период быстрого ремоделирования матрикса, который выражается в быстром пополнении его фрагментами ПГ одновременно поступающими в СЖ. Эти фрагменты несут большое количество цепей ХС. С развитием патологического процесса в тканях сустава возрастает активность протеолиза ПГ с участием широкого спектра протеаз - аггреканаз, катепсинов, метал-лопротеаз [12, 13]. В СЖ поступает все больше мелких фрагментов ПГ, в том числе лежащих в глубоких слоях хряща и содержащих цепи кератан сульфата (КС) [14]. В эксперименте показано, что повышенное содержания в СЖ кератан сульфата связано с усилением процессов катаболизма [14, 15]. В динамике развития ОА в осаждаемых ГАГ меняется соотношение хондроитин- и кератан сульфатов. В СЖ контроля и в начале заболевания преобладает ХС - количество галактозы и N – ацетилглюкозамина (структурных единиц КС) на этом этапе незначительно. На поздних этапах заболевания (2, 3-я стадии), примерно, у 30 % больных в структуре ГАГ преобладает КС на фоне низкого уровня УК. У этих больных можно предполагать наличие активной деструкции хряща с одновременным снижением активности анаболических процесссов.
В интактной синовиальной жидкости протеогликаны и гиалуроновая кислота образуют единый комплекс, часть которого осаждается, а часть, из-за избытка ГК, не осаждается ЦПХ (рис. 1, полосы 1, 2, 3). При прогрессировании заболевания СЖ теряет нативную структуру -происходит разрыв связей ПГ – ГК, хотя общее количество СГАГ практически не меняется. В результате на картине электрофореза четко видно на старте ГК и ушедшие далеко от старта ПГ/ГАГ, появляется свободная высокополимер-ная ГК, не связанная с ПГ и не осаждаемая ЦПХ (рис. 1, полосы 4, 5). На более поздних стадиях ОА в СЖ короткие фрагменты ПГ/ГАГ уходят далеко от старта, хорошо видны ГАГ, не осаждаемые ЦПХ (рис. 1, полосы 6, 7). Исчезает вы-сокополимерная ГК, обычно остающаяся на старте. Низкополимерная ГК движется вместе с легкими не осаждаемыми ГАГ. Поэтому элек-трофоретически ее можно регистрировать только после хроматографического разделения смеси (полоса 8). Т.е. с прогрессированием заболевания в СЖ накапливается пул ГАГ, близкий по структуре к олигосахаридам гликопротеинов, снижается количество и полимерность гиалуроновой кислоты. У больных с 3-й стадии ОА в СЖ остаются только короткие обломки ПГ/ГАГ, но все они практически полностью осаждаются ЦПХ (полоса 9, 10). Таким образом, с развитием ОА синовиальная жидкость теряет структурную организацию комплексов ПГ. Снижается их количество, способность образовывать агрегаты как между отдельными ПГ, так и с гиалуроновой кислотой, меняется качественный состав ГАГ, размеры молекул. На поздних стадиях заболевания количество С ГАГ в СЖ крайне низко, в них преобладает галактоза - химический элемент кератан сульфата.
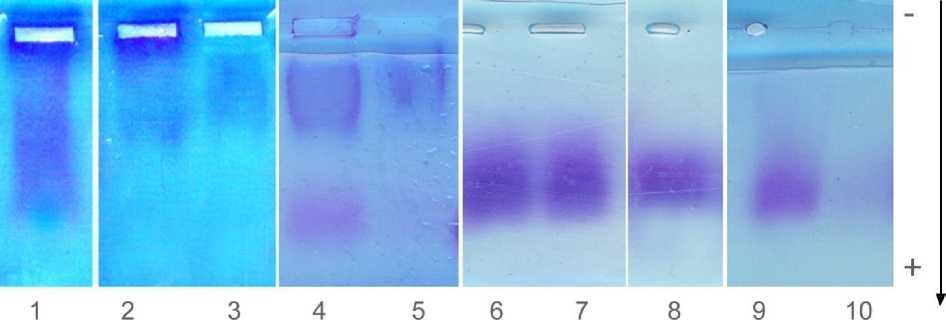
Рис. 1. Протеогликаны синовиальной жидкости коленного сустава. Электрофоретическое разделение в 1,2 % геле агарозы в 0,1 М трис-ацетатном буфере рН 7,3. № 1, 2, 3 – протеогликаны контрольного образца синовиальной жидкости. № 4, 5 – протеогликаны СЖ на ранних стадиях заболевания. № 6, 7 - ПГ/ГАГ, осаждаемые и не осаждаемые ЦПХ (1-2 стадии ОА). № 8 - низкополимерная ГК. № 9, 10 – ПГ из СЖ больных с 3-й стадией остеоартроза
ВЫВОДЫ
-
1. Активный обмен ПГ/ГАГ между суставным хрящом и СЖ создает предпосылки для создания диагностических биохимических тестов течения и прогнозирования патологического процесса ОА в коленном суставе и позволяет установить ранние проявления заболевания.
-
2. Комбинация трех аналитических тестов общего содержания ГАГ в СЖ - определение количества гексуроновых кислот, сульфаптиро-
- ванных гликозаминогликанов и галактозы позволяет диагностировать особенности метаболических процессов на разных стадиях заболевания и прогнозировать течение болезни.
-
3. Неблагопритным признаком течения ОА можно считать снижение количества уроновых кислот и сульфатированных ГАГ в СЖ, увеличение содержания галактозы и появление относительно большого количества кератансульфата.


