Биоэлектрогенез в корнеобитаемой среде листовых, плодовых и корнеплодных овощных культур
Автор: Кулешова Т.Э., Эзерина Е.М., Вертебный В.Е., Хомяков Ю.В., Синявина Н.Г., Панова Г.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Крайний Север, Арктика, Антарктика: новые агротехнологии
Статья в выпуске: 5 т.59, 2024 года.
Бесплатный доступ
Возникающие в корнеобитаемой среде растений биоэлектрогенные процессы, связанные с генерацией разности потенциалов при протекании окислительно-восстановительных реакций и диффузии ионов, которые сопутствуют развитию корневой системы, служат основой для создания альтернативных устройств получения возобновляемой экологически чистой ресурсосберегающей энергии - биоэлектрохимических систем (БЭС). Поиск биосовместимых, энергогенерирующих, высокопроизводительных компонентов БЭС, включая технические элементы, корнеобитаемые среды и растения - актуальная задача, решение которой позволит повысить автономность и эффективность производства растительной продукции. В настоящее время практически отсутствуют разработки БЭС на основе овощных культур либо сообщалось о неудачных попытках их создания. В представленной работе впервые в комплексном исследовании электрогенных процессов в оригинальных БЭС корнеобитаемая среда-овощные растения показана бóльшая стабильность электрических свойств у салата (листовая культура), больший выход электроэнергии у редиса (корнеплодная культура) и более продолжительная выработка электричества у томата (плодовая овощная культура). Целью работы было измерение совокупности параметров - электрогенных свойств корнеобитаемой среды, спектров отражения и флуоресценции листьев, морфометрических показателей, биохимического состава, характеризующих эффективность электрогенерации, способность преобразования энергии света, урожайность и качество получаемой растительной продукции при выращивании различных овощных культур в биоэлектрохимических системах. Фитотест-объектами служили растения салата ( Lactuca sativa L.) сорта Балет, редис ( Raphanus sativus L.) сорта Петербургский фиолетовый и карликовый томат ( Solanum lycopersicum L.) сорта Наташа. Растения выращивали в 2023-2024 годах в контролируемых условиях интенсивной светокультуры на агробиополигоне ФГБНУ АФИ с регулируемыми условиями микроклимата. В качестве источников света использовали разработанные нами светодиодные светильники AFI-5000, имитирующие солнечный свет, в качестве корнеобитаемой среды - торфяной грунт. Питание осуществляли раствором Кнопа. БЭС представляла собой емкость для выращивания с биосовместимой коррозионно-стойкой системой электродов из пористого электропроводящего материала, обеспечивающего поверхностный электрический контакт с корневой системой и прикорневой зоной. Объем БЭС - 440 см3 для салата, 320 см3 для редиса и 3000 см3 для томата. Электроды размером 6×6 см располагали в корнеобитаемой среде горизонтально. Для формирования корнеплода верхний электрод модифицировали, добавив круглое отверстие диаметром 3 см. Разность потенциалов регистрировали автоматически каждые 15 мин с помощью автоматизированного вольтметра (Arduino, «Arduino Software», Китай). Поляризационные кривые снимали в конце вегетационного периода салата и редиса и на 64-е сут выращивания томата. Уборку растений салата и редиса осуществляли на 28-е сут, томата - на 110-е сут от посева семян. При уборке учитывали массу листьев, плодов и корнеплодов, высоту надземной части растений и урожайность. Биохимической состав (содержание сухого вещества, нитратов, сахаров, витамина С, пигментов, макро- и микроэлементов) определяли общепринятыми методами (термогравиметрический, ионометрический, титрометрический, фотометрический). Показатели фотосинтетической активности (спектры отраженной от поверхности листьев радиации и параметры флуоресценции) оценивали неиванзивным способом с помощью спектрометрической системы («Ocean Optics», США) и флуориметра MINI-PAM-II («Heinz Walz GmbH», Германия). Средняя разность потенциалов, формируемая в корнеобитаемой среде растений салата, составила 289±27 мВ, максимальное значение достигало 391 мВ. Для растений редиса величина разности потенциалов в корнеобитаемой среде равнялась в среднем 394±50 мВ при максимальном значении 532 мВ. Средняя разность потенциалов в корнеобитаемой среде томата составила 257±123 мВ: в процессе начального развития надземной массы и корней наблюдалась стабильная генерация напряжения 317±17 мВ, однако во время фазы налива плодов разность потенциалов падала до 120±34 мВ, а при переходе в фазу созревания наблюдалось обратное увеличение до 340±74 мВ. Общая производительность исследованных культур при выращивании с учетом возможного числа сборов урожая с одного яруса за год была схожей: 73,5±10,3 кг/м2 для салата, 68,6±3,8 кг/м2 для редиса и 71,2±9,2 кг/м2 для томата, и превосходила таковую при выращивании в стандартных системах для салата и томата. Качество растительной продукции соответствовало санитарно-гигиеническим требованиям РФ. Так, содержание нитратов в листьях салата составило 1597,0±214,7 мг/кг биомассы естественной влажности (е.в.) (ПДК 2000 мг/кг е.в.), в корнеплодах редиса - 1206,0±144,8 мг/кг е.в. (ПДК 1500 мг/кг е.в.), в плодах томата - 70,2±9,3 мг/кг е.в. (ПДК 300 мг/кг е.в.).
Lactuca sativa l, raphanus sativus l, solanum lycopersicum l, биоэлектрохимические системы, биосовместимые электроды, флуоресценция, индексы отражения, продуктивность, биохимический состав
Короткий адрес: https://sciup.org/142243782
IDR: 142243782 | УДК: 631.171 | DOI: 10.15389/agrobiology.2024.5.893rus
Текст научной статьи Биоэлектрогенез в корнеобитаемой среде листовых, плодовых и корнеплодных овощных культур
В настоящее время для достижения устойчивого развития агропромышленного комплекса, особенно в суровых условиях Арктики и Антарктики, выделяют такие приоритетные направления, как совершенствование климатически регулируемого сельского хозяйства, применение бережных агротехнологий и повышение энергоэффективности с помощью наращивания доли возобновляемых источников энергии, что позволит минимизировать воздействие на окружающую среду благодаря рациональному использованию ресурсов и сокращению энергопотребления. Оптимизация топливно-энергетического баланса может быть реализована за счет увеличения доли экологически чистых, доступных и недорогих энергоресурсов.
К таким альтернативным природным «зеленым» энергоресурсам относятся биоэлектрохимические системы (БЭС) — устройства для получения электрической энергии за счет химических реакций, сопряженных с жизнедеятельностью живых организмов. Генерация электроэнергии с помощью биотехнологических устройств может быть совмещена с производственными процессами, к одному из которых относится получение растительной продукции.
Принцип работы растительных БЭС, или растительно-микробных топливных элементов (РМТЭ), основан на электрогенных процессах, происходящих в корнеобитаемой среде, — окислительно-восстановительных реакциях и диффузии ионов, сопутствующих развитию корневой системы, и окислении ризодепозитов (корневых выделений) микроорганизмами с образованием углекислого газа, протонов и электронов (1). В настоящее время известны три основных механизма внеклеточного переноса электронов, выделяемых экзоэлектрогенными микроорганизмами, на анод: прямой перенос через цитохромный комплекс внешней мембраны, транспорт с помощью медиаторов и передача посредством пилей (2).
На эффективность работы БЭС существенно влияет выбор растительного объекта. Значимую роль при этом играют интенсивность окислительно-восстановительных реакций, выделение ризодепозитов и формирование микробного сообщества в корнеобитаемой среде (3). В процессе исследования функционирования РМТЭ, интегрированного в озелененную крышу городского здания, были отмечены различия в величине генерируемой энергии для БЭС на основе различных растений: для китайского пен-нисетума (Pennisetum alopecuroides L.) напряжение составляло порядка 600 мВ, для рогоза узколистного (Typha angustifolia L.) — около 100 мВ; кроме того, на эти параметры влияли интенсивность солнечной радиации и температура воздуха (4). Одним из наиболее распространенных сельскохозяйственных растений, применяемых для создания РМТЭ, служит рис (Oryza sativa L.), поскольку условия его выращивания позволяют создавать эффективные конструкции, основанные на размещении анода и катода в средах с различными окислительно-восстановительными потенциалами — почве и воде.
Считается, что производительность БЭС будет больше для растительных культур с С4-путем фиксации углекислого газа, поскольку у этого типа растений выше эффективность фотосинтеза. В большинстве исследований РМТЭ создаются с использованием растений, осуществляющих связывание углерода по циклу Хэтча-Слэка. Так, получаемые напряжение и мощность БЭС в среднем составляют 800 мВ и 68 Вт/м2 для ветиверии ( Vetiveria zizanioides L.) (5), 670 мВ и 1 мВт/м2 для китайского пеннисетума ( Pennisetum alopecuroides L.) (4), до 195 мВт/м2 для амаранта ( Amaranthus vi-ridis L.) (6), 432 мВ и 13 мВт/м2 для драцены ( Dracaena braunii Engl.) (7). Однако было показано, что растения с С3-путем усвоения углерода могут генерировать сопоставимую и даже большую по величине электроэнергию (8): 505 мВ и 223 мВт/м2 для канны Штутгарт ( Canna stuttgart L.) (9), 25 мВт/м2 для тростника ( Phragmites australis (Cav.) Trin. ex Steud.) (10), 590 мВ и 19,5 мВт/м2 для рогоза ( Typha orientalis C.Presl) (11). Интегрирование БЭС в системы выращивания может приводить к повышению продуктивности растений. Например, сухая масса листьев лука клубневого ( Allium tuberosum Spreng.), культивируемого методом гидропоники, увеличивалась на 142 % в присутствии РМТЭ по сравнению с растениями без него (12). При этом генерируемая удельная мощность БЭС составила 130±45 мВт/м2.
Возможности БЭС включают ресурсосберегающие технологии производства растительной продукции, обеспечение зарядкой портативных устройств, электропитание датчиков, создание умных систем выращивания, фиторемедиацию почв, очистку сточных и промышленных вод (1, 13). Долговременность работы БЭС была испытана с использованием растений папируса ( Cyperus papyrus L.). Созданные РМТЭ функционировали в течении 900 сут и обеспечивали работу микроконтроллера, оснащенного датчиком температуры и влажности и передающего измеряемую информацию по беспроводной связи каждые 2 ч (14).
Одно из направлений развития БЭС — использование древесных растений с расположением топливных элементов на стволах. Например, при установке РМТЭ мембранного типа на стебель пахиры ( Pachira aquatica Aubl.) и тополя ( Populus alba L.) полученная удельная мощность составила соответственно 3,6 и 7,6 мВт/м2 (15).
РМТЭ имеют перспективу применения в субтропиках в качестве зеленых крыш. Уже есть примеры успешной реализации таких проектов озеленения кровель, совмещенного с выработкой электроэнергии (4). Интересным вариантом использования БЭС становится внедрение РМТЭ в системы выращивания цветов, а также использование генерируемой энергии мощностью 5,8 мВт для обеспечения непрерывным электропитанием энергоавтономного узла беспроводных датчиков измерения влажности и температуры внутри и снаружи улья (16).
В настоящее время практически отсутствуют разработки БЭС на основе овощных культур, что связано со сложностью совмещения процессов одновременного производства электроэнергии и растительной продукции. Попытка создания РМТЭ на основе томата (Solanum lycopersicum L.) и перца чили (Capsicum annuum L.) привела к гибели растений и подавлению элек-трогенной активности микроорганизмов уже на 11-е сут, предположительно, из-за стрессовых условий выращивания и токсичного действия системы электродов (17).
В представленной работе впервые при комплексном изучении электро-генных процессов в оригинальных БЭС корнеобитаемая среда—овощные растения показана большая стабильность электрических свойств у салата (листовая культура), больший выход электроэнергии у редиса (корнеплодная культура) и более продолжительная выработка электричества у томата (плодовая овощная культура).
Целью работы было измерение совокупности параметров — элек-трогенных свойств корнеобитаемой среды, спектров отражения и флуоресценции листьев, морфометрических показателей, биохимического состава, характеризующих эффективность электрогенерации, способность преобразования энергии света, урожайность и качество получаемой растительной продукции при выращивании различных овощных культур в биоэлектрохи-мических системах.
Методика. При выборе растений, наиболее перспективных с точки зрения электрогенеративных свойств, использовали распространенные сельскохозяйственные культуры, различающиеся хозяйственной ценностью и эффективностью работы фотосинтетического аппарата.
Фитотест-объектами служили растения салата ( Lactuca sativa L.) сорта Балет (коллекция ФГБНУ ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова, г. Санкт-Петербург), характеризующиеся высокой урожайностью, устойчивостью к негативным факторам и длительным периодом хранения; редис ( Raphanus sativus L.) сорта Петербургский фиолетовый (ФГБНУ Агрофизический научно-исследовательский институт, г. Санкт-Петербург) с салатным типом листа (18), выведенный с помощью методологии ускоренного получения трансгрессий по хозяйственно ценным признакам (19) специально для интенсивной светокультуры и характеризующийся скороспелостью, компактной листовой розеткой и устойчивостью к загущенному посеву; карликовый томат ( Solanum lycopersicum L.) сорта Наташа (ФГБНУ Федеральный научный центр овощеводства, Московская обл.), компактный и не требующий пасынкования, предназначенный для выращивания в многоярусных узкостеллажных вегетационных установках.
Растения выращивали в 2023-2024 годах в условиях интенсивной светокультуры на агробиополигоне ФГБНУ АФИ с регулируемым микроклиматом (20). В качестве источников света использовали разработанные нами светодиодные светильники AFI-5000, имитирующие солнечный свет, с цветовой температурой 5000 К и со спектром, близким к солнечному свету в полдень. Суммарная плотность фотосинтетического потока фотонов PPFD составляла 320±23 мкмоль • м - 2 •с - 1 c соотношением синего (400500 нм), зеленого (500-600 нм) и красного (600-700 нм) диапазонов спектра 1 (79±6 мкмоль-м - 2-с - 1):1,5 (мкмоль^м - 2•с - 1):1,5 (120±9 мкмоль^м - 2•с - 1). Продолжительность светового периода для салата и редиса — 14 ч/сут, для растений томата — 16 ч/сут.
Для высева использовали сухие семена. Плотность посева для салата составляла 50, редиса — 160, томата — 24 растения/м2. Температура воздуха поддерживалась в пределах 20-22 ° C в световой период и 18-20 ° C в темновой период для растений салата и редиса, 22-24 ° С в световой период и 1820 ° С в темновой период для растений томата. Относительная влажность 896
воздуха составляла 65-70 %.
В качестве корнеобитаемой среды использовали торфяной грунт Агробалт С («Пиндструп», Россия) на основе верхового торфа низкой степени разложения (в составе N не менее 150 мг/л, P 2 O 5 и K 2 O не менее соответственно 150 и 250 мг/л, Mg и Са — не менее 30 и 120 мг/л). Питание осуществляли раствором Кнопа, поступающим по капиллярам торфяного грунта снизу из поддонов. При этом обеспечивается более равномерное увлажнение корнеобитаемой среды, так как ранее нами было показано, что такой способ приводит к стабильному формированию разности потенциалов в ней и исключает влияние неравномерности сопротивления среды (21).
Для оценки биоэлектрогенеза (процесса генерации разности потенциалов в корнеобитаемой среде растений при выращивании) исследуемые культуры размещали в биоэлектрохимических ячейках.
В варианте с листовыми зеленными культурами (салат) БЭС представляли собой емкости для выращивания объемом 440 см3 с биосовмести-мой коррозионно-стойкой системой электродов, обеспечивающей поверхностный электрический контакт с корневой системой и прикорневой зоной. Электроды были выполнены из пористого электропроводящего материала квадратной формы размером 6½6 см и расположены в корнеобитаемой среде горизонтально. Верхний электрод размещался в области корневой шейки на расстоянии 3 см от поверхности субстрата и был выполнен из сетки из нержавеющей стали с размером ячейки 0,8½0,8 см, которая позволяет корневой системе прорастать сквозь нее без повреждений как растительных объектов, так и самих электродов, тем самым обеспечивая многоразовое использование материала. Нижний электрод из графитового войлока толщиной 0,5 см, который характеризовался большой удельной поверхностью, благоприятной для развития микрофлоры, в том числе потенциально электроактивной, располагался на расстоянии 3 см от верхнего электрода.
Для корнеплодных растений (редис) БЭС объемом 320 см3 были сконструированы аналогичном образом. Отличие заключалось в том, что в верхнем электроде из сетки из нержавеющей стали размером 6½6 см с ячейками 0,8½0,8 см, размещаемом на расстоянии 3 см от поверхности субстрата, было прорезано круглое отверстие диаметром 3 см для формирования корнеплода.
Для плодовых овощных культур (томат) объем БЭС составлял 3000 см3. Верхний электрод был выполнен из сетки из нержавеющей стали 10½10 см с размером ячеек 0,5½0,5 см и расположен на глубине 5 см от поверхности, нижний электрод из графитового войлока размером 10½10 см и толщиной 0,5 см размещался на расстоянии 5 см от верхнего электрода.
Разность потенциалов, генерируемую в корнеобитаемой среде в процессе выращивания, регистрировали автоматически каждые 15 мин с помощью аппаратной платформы Arduino («Arduino Software», Китай) и специально разработанного нами программного обеспечения. Усреднение полученных экспериментальных кривых проводили методом скользящего среднего. Поляризационные кривые снимали в конце вегетационного периода салата и редиса и на 64-е сут выращивания томата при параллельном подключении внешних сопротивлений номиналом от 10 МОм до 1,1 кОм по 10-15 мин на каждый.
Уборку растений салата и редиса осуществляли на 28-е сут, томата — на 110-е сут от посева семян. При уборке учитывали массу листьев, плодов и корнеплодов, высоту надземной части растений и урожайность (массу растительной продукции на 1 м2).
Содержание сухого вещества и влаги определяли термогравиметри- ческим методом (воздушно-тепловой сушки) как выраженную в процентах потерю массы пробы при ее нагревании; сырой золы — методом сухого озоления при нагревании до 300-400 °С с доступом воздуха; нитратов — ионометрическим методом (мг/кг сырой массы естественной влажности, е.в.); витамина С — титрометрическим методом (мг/100 г е.в.); сахара — титрометрическим методом по Бертрану (% от сухого вещества, с.в.) (22).
Содержание фотосинтетических пигментов (мг/100 г е.в.) определяли фотометрическим методом. Каротиноиды и хлорофиллы экстрагировали 100 % ацетоном, их концентрацию измеряли по величине оптической плотности: для хлорофилла a при X = 645 нм, хлорофилла b — X = 662 нм, каротиноидов — X = 440 нм (22).
Массовую долю фосфора (% от с.в.) оценивали фотометрически. Растительные пробы подвергали сухой минерализации, растворяли и проводили цветную реакцию с молибден-ванадиевым реактивом; оптическую плотность измеряли при X = 436 нм (23). Содержание калия и кальция (% от с.в.), меди, цинка, железа и марганца (мг/кг с.в.) определяли с помощью спектрометра атомно-абсорбционного AA240FS («Varian, Inc.», США), распыляя раствор подготовленных минерализатов в воздушно-ацетилено-вом пламени и измеряя абсорбцию, пропорциональную концентрации металла, на длине волны соответствующей резонансной линии (23).
Спектры радиации, отраженной от поверхности листьев, регистрировали неинвазивным способом с помощью миниатюрной оптоволоконной спектрометрической системы («Ocean Optics», США), которая обеспечивала оптическое разрешение 0,065 нм в диапазоне от 400 до 1100 нм с шагом 0,3 нм. Датчик располагали в средней части листовой пластинки, избегая попадания на центральную жилку. Для каждого варианта регистрировали 10-15 спектров, по которым рассчитывали индексы отражения.
Параметры флуоресценции листьев также регистрировали неинвазивно, используя анализатор эффективности фотосинтеза — импульсный портативный флуориметр MINI-PAM-II («Heinz Walz GmbH», Германия) в соответствии со стандартной методикой (24). Оптоволоконный волновод размещали аналогично датчику отражения. Минимальную (возбуждается светом с очень низкой интенсивностью) и максимальную (возбуждается насыщающим световым импульсом) флуоресценцию определяли после экспозиции листьев в течение 30 мин в темноте. Параметры флуоресценции рассчитывали с использованием специального программного обеспечения WinControl-3 .
Спектры отражения и параметры флуоресценции снимали у салата на 14-е, 21-е и 28-е сут вегетативного цикла, соответствующие стадии активного формирования вегетативной массы, у редиса — на 21-е и 25-е сут развития в период интенсивного нарастания корнеплода, у томата — на 54-е и 90-е сутки генеративной фазы налива и созревания плодов.
При статистической оценке полученных данных рассчитывали основные описательные характеристики — среднее ( M ), стандартное отклонение (±SD), доверительный интервал (±CI) с применением программ Microsoft Excel 2016 и Statistica 8 («StatSoft, Inc.», США). Для выявления различий между средними значениями для каждого показателя использовали апостериорный тест Tukey HSD. Значение p < 0,05 (вероятность ошибки 5 %) считалось приемлемым пределом статистической значимости. Был выполнен корреляционный анализ, уровень значимости считали достоверным при p < 0,05.
Результаты. Схематическое изображение ячеек БЭС при выращива- нии различных растений в опыте представлено на рисунке 1.
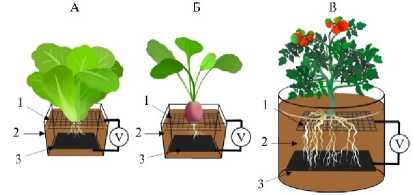
Рис. 1. Схематическое представление ячеек биоэлек-трохимических систем (БЭС) при выращивании растений: А — салат, Б — редис, В — томат; 1 — верхний электрод, 2 — корнеобитаемая среда, 3 — нижний электрод .
Средняя разность потенциалов, формируемая в корнеобитаемой среде растений салата сорта Балет, составила 289±27 мВ, максимальное значение достигало 391 мВ (рис. 2, А). В первые 10 сут вегетационного периода величина напряжения была практически ста- ционарной — 271±17 мВ. С 12-х сут в период активного формирования надземной биомассы наблюдался небольшой рост значений — на 13 % до 306±25 мВ с последу- ющей стабилизацией в пределах ∼ 300 мВ в конце вегетационного цикла.
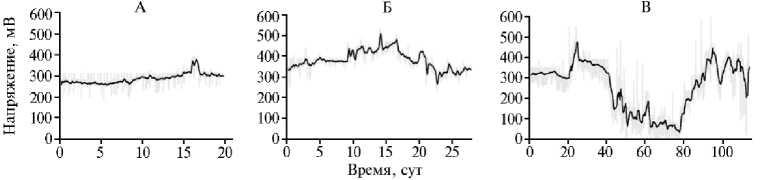
Рис. 2. Динамика формирования разности потенциалов в корнеобитаемой среде растений, выращиваемых в условиях биоэлектрохимических систем (БЭС) и интенсивной светокультуры: А — салат ( Lactuca sativa L.) сорта Балет, Б — редис ( Raphanus sativus L.) сорта Петербургский фиолетовый, В — карликовый томат ( Solanum lycopersicum L.) сорта Наташа; серая кривая — экспериментальные данные, черная кривая — усреднение (агробиополигон ФГБНУ Агрофизического научно-исследовательского института, г. Санкт-Петербург, 2023-2024 годы). Условия эксперимента см. в разделе «Методика».
Для растений редиса сорта Петербургский фиолетовый величина разности потенциалов в корнеобитаемой среде составляла в среднем 394±50 мВ, максимально — 532 мВ (см. рис. 2, Б). В первые 10 сут это значение достигало 407±35 мВ. Затем в период интенсивного развития корнеплода с 10-х по 20-е сут напряжение возрастало до 424±34 мВ и к 22-м сут снова снижалось до 340±37 мВ.
Среднее значение разности потенциалов в корнеобитаемой среде томатов сорта Наташа составило 257±123 мВ (см. рис. 2, В). В процессе начального развития надземной массы и корней в течение первых 20 сут наблюдалась стабильная генерация напряжения 317±17 мВ. На 23-и сут был отмечен рост до максимального показателя 454 мВ. В начале фазы цветения на 27-е сут разность потенциалов уменьшалась до 366±23 мВ, и эти значения сохранялись в течение периода завязывания плодов. Во время налива величина напряжения резко снизилась до 120±34 мВ и удерживалась в этом диапазоне в течение 40-77-х сут, а при переходе в фазу созревания наблюдалось плавное увеличение со скоростью ∼ 23 мВ/сут. С 90-х сут разность потенциалов в корнеобитаемой среде составляла 340±74 мВ.
Показано, что производительность БЭС можно контролировать с помощью подключения внешнего сопротивления различного номинала. Если внешнее сопротивление равно внутреннему сопротивлению БЭС, достигается большее производство биомассы. Когда внешнее сопротивление больше внутреннего, увеличивается удельная мощность. Если внешнее сопротивление меньше внутреннего, генерируется наибольший ток (25).
У исследуемых растений мы измерили генерируемую удельную мощность и силу тока в зависимости от величины подключаемой внешней нагрузки (рис. 3). Для салата максимальная мощность составила 13,58 мкВт/м2 при сопротивлении 1 МОм, наибольшую силу генерируемого тока 0,36 мкА регистрировали при 150 кОм. У редиса максимальная мощность достигала 34,83 мкВт/м2 при нагрузке 150 кОм, наибольший ток — 1,27 мкА при 11 кОм. Для томата максимальная удельная мощность была 3,02 мкВт/м2 при подключении сопротивления 150 кОм. При этом получение наибольших из всех исследованных вариантов значений силы тока (до 2,43 мкА при 11 кОм) было связано в первую очередь с использованием увеличенной почти в 3 раза площади электродов из-за больших объемов ячейки БЭС и корневой системы томата.
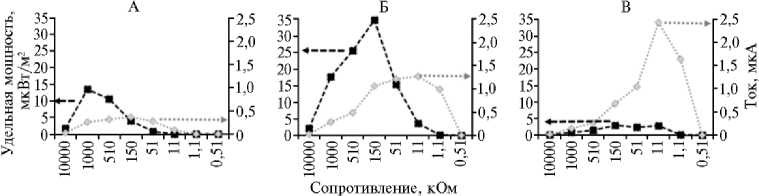
Рис. 3. Поляризационные кривые зависимости удельной мощности и силы тока от прикладываемого внешнего сопротивления для биоэлектрохимических систем (БЭС) на основе растений, выращиваемых в условиях интенсивной светокультуры: А — салат ( Lactuca sativa L.) сорта Балет, Б — редис ( Raphanus sativus L.) сорта Петербургский фиолетовый, В — карликовый томат ( Solanum lycopersicum L.) сорта Наташа (агробиополигон ФГБНУ Агрофизического научноисследовательского института, г. Санкт-Петербург, 2023-2024 годы).
В нашем опыте наибольшая величина напряжения, формируемого в процессе выращивания листовых, корнеплодных и плодовых овощных культур в условиях БЭС, была характерна для вегетативной стадии, во время которой происходит более интенсивное выделение ризодепозитов. На генеративной стадии органические вещества расходуются на формирование плодов и семян и выделяются в корнеобитаемую среду в меньшем количестве (26).
В целом можно предположить, что у редиса более интенсивные процессы, происходящие в корнеобитаемой среде при формировании и развитии корнеплода, привели к большей генерации напряжения в прикорневой зоне.
Полученная масса растения салата сорта Балет составила 113±16 г, высота достигала 31,7±2,1 см, урожайность — 5,7 кг/м2. При культивировании в БЭС редиса сорта Петербургский фиолетовый масса растения была 31±5 г, высота — 16,3±0,8 см, общая урожайность с учетом салатного типа листа и корнеплодов — соответственно 4,9±0,8 кг/м2 и 3,5±0,3 кг/м2. Масса растения томата сорта Наташа достигала 591±46 г, высота — 33,0±2,4 см, урожайность плодов — 17,8±2,3 кг/м2. С учетом возможного числа сборов урожая с одного яруса за год общая производительность исследованных культур была схожа: 73,5±10,3 кг/м2 в год для салата, 68,6±3,8 кг/м2 в год для редиса и 71,2±9,2 кг/м2 в год для томата.
Продуктивность салата сорта Балет при его выращивании в БЭС на агробиополигоне ФГБНУ АФИ с регулируемыми условиями микроклимата на 50 % превышала таковую у растений салата того же сорта, культивируемых в тепличном комплексе ФГБОУ ВО СПбГАУ с досветкой искусственным светом (27). Урожайность редиса сорта Петербургский фиолетовый на агробиополигоне ФГБНУ АФИ имела сходные значения в БЭС и без нее (18). Продуктивность томата сорта Наташа на агробиополигоне ФГБНУ АФИ была больше в 2,8 раза по сравнению с культивированием этого сорта в тепличных условиях ФГБНУ ФНЦ овощеводства с использованием торфяного питательного субстрата (28).
Качество получаемой при выращивании в БЭС растительной продукции полностью соответствовало санитарно-гигиеническим требованиям Российской Федерации (29). Так, содержание нитратов в листьях салата составило 1597,0±214,7 мг/кг е.в. (ПДК 2000 мг/кг е.в.), в корнеплодах редиса — 1206,0±144,8 мг/кг е.в. (ПДК 1500 мг/кг е.в.), в плодах томата — 70,2±9,3 мг/кг е.в. (ПДК 300 мг/кг е.в.). Сумма сахаров достигала соответственно 13,0±1,2; 29,6±2,9 и 32,1±3,7 % с.в., витамина С — 12,9±1,6; 7,7±0,7 и 17,4±2,1 мг/100 г е.в.
Для листьев салата было характерно большее по сравнению с листьями редиса и томата содержание железа соответственно на 22 и 48 % и марганца на 25 и 90 % (p ≤ 0,05), которые служат кофакторами в фотосинтетических процессах (табл. 1). Корнеплоды редиса характеризовались повышенным относительно листьев салата и плодов томата содержанием фосфора на 57 и 57 % и калия на 38 и 129 %, а в листьях редиса наблюдалось почти 2-кратное увеличенное количества цинка по сравнению с листьями других культур (p ≤ 0,05). Количество сухого вещества было наибольшим в листьях томата сорта Наташа (р < 0,05).
-
1. Биохимический состав растительной продукции при выращивании растений в биоэлектрохимических системах (БЭС) в условиях интенсивной светокультуры ( n = 4, М ±SD, агробиополигон ФГБНУ Агрофизического научноисследовательского института, г. Санкт-Петербург, 2023-2024 годы)
-
2. Содержание фотосинтетических пигментов в листьях растений при выращивании в биоэлектрохимических системах (БЭС) в условиях интенсивной светокультуры ( n = 4, М ±SD, агробиополигон ФГБНУ Агрофизического научноисследовательского института, г. Санкт-Петербург, 2023-2024 годы)
3. Исследуемые показатели фотосинтетической активности при выращивании растений в биоэлектрохимических системах (БЭС) в условиях интенсивной светокультуры
Содержание хлорофиллов и каротиноидов в листьях у томата было выше, чем у салата, соответственно на 98 и 84 % и выше, чем у редиса, на 52 и 61 % (р < 0,05). Основная функция фотосинтетических пигментов заключается в преобразовании энергии света в накопленную химическую энергию. Вероятно, у салата наименьшее из исследованных вариантов количество фотосинтетических пигментов в расчете на единицу сырой массы листьев связано с большей площадью поверхности, усваивающей световую энергию (табл. 2).
Таким образом, на примере салата, редиса и томата показана биосовместимость разработанных электродных систем и возможность получения высоких урожаев качественной растительной продукции, в том числе товарных корнеплодов редиса, при выращивании растений в БЭС.
Важно отметить улучшение показателей качества растений при культивировании в БЭС по сравнению с другими технологиями выращивания, используемыми в светокультуре. Так, в нашем случае наблюдалось увеличение содержания хлорофиллов почти в 4 раза и снижение количества нитратов в 1,3 раза в листьях салата сорта Балет по сравнению с растениями, выращенными с использованием гидропонных технологий (30). Для редиса значимых различий в химическом составе корнеплодов обнаружено не было (31). Для полученных нами плодов томата сорта Наташа было характерно повышенное содержание сухого вещества при схожих показателях количества витамина С и нитратов относительно метода культивирования с применением малообъемной панопоники (32).
Ранее мы установили, что интенсивность конверсии света листьями влияет на величину разности потенциалов, генерируемой в корнеобитаемой среде (33). В связи с этим представляло интерес сравнить изменения фотосинтетической активности (табл. 3) исследуемых культур и динамики био-электрогенных процессов в прикорневой зоне на протяжении вегетационного периода. Средние значения напряжения в корнеобитаемой среде на даты измерения показателей фотосинтетической активности составили для салата 297 мВ на 14-е и 297 мВ на 21-е сут, для редиса — 390 мВ на 21-е и 327 мВ на 25-е сут, для томата — 136 мВ на 54-е и 322 мВ на 90-е сут.
Индекс I Характеристика Формула I Ссылка
|
Индексы отражения света листовой поверхностью |
|||
|
ChlRI |
Индекс отражения хлорофилла |
ChlRI = (R 750 - R 705 )/(R 750 + R 705 - 2R 445 ) |
(34) |
|
SIPI |
Отношение суммы каротиноидов к сумме хлорофиллов |
SIPI = (R 800 - R 445 )/(R 800 – R 680 ) |
(35) |
|
PRI |
Фотохимический индекс отражения |
PRI = (R 570 - R 531 )/(R 570 + R 531 ) |
(36) |
|
R800 |
Индекс интенсивности рассеяния света |
R 800 |
(34) |
|
Fv/Fm |
Параметры флуорес Максимальный фотохимический квантовый выход |
ценции хлорофилла Fv/Fm = (Fm - Fo)/Fm |
(37) |
|
Y(II) |
Эффективный фотохимический (реальный) квантовый выход |
Y(II) = (F′m - Ft)/F′m |
(38) |
|
NPQ |
Коэффициент зеаксантин-зависимого нефотохимического тушения |
NPQ = Fm/F′m - 1 |
(39) |
|
Y(NO) |
Коэффициент квантового выхода нерегулируемой диссипации тепла и эмиссии флуоресценции, не включающий транстилакоидную ΔpH и зеаксантин |
Y(NO) = Ft /Fm |
(40) |
Пр и м еч ани е. R λ — интенсивность отражения света от листовой поверхности при длине волны λ (нм),
Fo —минимальная флуоресценция, Fm — максимальная флуоресценция, F′m — максимальный выход флуоресценции адаптированного к свету образца, Ft — стационарный (мгновенный) уровень флуоресценции адаптированного к свету образца.
Индекс отражения хлорофилла ChlRI, коррелирующий с содержанием этого пигмента в листьях (r = 0,99, р = 0,0002), был больше у растений томата (рис. 4). Увеличение ChlRI в листьях в процессе вегетации в виде тенденции наблюдалось у салата сорта Балет и достоверно — у редиса сорта Петербургский фиолетовый. При этом величина ChlRI была на 30-36 % выше для редиса, чем для салата, что соответствовало тому же диапазону увеличения напряжения в корнеобитаемой среде корнеплодных по сравне- нию с листовыми культурами в конце вегетационного периода. Однако в листьях томата, наоборот, величина ChlRI в фазу созревания плодов уменьшалась при росте разности потенциалов в прикорневой зоне.
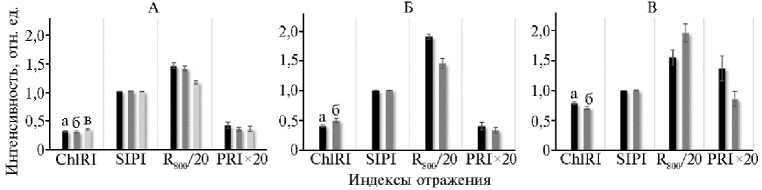
Рис. 4. Индексы диффузного отражения листьев при выращивании растений в биоэлектрохими-ческих системах (БЭС) в условиях интенсивной светокультуры: А — салат ( Lactuca sativa L.) сорта Балет на 14-е (а), 21-е (б) и 28-е сут (в) вегетативного периода, Б — редис ( Raphanus sativus L.) сорта Петербургский фиолетовый на 21-е (а) и 25-е сут (б) вегетативного периода, В — карликовый томат ( Solanum lycopersicum L.) сорта Наташа на 54-е (а) и 90-е сут (б) генеративного периода ( n = 30, М ±CI, агробиополигон ФГБНУ Агрофизического научно-исследовательского института, г. Санкт-Петербург, 2023-2024 годы).
Отношение суммы каротиноидов к сумме хлорофиллов SIPI было практически одинаковым для всех исследованных культур и находилось в диапазоне 1,000-1,024. Немного большие показатели SIPI для растений салата могли свидетельствовать о накоплении в листьях каротиноидов, выполняющих антиоксидантные функции, что, однако, не было подтверждено биохимическим анализом.
Индекс интенсивности рассеяния света R 800 может свидетельствовать о возникновении структурных трансформаций листа, в частности изменений величины межклеточного воздушного пространства (41). R 800 уменьшался к концу вегетативной стадии у салата и редиса и увеличивался в процессе генеративной стадии у томата. Этот индекс характеризует изменения отношения площади поверхности мезофилла к площади листа. Предполагается, что этот процесс может коррелировать и с электрогенными свойствами. Так, уменьшение величины R 800 сопровождалось уменьшением напряжения в корнеобитаемой среде у редиса, а увеличение R 800 для листьев томата могло быть связано с повышением разности потенциалов в прикорневой зоне растений.
Фотохимический индекс отражения PRI имел наибольшие значения у растений томата. У всех изученных культур в процессе роста наблюдалось уменьшение величины PRI, что могло быть связано со снижением интенсивности тепловой диссипации в листьях и увеличением эффективности превращения энергии света в химическую энергию. Уменьшение этого индекса в процессе роста сопровождалось увеличением значений ChlRI, что и наблюдалось в наших опытах для растений салата и редиса.
Мы также рассчитали параметры флуоресценции хлорофилла, а именно оценили количество адсорбированной энергии квантов, используемой фотосистемой II (ФСII) в фотохимических и нефотохимических процессах (рис. 5).
Максимальный фотохимический квантовый выход Fv/Fm, отражающий потенциальный квантовый выход ФСII, у салата был стационарен и составлял 0,821-0,824, у редиса уменьшался с 0,819 до 0,801, у томата был максимальным — 0,831 на 54-е сут генеративного периода и снижался до 0,819 к 90-м сут (см. рис. 5).
Эффективный фотохимический квантовый выход Y(II), характери- зующий соотношение числа квантов, используемых в фотохимических реакциях, к общему числу поглощенных квантов, был наибольший для растений редиса на 21-е сут развития. Интересно отметить, что на этот срок в корнеобитаемой среде редиса зафиксировали и наибольшую разность потенциалов.
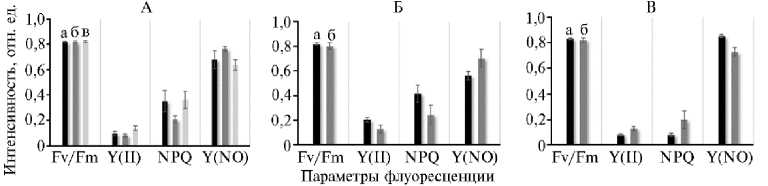
Рис. 5. Параметры флуоресценции листьев при выращивании растений в биоэлектрохимических системах (БЭС) в условиях интенсивной светокультуры: А — салат ( Lactuca sativa L.) сорта Балет на 14-е (а), 21-е (б) и 28-е сут (в) вегетативного периода, Б — редис ( Raphanus sativus L.) сорта Петербургский фиолетовый на 21-е (а) и 25-е сут (б) вегетативного периода, В — карликовый томат ( Solanum lycopersicum L.) сорта Наташа на 54-е (а) и 90-е сут (б) генеративного периода ( n = 9, М ±CI, агробиополигон ФГБНУ Агрофизического научно-исследовательского института, г. Санкт-Петербург, 2023-2024 годы).
Коэффициент нефотохимического тушения NPQ, связанный с тилакоидными рН- и зеаксантин-зависимыми механизмами тушения, уменьшался в процессе вегетации у редиса и увеличивался у томата, что соответствовало изменению напряжения в прикорневой зоне у этих культур (см. рис. 5).
Нерегулируемые потери энергии возбуждения Y(NO), включающие рассеяние тепла и флуоресцентное излучение, менялись обратно пропорционально коэффициенту NPQ и показали обратную корреляцию с формированием разности потенциалов в корнеобитаемой среде (см. рис. 5).
На основании полученных результатов можно сделать заключение, что из исследованных параметров фотосинтетической активности индекс рассеяния света R 800 и эффективный фотохимический квантовый выход Y(II) были связаны с интенсивностью электрогенных процессов наиболее тесной прямой корреляцией.
Другие исследователи также отмечали значимость активности фотосинтетического аппарата для процессов производства биоэлектричества и важность применения неиванзивных методов ее оценки по оптическим показателям и параметрам флуоресценции — максимальному отношению Fv/Fm и эффективному фотохимическому квантовому выходу Y(II) (42, 43).
Полученные нами результаты согласуются с имеющимися в литературе. Так, при выращивании в РМТЭ различных сортов риса было обнаружено снижение количества корневых экссудатов на стадии плодоношения и уменьшение вследствие этого величины генерируемого напряжения (44). У фасоли на вегетативной стадии отмечалось устойчивое увеличение напряжения и его падение в начале цветения и в дальнейшем при развитии плодов, что было связано с меньшим выделением ризодепозитов (45). Следовательно, при использовании плодоовощных, бобовых, зерновых культур может возникать конкуренция между выработкой биоэлектричества и увеличением биомассы плодов на генеративной стадии. В связи с этим для БЭС перспективны листовые и корнеплодные культуры, продукционный потенциал которых полностью реализуется на вегетативной стадии.
Использование биоэлектрогенеза в системе корнеобитаемая среда— растения имеет большой потенциал в первую очередь в сельском хозяйстве для обеспечения электропитанием маломощных устройств мониторинга состояния окружающей среды и растений, а также для частичного электроснабжения устройств поддержки жизнедеятельности растений в искусственных агроэкосистемах. Это особенно важно на удаленных от энергосетей территориях, в частности в Арктической и Антарктической зонах. Разработанные конструкции БЭС позволяют решить задачу их интеграции в агропроизводство без глобального вмешательства в экосистему корнеобитаемой среды, расширяют состав возделываемых растений и могут быть реализованы в условия как открытого, так и защищенного грунта, в почве и в искусственных средах.
Экономическая эффективность БЭС обусловлена созданием комбинированного производства растительной продукции, сопровождающегося получением экологически чистой электроэнергии. При этом применение БЭС позволит снизить затраты за счет использования растительных организмов в качестве доступных и возобновляемых энергоресурсов. В агропромышленном комплексе такие биоэнергетические устройства не требуют значительных вложений, в том числе средств на дополнительное техническое обслуживание, поскольку частично они основаны на компонентах, имеющихся в системах культивирования.
Итак, при выращивании в биоэлектрохимических системах средняя величина генерируемой в корнеобитаемой среде разности потенциалов для салата сорта Балет составила 289 мВ, для редиса сорта Петербургский фиолетовый — 394 мВ, для томата сорта Наташа — 257 мВ. При этом листовая культура обладала лучшими по стабильности электрическими свойствами, корнеплодная давала больший выход электроэнергии, а плодовая овощная позволяла получать вырабатываемое электричество более длительное время. С учетом возможного числа сборов урожая с одного яруса за год общая продуктивность составила 73,5±10,3; 68,6±3,8 и 71,2±9,2 кг/м2 в год соответственно для салата, редиса и томата. Качество получаемой при выращивании в БЭС растительной продукции полностью соответствовало санитарно-гигиеническим требованиям Российской Федерации: содержание нитратов — 1597,0±214,7; 1206,0±144,8; 70,2±9,3 мг/кг при естественной влажности (е.в.), сумма сахаров — 13,0±1,2; 29,6±2,9 и 32,1±3,7 % сухого вещества (с.в.), количество витамина С — 12,9±1,6; 7,7±0,7 и 17,4±2,1 мг/100 г е.в. соответственно в листьях салата, корнеплодах редиса и плодах томата. Из неинвазивно исследованных параметров, характеризующих фотосинтетическую активность растений, с интенсивностью электрогенных процессов наиболее тесной прямой корреляцией были связаны индекс рассеяния света R 800 (23,5±0,5; 29,1±1,7; 39,2±3,0 отн. ед.) и эффективный фотохимический квантовый выход Y(II) (0,134±0,018; 0,131±0,032; 0,129±0,016 отн. ед.) соответственно у салата на 28-е сут, у редиса на 25-е сут, у томата на 90-е сут вегетации.
Список литературы Биоэлектрогенез в корнеобитаемой среде листовых, плодовых и корнеплодных овощных культур
- Кулешова Т.Э., Галушко А.С., Панова Г.Г., Волкова Е.Н., Apollon W., Shuang C., Sevda S. Биоэлектрохимические системы на основе электроактивности растений и микроорганизмов в корнеобитаемой среде (обзор). Сельскохозяйственная биология, 2022, 57(3): 425-440 (doi: 10.15389/agrobiology.2022.3.425rus).
- Winaikij P., Sreearunothai P., Sombatmankhong K. Probing mechanisms for microbial extracel-lular electron transfer (EET) using electrochemical and microscopic characterisations. Solid State Ionics, 2018, 320: 283-291 (doi: 10.1016/j.ssi.2018.02.044).
- Tongphanpharn N., Guan C.Y., Chen W.S., Chang C.C., Yu C.P. Evaluation of long-term per-formance of plant microbial fuel cells using agricultural plants under the controlled environment. Clean Technologies and Environmental Policy, 2023, 25(2): 633-644 (doi: 10.1007/s10098-021-02222-9).
- Guan C.Y., Yu C.P. Evaluation of plant microbial fuel cells for urban green roofs in a subtropical metropolis. Science of the Total Environment, 2021, 765: 142786 (doi: 10.1016/j.sci-totenv.2020.142786).
- Regmi R., Nitisoravut R., Charoenroongtavee S., Yimkhaophong W., Phanthurat O. Earthen pot—plant microbial fuel cell powered by Vetiver for bioelectricity production and wastewater treatment. CLEAN — Soil, Air, Water, 2018, 46(3): 1700193 (doi: 10.1002/clen.201700193).
- Arulmani S.R.B., Gnanamuthu H.L., Kandasamy S., Govindarajan G., Alsehli M., Elfasa-khany A., Zhang H. Sustainable bioelectricity production from Amaranthus viridis and Triticum aestivum mediated plant microbial fuel cells with efficient electrogenic bacteria selections. Process Biochemistry, 2021, 107: 27-37 (doi: 10.1016/j.procbio.2021.04.015).
- Sarma P.J., Mohanty K. Epipremnum aureum and Dracaena braunii as indoor plants for enhanced bio-electricity generation in a plant microbial fuel cell with electrochemically modified carbon fiber brush anode. Journal of Bioscience and Bioengineering, 2018, 126(3): 404-410 (doi: 10.1016/j.jbiosc.2018.03.009).
- Bhattacharya R., Parthasarthy V., Bose D., Gulia K., Srivastava S., Roshan K.R., Shankar R. Overview of the advances in plant microbial fuel cell technology for sustainable energy recovery from rhizodeposition. Biotechnology and Bioengineering, 2023, 120(6): 1455-1464 (doi: 10.1002/bit.28380).
- Sophia A.C., Sreeja S. Green energy generation from plant microbial fuel cells (PMFC) using compost and a novel clay separator. Sustainable Energy Technologies and Assessments, 2017, 21: 59-66 (doi: 10.1016/j.seta.2017.05.001).
- Hu J., Yang Z., Huang Z., Li H., Wu Z., Zhang X., Qin X., Li C., Ruan M., Zhou K., Wu, X., Zhang Y., Xiang Y., Huang J. Co-composting of sewage sludge and Phragmites australis using differ-ent insulating strategies. Waste Management, 2020, 108: 1-12 (doi: 10.1016/j.wasman.2020.04.012).
- Di L., Li Y., Nie L., Wang S., Kong F. Influence of plant radial oxygen loss in constructed wetland combined with microbial fuel cell on nitrobenzene removal from aqueous solution. Jour-nal of Hazardous Materials, 2020, 394: 122542 (doi: 10.1016/j.jhazmat.2020.122542).
- Sato C., Apollon W., Luna-Maldonado A. I., Paucar N. E., Hibbert M., Dudgeon J. Integrating microbial fuel cell and hydroponic technologies using a ceramic membrane separator to develop an energy—water—food supply system. Membranes, 2023, 13(9): 803-824 (doi: 10.3390/mem-branes13090803).
- Lepikash R., Lavrova D., Stom D., Meshalkin V., Ponamoreva O., Alferov S. State of the art and environmental aspects of plant microbial fuel cells’ application. Energies, 2024, 17(3): 752 (doi: 10.3390/en17030752).
- Bataillou G., Ondel O., Haddour N. 900-Days long term study of plant microbial fuel cells and complete application for powering wireless sensors, Journal of Power Sources, 2024, 593: 233965 (doi: 10.1016/j.jpowsour.2023.233965).
- Lu Z., Yin D., Chen P., Wang H., Yang Y., Huang G., Cai L., Zhang L. Power-generating trees: Direct bioelectricity production from plants with microbial fuel cells. Applied Energy, 2020, 268: 115040 (doi: 10.1016/j.apenergy.2020.115040).
- Osorio-de-la-Rosa E., Valdez-Hernández M., Vázquez-Castillo J., Franco-de-la-Cruz A., Woo-García R., Castillo-Atoche A., La-Rosa R. Plant microbial fuel cells as a bioenergy source used in precision beekeeping. Sustainable Energy Technologies and Assessments, 2023, 60: 103499 (doi: 10.1016/j.seta.2023.103499).
- Maddalwar S., Nayak K.K., Singh L. Evaluation of power generation in plant microbial fuel cell using vegetable plants. Bioresource Technology Reports, 2023, 22: 101447 (doi: 10.1016/j.biteb.2023.101447).
- Sinyavina N.G., Kochetov A.A., Kocherina N.V., Egorova K.V., Kurina A.B., Panova G.G., Chesnokov Y.V. Breeding approaches for controlled conditions of artificial light culture for small radish and radish (Raphanus sativus L.). Horticulturae, 2023, 9(6): 678 (doi: 10.3390/horticul-turae9060678).
- Кочетов А.А., Синявина Н.Г. Патент на селекционное достижение 11518 РФ. Редис Raphanus sativus var. sativus Петербургский фиолетовый. ФГБНУ Агрофизический научно-исследовательский институт. Заявка № 8058521. Дата приоритета. 28.11.2019. Выдан 25.03.2021.
- Panova G.G., Udalova O.R., Kanash E.V., Galushko A.S., Kochetov A.A., Priyatkin N.S., Arkhipov M.V., Chernousov I.N. Fundamentals of physical modeling of “ideal” agroecosystems. Technical Physics, 2020, 65: 1563-1569 (doi: 10.1134/S1063784220100163).
- Кулешова Т.Э., Галль Н.Р. Динамика биоэлектрического потенциала в прикорневой зоне растений при поливах. Почвоведение, 2021, 3: 338-346 (doi: 10.31857/S0032180X21030084).
- Ермаков А.И., Арасимович В.В., Ярош Н.П., Перуанский Ю.В., Луковникова Г.А., Смирнова-Иконникова М.И. Методы биохимического исследования растений. Л., 1987.
- Руководство по методам анализа качества и безопасности пищевых продуктов /Под ред. Скурихина И.М., Тутельяна В.А. М., 1998.
- MINI-PAM Photosynthesis Yield Analyzer. Manual. Edition 3. Heinz Walz GmbH, Effeltrich, Ger-many, 2018.
- Wang S., Gariepy Y., Adekunle A., Raghavan V. External resistance as a potential tool for bioe-lectricity and methane emission control from rice plants in hydroponic microbial fuel cell. Fuel, 2024, 368: 131431 (doi: 10.1016/j.fuel.2024.131431).
- Holland B.L., Monk N.A.M., Clayton R.H., Osborne C.P. A theoretical analysis of how plant growth is limited by carbon allocation strategies and respiration. In Silico Plants, 2019, 1(1): diz004 (doi: 10.1093/insilicoplants/diz004).
- Апалько А.Д., Кондратьев В.М., Осипова Г.С. Сравнительная агробиологическая оценка салата сорта Балет в условиях светокультуры. Вестник Студенческого научного общества, 2017, 8(1): 91-92.
- Балашова И.Т., Сирота С.М., Пинчук Е.В., Вершинина Н.П., Сивоченко С.П. Семеноводство сортов томата, предназначенных для многоярусных гидропонных конструкций: первые шаги. Овощи России, 2020, 1: 29-34 (doi: 10.18619/2072-9146-2020-1-29-34).
- СанПиН 2.3.2.1078-01. Гигиенические требования к безопасности и пищевой ценности пищевых продуктов. 06.11.2001.
- Осипова Г.С., Апалько А.Д., Кондратьев В.М. Агробиологическая оценка салата сорта Балет в условиях светокультуры. Научный вклад молодых исследователей в сохранение традиций и развитие АПК, 2016: 73-74.
- Синявина Н.Г., Кочетов А.А., Хомяков Ю.В., Конончук П.Ю., Вертебный В.Е., Дубовиц-кая В.И., Ткачева А.Ю. Редис для светокультуры: задачи и перспективы селекции. Овощи России, 2019, 3: 35-39 (doi: 10.18619/2072-9146-2019-3-35-39).
- Балашова И.Т., Сирота С.М., Пинчук Е.В., Удалова О.Р., Аникина Л.М., Панова Г.Г. Улучшение сортовых характеристик томата Наташа под влиянием искусственного освещения на вегетационной световой установке АФИ. Материалы II Международной научной конференции посвященной памяти академика Е.И. Ермакова «Тенденции развития агрофизики: от актуальных проблем земледелия и растениеводства к технологиям будущего». СПб, 2019: 180-189.
- Кулешова Т.Э., Желнина А.И., Удалова О.Р., Панова Г.Г., Галль Н.Р. Динамика конверсии света листьями растений в электрический ток в прикорневой зоне. Актуальные вопросы биологической физики и химии, 2020, 5(3): 379-385.
- Sims D.A., Gamon J.A. Relationships between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and developmental stages. Remote Sensing of Envi-ronment, 2002, 81(2-3): 337-354 (doi: 10.1016/S0034-4257(02)00010-X).
- Peñuelas J., Filella I., Biel C., Serrano L., Save R. The reflectance at the 950-970 nm region as an indicator of plant water status. International Journal of Remote Sensing, 1993, 14(10): 1887-1905 (doi: 10.1080/01431169308954010).
- Gamon J.A., Serrano L., Surfus J.S. The photochemical reflectance index: an optical indicator of photosynthetic radiation use efficiency across species, functional types, and nutrient levels. Oecologia, 1997, 112: 492-501 (doi: 10.1007/s004420050337).
- Kitajima M., Butler W.L. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1975, 376(1): 105-115 (doi: 10.1016/0005-2728(75)90209-1).
- Genty B., Briantais J.-M., Baker N.R. The relationship between the quantum yield of photosyn-thetic electron transport and quenching of chlorophyll fluorescence. Biochimica et Biophysica Acta (BBA) - General Subjects, 1989, 990(1): 87-92 (doi: 10.1016/S0304-4165(89)80016-9).
- Bilger W., Björkman O. Role of the xanthophyll cycle in photoprotection elucidated by measure-ments of light-induced absorbance changes, fluorescence and photosynthesis in leaves of Hedera canariensis. Photosynthesis Research, 1990, 25: 173-185 (doi: 10.1007/BF00033159).
- Genty B., Harbinson J., Cailly A.L., Rizza F. Fate of excitation at PS II in leaves: the non-photochemical side. Proc. 3rd BBSRC Robert Hill Symposium on photosynthesis /B. Genty, J. Har-binson, A.L. Cailly, F. Rizza. University of Sheffield, Department of Molecular Biology and Biotechnology, Western Bank, Sheffield, UK, 1996: 28.
- Канаш Е.В., Осипов Ю.А. Диагностика физиологического состояния и устойчивости растений к действию стрессовых факторов среды (на примере УФ-В радиации). Методические рекомендации. СПб, 2008.
- Fincheira P., Quiroz A., Tortella G., Diez M.C., Rubilar O. Current advances in plant-microbe communication via volatile organic compounds as an innovative strategy to improve plant growth. Microbiological Research, 2021, 247: 126726 (doi: 10.1016/j.micres.2021.126726).
- Kwon K.J., Park B.J. Efficiency of Spathiphyllum spp. as a plant-microbial fuel cell. Ornamental Horticulture, 2021, 27: 173-182 (doi: 10.1590/2447-536X.v27i2.2264).
- Aulakh M., Wassmann R., Bueno C., Kreuzwieser J., Rennenberg H. Characterization of root exudates at different growth stages of ten rice (Oryza sativa L.) cultivars. Plant Biology, 2001, 3(2): 139-148 (doi: 10.1055/s-2001-12905).
- Pamintuan K.R.S., Katipunana A.M.C., Palaganasa P.A.O., Caparangaa A.R. An analysis of the stacking potential and efficiency of plant-microbial fuel cells growing green beans (Vigna ungicu-lata ssp. sesquipedalis). International Journal of Renewable Energy Development, 2020, 9(3): 439-447 (doi: 10.14710/ijred.2020.29898).


