Биологическая активность грибов рода Trichoderma и их промышленное применение
Автор: Гнеушева И.А., Павловская Н.Е., Яковлева И.В.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Научное обеспечение развития растениеводства
Статья в выпуске: 3 (24), 2010 года.
Бесплатный доступ
Проведена оценка биологической активности гриба рода Trichoderma viride. Установлено, что при культивировании микромицета на жидкой питательной среде с добавлением твердого остатка соломы гречихи, культуральная жидкость исследуемого штамма проявляет высокую целлюлазную активность и не обладает фитотоксичностью. Данный экспериментальный субстрат рекомендован к использованию его для биоконверсии грибами рода Trichoderma viride при промышленном получении жидкого биопрепарата «Триходермин».
Биологическая активность, целлюлазная активность, биопрепарат
Короткий адрес: https://sciup.org/147123511
IDR: 147123511 | УДК: 573.6.086.835:579.8
Текст научной статьи Биологическая активность грибов рода Trichoderma и их промышленное применение
В последние годы в связи с бурным развитием биотехнологии возрастает интерес к микроскопическим грибам рода Trichoderma, которые привлекают внимание исследователей в связи с их практическим значением для получения биологически активных веществ, средств защиты растений и как активного деструктора растительных полисахаридов [4]. Разработка на их основе экологически чистых технологий является важным направлением в экологической биотехнологии.
При исследовании биологии микромицета в первую очередь акцентируют внимание на его ингибирующую активность в отношении фитопатогенных грибов, таких как Fusarium oxysporum, Phytophthora parasitica и др. Поэтому грибы рода Trichoderma используются в мировой практике для создания и разработки биологических препаратов, исходя из высокого антагонистического потенциала, скорости роста и возможности культивирования в производственных условиях.
Известно также, что Trichoderma выделяет различные метаболиты: факторы роста (ауксины, цитокины и этилен), органические кислоты, внутриклеточные аминокислоты , витамины и свыше 100 антибиотиков [1]. Фитогормоны Trichoderma (цитокинины), отвечающие за стимуляцию физиологических процессов растений, поступают в растительный организм и приводят к более активному его развитию [5]. Из тканей гриба можно получить трихотецин – антибиотик и триходермин – средство защиты растений от грибных болезней.
Микромицет рода Trichoderma является активным продуцентом фермента целлюлазы и способен к глубокой деструкции как клеточных стенок растений, так и отдельных трудно расщепляемых растительных полисахаридов: целлюлозы, гемицеллюлозы, пектина до мономерных форм [6]. В настоящее время активно исследуются фенолоксидазы микромицета в связи со значительной ролью этих ферментов в биодеградации лигнина [2].
The estimation of biological activity of a mushroom of sort Trichoderma viride Is lead. It is established, that at cultivation microscopic mushroom on a liquid nutrient medium with addition of the firm rest of straw fagopyrum, еру culture liquid investigated к ind shows high cellulose activity and does not possess fitoooxicity. The given experimental substratum is recommended to its use for bioconversion by mushrooms of sort Trichoderma viride at industrial reception of a liquid biological product «Trihodermin ».
Trichoderma viride – биодеструктор лигноцеллюлазных материалов проявляет высокую целлюлазную активность на любых питательных средах [9].
Целью данной работы являлась оценка биологической активности гриба рода Trichoderma viride в отношении фитопатогена Fusarium oxysporum, вызывающего корневые гнили бобовых растений, и определение целлюлазной активности микромицета при культивировании на трудногидролизуемом целлюлозосодержащем субстрате (соломе гречихи).
М атериалы и методика исследований
Исследование проводилось в лаборатории биотехнологии Орловского регионального биотехнологического центра сельскохозяйственных растений Орел ГАУ на инновационном оборудовании.
Объекты исследования . В работе использовался микромицет Trichoderma viride, который был выделен из биогумуса. К 25 г биогумуса с влажностью 60% добавляли МКЦ (карбоксиметилцеллюлоза), из расчета 0,3 г на 1 кг и культивировали в термостате при температуре 27оС. Выделенную накопительную культуру идентифицировали по Гаузе [7]. Посевной материал выращивали на агаризованной среде Чапека при температуре 28оС, 5 суток в термостате. Для получения инокулята спорово-мицелиальную суспензию микромицета фильтровали и разбавляли до 1*106 спор/г.
Фитопатоген Fusarium oxysporum любезно предоставлен заведующей лабораторией защиты иммунитета и агротехники ГНУ ВНИИ ЗБК к.с.х.н. Борзенковой Г.А.
М етоды
Определение ингибирующей активности Trichoderma viride выявляли методом «аппликаций». На тест-культуру Fusarium oxysporum, равномерно распределенной по поверхности твердой питательной среды Чапека в чашке Петри, накладывали диск из фильтровальной бумаги, смоченный исследуемым биоцидом – Trichoderma viride. После инкубации определяли зону задержки роста тест-культуры.
Потенциальная способность микромицета разрушать целлюлозосодержащий субстрат была подтверждена в результате проведения качественных реакций с использованием КМЦ (карбоксиметилцеллюлоза), о чем свидетельствовало образование зон просветления среды вокруг колонии гриба.
Для биоконверсии использовали целлюлозосодержащий субстрат – солому гречихи, которая является ценным биотехнологическим сырьем с богатым комплексом распространенных биополимеров, биологически активных веществ, а также органических веществ не волокнистого характера (биофлавоноидов), которые способствуют устойчивости к поражению патогенными грибами. Для снижения селективности субстрата биофлавоноиды были частично извлечены из сырья путем водной экстракции.
Характеристика твердого остатка соломы гречихи представлена в таблице 1.
Клетчатка является веществом для биоконверсии растительного сырья микромицетами, а фенольные соединения (биофлавоноиды) – дополнительным источником углерода.
Таблица 1 – Характеристика твердого остатка соломы гречихи
|
Показатели |
Характеристика |
|
Влажность , % |
65 |
|
РСВ , % |
1,5 |
|
« Сырая » клетчатка , % |
45,7 |
|
Сумма биофлавоноидов , г / л |
1,4 |
Предварительно термически обработанную экспериментальную среду (110 г твердого остатка соломы гречихи и 1 л питательной среды по Чапеку-Доксу) инокулировали споровой суспензией Trichoderma viride. Биодеструкцию целлюлозы проводили методом глубинной ферментации в биореакторе BIOSTAT A plus при температуре 25-28оС, рН 5,0-5,5, 200 об./мин.
Зависимости между наличием биомолекул-стимуляторов, продуцируемых микромицетом Trichoderma viride, и улучшением физиологических и биохимических свойств микрорастений гороха проводили согласно методике (Молина, Алимова, 2009) [11]. Отфильтрованной культуральной жидкостью обрабатывали 3-дневные прорости гороха. На 7-е сутки измеряли длину стеблей, корней, пероксидазную активность . Подсчет фитотоксической активности проводили по формуле:
Аф=100-((Дх-Дн/Дк-Дн)*100), где
Аф – фитотоксическая активность в процентах ингибирования роста корней ( стеблей );
Дх – средняя длина корней ( стеблей ) на 7- е сутки в опытном варианте , см ;
Дк – средняя длина корней ( стеблей ) на 7- е сутки в контроле , см ;
Дн – начальная длина корней ( стеблей ) на 3- е сутки , см .
Показателем фитотоксичности является угнетение роста корней (проростков) более чем на 30% по сравнению с контролем [8].
Определение целлюлазной активности Trichoderma viride на целлюлозосодержащем субстрате проводили по Konig (2002) [3]. Пробы отбирали каждые 24 часа. Клетки отделяли центрифугированием [10].
Исследования проводили в трех биологических повторностях. Данные в таблице 2 приведены – среднее значение +/- стандартное отклонение. Статистическая обработка результатов и графическое представление данных проводили с использованием программы Microsoft Office Excell.
Результаты и их обсуждение
Антагонистическое действие гриба рода Trichoderma viride в отношении Fusarium oxysporum, оцененное зонами подавления роста фитопатогена, представлено в таблице 2.
Таблица 2 – Ингибирующая активность Trichoderma viride
|
Время инкубации , час |
Диаметр зоны подавления роста гриба Fusarium oxysporum, мм |
|
24 |
4 |
|
48 |
12 |
|
72 |
28 |
|
96 |
42 |
|
120 |
50 |
При совместном культивировании с Trichoderma viride плотность популяции фитопатогена сокращалась до минимума на 5 сутки. Микроскопированием мицелия, конидиеносцев Fusarium oxysporum не установлено внедрение в их клетки гиф гриба рода Trichoderma viride. Антагонистическая активность исследуемого микромицета обусловлена продуцированием фитогормонов, антибиотиков и способностью к быстрой колонизации субстрата.
При изучении влияния культуральной жидкости Trichoderma viride на рост гороха отмечено, что данный штамм увеличивает рост корней (проростков) 7-дневных микрорастений в 2,5 (2,3) раза по отношению к контролю (рис. 3).
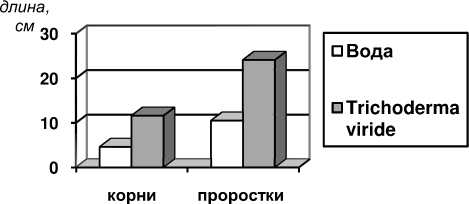
Рисунок 3 – Длина корней и проростков 7- дневных микрорастений гороха , обработанных и необработанных
Trichoderma viride
При изучении пероксидазной активности было установлено, что выделение данного фермента у 7-дневных проростков гороха, обработанных Trichoderma viride, увеличилось по отношению к контролю в 2 раза (рис. 4).
В результате исследований показано, что изучаемый штамм Trichoderma viride не обладает фитотоксичностью, а стимулирует рост корней и проростков гороха. Ингибирующую способность по отношению к микрорастению гороха проявляет Fusarium oxysporum, т.е. обладает 100% фитотоксической активностью (рис. 5).
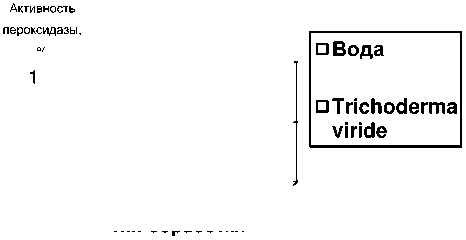
Рисунок 4 – Активность пероксидазы в 7- дневных проростах гороха , обработанных и необработанных Trichoderma viride
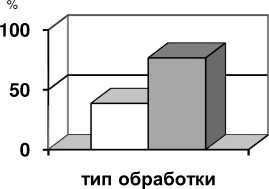
для выращивания гриба рода Trichoderma viride в качестве стимуляторов роста гороха штамм перспективен, так как стимулирует рост корней и проростков, увеличивает пероксидазную активность , то есть не проявляет фитотоксичности.
Полученные нами результаты показывают, что целлюлоза твердого остатка соломы гречихи подвержена деструкции под действием микромицета Trichoderma viride методом глубинной ферментации. Микромицет проявляет высокую целлюлазную активность . Содержание «сырой» клетчатки после 96 часов ферментации составило 32,4%, что на 30% меньше, чем в исходном субстрате.
Таким образом, благоприятный состав твердого остатка соломы гречихи позволяет использовать его в
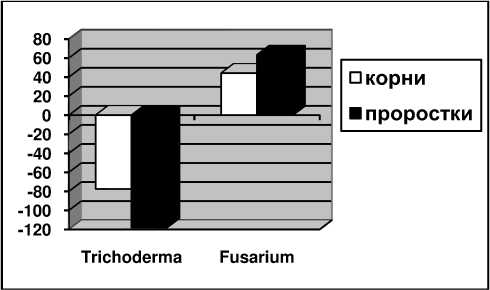
Рисунок 5 – Влияние культуральной жидкости Trichoderma viride и Fusarium oxysporum на рост корней и проростков гороха
В процессе культивирования Trichoderma viride продуцирует фермент целлюлазу, за счет чего происходит гидролиз полисахаридов до растворимых сухих веществ (РСВ) [5]. Целлюлазная активность микромицета на экспериментальном субстрате представлена в таблице 6.
Таблица 6 – Целлюлазная активность Trichoderma viride на экспериментальном субстрате
|
Время культивирования , час |
Целлюлазная активность , ед / мл |
Содержание РСВ , % |
|
24 |
0,025+/-0,002 |
3,3 |
|
48 |
0,042+/-0,005 |
4,4 |
|
72 |
0,283+/-0,03 |
7,1 |
|
96 |
0,10+/-0,01 |
9,9 |
Полученные результаты показывают, что в ходе культивирования на трудногидролизуемом целлюлозосодержащем субстрате Trichoderma viride проявляет высокую целлюлазную активность . Содержание «сырой» клетчатки после 96 часов ферментации составило 32,4%, что на 30% меньше, чем в исходном твердом остатке соломы гречихи.
Выводы
Микроскопический гриб Trichoderma viride в отношении Fusarium oxysporum проявляет ингибирующую активность . Плотность фитопатогена при совместном его культивировании с микромицетом сокращается до минимума на 5 сутки.
При использовании твердого остатка соломы гречихи после водной экстракции биофлавоноидов (с высоким содержанием «сырой» клетчатки – 45,7%) 38
качестве экологически чистого сырья для биоконверсии грибами рода Trichoderma viride, проявляющие высокую биологическую активность в отношении Fusarium oxysporum, а высокий титр спор в полученной культуральной жидкости (1*108 спор/гр.) дают основание рекомендовать этот субстрат для промышленного получения жидкого биопрепарата «Триходермин».
Список литературы Биологическая активность грибов рода Trichoderma и их промышленное применение
- Benitez, T. Biocontrol mechanisms of Trichoderma strains [Теxt]/T.Benitez, A.M.Rincon, M.C.Limon, A.C.Codon//International Microbiology, -2004. -№ 7. -р. 249 -260.
- Claus, H. Laccases: structure, reactions, distribution [Теxt]/H. Claus//Micron. -2004. -V. 35. -Р. 93-95
- Konig j. et al. Determination of xylanase, glucanase, and cellulose activity [Теxt]//Anal Bional Chem. -2002. -v. 374, №1. -p. 80-87.
- Алимова, Ф. К. Trichoderma/Hypocrea (Fungi, Ascomycetes, Hupocreales): таксономия и распространение [Текст]/Ф.К.Алимова. -Учебник. -Казань: Казанский государственный университет им. В.И. Ульянова-Ленина, 2006. -264 с.
- Алимова, Ф. К. Биотехнология. Промышленное применение грибов рода Trichoderma [Текст]: учебно-методическое пособие/Ф.К.Алимова, Д.И.Тазетдинова, Р.И.Тухбатова. -Казань: УНИПРЕСС ДАС, 2007. -234.
- Бабицкая, В. Г. Грибы -эффективные деструкторы лигноцеллюлозных субстратов: их морфологическая и физиолого-биохимическая характеристика [Текст]/В.Г.Бабицкая//Микология и фитопатология. -1993. -Т. 27. -№5. -с. 38-44.
- Гаузе, Г. Ф. Определитель актиномицетов [Текст]/Гаузе Г.Ф. и др. -М., 1983.
- Захарова, Н.Г. Методические указания к выполнению лабораторных работ по теме: Экология микроорганизмов [Текст]/Н.Г.Захарова, Ф.К.Алимова, С.Ю.Егоров. -Казань: КГУ, 1993. -с. 37-39.).
- Лазарева, Е.С. Влияние компонентов среды культивирования на фенолоксидазную активность микромицетов Trichoderma viride и Trichoderma Lignorum [Текст]/Е.С.Лазарева, В.Ф.Смирнов, И.В.Стручкова//Вестник Нижегородского университета им. Н.И. Лобачевского, 2008. -№1. -с.77-80.]
- Методы экспериментальной микологии [Текст]/под ред. В.И. Билай. -Киев: Наукова Думка, 1982.
- Молина, С. В. Экспресс-метод отбора микроорганизмов-продуцентов биомолекул фитостимуляторов [Текст]/С.В.Молина, Ф.К.Алимова//Электронный журнал «Структура и динамика молекулярных систем». -№6, А. -2009.


