Биологическая активность наноструктурных кальцийфосфатных покрытий и ее модификация посредством электронного облучения
Автор: Карлов А.В., Хлусов И.А., Аронов Д., Розенман Г.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2007 года.
Бесплатный доступ
Биосовместимость и функциональная активность имплантатов для остеосинтеза во многом зависит от процессов, протекающих на границе раздела кость/имплантат. Целью данного исследования было выявление эффекта наноструктурирования кальцийфосфатных (КФ) поверхностей, а также их электронной обработки на способность клеток костного мозга формировать костную ткань in situ. Для этого применяли вариант феномена эктопического костеобразования in situ, когда искусственный образец с нанесенным костным мозгом имплантируется под кожу мышей на 45 суток без инъекции дополнительных ростовых факторов. Электронную обработку КФ поверхностей проводили с помощью электронного источника (Kimball Physics Inc, США) в вакууме 10-7 тор. Образцы с анодно-искровыми КФ покрытиями, выполненными из наноразмерных частиц гидроксилапатита (ГАП) в растворе электролита, облучались зарядом Q1=10 µКл/см2 (низкий уровень облучения) и Q2=300 µКл/см2 (высокий уровень облучения). Результаты показали, что предложенный способ электронной обработки КФ поверхностей, выполненных из наноразмерного ГАП синтетической либо биологической природы, независимо от технологии их изготовления стимулирует в среднем на 82,5 % вероятность формирования костной ткани в тесте эктопического подкожного остеогенеза. Выявлены 3 механизма улучшения остеогенных свойств наноструктурных КФ покрытий посредством электронного облучения в оптимальной дозе: 1) изменение поверхностной энергии; 2) усиление гидрофобности поверхностей; 3) модификация их элементного состава.
Остеосинтез, наноструктурные кальцийфосфатные покрытия, биологическая активность
Короткий адрес: https://sciup.org/142121060
IDR: 142121060
Текст научной статьи Биологическая активность наноструктурных кальцийфосфатных покрытий и ее модификация посредством электронного облучения
По мнению различных исследователей и клиницистов, биосовместимость и функциональная активность погружных конструкций для остеосинтеза во многом зависит от процессов, протекающих на границе раздела кость/имплантат [15]. Ранее нами было показано существенное влияние физико-химических свойств кальцийфосфатных (КФ) поверхностей на реализацию in vivо остеогенного потенциала мультипотентных мезенхимальных стромальных клеток (ММСК) костного мозга [3, 4, 7].
Применение метода экзоэлектронной эмиссии, чувствительной к наличию дефектов в тонких поверхностных слоях, позволило установить, что наноструктурированная КФ поверхность обладает высокой дефектностью. Более того, оказалось, что часть дефектов, представляющих собой центры электронно-дырочного захвата, несут электрический заряд [9]. Электрическая поляризация гидроксиапатитовой (ГАП) керамики значительно улучшает ее биологические свойства [14, 26], что может иметь значение для прилипания остеогенных клеток и реализации их потенциала.
Тем не менее, не существует единого механизма адгезии клеток и биомолекул. В качестве потенциальных приложений рассматривают силы Ван-дер-Вальса, водородные, электростатические, гидрофобно-гидрофильные и рецепторные взаимодействия, факторы адгезии (лектин, фибронектин, коллаген и т.д.) [2, 12, 13]. Для адаптации биологических подложек разработаны электрические, оптические, электрохимические и другие методы, общей чертой которых является модификация исходной поверхностной энергии и связанных с ней свойств подложки (смачиваемость, адсорбция, адгезия и т.д.).
Другой подход к трансформации биохимических взаимодействий на межфазной границе клетка (биомолекула)/поверхность биоматериала был предложен в наших работах [9, 21, 23]. Эта новая концепция базируется на электронно-индуцированной модификации поверхностной энергии с помощью низкоэнергетического электронного облучения. При этом энергия электронов и электронная плотность тока адаптированы к природе материала и его электронной структуре вблизи поверхности так, чтобы не создавать новых дефектов и не менять фазового состояния в поверхностном слое. В разработанном методе бомбардирующие первичные электроны с энергией порядка 100 эВ и генерируемые вторичные электроны и дырки проникают на глубину 10-20 Å и захватываются на ловушки, связанные с поверхностными состояниями и объемными локальными центрами вблизи поверхности.
Вследствие различной подвижности электронов и дырок эти локализованные заряды образуют двойной электрический слой и меняют потенциал поверхности. Было найдено, что электронно-индуцированое изменение поверхностного электрического потенциала сопровождается сильно выраженной модификацией поверхностной энергии материалов и связанных с ней базовых свойств, таких как адгезия, адсорбция, смачиваемость и другие.
Согласно многочисленным данным, именно смачиваемость является ключевым фактором, определяющим биологическую активность, биоадгезионные и биосовместимые свойства биоматериалов [12, 13]. Метод электронно-индуцированной модификации поверхностной энергии был апробирован на материалах различной природы (кремний, двуокись кремния, окислы металлов, диэлектрические окислы, стекла, полимеры и биоматериалы) и показал идентичные результаты. Преимуществом метода является возможность широкого и плавного изменения таких свойств, как смачиваемость в интервале краевых углов 0-120˚ для воды, с высоким пространственным разрешением порядка 10 нм. Было показано, что такой подход способствует селективной адгезии ДНК и бычьего сывороточного альбумина, различных видов бактерий [9, 19, 21, 23].
В связи с этим, а также бурным развитием наноиндустрии, представляется актуальным исследование эффекта наноструктурирования КФ поверхностей, а также их электронной обработки на способность клеток костного мозга формировать костную ткань in situ.
МАТЕРИАЛЫ И МЕТОДЫ
Наноразмерные порошки синтетического гидроксилапатита (ГАП) Са 10 (РО 4 ) 6 (ОН) 2 и биологического ГАП (из костей крупного рогатого скота) для изготовления покрытий получали ме-ханохимическим методом, как описано нами ранее [6]. Электронная микроскопия (JEM-200CX, Япония) показала, что наряду с частицами диаметром 10-40 нанометров, в порошке присутствуют их агрегаты размером до 100 нм. Фазовый состав и кристалличность нанопорошков ГАП подтверждены данными рентгенофазового анализа и инфракрасной спектроскопии.
Двусторонние КФ покрытия формировали, как описано ранее [8], в модифицированном варианте. Титановые диски марки ВТ-6 обрабатывали анодно-искровым способом в 10 % растворе фосфорной кислоты, содержащей СаС0 3 и взвесь наночастиц ГАП синтетического или биологического происхождения. Были получены 3 типа модифицированных покрытий: 1) ГАП синтетический + обычный режим оксидирования; 2) ГАП синтетический + новый режим оксидирования; 3)
ГАП биологический + новый режим оксидирования. При обработке варьировали частоту импульсного тока в диапазоне 1-10 Гц и длительность импульсов от 20 до 200 мс.
Электронную обработку КФ поверхностей проводили с помощью электронного источника (Kimbаll Physics Inc, США) в вакууме 10-7 тор. Для того, чтобы локализовать область, облученную электронами вблизи КФ поверхностей, энергия электронов была выбрана приблизительно в 100 эВ, что обеспечивает область проникновения электронов на глубину до 20 Å. Образцы были облучены с зарядом Q1=10 Кл/cм2 (низкий уровень облучения) и Q2=300 Кл/cм2 (высокий уровень облучения).
Морфологию и структуру поверхности био-совместимых покрытий выявляли методом растровой электронной микроскопии (РЭМ, RАITH 150, Ultrа High Resоlutiоn E-Beаm Tооl, Германия) и атомно-силовой микроскопии (АСМ, Multimоde, Digitаl Instruments, США). Дополнительно оценивалось состояние поверхности КФ покрытий по значениям параметров вертикальных неровностей профиля с помощью измерительной системы Tаlysurf 5-120 (разрешающая способность 1 нм). Определялись следующие параметры шероховатости подложек: 1) класс шероховатости согласно ГОСТ 2789-73; 2) Rа -средний результат шероховатости в пределах нескольких длин участков измерений; 3) Rz -разница средних высот между пятью наиболее высокими гребнями и 5 наиболее глубокими впадинами поверхности в пределах оценочной длины участка измерения.
Элементный химический состав был определен с помощью рентгенофотоэлектронной спектроскопии (РФЭС, 5600 Multi-Technique System, США) с использованием монохроматического излучения АlKα (hν = 1486,6 эВ).
Распределение поверхностного потенциала изучалось нами с помощью электросиловой микроскопии (ЭСМ). Метод основан на измерении контактной разности потенциалов между зондом (нанометровый наконечник АСМ) и поверхностью образца, так называемый метод Кельвина [16]. Для исследования распределения потенциала φ на поверхности образцов применялась двухпроходная методика (LiftMоde TM ). В каждой строке сканирования производится следующая процедура. На первом проходе с помощью пьезовибратора возбуждаются колебания кантилевера на частоте, близкой к резонансной частоте, ω 0 , и снимается АСМ изображение рельефа в "полуконтактном" режиме (Tаpping Mоde). Затем зонд отводится от поверхности на расстояние zо, между зондом и образцом подается переменное (на частоте ω=ωо) напряжение, Vаc, и осуществляется повторное сканирование.
Таким образом, напряжение между зондом и поверхностью образца можно представить в виде: V о +V аc sin(ωt)+φ. На втором проходе зонд движется над поверхностью по траектории, повторяющей рельеф образца. Поскольку в процессе сканирования локальное расстояние между зондом и поверхностью в каждой точке постоянно, изменения амплитуды колебаний кантилевера на частоте 2ω будут связаны с изменением емкости системы зонд-образец вследствие изменения поверхностного потенциала φ. При сканировании образца на втором проходе в каждой точке с помощью перестраиваемого источника постоянного напряжения подбирается величина V 0 таким образом, чтобы амплитуда колебаний кантилевера на частоте ω становилась равной нулю. Измерения проводились, используя Si – наконечники с Pt/Ir проводящим покрытием с диаметром ~ 30 нм. ЭСМ даёт нам картину распределения электрического потенциала по КФ поверхности.
Смачиваемость поверхностей выявляли по- средством измерения эффективного краевого угла θ капли деионизированной воды, используя как оптические измерения (Оlympus MX-50 микроскоп) так и специально разработанную установку, которая позволяет при помощи двух ортогонально ориентированных видеокамер, подключенных к компьютерной системе, получать информацию об угле смачиваемости с учетом неоднородности поверхности. Исследования выполнялись при температуре 26±1 °C и влажности 45±5 %.
Ранее проведенные работы показали [3, 4, 7], что адекватным экспериментальным подходом для определения остеогенных свойств КФ материалов является вариант феномена эктопического костеобразования in situ, когда искусственный образец с нанесенным костным мозгом имплантируется под кожу без инъекции дополнительных ростовых факторов.
В биологической части экспериментов использовались 28 мышей-самцов линии CBА/CаLаc. 14 животным под эфирным наркозом подкожно вводили по 1 имплантату (диаметр 12 мм, толщина 1 мм) с нанесенным в асептических условиях столбиком сингенного костного мозга, взятого из бедренной кости. Использовали 9 образцов, представленных в таблице 1, и 5 дополнительных дисков с наноструктурными КФ покрытиями без электронной обработки.
Для адгезии клеток органную культуру костного мозга на подложке культивировали в течение 45 мин в культуральной среде, содержащей 95 % среды RPMI-1640 (ICN) и 5 % эмбриональной телячьей сыворотки (ICN). Костный мозг служил источником ММСК и ростовых факторов. При раздельном подкожном введении мышам подложек или фрагментов костного мозга образования тканевых пластинок не наблюдалось.
Через 45 суток имплантаты извлекали, фотографировали в отраженном свете с фиксированными параметрами. Проводили количественную морфометрию цифровых изображений согласно статистике серых уровней до и после имплантации посредством программы Phоtоshоp 6.0 как описано ранее [5]. Для проведения гистологического анализа применяли стандартные методы световой микроскопии тонких срезов. После декальцинации тканевых пластинок, выросших на имплантатах, осуществляли обычную окраску гематоксилином-эозином парафиновых срезов, выполненных перпендикулярно поверхности дисков.
Статистическую обработку данных проводили с применением непараметрического U-критерия Вилкоксона-Манна-Уитни (Pu).
Таблица 1
Влияние электронной обработки различных наноструктурных кальцийфосфатных поверхностей на оптические и геометрические характеристики тканей, формирующихся из костного мозга в тесте эктопического остеогенеза, Х
|
Исследуемая группа |
Костный мозг (до имплантации) |
Тканевая пластинка (после имплантации) |
|||
|
площадь, мм 2 |
оптическая плотность, у.е.о.п. |
площадь, % от исходной |
оптическая плотность, % от исходной |
гистологический состав |
|
|
Необработанные кальцийфосфатные поверхности |
|||||
|
ГАП синтетический обычный режим |
6,91 |
30,64 n=3 |
132,71 |
3,98* |
костная ткань, костный мозг |
|
ГАП синтетический новый режим |
2,57 |
24,03 n=3 |
213,62 |
4,20* |
соединительная ткань, мышечные волокна |
|
ГАП биологический новый режим |
4,98 |
31,50 n=3 |
133,13 |
26,67* |
соединительная ткань |
|
Низкий уровень электронной обработки |
|||||
|
ГАП синтетический обычный режим |
4,55 |
29,60 n=3 |
380,88 |
15,34* |
костная ткань |
|
ГАП синтетический новый режим |
4,98 |
26,96 n=3 |
239,56 |
53,86* |
соединительная ткань, костная ткань, костный мозг |
|
ГАП биологический новый режим |
3,44 |
27,88 n=3 |
185,47 |
10,15* |
костная ткань, костный мозг |
|
Высокий уровень электронной обработки |
|||||
|
ГАП синтетический обычный режим |
5,02 |
29,55 n=3 |
163,15 |
15,30* |
нет результата, т.к. тонкие пластинки |
|
ГАП синтетический новый режим |
4,99 |
35,86 n=3 |
215,83 |
23,65* |
костная ткань, костный мозг |
|
ГАП биологический новый режим |
3,87 |
33,70 n=3 |
159,43 |
24,99* |
нет результата, т.к. тонкие пластинки |
Примечание: * – показаны статистические различия (Pu<0,05) с оптической плотностью костного мозга согласно U-критерию Вилкоксона-Манна-Уитни.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование поверхности КФ покрытий, полученных с помощью анодно-искрового оксидирования поверхностей в электролите, содержащем наночастицы ГАП, показало наличие как микро-, так и макрорельефа. Согласно АСМ высокого разрешения (рис. 1), микрорельеф КФ покрытий состоит из глобул диаметром около 1 мкм и высотой примерно 30 нм. Они формируют микросферолиты, имеющие диаметр примерно 5 мкм и высоту до 300 нм. В центре мик-росферолитов и между ними располагаются сквозные поры диаметром менее 1-2 мкм, доходящие до металлической подложки.
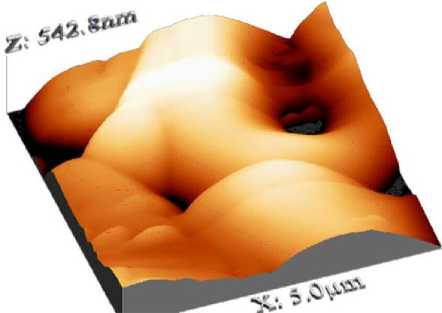
Рис. 1. 3D-топография наноструктурных кальцийфосфатных покрытий согласно атомно-силовой микроскопии. Увеличение 37000
РЭМ отчетливо демонстрирует выраженный макрорельеф наноструктурных КФ поверхностей, представленный сферолитами диаметром до 30 мкм с единичными или многочисленными порами 5-20 мкм в диаметре (рис. 2). На сферолитах обнаруживаются наноразмерные включения, отсутствующие в случае изготовления обычных покрытий из крупных частиц ГАП. Шероховатость всех типов КФ поверхностей, выполненных из наночастиц ГАП, соответствовала 4-5 классу ГОСТ со средним Rа=5,13-6,43 мкм, Rz=18,71-24,16 мкм.
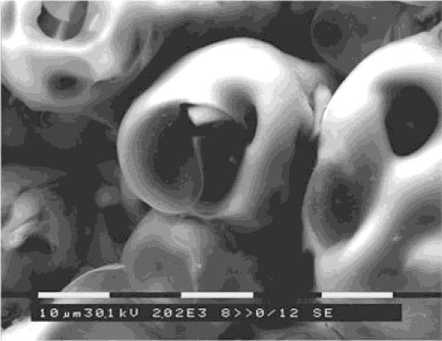
Рис. 2. Макрорельеф наноструктурных кальцийфосфатных покрытий согласно растровой электронной микроскопии. Увеличение 2020
Согласно существующей панели корреляционных взаимоотношений физических (пористость, шероховатость) и биологических свойств анодно-искровых КФ поверхностей [7], вероятность образования тканевой пластинки на наноструктурных КФ покрытиях должна составлять 80-100 %. Реально был получен 100 % выход тканевых пластинок на 8 образцах наноструктурных необлученных КФ покрытий. Площадь пластинок увеличивается на 133-214 % от первоначальной, что свидетельствует в пользу адгезии и продвижения (кондукции) костномозговых клеток по искусственным поверхностям.
Изменение структуры ткани можно зафиксировать по сдвигу спектральных характеристик ее взаимодействия с фотонами, в частности по изменению процессов поглощения и отражения света видимого спектра. Согласно данным компьютерной морфометрии видеоизображений тканевых структур, формирующихся на дисках с наноструткурными КФ покрытиями, оптическая плотность тканевых пластинок значительно (PT<0,05) снижается по сравнению с аналогичными значениями для исходного костного мозга (табл. 1). Это свидетельствует об уменьшении в формирующихся тканях общего числа хромофоров, интенсивно поглощающих фотоны.
В клетках системы крови (костный мозг, кровь) гемоглобин наиболее интенсивно поглощает свет в видимой части спектра [1]. Поэтому активное отражение света по сравнению с исходным костным мозгом может свидетельствовать о формировании гистологических структур, в которых мало эритроидных клеток и эритроцитов. В тесте подкожного эктопического костеобразования такой структурой может быть соединительная ткань и ее производные. Гистологические исследования 8 тканевых пластинок показали, что на данных типах покрытий костная ткань формировалась только в 1 из 8 случаев (12,5 %) при ожидаемой вероятности, согласно ранним результатам [7], 6383 % по Rа и 45-60 % по Rz.
Таким образом, КФ покрытия, выполненные из наноразмерного ГАП различной природы (синтетический либо биологический), независимо от технологии их изготовления, слабо способствуют росту костной ткани (табл. 1). В большинстве случаев из костного мозга формируется васкуляризированная рыхлая неоформленная соединительная ткань, иногда с примесью мышечной (рис. 3) и жировой тканей.
В то же время покрытия из частиц ГАП микронного размера, имеющие аналогичные характеристики макрорельефа, обладают 67-100 % остеоиндуцирующей активностью [7]. Одним из объяснений биологической “дефектности” КФ покрытий, выполненных из наноразмерных частиц, является, по-видимому, снижение поляризации их поверхности. Это препятствует дифференцировке пула стромальных стволовых клеток в остеобласты и в стромальные клетки, способные поддерживать кроветворение.
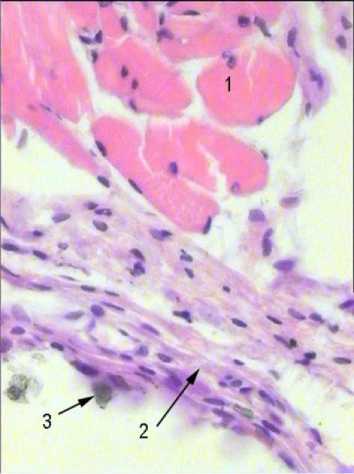
Рис. 3. Морфологическая структура тканевых пластинок, выросших на необработанных электронами наноструктурных кальцийфосфатных поверхностях в тесте эктопического остеогенеза. Определяются участки мышечных волокон (1), соединительной ткани (2) и кристаллы фосфатов кальция (3). Окраска гематоксилином – эозином. Увеличение 700
Детальные исследования физических свойств таких как фото- и термолюминесценция, термостимулированная экзоэлектронная эмиссия, фотовольтаическая спектроскопия показали, что ГАП керамика представляет собой полупроводник p -типа с большой шириной запрещенной зоны, составляющей примерно 4 эВ [19]. Электронные свойства ГАП нанокерамики могут быть сильно модифицированы вблизи поверхности отдельно от объема в результате использования электронов низкой энергии. Вариация заселенности поверхностных состояний и объемных локальных уровней вблизи ГАП поверхности вторичными электронами и дырками, индуцированными налетающими низкоэнергетическими электронами, приводит к изменению поверхностного электрического потенциала.
Известно, что в случае прикладывания постоянного электрического поля in vitrо в пределах 0,1-1 В/мм остеобласты быстро мигрируют к отрицательному, а остеокласты – к позитивному электроду [18]. Различный электрический вектор остеогенных клеток может лежать в основе остеоиндукции на искусственных подложках. Результаты ЭСМ измерений действительно показывают возрастание разности поверхностных потенциалов Δφ после электронного облучения, которое достигает 0,6 В между исходной и заряженной КФ поверхностью [25]. Мы нашли, что электронная обработка резко усиливает биомиметические свойства КФ покрытий. Так, возрастает площадь тканевых пластинок, гистологическая структура которых в 100 % соответствует грубоволокнистой костной ткани, содержащей костный мозг (табл. 1, рис. 4).
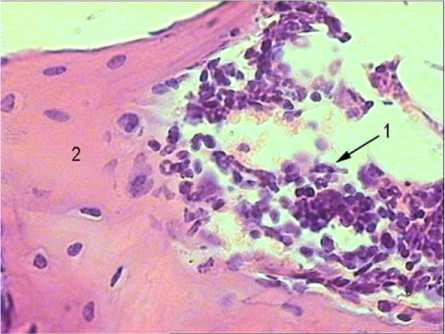
Рис. 4. Морфологическая структура тканевых пластинок, выросших на наноструктурных кальцийфосфатных поверхностях, предварительно обработанных электронами в низкой дозе. Определяются участки костной ткани (2), образующие ячейки, в которых располагаются клетки красного костного мозга (1).
Окраска гематоксилином – эозином. Увеличение 700
Известно, что увеличение электропроводности (уменьшение поляризационного сопротивления, Rп) искусственных материалов препятствует адгезии остеобластов, активно взаимодействующих с гидрофобными поверхностями типа оксида циркония ZrО2. При повышении обратного Rп от 0 до 1,75 мОМ-1см-2 доля прилипших костных клеток уменьшается на 16 % [11].
Вероятно, с этим связано нарушение остеогенеза при индукции высоких уровней заряда на КФ поверхностях. В двух случаях из трех тканевые пластинки оказались настолько тонкими, что не удалось приготовить гистологические препараты (табл. 1), несмотря на то, что площадь исходного костного мозга, нанесенного на покрытия, не отличалась от других образцов.
С другой стороны, в результате электронного облучения исследованные поверхности демонстрируют резкие различия в смачиваемости. Исходные (незаряженные) наноструктурные КФ поверхности глубоко гидрофильны с краевым углом θ=10°. Гидрофильные поверхности способствует прилипанию и распространению фибробластов [24], что, по-видимому, является одним из механизмов преимущественного роста соединительной ткани на исходных (необработанных электронами) наноструктурных КФ покрытиях.
Образцы КФ поверхностей, дополнительно обработанные электронами, характеризуются увеличением краевого угла θ. Так облученный зарядом Q1=10 Кл/cм2 (низкий уровень облучения) ГАП демонстрирует краевой угол θ=30°. Рост заряда до уровня Q2=300 Кл/cм2 (высокий уровень облучения) приводит к увеличению краевого угла до θ=100° и такие образцы ГАП могут быть однозначно отнесены к сильно гидрофобным. При этом образцы, обработанные низкой дозой электронов, улучшают результаты эктопического остеогенеза в сравнении с необ-лученными или получившими более высокую дозу поверхностями (табл. 1, рис. 3, 4).
Таким образом, для успеха теста эктопического костеобразования, моделирующего поведение имплантатов в процессе остеосинтеза, имеет значение, наряду с другими физическими характеристиками, оптимальная величина смачиваемости и поверхностной энергии КФ покрытий, которая модифицируется путем изменения электронного заряда. Следует отметить, что в случае низкоэнергетической электронной обработки поверхностей результаты остеоиндукции практически не зависят от вида наночастиц ГАП и способов формирования покрытий (табл. 1).
Прилипание и продвижение стромальных клеток (в том числе остеогенных) детерминированы физическими свойствами поверхности имплантата, их дифференцировка в костную ткань обусловливается достаточным наличием кальция и соотношением Cа/P [7]. На стволовых клетках костного мозга экспрессируются Са2+-чувствительные рецепторы [22], регулирующие их хоминг и диф-ференцировочные потенции. РФЭС измерения элементного состава нативных (необработанных) наноструктурных КФ поверхностей показали молярное соотношение Cа/P=0,27 (табл. 2), недостаточное для остеоиндукции [7].
Таблица 2
Элементный состав (Моль) наноструктурных кальцийфосфатных покрытий сосгласно данным рентгенофотоэлектронной спектроскопии, Х
|
Элемент в покрытии |
Необработанные электронами поверхности |
Поверхности после низкоэнергетической обработки |
Поверхности после высокоэнергетической обработки |
|
Углерод |
20,29 |
31,29 |
57,37 |
|
Кислород |
56,04 |
48,26 |
30,03 |
|
Кальций |
3,97 |
3,30 |
2,01 |
|
Фосфор |
14,71 |
13,14 |
7,79 |
|
Азот |
1,97 |
1,17 |
0,54 |
|
Титан |
3,02 |
1,99 |
1,12 |
Облучение электронами вызывало прогрессивный захват углерода в структуру покрытий с вытеснением кислорода и азота (табл. 2), что увеличивает гидрофобность поверхности. Известно, что карбонатное замещение в структуре ГАП повышает его биологическую активность [10] с улучшением остеогенных свойств наноструктурных КФ покрытий (табл. 1). Так, Redey et аl. (1999) [17] показали зависимость адгезии остеокластов in vitrо от поверхностной энергии, а их распространение – от химии поверхности синтетического или карбонатного ГАП. В то же время высокий уровень заряда поверхности мог негативно влиять на воспроизводимость теста эктопического костеобразования посредством практически 2-кратного снижения концентрации кальция, фосфора и кислорода в покрытиях (табл. 2).
Описано несколько тонких физико- химических процессов (шероховатость, смачиваемость, поляризация, поверхностная энергия, химический состав), регулирующих поведение различных типов клеток (фибробластов, остеобластов, остеокластов) на искусственных поверхностях in vitrо [11,20]. В наших экспери- ментах с многоклеточной системой костного мозга in situ подобные параметры КФ покрытий способствуют, по-видимому, селекции и дифференцировке потомков ММСК в одном из вероятных направлений формирования тканей мезенхимального происхождения.
ВЫВОДЫ
-
1. Предложенный способ обработки КФ поверхностей, выполненных из наноразмерного ГАП синтетической либо биологической природы, независимо от технологии их изготовления стимулирует в среднем на 82,5 % вероятность формирования костной ткани в тесте эктопического подкожного остеогенеза.
-
2. Выявлены 3 механизма улучшения остео-
- генных свойств наноструктурных КФ покрытий посредством электронного облучения в оптимальной дозе: 1) изменение поверхностной энергии; 2) усиление гидрофобности поверхностей; 3) модификация их элементного состава.
Работа выполнена при поддержке гранта NMP3-CT-2003-504937 6-й рамочной программы Европейской комиссии.


