Биологическая активность вторичных метаболитов растений семейства brassicaceae
Автор: Козарь Елена Георгиевна
Журнал: Овощи России @vegetables
Рубрика: Физиология и биохимия растений
Статья в выпуске: 1 (10), 2011 года.
Бесплатный доступ
В статье дан краткий обзор особенностей биологического действия вторичных метаболитов растений сем. Brassicaceae - глю-козинолатов (тиогликозидов) и их производных, как с точки зрения фармакологии, так и их роли в жизнедеятельности самих растений. Показана перспективность использования растительных препаратов на основе двух представителей этого семейства -кресса водяного и хрена обыкновенного - в качестве фитонема-тицидов для борьбы с мелойдоги-нозом культурных растений в защищенном грунте.
Биологическая активность, мелойдогиноз, защита растений, капустные культуры, глюкозинолаты, фитопрепараты, нема-тициды
Короткий адрес: https://sciup.org/14024872
IDR: 14024872 | УДК: 635.34:581.13
Текст научной статьи Биологическая активность вторичных метаболитов растений семейства brassicaceae
О вощи семейства Крестоцветные (Капустные) обладают уникальными свойствами и должны ежедневно присутствовать в нашем рационе. Кроме диетической клетчатки, лютеина, фолиевой кислоты, макро- и микроэлементов, витаминов, они являются богатым источником фитонутриентов и нутрицевтиков в пищевом рационе человека, в частности, глюкозинолатов (тиогликозидов) – уникального класса биологически активных серосодержащих соединений, интерес к которым в последнее время сильно возрос. Это связано с тем, что глюкозинола-ты обладают широким спектром действия на самые различные организмы. Причем, наиболее выраженным физиологическим действием обладают не нативные глюкозино-латы, а многочисленные их производные.
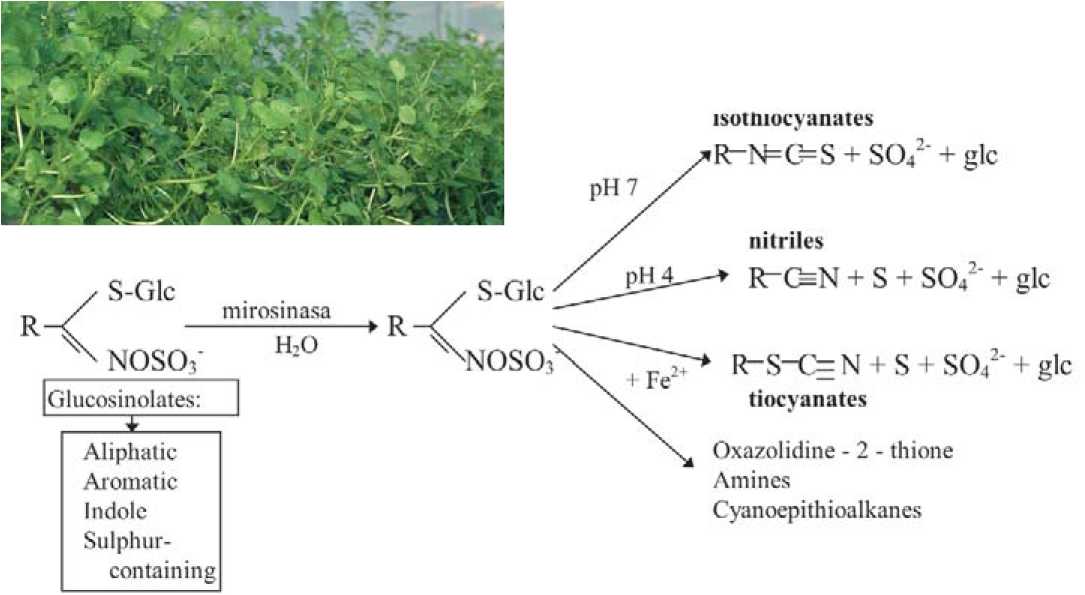
Нативные глюкозинолаты в клетках растения малоактивны и пространственно изолированы от мирозиназы (тиогликозидаза) – фермента расщепляющего эти соединениях [1]. При нарушении целостности клеточных структур под воздействием биотических или абиотических факторов, либо механического повреждения, происходит слияние фермента с субстратом и гидролиз глюкозинолатов на глюкозу и агликоны, которые в свою очередь могут образовывать несколько продуктов расщепления: изотиоцианаты, нитрилы, тиоцианаты, оксазолидины и другие, многие из которых являются эфирными соединениями и легко растворяются в воде (рис.1).
Качественный и количественный состав продуктов гидролиза глюкози-нолатов во многом определяется условиями реакции: активностью миро-зиназы, наличием аскорбиновой кис-
Рис. 1. Общая структура глюкозинолатов и продуктов их ферментативного гидролиза под действием миро-зиназы в зависимости от условий реакции [2].
Oxazolidine - 2 - thione
Amines
Cyanoepithioalkancs
H^O
NOSOV
S-Glc mirosinasa pH 7
isothiocyanates
R-N=OS + S042' + glc
S-Glc
NOSOV nitriles
ItON + S + SO42 + glc
R-S-C = N + S + SO42" 4- glc tiocyanates
+ Fe2+
Aliphatic Aromatic Indole Sulphur-containing
Glucosinolates:
лоты, которая выступает как катализатор реакции, рН и температурой среды, концентрацией ионов железа и меди и т.д., то есть является сложным биологическим процессом, регулируемым как самим растением, так и факторами внешней среды [1,2,3,4,5]. Именно продукты ферментного гидролиза придают острый горчичный вкус и запах многим культурам из семейства Brassicaceae и обладают широким спектром биологического действия, поэтому сохранность в сырье ферментов, расщепляющих эти соединения, является непременным условием для проявления их специфической фармакологической активности.
Глюкозинолаты и их производные в соответствующих концентрациях препятствуют образованию различных канцерогенных соединений в клетках, выступают как «блокирующие» и «супрессивные» агенты, инактивируя и выводя из клеток канцерогены (например, токсины табака), способствуя очищению организма. Они активизируют ферменты печени и предотвращают образование опасных метаболитов в тонком и толстом кишечнике, то есть являются «бифункциональными модуляторами» натуральных процессов детоксикации. Большинство производных глюкозинолатов обладают антиоксидантными свойствами, подавляют негативное воз- действие свободных радикалов на организм человека и укрепляют иммунную систему [2,5,6]. Глюкозинолаты также способствуют нормальному функционированию эндокринной системы и поддержанию гормонального баланса в организме, влияя на ход метаболизма стероидов, особенно эстрогена 2-гидроксиэстрон [7,8].
Учитывая прогрессирующий рост онкологических заболеваний, растения семейства крестоцветных такие, как брокколи, капуста брюссельская, капуста цветная, капуста кочанная, пак чой, кольраби, брюква, репа, хрен и кресс водяной, представляют особый интерес. Установлено, что в странах, жители которых традиционно употребляют в пищу много этих овощей, заболеваемость раком существенно ниже, чем в других местах [2,5]. Американские ученые из Университета Джорджтауна, исследование которых опубликовано в British Journal of Cancer, показали, что глюкозинолаты, в частности индол-3-карбинол, активизирует работу генов BRCA1 и BRCA2, отвечающих за структуру протеинов, играющих важную роль в предотвращении перерождения нормальных клеток различных тканей и органов в злокачественные клетки [9,10]. В клетках злокачественных опухолей наблюдается пониженная концентрация протеинов, структура которых определяется этими генами.
Люди с мутациями этих генов подвержены повышенному риску таких онкологических заболеваний как рак молочной железы, яичников или простаты. Глюкозинолаты способствуют апоптозу, распаду клеток – важной функции в профилактике и устранении новообразований [11,12]. Помимо этих свойств, глюкозинолаты оказывают бактерицидное и фунгицидное действие на многие болезнетворные микроорганизмы человека [2].
Лекарственные растения, содержащие глюкозинолаты, издавна применяются в медицине также в качестве раздражающих и отвлекающих средств [7], например горчица са-рептская, действующим началом которой является гликозид синигрин и эфирные горчичные масла (аллилгор-чичное и кротонилгорчичное). Образующиеся при ферментативном расщеплении синигрина горчичные масла (аллилизотиоцианаты) – высокотоксичны и в больших концентрациях могут вызывать ожог кожных покровов, а при приеме внутрь – приводить к тяжелым отравлениям. Кроме того, изотиоцианаты способны высвобождаться из связанной формы и частично перегруппировываться в соответствующие тиоцианаты, приводящие к гипертириозу и образованию зоба [9,10]. То есть употребление в пищу или использование в лечебных целях растений с высоким содержанием тиогликозидов типа синигрина, образующих при расщеплении горчичные масла, должно быть строго регламентировано.
В настоящее время разработаны научно обоснованные нормы суточного потребления свежей продукции овощей из семейства капустные, как профилактического средства [4]. Многие из них входят в состав гомеопатических средств [13] и биологически активных добавок (БАВ). Например, в состав продукта «ExPress Essential» компании Santegra® (США) входит овощной концентрат капустных культур (брокколи, капуста, редька огородная) с гарантированным содержанием активных веществ – глю-козинолатов (2%) и индол-3-карбино-ла – 35 мг. Эту овощную добавку рекомендовано включать в рацион взрослых и детей для профилактики гормонального дисбаланса, защиты и восстановления организма после интоксикации, злоупотребления алкоголем, работ на вредных производствах, аллергии, несбалансированной диеты и запоров. БАД «АдваКлиар» (AdvaClear) – средство для оптимальной персонализированной детоксикации, содержит 3 натуральных вещества, которые действуют как бифункциональные модуляторы, т.е. способствуют поддержанию баланса детоксикационной активности. Одним из этих компонентов являются глюкози-нолаты водяного кресса (Nasturtium officinale), так называемые прекурсоры фенетилового изотиоцианата (PEITC). PEITC эффективно ингибируют чрезмерную индукцию специфических энзимов цитохрома Р450 и увеличивают активность глютатион S-трансферазы и квинон редуктазы во II фазе детоксикации, в которой био-трансформированные промежуточные продукты токсинов подвергаются конъюгации для более легкого выведения из организма.
Другой препарат «Супер Индол» (Super Indole), по мнению доктора Лэрри Дж. Майлэма, способствует здоровому метаболизму эстрогенов, уменьшает риск развития некоторых болезней и рекомендован для профилактики ряда онкологических заболеваний. Этот запатентованный продукт содержит смесь фитонутриентов и нутрицевтиков, основным компонентом которых является группа биохимических веществ – индол-3-карбинол
(I3C), DIM (дииндолилметан), аскор-биноген, сульфорафин, индолы, изо-тиоцинаты и глюкозинолаты, извлекаемых по оригинальной методике из растений сем. Brassicaceae .
Средний уровень накопления и состав глюкозинолатов в продуктовых органах основных овощных культур сем. Brassicaceae значительно варьирует (табл.1). Минимальное содержание этих соединений отмечено в капусте листовой и белокочанной (до 100 мг/кг), максимальное – в корневищах хрена обыкновенного (более 1000 мг/кг) и зелени водяного кресса, особенно в период цветения (более 6000 мг/кг). Наиболее разнообразны по своему составу глюкозинолаты турнепса, в котором обнаружено более 10 различных соединений этого класса; наименее – капуста китайская и редька белая [4].
Накопление глюкозинолатов в тканях растений имеет суточные, сезонные и возрастные ритмы, зависит от минерального питания и освещенности растения. Так, максимальное количество этих соединений в листовых капустах отмечается с 6 до 9 часов утра. Днем, как правило, их количество в листьях уменьшается, а к вечеру снова увеличивается [14,15]. Наибольшее накопление глюкозинола-тов в листьях кресса водяного (до 12,6 мг/г) при выращивании на гидропонике отмечено при 12-часовом фотопериоде и температуре 25оС. Этому также способствует повышение интенсивности облучения с 265 до 435 мкмоль . м-2 . с-1 за 1 неделю до уборки зелени (срезки) при 8-часовом фотопериоде [16].
На уровень глюкозинолатов в растениях влияет количественное соотношение азота и серы в почве или питательном растворе. Повышение дозы вносимого азота и серы в почву приводит к увеличению общего количества глюкозинолатов в растениях B. napus и листьях кресса водяного, хотя различные глюкозинолаты имеют различную динамику накопления. В большей степени накапливаются алил-глюкозинолаты, в меньшей – глюкозинолаты индольной природы [17,18,19].
Снижение поступления сульфата и азота в растения, наоборот, приводит к снижению количества этого класса соединений, но не столько за счет уменьшения их синтеза, сколько за счет их использования как дополнительных источников серы и азота для белкового обмена клеток капустных растений [2,15,20].
Максимум накопления тиогликозидов (типа синигрина), образующих при расщеплении эфирные горчичные масла, у большинства растений этого семейства отмечается в недозрелых семенах, поэтому многие «неядовитые» крестоцветные в период созревания семян становятся опасными для скота и птицы, поедающих надземные части в массовых количествах. Это представители рода Brassica (капуста, горчица, рапс, брюква, репа) и рода Synapis (горчица) [15]. Накопление горчичных масел происходит в редьках (Raphanus) , сурепках (Barbarea) , репниках (Rapistrum) , же-рушниках (Rorippa) , гулявниках (Sisimbrium) , резухах (Arabis) , деску-райниях (Descurainia) , клоповниках (Lepidium) , пастушьей сумке (Capsella) , иберийке (Iberis) , чесночнице (Alliaria) , икотнике (Berteroa) , сердечниках (Cardamine) , кардарии (Cardaria) , двуряднике (Diplotaxis) , эв-треме (Eutrema) , ярутках (Thlaspi) . Большое количество синигрина также является действующим веществом хрена (Armoracia) – максимум накопления наблюдается в корнях, которые также должны употребляться в пищу с определенной осторожностью и после соответствующей обработки [6].
В растениях глюкозинолаты и продукты их расщепления выполняют различные функции. Помимо участия в обмене серы и метаболизме азота, глюкозинолаты индольной природы, например глюкобрассицин и неоглю-кобрассицин, агликоном которых является ИУК, служат «резервным» банком и одним из путей получения фитогормонов ауксинового ряда у растений сем. Brassicaceae [21,22]. Некоторые продукты гидролиза ароматических (глюкотропаеолин, глюкона-стурциин, глюкосинальбин) глюкози-нолатов, в частности изотиоцианаты и нитрилы, также могут проявлять аук-син-подобное действие и принимать участие в процессах регуляции роста растений не только семейства капустные, активируя и стабилизируя в соответствующих концентрациях ростовые клеточные процессы [2,5,21]. Однако в других работах, глюкозинола-ты капустных культур чаще рассматривают в качестве биогербицидов,
ФИЗИОЛОГИЯ И БИОХИМИЯ РАСТЕНИЙ
1. Общее содержание глюкозинолатов в растениях разных видов сем. Brassicaceae [4]
Тиогликозиды также являются неспецифическим защитным барьером растений сем. Brassicaceae [26], хотя попытки связать устойчивость отдельных видов и сортов этого семейства с их содержанием и качественным составом, дали противоречивые результаты. Как показали многочисленные исследования, продукты гидролиза многих глюкозинолатов обладают широким токсическим спектром действия в отношении многих неспецифичных для капустных вредителей (насекомых, клещей), грибов, вирусов, и избранно – для истинных вредителей и фитопатогенов капустных
[18,28,29,30]. Индийскими учеными была показана высокая фунгицидная активность внесенных в почву остатков капусты против Macrophomina phaseolina: активность увеличивалась при повышении температуры (за счет соляризации) и влажности почвы [31]. Фенитилизотиоционат – производное от гликонастуртиина, выделенного из водяного кресса, показал высокую активность против вредителей Gammarus pseudolimnaeus, Hesperophylax designatus, Limnephilus spp., Physella spp. [15].
Глюкозинолаты, выделенные из растений различных представителей семейства капустных, после ферментного гидролиза мирозиназой, проявляют выраженный антигельминтный эффект [3]. При внесении растительных остатков, водных настоев или муки из семян крестоцветных во влажную почву, происходит разложение глюкозинолатов с образованием большого количества различных соединений (до 11), многие из кото- рых обладают нематицидной активностью. В результате водные экстракты из листьев растений различных видов капустных эффективно сдерживают развитие эндопаразитических корневых нематод Pratylenchus penetrans, а внесение в почву размолотых семян B. napus cv. Jupiter – развитее галловых нематод Meloidogyne chitwoodi Golden в зоне внесения в течение 6 недель. Однако внесение в почву зеленной биомассы этой культуры не влияло на плотность популяции M. incognita и M. javanica, что, по предположению автора, связано с низким содержание глюкозинолатов в листьях этой культуры [2,15,32]. Высокая активность в отношении личинок Globodera rostochiensis отмечена у продуктов расщепления ароматических гликозидов глюкотапина, глютро-паеолина и алифатического гликозида синигрина – изотиоцианатов и нитрилов, которая зависела от концентрации исходного глюкозинолата и от времени экспозиции [3,33]. Корне- вые эксудаты Sinapis alba и Brassica nigra, которые ингибировали выход личинок золотистой картофельной нематоды, также содержали различные изотиоцианаты [34].
В последнее время в мировой практике защиты растений все больше уделяется внимание использованию телетоксических свойств растений и созданию фитопрепаратов на их основе, лишенных многих недостатков, присущих высокотоксичным химическим нематицидам, которые долго инактивируются и накапливаются в почве и растительном сырье [35,36,37,38,39,40]. С этой точки зрения, виды растений, содержащие глюкозинолаты, представляют большой интерес в качестве биопестицидов. Причем, в отличие от индивидуальных синтезированных или выделенных соединений, использование нативных растительных препаратов, содержащих все компоненты гликози-нолат-мирозиназного комплекса, предпочтительнее, поскольку только в данном случае можно получить весь спектр биологически активных продуктов гидролиза, многие из которых, являясь эфирными маслами, хорошо растворимы в воде, накапливаются в водных настоях. Они также устойчивы к действию высоких температур и могут в значительном количестве проникать в глубокие ее горизонты [5,23,29,30]. Было установлено, что наиболее активные продукты гидролиза глюкозинолатов – изотиоциона-ты и нитрилы, быстро разлагаются в почве. Причем скорость распада изо-тиоционатов ускоряется по мере увеличения их концентрации (r= -0,95), увеличении содержания органического углерода и общего азота (r= -0,67 и r= -0,63 соответственно), повышении температуры (r= -0,99), но замедляется при увеличении влажности почвы (r= +0,94), не зависит от активности почвенной микрофлоры и в среднем период их полураспада составляет 20-40 часов. Разложение нитрилов, наоборот, в основном, ускоряется под действием почвенных микроорганизмов и увеличении влажности почвы (r= -0,78), и замедляется при увеличении температуры выше 10оС (r= -0,99); концентрация же самого вещества и содержание неорганического азота в почве практически не влияют на скорость распада нитрилов. Период полураспада этих соеди- нений в среднем находится в пределах 104 -115 суток после внесения в почву [41].
Как было уже отмечено, самое высокое содержание глюкозинолатов среди возделываемых в культуре видов семейства Brassicaceae обнаружено в растениях хрена обыкновенного и кресса водяного (табл. 1). Еще в 70-х годах ХХ столетия д.с.-х.н., профессором П.Ф. Кононковым [13] было замечено резкое снижение числа пораженных фитогельминтозами растений на сельскохозяйственных плантациях Кубы, где перед этим выращивали в многолетней культуре кресс водяной. Позже, совместными исследования ВНИИССОК и лаборатории фитогельминтологии ВИГИС было показано, что кресс водяной, как и хрен обыкновенный, является растением-антогонистом в отношении южной галловой нематоды (Meloidogyne incognita (L.) Chitwood) (рис.2)- опасного паразита растений защищенного грунта, выделяя в процессе вегетации вещества с нематицидной активностью [42].
Эти соединения содержатся во всех органах этих растений, причем нематицидная активность водных вытяжек из зеленой части (листья, стебель) выше, чем из корней, у которых более активна летучая фракция эфирных горчичных масел (рис.3). Поэтому данные виды растений послужили в нашей работе основой создания растительных биопрепаратов (соки, водные настои, измельченная свежесрезанная или сухая биомасса) и разработки экологически безопасной технологии защиты культурных растений от галловой нематоды в условиях защищенного грунта [43,44].
Изучение характера воздействия различных форм растительных препаратов получаемых на основе этих культур, показало, что в концентрированном виде они вызывают быструю гибель инвазионных личинок галловой нематоды даже внутри яиц, свободно проникая через внешние покровы оотек (нематицидная и овицид-ная активность), но достаточно фито-токсичны для растений-хозяев. В низких концентрациях фитопрепараты, проявляя высокую овистатическую или нематостатическую активность (ингибирование выхода личинок из яиц и парализующее действие на свободные инвазионные личинки), ока- зывают стимулирующее и стабилизирующее действие на развитие тепличных культур (томат и огурец). Причем у фитопрепаратов на основе кресса водяного, ростстимулирующий эффект был более выражен, чем у фитопрепаратов из хрена обыкновенного, что, по-видимому, объясняется различием состава содержащихся в них глюкозинолатов (табл. 1). В зависимости от концентрации фитопрепараты оказывают также фунгицидное или фунгистатическое действие на рост некоторых фитопатогенных грибов Botrytis cinerea, Sporodesmium muco-sum, Fusarium oxisporum, не подавляя развитие сапрофитных почвенных грибов, в частности грибов рода Trichoderma. То есть их вполне можно применять совместно с биопрепаратом триходермином, используемым для борьбы с корневыми гнилями овощных культур.
На основании проведенных исследований, была предложена следующая технология приготовления фитопрепаратов. Жидких препаратов по схеме: измельчение биомассы (зелень, корневища); получение сока или 12-ти часовых 10% водных настоев; консервация фитопрепаратов КCl 75 г/л (сока сразу после получения, водных настоев не позже, чем через 24 часа настаивания). Лучшим способом заготовки сухих фитопрепаратов кресса водяного является сушка нативных растений при температуре 45…50оС, активность которых сохраняется в течение 1-2 месяцев хранения в сухом месте при комнатной температуре (20…22оС). При лиофильной сушке нематицидная активность растений или сока кресса водяного оставалась на исходном уровне в течение 1 года хранения в герметично запаянных пакетах. Использовать сухие препараты можно в виде мульчи (с обильным поливом почвы) или 12-24 часовых 1-5% водных настоев. С целью использования фитопрепаратов в качестве бионематицидов были определены пороги их фитотоксичности: сока кресса водяного – разведение 1:5, 10% настоя из свежеизмельчен-ной зелени – 1:10, для сухого фитопрепарата – 2%-ный водный настой или 10 г измельченного порошка под растение; подобраны рабочие концентрации, которые обладают высоким нематицидным эффектом при минимальной фитотоксичности.

а б в г д
Рис.2. Галловая нематода: а, б, в – корни, г – личинки, д – самки
Защитное действие растительных препаратов из кресса водяного и хрена может идти по двум направлениям – это снижение общей численности инвазионных личинок нематоды в почве и индукция устойчивости растения-хозяина. Так, предварительная обработка корневой системы растений томата и огурца водными настоями кресса водяного перед высадкой в зараженную M. incognita почву приводила к снижению процесса галлообразования. Индекс галлообразования на растениях томатах, обработанных соком кресса водяного, снижался в 2,9 раза, а настоем хрена – в 4,6 раза. Микроскопирование образовавшихся галлов показало, что фитопрепараты способствуют смещению структуры популяции галловой нематоды в сторону мужских особей (в 6-8 раз относительно контроля) и снижению числа половозрелых самок в корнях обработанных растений в 4-6 раз. Причем, сырая масса корней и надземной части обработанных фитопрепаратами растений в 3-4 раза была больше, чем в контроле. Индукцию системной устойчивости растений к галловой нематоде под действием фитопрепаратов отмечали в своих работах и другие исследователи, например у водных экстрактов из свежих листьев лимонной травы Cymbopodom flexuo-sus (в разведении 1:2 и 1:10) [47] и при обработке надземной части растений масляным экстрактом из семян Argemone mexicana [48].
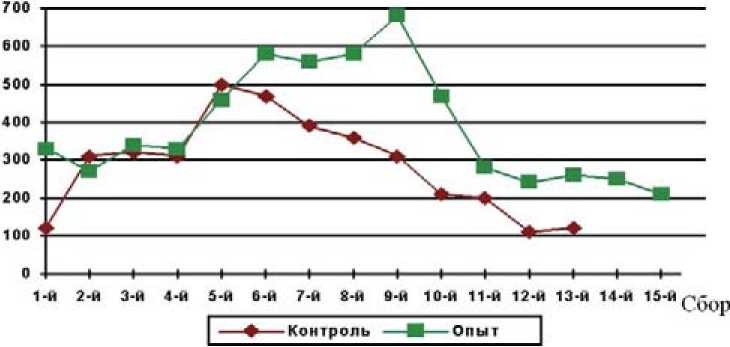
Для борьбы с галловой нематодой фитопрепараты (свежеприготовленные или консервированные) разбавляют до нужного разведения и проливают очаги мелойдогинoза с захватом неза-раженной зоны. В производственных испытаниях было установлено, что двух и трехкратные обработки соком или настоями водяного кресса уменьшали развитие мелойдогиноза и индекс гал-лообразования на корнях томата по сравнению с необработанными растениями почти в 2 раза, сдерживая развитие мелойдогиноза на хозяйственно безопасном уровне и обеспечивая возможность получения урожая до конца культурооборота. Количество выпадов от мелойдогиноза и корневых гнилей в контроле составило в среднем 20%, а в опытных вариантах их не было. Снижение степени пораженности корневой системы в опытных вариантах коррелировало с увеличением средней продуктивности растений томата (r= -77), которая при 2-х кратной обработке составила 136,9% и при 3-х кратной – 173,1% от контроля. Выход товарной продукции на обработанных препаратом делянках начинался раньше и во второй половине вегетации был значительно выше, чем на необработанных (рис.4), что в свою очередь привело к возрастанию общей урожайности на 35-40% по сравнению с контролем [43].
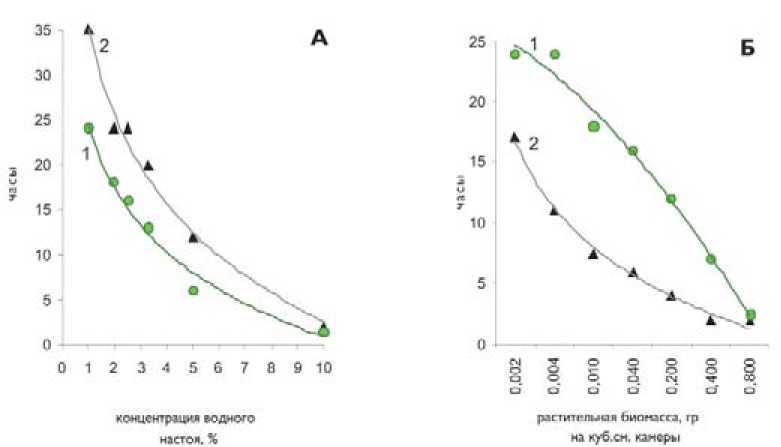
Рис. 3. Время регистрации 100% гибели инвазионных личинок под действием водных фракций (А) и летучих выделений (Б) надземной части (1) и корней (2) кресса водяного в зависимости от концентрации (количества) фитопрепаратов (фильтрат 12-часового настоя, нативная измельченная биомасса)

Рекомендуется также обрабатывать почву и вегетирующие растения в зараженных галловой нематодой очагах настоями корневища (5%) или надземной части хрена (10%) обыкновенного, которые при однократном внесении снижали индекс галлообразования на корнях томата в условиях стеллажных экспериментальных теплиц в среднем на 84% относительно контроля [45].
Увеличение кратности обработки усиливает нематицидное действие фитопрепарата, благотворно влияя на развитие овощных растений, поэтому целесообразно проведение обработок очагов мелойдогиноза фитопрепаратами на протяжении всего культуроо-борота, интервал между которыми, исходя из биологического цикла развития галловой нематоды, не должен превышать 25-30 суток. Наибольший эффект был получен при внесении фитопрепаратов в почву в период вегета- ции овощных растений с предварительным выращиванием водяного кресса как промежуточной культуры. На культуре огурца биологическая эффективность этой технологической цепочки была на 80% выше, чем у высокотоксичного нематицида видата; достоверно снижалось и количество растений с признаками поражения корневыми гнилями (18,7% – видат и 1,1-1,5% – фитопрепараты). Одно выращивание кресса водяного снижало развитие мелойдогиноза на уровне видата. Прибавка урожайности на опытных делянках относительно видата составила 0,6-1,3 кг/м2.
В заключение важно отметить, что кресс водяной можно назвать уникальной культурой – это и ценная витаминная зеленная культура и почвенный фитосанитар. Выращивание кресса водяного между культурообо-
Рис. 4. Влияние трехкратной обработки почвы соком водяного г/w' кресса на динамику выхода товарной продукции томата
ротами вполне можно рекомендовать как один из способов биоконтроля за развитием мелойдогиноза и корневых гнилей в теплицах. Включение кресса водяного (вегетативно размножаемый сорт Подмосковный [46]) в полный культурооборот, как зеленной культуры, с выращиванием ее в течение года в сильно инвазированных теплицах будет способствовать созданию непрерывного «зеленого конвейера» товарной продукции для реализации и одновременно оздоровлению грунтов [44,49,50]. Данная технология является экологически безопасной и безотходной, т.к. выращенный растительный материал с высоким содержанием глюкозинолатов может служить сырьем как для фармакологии, так и для фитонематицидов с целью защиты сельскохозяйственных культур.
Список литературы Биологическая активность вторичных метаболитов растений семейства brassicaceae
- Кретович В.Л. Биохимия растений. -М:Высшая школа. -1980. -447 с.
- Bones A.M., Rossiter J.T. The myrosinase-gucosinolate system, its organisation and riochemistry.//Physiol. Plantarum. 1996. -Vol. 97. -P. 194-208.
- Lazzeri L., Tacconi R., Palmieri S. In vitro activity of some glucosonolates and their reaction products toward a populatin of nematode Heterodera schachii.//J/Agric. Food. Chem. 1993. -V. 41. -P. 825-829.
- Hrnciric K., Veljek J. Glucosinolate content of common Brassicaceae famyli vegetables.//Potrav.Vedy -1997 (3). -№ 15. -P. 161-172.
- Rosa E.A.S. Daily variation in glucosinolate concentrations in the leaves and roots of cabage seedlings in two constant temperature regimes.//J. Sci. Food. Agric. 1997. -V. 73. -P. 364-368.
- И-Сан Лин Р. Биохимические вещества и антиоксиданты./В кн.: Функциональные пищевые продукты: лечебные пищевые продукты, биологически активные вещества растительного происхождения, под ред. Голдберг. И. -Нью-Йорк: Чапмен энд Холл и Зал. -1994. -С. 435449.
- Марвик С. Использование биохимических веществ при лечении болезней//JAMA. -1995. V.274. -P.1328-1330.
- Зелигс М. Диета и статус эстрогена: влияние крестоцветных растений.//Журнал лекарственных продуктов питания. -1998. -Том 1. -№ 2. -C.78.
- Уоттенберг Л.В. Ингибирование онкогенеза счет умеренных количеств БАД.//Исследование в области онкологических заболеваний (доп.). -1992. -N 52. -P.20855-20915.
- Блок Г., Паттерсон В., Субар А. Фрукты, овощи и профилактика онкологических заболеваний: обзор эпидемиологических данных//Институт онкологических заболеваний. -Дж. Ната. -1992. -N18. -P.1-29.
- Бойк Дж. Онкологические заболевания и природная медицина: Пособие по фундаментальным Научным и Клиническим Исследованиям. -Принстона:Орегон Медикал Пресс. -1995. -Т.274. -С.1328-1330.
- Михнович Дж.Дж., Брэдлоу Х.Л. Эффективность I3С для профилактики рака//Журнал «Увеличение продолжительности жизни", Фонд увеличения продолжительности жизни, май 2001, стр. 18.
- Кононков П.Ф., Кононкова С.Н., Примак А.П. Водяной кресс -ценная для интродукции овощная культура в защищенном грунте.//Тр. по селекции овощных культур (ВНИИССОК). -М., 1978. -Т. VII. -С. 118-120.
- Rosa E.A.S., Asaney R.K., Rego F.C., Fenwick G.R. The variation of glucosinolate concentration during a single day in young plants of Brassica oler-acea var. acephala and capitata.//J. Sci. Food. Agric. 1994. -V. 66. -N 4. -P. 457-463.
- Rosa E.A.S., Heaney R.K., Fenwick G.R., Portas C.A.M. Glucosinolates in Crop Plants.//Horticul. Reviews. 1997. -Vol. 19. -P. 99-186.
- Palaniswamy U., McAvoy R., Bible B. Supplemental Light befor harvest increases phenetyl isothiocyanate in Watercerss under 8-hour photoperiod.//Crop Production. 1997. -Vol. 32(2). -P. 222-223.
- Palaniswamy U., McAvoy R., Bible B., Singha S., Hill D.W. Phenylethylisothiocyanat concentrarion in watercress (Nasturtium officinale R.Br.) is altered by nitrogen to sulfur ratio in hydroponic solution.//Phytochemicals and heath. Amer. Soc. Plant Physiol., Rockville, Md. 1995. -P. 280-283.
- Booth E.J., Walker K.C. Can glucosinolates be used to provide greater plant protection ?//Crop. Sci. Research Rep. 1996. -P.6-9.
- Jen C.-C., Wei Q.-K. Myrosinase activity and total glucosinolat content of Cruciferous vegetables in Taiwan.//J/Sci. Food. Agric. 1993. -V. 1. -P. 471-475.
- Shattuck V.I., Wang W. Growth stress induces glucosinolate changes in pakchoy (Brassica campestris ssp. chinensis).//Can.J.Plnt Sci. 1994. -V. 74.-P. 595-601.
- Рост растений и его регуляция: Генет. и физиол. аспекты/АН МССР. Ин-т физиологии и биохимии растений, АН СССР. Координац. совет по физиологии и биохимии растений. Отв. ред. Кефели В.И., Тома С.И. -Кишинев: Штиинца. -1985. -223 с.
- Кефели В.И. Физиологические основы конструирования габитуса растений [В условиях агроценоза]. M:Наука. -1994. -269 с.
- Borec V., Morra M., Brown P.D., McCaffrey J.P. Allelochemicals produced during sinigrin decomposition in soil.//J.Agric.Food. Chem. 1994. -V. 42. -P. 1030-1034.
- Brown P.D., Morra M.J. Glucosinolate -containing plant tissues as bioherbicides.//J. Agr. Food. Chem. 1995. -V. 43. -N 12. -P.3070-3073.
- Waligora D. Rape glucosinolates and Alfalfa saponins as allelopathic factors for lettuce seeds germination.//S. Of plant propetection Reseach. 1996/-V. 37. -N 1/2. -P.109-112.
- Рост и устойчивость растений/Сб.ст. Сиб. ин-т физиологии и биохимии растений. Отв. ред. Саляев Р.К., Кефели В.И. -Новосибирск: Наука. Сиб. отд-ние. -1988. -210 с.
- Рубин Б.А., Арциховская Е.В. Биохимия и физиология иммунитета растений. -М.:Высшая школа. -1968. -412 с.
- Blua M.S., Hanscom Z.M., Collier B.D. Glucocapparin variability among for populations of isomeric arborea Nutt.//S. Chem. Ecol. 1988. -V. 14. -N 2. -P. 623-634.
- Spak J., Kolarova L., Lewis J., Fenwick G.R. The effect of glucosinolates (mustard oil glycosides) and products of their enzymic degrdationon the infectivity of turnip mosaic virus.//Biol. Plantarum. 1993. -V. 35. -N1. -P. 73-80.
- Subbarao K.V., Hubbard J.C. Interactive effects of broccoli residue and temperature on Verticillium dahliae microsclerotia in soil and on Wilt in cauliflower.//Phytopathology. 1996. -Vol. 86. -N 12. -P. 1303-13010.
- Lodha S., Sharma S.K., Aggarwal R.K. Solarization and natural heating of irrigated soil amended with cruciferous residues for improved control of Macrophomina phaseolina.//Plant Pathology. 1997. -V. 46. -P. 186-190.
- Chitwood D.J. Naturally occurring nematicides.//Pest control with enhanced envaronmental safety. -Washington:DC. 1993. -P.300-315.
- Brown P.D., Matthew J.M., Borec V. Gas chromatography of allelo-chemicaly produced during glucosinolate degradation in soil.//J. Agr. Food. Chem. 1994. -V. 42. -N9. -P 2029-2034.
- Gommers F.J. Nematicidal principles in Compositae. Department of Nematology, Agriculturae University Wagningen. The Netherlands H. Veenman Zonntn.D.V. -Wageningen. -1973.
- Синадский Ю.В.; Козаржевская Э.Ф. Состояние и перспективы биологического метода борьбы/Миграция патоген. организмов при интродукции растений. -M. -1987. -C. 14-20.
- Покровская Т.В. Мелойдогиноз и борьба с галловыми нематодами. -М.: Наука.-1988.-111с.
- Кузнецова А.А. Растения-пестициды в борьбе с болезнями растений//Защита растений. 1990. -N 6. -С.59-60.
- Пешкова Г.И. Растения -защитники плодовых и овощных культур. -М.: МСХА. 1991. -С.51.
- Khan F.A.,Chindo P.S. Effect of water extract of graund-nut cake on larval mortality of certain plant-parasitic nematodes.//Pakistan J. Nematol. 1990. -Vol.8. -N1. -P.29-31.
- Gloger K. Pflanzliche rohextrakte und pflanzeninhaltsstoffe mit nematizider Wirkung gegen Xiphinema index Thron. und Meloidogyna ingonita Ch./Diss.zur Erlangung. des G.D.Agr. -1995. -125 s.
- Borec V., Morra M., Brown P.D., McCaffrey J.P. Information of the glucosinolate-derived allelochemicals allyl isothiocyanate and allylnitrile in soil.//J.Agric.Food. Chem. 1995. -V. 43. -P. 1935-1940.
- А.с. № 1533040 «Способ защиты растений от галловой нематоды", выдан 1 сентября 1989 г. Авторы: Кононков П.Ф., Приходько В.Ф., Кононкова С.Н., Самохвалов А.Н., Шестеперов А.А., Тихонова Л.В.
- Котова В.В. Поиск растений с нематицидными свойствами и применение препарата сока водяного кресса в борьбе с галловыми нематодами в теплицах./Автореф. дисс. на соиск. учен. степ. к.б.н. -М. -1995. -27 с.
- Козарь Е. Г. Разработка технологии выращивания водяного кресса в условиях Hечерноземья Pоссии c элементами защиты тепличных овощных культур от мелойдогиноза/Автореф. дисс. на соиск. учен. степ. к.с.-х.н. -М. -1999. -28 с.
- Патент № 2059370 «Способ защиты растений от галловой нематоды", выдан 10 мая 1996 г. Авторы: Кононков П.Ф., Козарь Е.Г., Ше-стиперов А.А., Котова В.В.
- А.с. № 6729 «Сорт водяного кресса Подмосковный", выдан 5 мая 1995 г. Авторы: Кононков П.Ф., Кононкова С.Н., Козарь Е.Г., Сивоченко С.П., Васякин И.Н., Харламова С.А.
- Tiyagi S.A., Ahmad A., Alam M.M. Control of root-knot reniform and stunt nematodes by root dip in leaf extract of lemongrass//Intern. Pest Control.1990. -Vol.32. -N 3. -P.70-71.
- Das S., Sukul N.C. Nematicidal effect of the oil from the seeds of Argemone mexicana//Environment and Ecology. 1988. -Vol.6. -N1. -P.194-197.
- Кононков П.Ф.; Козарь Е.Г.; Шестакова Е.В.; Котова В.В. Водяной кресс -перспективная овощная культура для защищенного грунта//Гавриш.-1997.-N 3. -С. 7-9.
- Котова В.В.; Козарь Е.Г.; Кононков П.Ф.; Шестеперов А.А. Борьба с фитопаразитическими нематодами на основе использования свойств растений-антагонистов [Защита овощных культур защищенного грунта от южной галловой нематоды]: Обзор//С.-х. биология.Сер.Биология растений -1999.-N 3. -С. 24-32.


