Биологическая эффективность различных препаратов против семенной инфекции сосудистого бактериоза капусты
Автор: Орынбаев А.Т., Джалилов Ф.с-У., Масленникова С.Н.
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 2 (46), 2019 года.
Бесплатный доступ
Сосудистый бактериоз (возбудитель - Xanthomonas campestris pv. campestris) - одна из наиболее опасных болезней капустных культур. При выращивании рассадным методом даже небольшая зараженность семян приводит к массовому распространению патогена и, в дальнейшем, к значительным потерям урожая в поле. Целью работы было сравнительное испытание эффективности препаратов различного происхождения в отношении семенной инфекции сосудистого бактериоза капусты. Проводили оценку антибактериальной активности препаратов in vitro методом диффузии из лунок, методом нанесения капли препарата на газон бактерий, а также методом совместной инкубации суспензий испытываемых препаратов и патогена. Оценку биологическую эффективности препаратов против семенной инфекции сосудистого бактериоза капусты проводили методами замачивания семян и обработки с увлажнением. Показано, что сильной антибактериальной активностью по отношению к возбудителю сосудистого бактериоза капусты в условиях in vitro обладали консорциум бактериофагов, Биокомпозит-коррект, Зерокс, НУК 15, Ps 11 и Косайд 2000. Наибольшую биологическую эффективность в подавлении семенной инфекции сосудистого бактериоза показали бактериофаги, Биокомпозит-коррект, НУК 15, Зерокс и Косайд 2000.
Капуста, сосудистый бактериоз
Короткий адрес: https://sciup.org/140240700
IDR: 140240700 | УДК: 635.33:632.35 | DOI: 10.18619/2072-9146-2019-2-88-91
Текст научной статьи Биологическая эффективность различных препаратов против семенной инфекции сосудистого бактериоза капусты
Conflict of interest: The authors declare no conflict of interest.
Received: 20.03.2019
Accepted: 30.03.2019
THE BIOLOGICAL EFFECTIVENESS OF VARIOUS PREPARATIONS AGAINST SEED INFECTION OF CABBAGE BLACK ROT
Black rot (pathogen – Xanthomonas campestris pv. campestris) is one of the most harmful diseases of brassicas. Seedlings growing in trays in greenhouse can meet rapid spreading of the pathogen and heavy yield loss even at very low seed infection level. This work was targeted on efficiency comparison for different plant protection agents against black root infection in seeds. Antibacterial effect of the agents was tested in vitro by well diffusion, direct placement of the agent onto bacterial lawn, and by incubation of bacterial suspension with the agents. Biological efficiency of the agents against seed infection was tests by seed soaking or by wet treatment. High antibacterial effect against black rot pathogen in vitro was shown for bacteriophage cocktail, Biocomposite-correct, Zeroxxe, Peroxyacetic acid (NUK15), Ps 11, and Kocide 2000. Highest biological efficiency against seed infection by black rot was shown for bacteriophage cocktail, Biocomposite-correct, Zeroxxe, Peroxyacetic acid (NUK15), and Kocide 2000.
С осудистый бактериоз капусты, вызываемый бактерией
Xanthomonas campestris pv. campestris (Pammel, 1895; Dowson, 1939) – наиболее вредоносное заболевание капустных культур. Эта болезнь встречается практически повсеместно в России и во всех странах, где выращивают эту культуру [1,2].
Признано, что основным источником инфекции являются зараженные семена и растительные остатки [2,3,5]. Сильное распространение патогена происходит при выращивании рассады, когда при верхнем поливе происходит распространение бактерий от растений, полученных из зараженных семян, на листья здоровых растений [3], и это приводит к заражению растений от единичного источника инфекции в течение 3 недель до 60 % [1]. Ранее было установлено, что достаточно наличия 3-5 зараженных семян из 10000 шт., чтобы вызывать существенное заражение в поле [4].
Поражение капустных растений проявляется на всех стадиях выращивания культуры: всходы, рассада и взрослые растения. При сосудистом бактериозе на семядольных листочках образуются водянистые пятна бурого цвета, в дальнейшем приводящие к некротизации сосудов, засыханию семядолей и последующей гибели всходов (рис.1А). У взрослых растений симптомы заражения обычно заметны у края листовой пластинки в виде V-образных хлоротичных пятен, вследствие проникновения бактерий через гидатоды (рис.1С). На пожелтевшей ткани листа, на срезе черешка или кочерыги также хорошо заметна некротизация сосудов [5]. При одностороннем поражении лист искривляется в эту сторону, приобретая уродливую форму [1] (рис.1В). В дальнейшем бактерии попадают в стебель и распространяются по нему вверх и вниз к листьям и корням. При системном инфицировании хлоротичные участки могут появляться в любом месте на листьях. Вследствие развития заболевания зараженные листья могут преждевременно опадать.
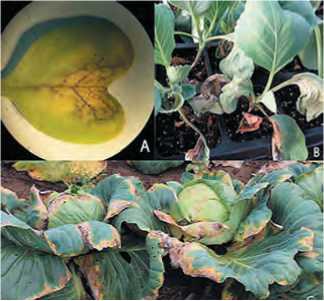
Рис.1. Симптомы сосудистого бактериоза: А – на семядольных листьях,
В – на рассаде,
С – на взрослых растениях, (фото автора).
Fig.1. Symptoms of black rot of brassicas:
A – on the cotyledon leaves,
B – on cabbage seedling,
C – on adult plant (photo by the author).
Возбудитель проникает в растения в основном через гидатоды при высокой влажности воздуха, через механические травмы, в том числе повреждения насекомыми, и через корневую систему в случае выращивания капусты на полях, где в предыдущие годы наблюдалось заболевание [6]. Болезнь не только снижает урожайность, качество и товарный вид свежей продукции, но и ухудшает лежкость в период хранения за счет снижения устойчивости к слизистому бактериозу [6]. В условиях теплой и влажной погоды заболевание способно снижать урожайность капусты до 50% [7], хотя встречаются сообщения и о полной гибели урожая [8].
К защитным мерам от заболевания относятся: севооборот с возвращением капусты на прежнее место не ранее чем через 2 года, диагностика зараженности семян и их протравливание, опрыскивание растений в поле с использованием биопрепаратов на основе антагонистических бактерий [7]. Большие перспективы в борьбе с болезнью имеет использование бактериофагов. Опрыскивание рассады капусты бактериофагами снижало распространение сосудистого бактериоза на 65% [9]. Ранее нами было предложено обеззараживание семян с использованием препарата НУК 15 [10]. Сообщается об использовании в качестве средств защиты растений препаратов на основе наночастиц серебра. Так был показан сильный антибактериальный эффект препарата Зерокс против некоторых фитопатогенных бактерий in vitro [11].
Целью нашего исследования являлось сравнительное испытание эффективности препаратов различного происхождения в отношении семенной инфекции сосудистого бактериоза капусты.
Материалы и методы
Исследование проводили в лаборатории защиты растений РГАУ-МСХА имени К.А. Тимирязева. Испытали антибактериальную активность следующих химических и биологических препаратов:
-
• Биокомпозит-коррект, КС – 109 колониеобразующих единиц (КОЕ)/мл консорциум штаммов нескольких видов полезных бактерий, АО «Щелково Агрохим»;
-
• Ps 11, КС – 109 КОЕ/мл Pseudomonas sp. 11RW, АО «Щелково Агрохим»;
-
• Консорциум бактериофагов, ВР – 109 бляшкообразующих единиц (БОЕ)/мл, изоляты BT 2, SM 10, Ph 30-1, Ph 44, DB 1, Tir 2, лаборатория защиты растений РГАУ-МСХА имени К.А. Тимирязева;
-
• НУК-15, ВР – 15-17% надуксусная кислота и 18-20% перекиси водорода, ООО «Лега»;
-
• Косайд 2000, ВДГ – 350 г/кг гидроокись меди, ООО «Дюпон Наука и Технологии»;
-
• Наноколлоид 2, ВКР – наноразмер-ные частицы коллоидного серебра, ООО «Концерн «Наноиндустрия»;
-
• Зерокс, ВКР – наноразмерные частицы коллоидного серебра, МГУ имени М.В. Ломоносова и ООО «Нанобиотех».
Антибактериальную активность (АА) препаратов в отношении Xanthomonas campestris pv. campestris (далее Хсс) изучали методом диффузии из лунок, методом нанесения капли препарата на газон бактерий, а также после совместной инкубации суспензии испытываемых препаратов и Хсс.
Для качественной оценки АА на поверхность агаризованной среды YDC высевали 0,1 мл бактериальной суспензии 48-часовой культуры плотностью 109 КОЕ/мл. Суспензию распределяли по поверхности среды шпателем Дригальского. Затем, после 15-ти минутного подсушивания наносили капли по 10 мкл испытываемых препаратов в рабочих концентрациях. В другой модификации теста сразу после посева пробковым сверлом (d=3 мм) в среде вырезали лунки, в которые вносили по 20 мкл испытываемые препараты. Повторность опыта двукратная. Чашки с посевами выдерживали в термостате при температуре 28°С в течение 48 часов
Антибактериальную активность препаратов оценивали по размерам стерильной зоны (мм) на газоне патогена.
Для более точной количественной оценки антибактериального эффекта препаратов использовали метод совместной инкубации. Для этого в стерильной пробирке на 1,5 мл смешивали суспензию бактерий Хсс с равным объемом рабочего раствора препаратов удвоенной концентрации, что бы конечная концентрация препаратов в смеси соответствовала рекомендованной рабочей концентрации. Смесь выдерживали 30 мин. В контрольные пробирки добавляли стерильную воду в том же объеме, что и суспензию препаратов. Затем проводили серию десятикратных разведений с последующим посевом 0,1 мл суспензии на питательную среду в двукратной повторности, инкубировали в термостате при температуре 28°С в течение 48 часов. Подсчитывали количество колоний Хсс и по полученным данным рассчитывали концентрацию колониеобразующих единиц в миллилитре (КОЕ/мл).
Оценивали биологическую эффективность препаратов против семенной инфекции сосудистого бактериоза капусты. Для этого предварительно искусственно заражали семена капусты белокочанной гибрида F1 Казачок возбудителем сосудистого бактериоза (штамм Ram 1-2) в концентрации 107 КОЕ/мл в условиях вакуума [12]. Затем семена подсушивали при комнатной температуре 24 часа и обработали препаратами методами с увлажнением с нормой расхода рабочей жидкости 1010 мл/кг семян и замачиванием на 30 мин. Положительным контролем служили зараженные семена, а отрицательным контролем – здоровые семена.
После обработки и подсушивания семена высевали на увлажненную фильтровальную бумагу в чашки Петри по 50 штук в трех повторностях. Чашки выдерживали на свету при комнатной температуре. Через 6-7 суток после посева учитывали количество зараженных проростков путем визуального осмотра семядольных листочков. В сомнительных случаях использовали бинокулярную лупу. Проводили учет лабораторной всхожести семян по ГОСТу 12038-84.
Статистическую обработку экспериментальных данных проводили методом дисперсионного анализа со сравнением средних по критерию Дункана с помощью пакета программ STATISTICA 5.5. и с использованием программы Microsoft Excel 2010. Данные выраженные в процентах перед обработкой преобразовывали в арксинусы.
Результаты и их обсуждение
В связи с тем, что тестировали препараты различного механизма действия, в экспериментах были использованы различные методы оценки АА.
При оценке АА методами «капли» и диффузии из лунок измеряли диаметр стерильной зоны на газоне патогена. Полученные результаты указывают на высокую антибактериальную активность препаратов Ps 11, НУК 15 и Биокомпозит-коррект (табл.1). При этом препарат Биокомпозит не давал стерильной зоны, но бактерии – продуценты этого препарата обладали
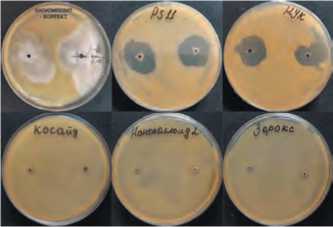
способностью формировать растущие колонии на газоне патогена (рис.2). Этот показатель учитывали как подавление патогена и измеряли как стерильную зону. Препараты Косайд 2000, Наноколлоид 2, Зерокс а также консорциум бактериофагов обладали слабой активностью при диффузии в питательной среде.
При оценке АА препаратов методом совместной инкубации установлено, что инкубирование Хсс в растворах Зерокс (3,0%) и НУК 15 (0,15%) в течение 30 мин приводило к полной потере жизнеспособности патогена. Препараты Косайд 2000 и консорциум бактериофагов снижали жизнеспособность бактерий по сравнению с контролем на 105 и 103 соответственно. Антибактериальная активность препарата Наноколлоид 2 была значительно слабее, и в этом варианте концентрация жизнеспособных клеток возбудителя не отличалась достоверно от контроля (табл.2).
Между различными методами оценки АА: метод диффузии и метод совместного инкубирования выявлена слабая отрицательная связь (r = -0,3). Это свидетельствует о необходимости учитывать химические свойства действующих веществ при выборе метода оценки. Например, если активные метаболиты бактерий и НУК хорошо диффундируют в агаровой среде, то
Таблица 2. Оценка антибактериальной активности различных препаратов в отношении Xanthomonas campestris pv. campestris методом совместной инкубации, (КОЕ/мл) Table 2. Evaluation of antibacterial effect of different agents against Xanthomonas campestris pv. campestris by co-incubation, (CFU / ml)
Рис.2. Результаты оценки антибактериальной активности различных препаратов методом диффузии.
Fig.2. Evaluation of antibacterial effect of different agents by diffusion method.
|
Препараты |
Статистические группы по критерию Дункана |
|||
|
a |
b |
c |
d |
|
|
Контроль (вода) |
2,2х107 |
|||
|
Бактериофаги, 108 БОЕ/мл |
5,7х104 |
|||
|
НУК 15, 0,15% |
0,0 |
|||
|
Косайд 2000, 0,15% |
1,4х102 |
|||
|
Наноколлоид 2, 3% |
3,0х106 |
|||
|
Зерокс, 3% |
0,0 |
|||
препараты на основе металлов и бактериофаги такой способностью не обладают. Таким образом, при выборе метода тестирования АА различных препаратов необходим учет их физико-химических свойств.
Оценку биологической эффективности препаратов в отношении семенной инфекции сосудистого бактериоза проводили двумя методами: замачиванием на 30 мин в суспензии препаратов и методом увлажнения с нормой расхода рабочей жидкости 10 мл/кг семян.
Предпосевная обработка семян двумя описанными выше способами не привела к существенному изменению их лабораторной всхожести.
Учет симптомов заболевания показал, что при методе замачивания наибольшая биологическая эффективность (96,0-78,9%) получена в вариантах с обработкой НУК 15, консорциум бактериофагов, Зерокс, Биокомпозит-коррект (табл. 3, рис. 3). Несколько ниже показали биологическую эффективность Ps 11, Косайд 2000 (70,068,2%). Биологическая эффективность препарата Наноколлоид 2 была существенно ниже (51%).
Метод замачивания не технологичен, так как требует последующего подсушивания семян. В связи с этим практический интерес представляло сравнение эффективности препара-
Таблица 1. Антибактериальная активность различных препаратов в отношении Xanthomonas campestris pv. campestris
Table 1. Antibacterial activity of different agents against Xanthomonas campestris pv. campestris
|
Препараты |
Стерильная зона, мм |
|
|
Метод капли |
Метод лунки |
|
|
Контроль (вода) |
0,0 |
0,0 |
|
Биокомпозит-коррект, 108 КОЕ/мл |
20,0 ± 1,0 |
31,0 ± 2,0 |
|
Ps 11, 108 КОЕ/мл |
21,0 ± 1,0 |
20,0 ± 1,0 |
|
Бактериофаги, 108 БОЕ/мл |
10,0 ± 0,5 |
1,6 ± 0,6 |
|
НУК 15, 0,15 % |
19,0 ± 2,0 |
19,6 ± 3,6 |
|
Косайд 2000, 0,15 % |
4,5 ± 0,5 |
1,0 ± 0,3 |
|
Наноколлоид 2, 3,0 % |
1,5 ± 0,5 |
1,0 ± 0,2 |
|
Зерокс, 3,0 % |
2,5 ± 0,5 |
2,6 ± 0,6 |
тов при обработке семян методом увлажнения. Полученные результаты показали значительное снижение зараженности проростков при этом методе обработки семян (табл. 4).
Если в контроле зараженность проростков составляла 40,6%, то после обработки бактериофагами, Биокомпозит-коррект и НУК 15 она составляла 12,0, 12,6 и 13,2% соответственно. Несколько слабее был эффект от обработки Зерокс и Косайд 2000. Слабую эффективность показал препарат Ps 11, который ранее показал высокую АА в тестах диффузии in vitro .
Препарат Наноколлоид 2 был неэффективен, этот вариант не отличался достоверно от положительного контроля.
Таблица 3. Биологическая эффективность (БЭ, %) обработки семян белокочанной капусты F 1 Казачок методом замачивания в отношении семенной инфекции сосудистого бактериоза капусты Table 3. Biological efficiency (OBE, %) of white cabbage F 1 Kazachok seeds treatment by a soaking against black rot seed infection
|
Препарат, рабочая концентрация |
Лаб. всхожесть, % |
Зараженность, % |
БЭ, % |
|
Контроль – здоровые семена |
87,0 |
0 d |
- |
|
Контроль – зараженные семена |
84,0 |
59,4 a |
- |
|
Биокомпозит-коррект, 108 КОЕ/мл |
88,0 |
12,5 сd |
78,9 |
|
Ps 11, 108 КОЕ/мл |
90,0 |
17,8 bс |
70,0 |
|
Бактериофаги, 108 БОЕ/мл |
87,0 |
4,6 сd |
90,6 |
|
НУК 15, 0,15% |
85,0 |
2,4 сd |
96,0 |
|
Косайд 2000, 0,15% |
84,0 |
18,9 bc |
68,2 |
|
Наноколлоид 2, 3 % |
86,0 |
29,1 b |
51,0 |
|
Зерокс, 3 % |
87,0 |
9,2 сd |
84,5 |
Заключение
В результате проведенных в 2018-2019 годах экспериментов показано, что сильной антибактериальной активностью по отношению к возбудителю сосудистого бактериоза капусты в условиях in vitro обладали консорциум бактериофагов, Биокомпозит-коррект, Зерокс, НУК 15, Ps 11 и Косайд 2000. Высокую биологическую эффективность по подавлению семенной инфекции сосудистого бактериоза показали бактериофаги, Биокомпозит-кор-рект, НУК 15, Зерокс и Косайд 2000. Эти препараты могут занять свое место в системе защиты капусты от болезней после государственной регистрации.
F
ф
Примечание: В таблицах 3 и 4 между вариантами, обозначенными одинаковыми буквами, при сравнении в пределах столбцов нет статистически достоверных различий по критерию Дункана при 95% уровне вероятности.

Рис.3. Результаты обработки семян различными препаратами методом замачивания.
Fig.3. Effect of seed treatment by different antibacterial agents applied by soaking.
Таблица 4. Биологическая эффективность (БЭ, %) обработки семян белокочанной капусты
F 1 Казачок методом увлажнения в отношении семенной инфекции сосудистого бактериоза капусты Table 4. Biological efficiency (OBE, %) of white cabbage F 1 Kazachok seeds treatment by a method of moistening against black rot seed infection
|
Препарат, рабочая концентрация |
Лаб. всхожесть, % Зараженность, % |
БЭ, % |
|
|
Контроль – здоровые семена |
88,0 |
0,0 d |
- |
|
Контроль – зараженные семена |
84,0 |
40,6 a |
- |
|
Биокомпозит-коррект, 108 КОЕ/мл |
87,0 |
12,6 cd |
69,0 |
|
Ps 11, 108 КОЕ/мл |
84,0 |
24,2 bc |
40,4 |
|
Бактериофаги, 108 БОЕ/мл |
84,0 |
12,0 сd |
70,4 |
|
НУК 15, 0,15% |
86,0 |
13,2 cd |
67,5 |
|
Косайд 2000, 0,15% |
84,0 |
19,1 c |
53,0 |
|
Наноколлоид 2, 3% |
87,0 |
32,1 ab |
19,2 |
|
Зерокс, 3% |
87,0 |
15,0 c |
63,1 |
F
ф
Об авторах: About the authors:
Масленникова С.Н. – асп. кафедры биохимии, клеточной биологии и микробиоло- Maslennikova S.N. – postgraduate student of Biochemistry, Cell Biology and Microbiology гии; начальник сектора биол. лаборатории Department; Head of Subdivision in Biological Laboratory
-
• Литература
-
1. Лазарев А.М., Мысник Е.Н., Игнатов А.Н. Ареал и зона вредоносности сосудистого бактериоза капусты // Вестник защиты растений. 2017. 1(91). С.52-55.
-
2. Игнатов А.Н. Распространение возбудителей опасных бактериозов растений в Российской Федерации // Защита картофеля. 2014. №2. С.53-57.
-
3. Джалилов Ф.С. Разработка комплекса мероприятий по защите капусты от сосудистого бактериоза / Международная научно-практическая конференция «Состояние и перспективы селекции т семеноводства капустных культур». Материалы конференции, 12–15 сентября 2016 г., г. Москва. 2016. C.115-116.
-
4. Schaad, N.W. Sitterly W.R., Humaydan H. Relationship of incidence of seedborne Xanthomonas campestris pv. campestris to black rot of crucifers // Plant Disease. 1980. 64. P.91-92.
-
5. Джалилов Ф.С., Во Тхи Нгок Ха Защита капусты от болезней в период вегетации / Картофель и овощи. 2014. №1. С.20-23.
-
6. Джалилов Ф.С., Монахос Г.Ф., Тивари Р.Д. Вредоносность сосудистого бактериоза капусты // Известия Тимирязевской сельскохозяйственной академии. 1989. Вып.3. С.169-172.
-
7. Ignatov A.N., Panchuk S.V., Vo Thi Ngok Ha, et al. Black rot of brassicas in Russia – epidemics, protection, and sources for resistant plants breeding // Картофель и овощи. 2016. №2. С.15-16.
-
8. Jensen B.D., Vicente J.G., Manandhar H.K., Roberts S.J. Occurrence and diversity of Xanthomonas campestris pv. campestris in vegetable Brassica fields in Nepal // Plant Disease. 2010. Vol. 94. 3. P.298–305.
-
9. Орынбаев А.Т., Джалилов Ф.С. Защита рассады капусты от сосудистого бактериоза / Международная научно-практическая конференция «Современные технологии и средства защиты растений – платформа для инновационного освоения в АПК России». Материалы конференции, 8–12 октября 2018 г., СПб – Пушкин. 2018. C.115-116.
-
10. Орынбаев А.Т., Джалилов Ф.С. Обеззараживание семян капусты от сосудистого бактериоза // Картофель и овощи. 2018. №1. С.23-25.
-
11. Мыца Е.Д., Еланский С.Н., Кокаева Л.Ю., и др. Новый препарат «Зерокс» – оценка фунгицидного и бактерицидного эффекта in vitro // Достижения науки и техники АПК. 2014. Т.28. №12. С.16-19.
-
12. Мазурин Е.С., Джалилов Ф.С., Игнатов А.Н., Варицев Ю.А. Усовершенствование диагностики зараженности семян капусты возбудителям сосудистого бактериоза методом иммуноферментного анализа // Известия ТСХА. 2009. Вып. 1. С.66-72.
-
-
• References
-
1. Lazarev A.M., Mysnik E.N., Ignatov A.N. Area of occurrence and economic harm for black rot of brassicas// Plant Protection News. 2017. 1 (91). P.52–55.
-
2. Ignatov A.N. Occurrence of emerging bacterial plant pathogens in Russia // Potato protection. 2014. №2. P.53-57.
-
3. Dzhalilov F.S. Development of integrated control of black rot disease on cab-bage/ International Scientific and Practical Conference "The state and prospects of plant breeding and cabbage seed production." Conference proceedings, September 12–15, 2016, Moscow. 2016. P.115-116.
-
4. Schaad, N.W. Sitterly W.R., Humaydan H. Relationship of incidence of seed-borne Xanthomonas campestris pv. campestris to black rot of crucifers // Plant Disease. 1980. 64. P.91-92.
-
5. Dzhalilov F.S, Vo Thi Ngok Ha Cabbage diseases control in field // Potato and vegetables. 2014. No.1. P.20-23.
-
6. Dzhalilov F.S., Monakhos G.F., Tiwari R.D. Harmfulness of cabbage black rot // News of Timiryazev Agricultural Academy. 1989. No.3. P.169-172.
-
7. Ignatov A.N., Panchuk S.V., Vo Thi Ngok Ha, et al. Black rot of brassicas in Russia – epidemics, protection, and sources for resistant plants breeding // Potato and vegetables. 2016. No.2. P.15-16.
-
8. Jensen B.D., Vicente J.G., Manandhar H.K., Roberts S.J. Occurrence and diversity of Xanthomonas campestris pv. campestris in vegetable Brassica fields in Nepal // Plant Disease. 2010. Vol. 94. 3. P.298–305.
-
9. Orynbayev A.T., Dzhalilov F.S. Protection of cabbage seedlings from black rot / International Scientific and Practical Conference "Modern technologies and plant protection products – a platform for innovative development in the agroindustrial complex of Russia." Conference proceedings, October 8–12, 2018, St. Petersburg — Pushkin. 2018. P.115-116.
-
10. Orynbayev A.T., Dzhalilov F.S. Control of black rot infection in cabbage seeds // Potatoes and vegetables. 2018. No.1. P.23-25.
-
11. Myats, E.D., Elansky, S.N., Kokaeva, L.Yu., et al. New preparation Zeroxxe: assessment of fungicidal and bactericidal properties in vitro // Achievements of Science and Technology of AIC. 2014. Vol.28. No.12. P.16-19.
-
12. Mazurin E.S., Dzhalilov F.S., Ignatov A.N., Varitsev Yu.A. Improved detection of black rot pathogen on cabbage seeds using the enzyme immunoassay // Proceedings of TSKHA. 2009. Vol. 1. P.66-72.
-
Список литературы Биологическая эффективность различных препаратов против семенной инфекции сосудистого бактериоза капусты
- Лазарев А.М., Мысник Е.Н., Игнатов А.Н. Ареал и зона вредоносности сосудистого бактериоза капусты//Вестник защиты растений. 2017. 1(91). С. 52-55.
- Игнатов А.Н. Распространение возбудителей опасных бактериозов растений в Российской Федерации//Защита картофеля. 2014. № 2. С. 53-57.
- Джалилов Ф.С. Разработка комплекса мероприятий по защите капусты от сосудистого бактериоза/Международная научно-практическая конференция «Состояние и перспективы селекции т семеноводства капустных культур». Материалы конференции, 12-15 сентября 2016 г., г. Москва. 2016. C. 115-116.
- Schaad, N.W. Sitterly W.R., Humaydan H. Relationship of incidence of seedborne Xanthomonas campestris pv. campestris to black rot of crucifers//Plant Disease. 1980. 64. P.91-92.
- Джалилов Ф.С., Во Тхи Нгок Ха Защита капусты от болезней в период вегетации/Картофель и овощи. 2014. № 1. С. 20-23.
- Джалилов Ф.С., Монахос Г.Ф., Тивари Р.Д. Вредоносность сосудистого бактериоза капусты//Известия Тимирязевской сельскохозяйственной академии. 1989. Вып.3. С. 169-172.
- Ignatov A.N., Panchuk S.V., Vo Thi Ngok Ha, et al. Black rot of brassicas in Russia -epidemics, protection, and sources for resistant plants breeding//Картофель и овощи. 2016. № 2. С. 15-16.
- Jensen B.D., Vicente J.G., Manandhar H.K., Roberts S.J. Occurrence and diversity of Xanthomonas campestris pv. campestris in vegetable Brassica fields in Nepal//Plant Disease. 2010. Vol. 94. 3. P.298-305.
- Орынбаев А.Т., Джалилов Ф.С. Защита рассады капусты от сосудистого бактериоза/Международная научно-практическая конференция «Современные технологии и средства защиты растений -платформа для инновационного освоения в АПК России». Материалы конференции, 8-12 октября 2018 г., СПб -Пушкин. 2018. C. 115-116.
- Орынбаев А.Т., Джалилов Ф.С. Обеззараживание семян капусты от сосудистого бактериоза//Картофель и овощи. 2018. № 1. С. 23-25.
- Мыца Е.Д., Еланский С. Н., Кокаева Л.Ю., и др. Новый препарат «Зерокс» -оценка фунгицидного и бактерицидного эффекта in vitro//Достижения науки и техники АПК. 2014. Т.28. № 12. С. 16-19.
- Мазурин Е.С., Джалилов Ф.С., Игнатов А.Н., Варицев Ю.А. Усовершенствование диагностики зараженности семян капусты возбудителям сосудистого бактериоза методом иммуноферментного анализа//Известия ТСХА. 2009. Вып. 1. С. 66-72.


