Биологическая концептуализация сторожевого лимфатического узла (литературный обзор)
Автор: Ермаков Анатолий Викторович, Зикиряходжаев Азиз Дильшодович, Сарибекян Эрик Карлович, Аблицова Наталья Валерьевна, Усов Федор Николаевич
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Фундаментальная онкология и экспериментальная медицина
Статья в выпуске: 4 (20), 2016 года.
Бесплатный доступ
В работе отражены современные представления о состоянии дел в свете изучения концепции сторожевого лимфатического узла при злокачественных новообразованиях. Статус лимфатических узлов остается наиболее важным прогностическим фактором выживаемости, а адекватное лечение зависит от количества вовлеченных узлов. Для идентификации сторожевого лимфатического узла используется радиологический метод как самостоятельно, так и в сочетании с красителем. Применяемая во время оперативного вмешательства методика лимфографии призвана идентифицировать сторожевой лимфатический узел. Для достижения соответствующей точности метода необходимы специальный отбор пациентов, эффективные препараты-маркеры и определенный хирургический опыт. Ключевым является междисциплинарный подход с привлечением радиолога и патоморфолога. Концепция сторожевого лимфатического узла не во всех случаях может быть использована для прогноза процесса метастазирования. Регион-специфичная модификация и коррекция необходимы для оптимизирования применения SLN-imaging (картирования сторожевых лимфатических узлов), особенно для пожилых пациентов с ранней стадией рака. Использование метода идентификации сторожевых лимфатических узлов представляется значимым в плане изучения индивидуальных особенностей лимфооттока от различных сегментов туловища, направления которого могут отличаться. Биопсия сторожевых лимфатических узлов процедура чрезвычайно важна для того, чтобы найти метастаз в узле на очень ранних стадиях рака. До развития метастазирования VEGF-А (человеческий васкулоэндотелиальный фактор роста А) индуцирует лимфангиогенез в сторожевом лимфатическом узле, что дает основание предполагать, что первичные опухоли могут готовить будущий путь метастазирования, продуцируя факторы лимфангиогенеза, которые обеспечивают эффективный транспорт опухолевых клеток к сторожевому лимфатическому узлу. Этот механизм стимулирования лимфангиогенеза в сторожевом лимфатическом узле, способствующий метастазированию опухоли, представляет собой новую терапевтическую мишень для предотвращения метастаза. У пожилых пациентов со злокачественными новообразованиями гистологическая разнородность сменяет гомогенную морфологию с многочисленными или большими вторичными фолликулами в хорошо развитой коре. Гистологическая разнородность может модулировать перемещение раковой клетки с большой вероятностью к лимфатическим узлам, имеющим возрастные архитектурные изменения. Лимфангиогенез и усиление тока лимфы через дренирующий опухоль регионарный лимфатический узел может усилить метастазирование по лимфатическим канальцам. Описания морфологических перестроек в регионарных лимфатических узлах в процессе злокачественного роста носят сходный характер и различаются по степени выраженности изменений в зависимости от вида опухоли, локализации и времени развития.
Сторожевой лимфатический узел, метастазирование, лимфангиогенез
Короткий адрес: https://sciup.org/140222669
IDR: 140222669 | DOI: 10.18027/2224-5057-2016-4-5-13
Текст научной статьи Биологическая концептуализация сторожевого лимфатического узла (литературный обзор)
Операция лимфаденэктомия, как важный этап диагностики и противоопухолевого лечения, сопровождается значительным риском развития осложнений, в частности лим- фэдемы, потери чувствительности определенных участков кожи и худшего заживления ран. Эта операция, также, приводит к возрастанию финансовых затрат на лечение больных вследствие большей продолжительности анестезии, более длительного пребывания в операционной и за-
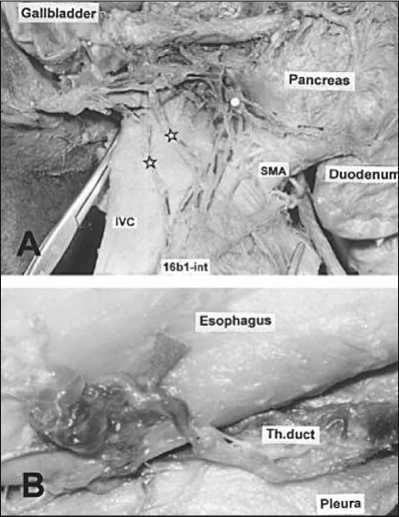
Рис. 1. Коллатеральные лимфатические сосуды потенциально могут быть путями метастазирования (Murakami G. et al., 2004)
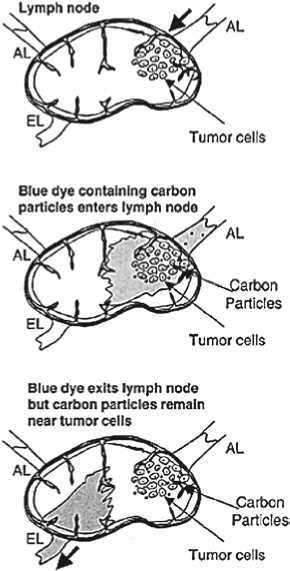
Рис. 2. Пути перемещения синего красителя, содержащего частицы углерода. Краситель проходит через узел, а частицы углерода депонируются в области вхождения афферентного лимфатического сосуда (AL). Присутствие этих углеродных частиц подтверждает статус сторожевого лимфатического узла и идентифицирует наиболее вероятную область в пределах узла для накопления опухолевых клеток. EL – выносящий лимфатический сосуд (Cochran A. J. et al., 2004) [2]
трат на послеоперационный уход. Несмотря на эти факты, статус лимфатических узлов остается наиболее важным прогностическим фактором выживаемости, а адекватное лечение зависит от количества вовлеченных узлов.
АКТУАЛЬНОСТЬ
В настоящее время для идентификации сторожевого лимфатического узла используется радиологический метод как самостоятельно, так и в сочетании с красителем. Использование красителя позволяет обнаруживать сторожевые лимфатические узлы в 82–87% случаев, а комбинированное использование красителя и радиоизотопа – в 99%. Применяемая во время оперативного вмешательства методика лимфографии призвана идентифицировать сторожевой лимфатический узел (или нескольких узлов). Для достижения соответствующей точности метода необходимы специальный отбор пациентов, эффективные препараты-маркеры и определенный хирургический опыт. Ключевым же является междисциплинарный подход с привлечением радиолога и патоморфолога. Тем не менее, исходя из данных литературы, концепция сторожевого лимфатического узла не во всех случаях может быть использована для прогноза процесса метастазирования [1].
ОБЗОР ПРЕДСТАВЛЕННОГО МАТЕРИАЛА
Группа авторов, в частности Murakami G. et al., в своей работе [1] продемонстрировала анатомическое обоснование возможных путей метастазирования опухоли. Метастазирование, по мнению авторов, могло осуществляться путем миграции клеток опухоли через коллатеральные сосуды или сосудистый ствол, который обходит один или более узлов лимфатического бассейна (рис. 1).
В то же время этими авторами [2] было отмечено, что гистология и клеточный состав лимфатических узлов может значительно изменяться в возрастном аспекте [3], что не учитывается хирургами. Так Hoshi H. et al. [4] описали ре-гион-специфические различия в структуре лимфатических узлов в постнатальном периоде у мышей. При изучении лимфатических узлов кролика Fisher B., Fisher E. R. [5] экспериментально продемонстрировали, что способность к фильтрации отдельного узла ограничена и что для его оптимальной функции требуются последовательно выстраиваемые узлы.
В работе Sainte-Marie G. et al. [6] показано, что «промежутки» поверхностной коры могут обеспечить быстрый шунт для тока лимфы от подкапсульного синуса к мозговому синусу в лимфатических узлах крысы (рис. 3А). По мнению авторов [1] «промежутки» поверхностной коры могут существенно ухудшать узловую фильтрацию.
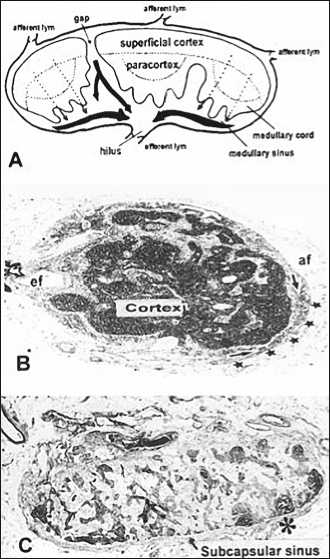
Рис. 3. «Промежутки» в корковой зоне лимфатического узла и атрофичные узлы
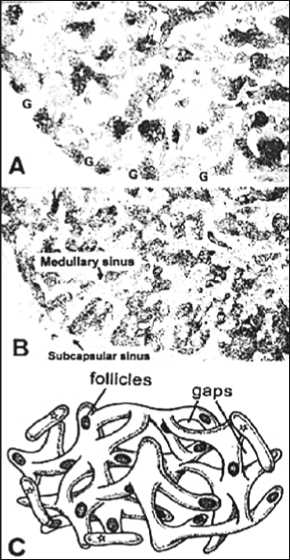
Рис. 4. Лимфатические узлы с архитектурой, подобной «острову»
(A) Архитектура лимфатических узлов. Введенные чернила в афферентный сосуд быстро проходят через «промежуток» в поверхностной коре к мозговому синусу (B). Маленькие узлы с полностью измененной гистологической конфигурацией (С). В этом узле незначительно развитый мозговой синус (стрелки) окружен подкапсульным синусом (звезды) (C). Небольшое развитие коры в узле. Узел содержит очень небольшое количество лимфоцитов. Фолликул, вероятно, содержит герминативный центр (звездочка), но может быть и артефактом (Murakami G. et al., 2004) [1].
Для доказательства того, что гипотеза сторожевого лимфатического узла не всегда работает, было проведено исследование лимфатических узлов различной локализации от трупов пожилых людей [1].
Было обследовано 419 лимфатических узлов (40 затылочных, 14 подмышечных, 154 грудных, 205 брюшных и тазовых, 6 паховых) от 27 трупов (12 японских мужчин и 15 японских женщин, в возрасте 72–95 лет). При взятии материала по возможности были маркированы выносящие сосуды каждого узла частицами углерода. Эти трупы не несли никаких макроскопически определяемых опухолей. Кроме того, было взято для исследования 150 лимфатических узлов от трупов 9 белых американских мужчин и 6 белых американских женщин, в возрасте 68–93 лет, которые использовали в качестве группы сравнения [1].
В результате проведенного исследования была выявлена специфичность архитектуры мелких лимфатических узлов. Из 419 узлов от японской группы 12 узлов были меньше чем 3 мм в максимальном диаметре. Эти узлы имели расположенную в центре кору. Подкапсульный синус был отделен от мозгового синуса и располагался снаружи (рис. 3B). В 18 средостенных и легочных узлах и 12 узлах, расположенных в области кишечника, поверхностная кора была более тонкой, чем максимальный диаметр фолликула. В этих узлах хорошо выявлялись промежутки коры. В то же время паракортикальную зону часто было трудно выделить [1].
Среди причин нарушения структуры и опустошения лимфатических узлов отмечали их жировое перерождение и фиброз. Инфильтрация жировой ткани в мозговой синус была обнаружена в 5 затылочных узлах, в 3 узлах около артерии левого желудочка и в 1 паховом узле. У пожилых белых американцев жировому замещению редко подвергалась большая часть узла. А у пожилых японцев в параа-ортальной области вместо узлов иногда идентифицировали капсулу, заполненную жировой тканью.
Фиброз был обнаружен в 12 средостенных и легочных узлах (72 из 154) и, особенно, в тазовых узлах, хотя степень этого процесса была различной. В средостенных лимфатических узлах фиброзирование отмечали в мозговом синусе, оно было представлено тонкими фибриллами
Биологическая концептуализация сторожевого лимфатического узла (Литературный обзор)
The biological conceptualization of the sentinel lymph node (Literature review)
коллагена (40–50 нм в диаметре, по данным электронной микроскопии). Напротив, фиброз тазовых узлов был представлен толстыми фибриллами (100–150 нм), которые ветвились и распространялись по периваскулярным пространствам в коре (рис. 4A). Этот тип фиброзирования иногда отмечали в брюшных и подмышечных лимфатических узлах. Экземпляры узлов от пожилых белых американцев, также, часто имели структурные признаки обширного фиброза в этих зонах. Фиброз в средостенных узлах обычно ограничивался 20% от размера узла, но восемь узлов вокруг трахеи имели более значительное фиброзирование, занимавшее больше чем 50% от объема органа. Из 46 тазовых узлов от пожилых японцев 12 демонстрировали фиброз, составляющий от 20 до 40% от объема коры. Из 154 грудных узлов 98 средостенных и легочных узлов были заполнены макрофагами с частицами угля и макрофагами, которые являлись CD68-лимфоцитами, но не содержали углерода. Накопление углерода иногда определяли в корковых зонах и в синусах (рис. 4B). Накопление угольных частиц хорошо выявлялось в экземплярах от пожилых японцев, которые, по-видимому, были курильщиками. Напротив, почти «белые» средостенные и легочные узлы были найдены у 5 из 10 некурящих пожилых белых американцев.
Множественные вторичные фолликулы были отмечены в 25 из 154 средостенных узлов и 12 из 252 брюшных и тазовых узлов. Все 12 брюшных и тазовых узлов с вторичными фолликулами были от 2 трупов. Вторичный фолликул был обычно большего размера, чем первичный фолликул и его максимальный диаметр составлял 200– 370 мкм. Кора и мозговые тяжи обычно занимали 70–80% от объема лимфатического узла. Вариации между индивидуумами были очевидны. Авторами были обнаружены регион-специфичные различия. Легочные узлы обычно имели небольшую величину коры (почти 30%), тогда как затылочные, подмышечные и верхние средостенные узлы имели тенденцию к большему размеру корковой зоны. Было замечено, что кора затылочных узлов была значительно (P<0,1) больше в экземплярах от пожилых белых американцев (64.7 ± 9.4%), чем у пожилых японцев (55.9 ± 20.4%).
«Промежутки» в коре (рис. 4A) были найдены в почти каждом узле, исследованном на серийных срезах. Однако затылочные, подмышечные и паховые узлы (то есть, соматические узлы) имели толстую поверхностную кору с немногими «промежутками». Наоборот, половина груд- ных узлов и одной трети брюшных и тазовых узлов имела тонкий слой коры с «промежутками» (1–3 «промежутка» в произвольно выбранных срезах). Кроме того, другая треть брюшных и тазовых узлов имела архитектуру коры, подобную «острову», характеризующуюся многократными «промежутками» в каждом срезе узла. Этот подобный «острову» образец был особенно представлен в парааор-тальных узлах (рис. 4A).
В узлах с архитектурой, подобной «острову», поверхностная кора была фрагментирована, в то время как мозговые тяжи были очень хорошо развиты. Области локализации B-лимфоцитов часто были расположены глубоко в «острове», также как и в поверхностной фрагментированной коре (рис. 4A). В половине случаев в лимфатических узлах со структурой, подобной «острову», волокнистая соединительная ткань занимала почти весь объем синуса.
Иммуногистохимические маркирования CD20-лимфо-цитов (A) и CD3-лимфоцитов (B) имеют почти сходные характеристики. Локализация B и T лимфоцитов сходна в большинстве корковых областей. Зона B-лимфоцитов расположена глубоко в среднем брюшном парааорталь-ном узле. Обильные корковые «промежутки» (G) видны в подкапсульном синусе (C). В этом схематическом представлении, трехмерная конфигурация синусов и тяжей определяется как подобный «острову» образец. Большинство корковых тяжей связываются с другими тяжами, но имеют место и отдельные независимые, несвязанные «острова» (отмечены звездочками) (Murakami G. et al., 2004) [1].
В зависимости от степени фиброза синуса, распределение макрофагов менялось от диффузного типа до их локализации вокруг коры, расположенной подобно «островам». Лимфатические узлы с подобной «острову» архитектурой коры иногда наблюдали в затылочных и верхних грудных узлах. Полученные авторами данные исследования структуры лимфатических узлов от трупов пожилых людей свидетельствуют, что корковый щит по афферентной стороне узлов может быть неполон из-за «промежутков» в тонкой поверхностной коре, особенно в грудных и брюшных висцеральных узлах. По-видимому, внутриузловой шунт для тока лимфы является частым в висцеральных узлах пожилых людей. Вероятно маленькие, почти опустошенные или «разрушенные» узлы потеряли корковые функции, типа связывания антигена. Серьезный антракоз, также, может нарушать функцию связывания антигенов в коре и синусах. В результате, частицы или антигены могут легко пройти через измененные висцеральные узлы. По мнению авторов [1] регион-специфические различия в пропорции объема корковой зоны могут быть критическим индикатором иммунной способности узла. Легочные лимфатические узлы, в которых обычно выявлялся значительный антракоз, имели наименьшие размеры коры в структуре всех узлов. Поэтому их защитная способность против раковых образований легкого должна отличаться и возможно является менее эффективной чем, например, у поднижнечелюстного лимфатического узла при раке языка, потому что поднижнечелюстные узлы имеют наибольший объем коркового вещества в органе. Лимфатические узлы от подмышечных, затылочных и паховых областей почти всегда имели большой объем корковой зоны, тогда как средостенные, брюшные и тазовые узлы характеризовались небольшими размерами коры с существенными изменениями в пределах индивидуумов и уникальной архитектурой [1]. Отмеченная подобная «острову» архитектура корковой зоны, вероятно, предполагает свободную связь между подкапсульным и другими синусами узла. Эта архитектура может соответствовать группе маленьких узелков, каждый из которых окружен общем синусом. Это является аргументом против функциональных единиц, сосредоточенных в области вхождения афферентного лимфатического сосуда. Тогда как в лимфатических узлах с «островной» архитектурой коркового вещества действия антиген-представляющих фолликулярных дендритных клеток могут зависеть от любого афферентного сосуда и из общего синуса. Эта уникальная архитектура, увеличивает корковые поверхностные зоны, в которых происходят различные критические взаимодействия между компонентами синусов и корой. Образование кластеров T-лимфоцитов, B-лимфоцитов и дендритных клеток – один из критических моментов в противораковой устойчивости. В отличие от различной локализации T-лимфоцитов и В-лимфоцитов у большинства экспериментальных животных, такие группы клеток легко формируются в лимфатических узлах с подобной «острову» архитектурой коры, где происходит наложение зон локализации различных лимфоцитов и увеличена зона коры. Однако эти же факторы могут ускорить инактивацию T-лимфоцитов в узлах при первичном раке. Из-за уникальной архитектуры с общим синусом метастазы в парааортальном узле могут с большой вероятностью говорить о том, что рак уже стал системной болезнью. Предполагаемые клетка-клетка взаимодействия в образцах узлов с подобной «острову» архитектурой или парааортальных узлах способны ускорить системный иммунный ответ вместо того, чтобы обеспечить местный барьер. Парааортальные узлы могут быть специализированы как последние ворота лимфатического дренажа брюшных и тазовых внутренних органов [1].
Авторы задают вопрос, почему клинические патологи игнорируют корковые «промежутки» или подобную «острову» архитектуру узла? И выдвигают гипотезу, что у пациентов с раковым заболеванием в пожилом возрасте гистологическая разнородность сменяет гомогенную морфологию с многочисленными или большими вторичными фолликулами в хорошо развитой коре. В то же время,
SLN-biopsy процедура чрезвычайно важна для того, чтобы найти метастаз в узле на очень ранних стадиях рака. Раковые клетки, вероятно, будут мигрировать к узлам с возрастными архитектурными изменениями. Гистологическая разнородность может модулировать перемещение раковой клетки. Способность к связыванию антигенов, вероятно, будет различной среди множества лимфатических узлов в пределах лимфатического бассейна, и даже в ближайших узлах. Поэтому авторы делают вывод о том, что регион-специфичная модификация и коррекция необходимы для оптимизирования применения SLN-imaging (картирования), особенно для пожилых пациентов с ранней стадией рака [1]. Следовательно, использование метода идентификации «сторожевых» лимфатических узлов представляется значимым в плане изучения индивидуальных особенностей лимфооттока от различных сегментов туловища, направления которого могут отличаться. В то же время механизмы метастазирования опухоли к сторожевому лимфатическому узлу недостаточно изучены и понятны [7]. Известно, что сосудистый эндотелиальный фактор роста (VEGF)-A играет принципиальную роль в прогрессии опухоли и ангиогенезе, однако его роль в связанных с опухолью лимфангиогенезом и метастазированием неясна [8–10]. На модели трансгенных мышей с гиперэкспрессией VEGF-A (человеческий васкулоэндо-телиальный фактор роста А) было показано, что VEGF-A не только обеспечивает быстрое развитие рака кожи, но и также вызывает активное увеличение экспрессии VEGF-А, способствующему развитию лимфатических сосудов и метастазированию в сторожевой лимфатический узел и к отдаленным лимфатическим узлам. Было обнаружено, что до развития метастазирования VEGF-А индуцировал лимфангиогенез в сторожевом лимфатическом узле. Это дает основание предполагать, что первичные опухоли могут готовить будущий путь метастазирования, продуцируя факторы лимфангиогенеза, которые обеспечивают эффективный транспорт опухолевых клеток к сторожевому лимфатическому узлу. Этот механизм стимулирования лимфангиогенеза в сторожевом лимфатическом узле, способствующий метастазированию опухоли, представляет собой новую терапевтическую мишень для предотвращения метастаза [7].
Кроме того, показано, что по плотности околоопухолевых и внутриопухолевых лимфатических микрососудов можно судить о возможности метастазирования в сторожевой лимфатический узел и выживаемости пациентов [11].
Другие авторы [1] при развитии опухоли отмечали расширение синусов в регионарном лимфатическом узле. В лимфатическом узле отмечали развитие лимфатических сосудов и заселение его опухолевыми клетками. Было показано значительное увеличение транзита наночастиц через лимфоузел. Авторы полагают, что лимфангиогенез и усиление тока лимфы через дренирующий опухоль регионарный лимфатический узел может усилить метастазирование по лимфатическим канальцам [12].
Известно, что характер метастазирования зависит от иммунного статуса регионарного лимфатического узла. Показана регрессия метастазов в регионарных лимфатических узлах при лимфосаркоме WGT-4 на 10 день после инъекции опухолевых клеток в ткань бедра нормальных крыс и гибель животных в результате мощного опухолевого роста и метастазирования у иммуносупрессивных животных [13].
При изучении зависимости показателей иммуно-функционального состояния регионарного лимфатического коллектора от возраста больных установлено, что в группе пациентов старше 60 лет отмечается снижение общего количества лимфоидных клеток в лимфатическом узле, что свидетельствует о снижении регионарного противоопухолевого барьера [14].
Важную роль в иммунном ответе играет микроархитектоника лимфатического узла, которая в основном поддерживается ретикулярными клетками и внеклеточным матриксом. Хемокины, продуцируемые ретикулярными клетками, индуцируют хемотаксис и адгезию Т-клеток и дендритных клеток на поверхности ретикулярных клеток. В свою очередь, сигналы от лимфоцитов индуцируют ретикулярные клетки к образованию внеклеточного матрикса, который обеспечивает движение и взаимодействие иммунных клеток в лимфатическом узле [15]. Одним из положений теории рака является представление о перестройке стромальных компонентов, создающей более благоприятные условия для злокачественного роста [16]. Имеющиеся в литературе описания морфологических перестроек в регионарных лимфатических узлах в процессе злокачественного роста носят сходный характер и различаются по степени выраженности изменений в зависимости от вида опухоли, локализации и времени развития [16–21]. Так, при исследовании взятых интраоперационно подвздошных лимфатических узлов у больных раком шейки матки было показано, что структура 25–41% узлов сильно изменена [19]. Отмечали жировое перерождение большей части лимфоидной паренхимы и склерозирование. По мнению авторов, это было следствием выраженной антигенной стимуляции и преждевременного старения организма, наблюдаемого у онкологических больных [19]. Наблюдали большое содержание первичных и вторичных лимфоидных узелков. Среди вторичных лимфоидных узелков преобладали лимфоидные узелки с герминативными центрами III и VI – заключительных стадий развития. Паракортикальная зона, играющая ключевую роль в противоопухолевом иммунном ответе, была атрофирована и определялась в виде узкой полосы между лимфоидными узелками и мозговыми тяжами. Посткапиллярные венулы встречались редко, как правило, имели плоский эндотелий и не обнаруживали признаки активной миграции лимфоцитов через их стенку. Морфофункциональное состояние лимфатических узлов соответствовало морфологической картине иммунодефицитного состояния [19].
Результаты исследования механизмов, развивающихся в регионарном лимфатическом узле при развитии опухолевого процесса, показывают, что опухолевая ткань оказывает регулирующее действие на процессы, связанные с рекрутированием антиген-представляющих дендритных клеток [20] и наивных лимфоцитов [21]. Близость опухоли нарушает процесс адгезии лимфоцитов к поверхности эндотелия венул с высоким эндотелием и способствует уменьшению экспрессии лимфоузлом хемокина CCL21. Параллельно с этими эффектами опухоль регулирует через P-селектин-зависимый механизм вращение и адгезию циркулирующих полиморфноядерных клеток в пределах венул лимфатического узла, где обычно редко наблюдается этот процесс [21]. Отмеченные эффекты опухоли были независимы от присутствия метастаза в лимфатическом узле и имели место, пока развивалась опухоль. Имеющиеся данные свидетельствуют о том, что близость опухоли нарушает физиологию лимфатического узла, изменяя молекулярные, пространственные и клеточные механизмы, которые обычно контролируют лейкоцит – эндотелиальные взаимодействия в периферических лимфатических узлах [20, 21].
ЗАКЛЮЧЕНИЕ
-
1. У пожилых пациентов со злокачественными новообразованиями гистологическая разнородность сменяет гомогенную морфологию с многочисленными или большими вторичными фолликулами в хорошо развитой коре. Гистологическая разнородность может модулировать перемещение раковой клетки с большой вероятностью к лимфатическим узлам, имеющим возрастные архитектурные изменения.
-
2. Регион-специфичная модификация и коррекция необходимы для оптимизирования применения SLN-imaging (картирования сторожевых лимфатических узлов), особенно для пожилых пациентов с ранней стадией рака. Следовательно, использование метода идентификации сторожевых лимфатических узлов представляется значимым в плане изучения индивидуальных особенностей лимфооттока от различных сегментов туловища, направления которого могут отличаться. В то же время, SLN-biopsy (биопсия сторожевых лимфатических узлов) процедура чрезвычайно полезна для того, чтобы найти метастаз в узле на очень ранних стадиях рака.
-
3. До развития метастазирования VEGF-А (человеческий васкулоэндотелиальный фактор роста А) индуцирует лимфангиогенез в сторожевом лимфатическом узле, что дает основание предполагать, что первичные опухоли могут готовить будущий путь метастазирования, продуцируя факторы лимфангиогенеза, которые обеспечивают эффективный транспорт опухолевых клеток к сторожевому лимфатическому узлу. Этот механизм стимулирования лимфангиогенеза в сторожевом лимфатическом узле, способствующий метастазированию опухоли, представляет собой новую терапевтическую мишень для предотвращения метастаза.
-
4. При развитии опухоли отмечается расширение синусов в регионарном лимфатическом узле, где отмечается значительное увеличение транзита наночастиц через лимфатический узел. Лимфангиогенез и усиление тока лимфы через дренирующий опухоль регионарный лимфатический узел может усилить метастазирование по лимфатическим канальцам.
-
5. При изучении зависимости показателей иммунофунк-ционального состояния регионарного лимфатического коллектора от возраста больных установлено, что в группе пациентов старше 60 лет отмечается снижение общего количества лимфоидных клеток в лимфатическом узле, что свидетельствует о снижении регионарного противоопухолевого барьера.
-
6. Описания морфологических перестроек в регионарных лимфатических узлах в процессе злокачественного роста носят сходный характер и различаются по степени выраженности изменений в зависимости от вида опухоли, локализации и времени развития. Отмечается жировое перерождение большей части лимфоидной паренхимы и склерозирование, что является следствием выраженной антигенной стимуляции и преждевременного старения организма, наблюдаемого у онкологических больных, а морфофункциональное состояние лимфатических узлов может соответствовать морфологической картине иммунодефицитного состояния.
Список литературы Биологическая концептуализация сторожевого лимфатического узла (литературный обзор)
- Murakami G., Izumi Taniguchi I. Histologic Heterogeneity and Intranodal Shunt Flow in Lymph Nodes from Elderly Subjects: A Cadaveric Study//Annals of Surgical Oncology. 2004.-Vol.11.-P. 279S-284.
- Cochran A. J., Roberts A., Wen D.-R., Huang R.-R., Itakura E., Luo F., Binder S. W. Optimized Assessment of Sentinel Lymph Nodes for Metastatic Melanoma: Implications for Regional Surgery and Overall Treatment Planning.//Annals of Surgical Oncology. 2004.-Vol.11.-P. 156S-161.
- Bourgeois P. Effect of age and lateralization on lymphoscintigraphic interpretation//Nuclear Med Comm 2002; 23: 257-60.
- Hoshi H., Horie K., Tanaka K., et al. Patterns of age-dependent changes in the numbers of lymph follicles and germinal centers in somatic and mesenteric lymph nodes in growing C57B1/6 mice. J Anat 2000; 198: 189-205.
- Fisher B., Fisher E. R. Barrier function of lymph node to tumor cells and erythrocytes//I. Normal nodes. Cancer.-1967.-20.-С. 1907-1913.
- Sainte-Marie G., Peng F. S., Bélisle C. Overall architecture and pattern of lymph flow in the rat lymph node. Am J Anat 1982; 164: 275-309.
- Hirakawa S., Kodama Sh., Kunstfeld R., Kajiya K., Brown L. F., Detmar M. VEGF-A induces tumor and sentinel lymph node lymphangiogenesis and promotes lymphatic metastasis.//JEM. 2005.-Vol. 201.-N. 7.-P. 1089-1099.
- Mylona E., Alexandrou P., Mpakali A. et al. Clinicopathological and prognostic significance of vascular endothelial growth factors (VEGF)-C and -D and VEGF receptor 3 in invasive breast Carcinoma//European Journal of Surgical Oncology.-2007.-V. 33.-N3.-P. 294-300.
- Warburton G., Nikitakis N. G., Roberson P. et al. Histopathological and Lymphangiogenic Parameters in Relation to Lymph Node Metastasis in Early Stage Oral Squamous Cell Carcinoma//Journal of Oral and Maxillofacial Surgery. 2007.-V. 65.-N3.-P. 475-484.
- Van der Auwera I., Cao Y., Tille J. C. et al. First international consensus on the methodology of lymphangiogenesis quantification in solid human tumours.//Br J Cancer. 2006.-N2.-P. 1425-1429.
- Massi D., S. Puig, A. Franchi, J. Malvehy, S. Vidal-Sicart, M. Gonzalez-Cao, G. Baroni, S. Ketabchi, J. Palou and M. Santucci. Tumour lymphangiogenesis is a possible predictor of sentinel lymph node status in cutaneous melanoma: a case-control study.//Journal of Clinical Pathology 2006;59:166-173.
- Harrel M. I., Iritani B. M., Ruddell A. Tumor-induced sentinel lymph node lymphangiogenesis and increased lymph flow precede melanoma metastasis//Am. J. Pathol.-2007.-vol. 170.-N2.-P. 774-786.
- Серов А. А. Оценка иммуногистологического состояния лимфатических узлов, регионарных к опухоли//Бюллетень эксперим. биол. мед.-1980.-№ 2.-С. 196-197.
- Katakai1 T., Hara1 T., Sugai1 M. et al. Lymph Node Fibroblastic Reticular Cells Construct the Stromal Reticulum via Contact with Lymphocytes//JEM.-2004.-Vol.-200.-N6.-P. 783-795.
- Имянитов Е. Н., Хансон Х. П. Фундаментальная онкология: наиболее примечательные события 2004 года//Практическая онкология.-2005.-Т. 6.-№. 1.-С. 1-5.
- Асташов В. В., Афанасьева О. Г., Марханова И. В. Морфофункциональные изменения регионарных лимфатических узлов при моделировании опухолевого процесса//Проблемы экспериментальной, клинической и профилактической лимфологии: Материалы международного симпозиума.-Новосибирск, 2000.-С. 19-21.
- Исакова Н. Б. Морфо-функциональные преобразования паховых лимфатических узлов, регионарных злокачественному росту, а также ткани опухоли в условиях энтерального введения биофлавоноидов Красного корня//Проблемы саногенных и патогенных эффектов экологических воздействий на внутреннюю среду организма: Материалы международной конференции. Бишкек, 2001.-С. 42-44.
- Красильников С. Э., Бабаянц Е. В., Тархов А. В., Герасимов А. В. Дюрягина О. Ю. Морфологические изменения в регионарных лимфатических узлах у больных раком шейки матки после введения ридостина//Проблемы лимфологии и интерстициального переноса. Труды ГУ НИИ КиЭЛ СО РАМН.-Новосибирск, 2004.-т. 10.-Ч. 1.-С. 209-210.
- Vuylsteke R. J. C. L. M., Molenkamp B. G., Gietema H. A., van Leeuwen P. A.M., Wijnands P. G.J.T.B., Vos W., van Diest P. J., Scheper R. J., Sybren Meijer S., de Gruijl T. D. Local Administration of Granulocyte/Macrophage Colony-stimulating Factor Increases the Number and Activation State of Dendritic Cells in the Sentinel Lymph Node of Early-Stage Melanoma.//Cancer Research.2004.-Vol. 64.-P. 8456-8460.
- Carrière V., Colisson R., Jiguet-JiglaireC., Bellard E., Bouche G., Saati T. A., Amalric F., Girard J.-Ph., M'Rini Ch. Cancer Cells Regulate Lymphocyte Recruitment and Leukocyte-Endothelium Interactions in the Tumor-Draining Lymph Node.//Cancer Research. 2005.-Vol.65.-P. 11639-11648.


