Биологическая трансформация белого фосфора стрептомицетами и грибами
Автор: Миндубаев А.З., Волошина А.Д., Кулик Н.В., Сапармырадов К.А., Минзанова С.Т., Миронова Л.Г., Хаяров Х.Р., Бадеева Е.К.
Журнал: Антропогенная трансформация природной среды @atps-psu
Рубрика: Восстановление природной среды и рациональное природопользование
Статья в выпуске: 4, 2018 года.
Бесплатный доступ
Впервые произведены посевы микроорганизмов различных таксономических групп в синтетические культуральные среды, содержащие белый фосфор в качестве единственного источника фосфора. Проведен поиск метаболитов белого фосфора. Самая высокая концентрация соответствует превышению ПДК белого фосфора в сточных водах в 5000 раз!
Биодеградация, детоксикация, белый фосфор, культуральные среды, селекция
Короткий адрес: https://sciup.org/147226863
IDR: 147226863 | УДК: 579.695;
Текст научной статьи Биологическая трансформация белого фосфора стрептомицетами и грибами
Биодеградация становится одним из наиболее популярных и часто применяемых на практике методов обезвреживания промышленных стоков, обогащенных неприродными веществами самых разнообразных классов, зачастую очень токсичных [1]. Главное преимущество биодеградации, по сравнению с многочисленными иными методами обезвреживания стоков, заключается в том, что при ее использовании в окружающую среду' не вносятся новые химические загрязняющие агенты.
Целью проведенного нами исследования являлась переработка при помощи микроорганизмов белого фосфора - одного из самых опасных веществ, применяемых в крупнотоннажном химическом производстве. В литературных источниках не найдено сведений о доказанных примерах биологической деградации белого фосфора. Предыдущие работы нашего коллектива [2. 3] позволили пролить свет на практически неизученный вопрос токсичности белого фосфора для прокариот. Нами впервые произведен посев устойчивой микрофлоры в искусственную культуральную среду, содержащую в качестве единственного источника фосфора белый фосфор, и наблюдался рост в этой среде. То есть наблюдалось включение белого фосфора в природный круговорот этого элемента. Кроме того, наблюдалась адаптация микроорганизмов к возрастающим концентрациям белого фосфора в средах.
Посевы производились в модифицированную среду Придхем-Готлиба. Классическая среда Придхем-Готлиба не содержит источники углерода: в качестве таковых выступают нефтепродукты. Наша модификация включает глюкозу, но не содержит источники фосфора (в качестве такового выступает белый фосфор). Посев Aspergillus niger, споры которого были внесены вместе с белым фосфором, производили в среду', содержащую белый фосфор в концентрации 0.01 и 0.05% по массе. В контрольные среды К (+) вносился фосфат. В контрольные среды К (-) источники фосфора не вносились. Произвели посев выросших A. niger в контрольные среды К (+) и К (-). Второй пересев A. niger произведен в среды аналогичного состава, третий - в среды с увеличенной концентрацией белого фосфора: 0.05, 0.1 и 0.2% по массе. Аналогично был произведен посев Streptomyces sp. А8. Четвертый пересев проводился в среды с концентрацией белого фосфора 0.1, 0.5 и 1 % по массе. В этом посеве, помимо аспергилла и стрептомицета, высевался гриб Trichoderma asperellum F-1087, любезно предоставленный кафедрой биохимии ИФМиБ КФУ Посев проводился в среды с концентрацией белого фосфора: 0.05, 0.1 и
0.2% по массе. Пересев S sp. был произведен через 28 суток (одновременно с четвертым посевом аспергилла) в среды с концентрацией белого фосфора: 0.5, и 1% по массе. Пятый и шестой пересевы были произведены в среды с теми же самыми концентрациями Р4 Одновременно с шестым пересевом был произведен третий пересев S sp. А8. Посев проводился в среды с концентрацией белого фосфора 0.2 %, а также 0.5% по массе, при которой стрептомицет ранее не рос. Также, одновременно с ними, был произведен третий пересев Trichoderma asperellum F-1087. Тем не менее, аспергилл был также посеян в среду' с 1% белого фосфора, на которой ранее не рос. Седьмой пересев A. niger был произведен в среды с теми же самыми концентрациями Р4. что и в предыдущем. Одновременно был произведен четвертый пересев S. sp. А8. Посев проводился в среды с концентрацией белого фосфора 0.5 % по массе, а также 1% по массе, при которой стрептомицет ранее не рос. Также, одновременно с ними, был произведен четвертый пересев L asperellum F-1087.
В посеве с Aspergillus niger на следующие сутки отмечалось образование черного осадка, предположительно, фосфвдов, который на пятые сутки полностью исчез. Следует учесть, что среда Придхем-Готлиба богата ионами переходных металлов, в присутствии которых белый фосфор неустойчив и легко диспропорционирует до нерастворимых фосфвдов и водорастворимых солей кислородсодержащих кислот фосфора [4]. По всей видимости, споры плесневого гриба попали в среды с навесками белого фосфора: перед внесением в среды он не подвергался стерилизации в автоклаве при 120 °C по причине высокого риска работы с этим веществом, особенно при нагреве. В средах с 0.01% белого фосфора выросло множество мелких колоний A. niger. а в средах с 0.05% - меньшее число колоний, но более крупных. По всей видимости, это означает, что в среде с большей концентрацией ксенобиотика не все споры смогли прорасти.
На пятые сутки пересеяли культуру A. niger, выросшую при 0.05% белого фосфора, в контрольные среды К (+) и К (-). Через шесть суток после посева наблюдалась следующая картина. В среде К (+) с фосфатом выросло значительное число сравнительно мелких колоний: это означает, что большинство спор проросло, что естественно в благоприятных условиях. В среде К (-) без источников фосфора колонии выросли немногочисленные, занимающие сравнительно большую площадь, но очень слабые (практически прозрачные, с неразвитым мицелием и отдельными конидиеносцами, выглядящими, как россыпь черных точек, а не сплошное черное поле). По всей видимости, сказалась нехватка фосфора: агар, используемый для приготовления среды, содержит примесь фосфата, но недостаточную для полноценного роста грибов (рис. 1). Известно, что растения и мкроорганизмы в природных условиях часто испытывают фосфорное голодание, и вырабатывают к нему ряд адаптаций. Причем, согласно [5|. микроорганизмы выдерживают более жесткий дефицит фосфора, что и наблюдалось нами. Любопытно, что в среде с 0.05% белого фосфора колоний выросло меньше, чем в К(+). однако они производят впечатление совершенно нормальных, не испытывающих дефицит питательных веществ. Отсюда следует вывод, что в среде с белым фосфором выживают не все споры гриба, но выжившие обладают способностью использовать в качестве источника фосфора либо сам белый фосфор, либо продукты его химических превращений. Значительный размер колоний, выросших в присутствии Р4, объясняется менее жесткой конкуренцией между немногими адаптировавшимися культурами.
После второго пересева, произведенного через 63 дня после первого посева, наблюдается интенсивный рост аспергилла в среде, содержащей 0.01 и 0.05% белого фосфора. Судя по всему, среда с 0.01% белого фосфора более благоприятна для роста грибов: на четвертый день после посева колонии уже приобрели характерную черную окраску, свидетельствующую о спороношении. В среде с 0.05% Р4 колонии на четвертый день еще только приступают к размножению и имеют светлую окраску. Поскольку черный цвет.4. niger придают споры, светлая окраска свидетельствует о пониженной фертильности плесневого гриба. растущего при высокой концентрации Р4, _________
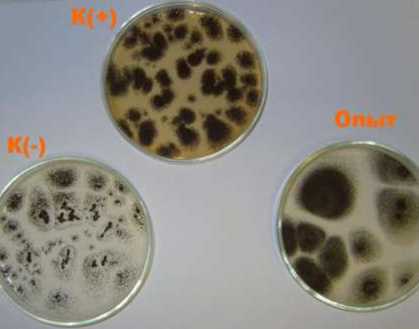
Рисунок 1. Первый пересев устойчивых грибов .4. niger. К(+) - среда с фосфатом: наблюдался рост
49 спорообразующих колоний .4. niger. К(-) -среда без источника фосфора: на ней наблюдался рост
33 ослабленных колоний. Опыт - среда с 0.05% белого фосфора: наблюдался рост 11 кру пных спорообразующих колоний .4. niger. Чашки сфотографированы через шесть суток после пересева.
Очередной (третий) пересев на 84 день после первого посева, был произведен в среды с более высокой концентрацией белого фосфора, с целью адаптации гриба к ней. Были выбраны концентрации 0.05. 0.1 и 0.2% Р4. Последняя, самая высокая, концентрация ранее нами никогда не использовалась. Согласно [6], она соответствует тысячекратному' превышению ПДК белого фосфора в сточных водах! Тем не менее, даже при столь высоком содержании белого фосфора в среде наблюдался интенсивный рост колоний гриба. На четвертый день после посева при всех трех концентрациях белого фосфора наблюдалось начало спороношения. но при 0.1 и 0.2% Р4 грибы отставали в развитии по сравнению с 0.05%. Возможно, использованные концентрации исследуемого токсиканта отрицательно сказываются на фертильности грибов, хотя полностью не подавляют ее. Тем не менее, результаты посев;! позволяют заключить, что черный аспергилл легко переносит присутствие белого фосфора в среде даже в концентрации 0.2%.
Четвертый пересев аспергилла (и второй стрептомицстов) был произведен через 112 суток после первого посева. Концентрацию белого фосфора в среде снова увеличили до 0.5 и 1% по массе. При внесении столь большого количества Р4 густой черный осадок в средах выпадает моментально. Среды издают сильный специфический запах белого фосфора даже спустя несколько суток после посева. Через сутки рост посеянных микроорганизмов еще не наблюдался. Через четверо суток в среде с содержанием белого фосфора 0.5% наблюдался рост мелких колоний аспергилла. имеющих еще белый цвет (то есть рост сильно замедлен). В средах с 1% белого фосфора через четверо суток после посева рост не наблюдался. По-видимому. выпавший черный осадок фосфидов перевел в нерастворимую форму микроэлементы. присутствующие в среде и необходимые для роста микроорганизмов. Следует отметить, что по [6]. концентрация белого фосфора 0.5% соответствует 2500 ПДК! Кроме того, был посеян гриб Trichoderma asperellum F-1087 при концентрации 0.1. 0.5 и 1 %. Через четверо суток в среде с самой малой концентрацией выросла одна крупная колония триходермы. т.е. данный гриб тоже способен усваивать белый фосфор. Грибы развиваются очень медленно. По-видимому, данные концентрации белого фосфора близки к предельным, при которых еще возможен рост грибов. Рост стрептомицстов при 0.5% не наблюдается и спустя 19 суток после посева. На восьмые сутки на поверхности колоний аспергилла наблюдается россыпь спор. т е. гриб сохранил способность к размножению! На восьмые же сутки наблюдается рост колонии триходермы на белом фосфоре в концентрации 0.5%. В средах с 1% Р4 рост триходермы стал наблюдаться только на 11 сутки после посев;!. В случае триходермы прослеживается четкая зависимость: чем выше концентрация белого фосфора в субстрате, тем медленнее растет гриб. На 12 сутки после посева при 0.1% белого ((юсфора гриб уже сформировал воздушный мицелий и имеет розовую окраску, при 0.5% колония еще бесцветная, но уже всплыла на поверхность субстрата и имеет форму, близкую к правильному кругу, а при 1% колония состоит из субстратного мицелия.
Триходерма Т asperellum F-1087 проявила большую устойчивость к белому' фосфору, чем Л. niger и тем более стрептомицеты. На восемнадцатые сутки после посева приобрела окраску и начала спороносить триходерма при 0.5% белого фосфора. Следует особо подчеркнуть, что триходерма адаптировалась к таким высоким концентрациям белого фосфора сразу, без предварительного культивирования с рядом пересевов. Ранее данный штамм гриба никогда нс выращивался в присутствии белого фосфора. Напомним о том. что концентрация белого фосфора 1% это превышение ПДК в сточных водах в 5000 раз!
Третий пересев Streptomyces sp. впервые продемонстрировал рост устойчивости микроорганизмов к белому фосфору в процессе селекции. На 22 сутки после посева наблюдался рост стрептомицета в среде, содержащей 0.5% белого фосфора! В предыдущих посевах S. sp. рос при концентрациях не более 0.2. Разумеется, рост начался после длительной задержки. Даже на 20 сутки после посева признаки роста были неочевидными. На 22 сутки стрептомицет представлял собой субстратный мицелий.
На 27 сутки после шестого посева Д. niger наблюдается начало роста гриба в среде с 1% белого фосфора. В предыдущих посевах максимальная концентрация белого фосфора, при которой рос
О
-
р. __________„ II „ р
н
Фосфпн
Фосфпнокспд аспергилл. составляла 0.5%. То есть. Л. niger, как и стрептомицет. после нескольких пересевов выработал значительно большую устойчивость по сравнению с изначальной. Итак, наилучшую приспособляемость к белому фосфору проявили именно стрептомицеты. Через пять последовательных посевов их устойчивость возросла пятикратно. Грибы растут и адаптируются медленнее (у аспергилла после восьми посевов устойчивость выросла вдвое), однако их устойчивость изначально была выше, чем у актиномицетов. особенно у триходермы [71.
В опытном спектре !Р ЯМР. снятом с водной фазы, проявились сигналы в области 0.3, 3.7 и 6.2 ppm. соответствующие фосфиту и гипофосфиту'. Таким образом, он соответствует соединениям, которые, предположительно, являются метаболитами белого фосфора, т.е.. является подтверждением предполагаемого нами метаболического пути. Спектр. снятый с контрольного образца одновременно с опытным, на том же приборе и в тех же условиях, не содержит аналогичные сигналы [8]. Эго слу жит доказательством того, что обнару женные соединения действительно являются метаболитами белого фосфора. Ниже мы приводим предполагаемую схему метаболизма белого фосфора (рис. 2). Разумеется, она достаточно упрощена. Нам еще ничего не известно о задействованных в метаболизме элементного фосфора ферментных системах, поэтому они не указаны. Со временем, без сомнения, схема будет дополняться.
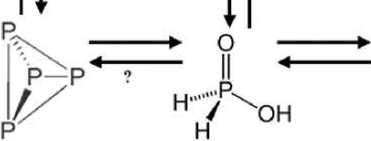
Белый фосфор
Фосфорноватпстая кислота
О
н-ргон
ОН
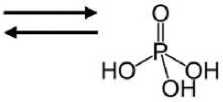
Фосфорная кислота
Фосфористая кислота
Рисунок 2. Предполагаемый метаболический путь белого фосфора (знаком вопроса обозначены еще не обнаруженные превращения).
Поскольку' в литературе отсутствуют сведения о микроорганизмах, устойчивых к Р4, представленная работа имеет бесспорну ю новизну.
Список литературы Биологическая трансформация белого фосфора стрептомицетами и грибами
- Миндубаев А.З. Кто съел полиэтилен? // Наука и жизнь. 2018. № 4. С. 32-38.
- Миндубаев А.З., Волошина А.Д., Бабынин Э.В., Бадеева Е.К., Хаяров Х.Р., Минзанова С.Т., Яхваров Д.Г. Микробиологическая деградация белого фосфора // Экология и промышленность России. 2018. Т. 22. № 1. С. 33-37.
- Миндубаев А.З., Волошина А.Д., Валидов Ш.З., Яхваров Д.Г. Биодеградация белого фосфора // Природа. 2017. №5. С. 29-43.
- Prabusankar G., Doddi A., Gemel C., Winter M., Fischer R.A. P-P Bond Activation of P4 Tetrahedron by Group 13 Carbenoid and its Bis Molybdenum Pentacarbonyl Adduct // Inorg. Chem. 2010. Vol.49. No 17 P.7976-7980.
- Kulakovskaya T. Phosphorus storage in Microorganisms: Diversity and Evolutionary Insight. Biochem Physiol. 2015. Vol. 4. No 1. e130. P. 1-4.
- Barber J.C. Processes for the disposal and recovery of phossy water // Патент US5549878, заявлен: 24 мая 1995, выдан: 27 августа 1996.
- Миндубаев А.З., Волошина А.Д., Горбачук Е.В., Кулик Н.В., Алимова Ф.К., Минзанова С.Т., Миронова Л.Г., Сапармырадов К.А., Хаяров Х.Р., Яхваров Д.Г. Включение белого фосфора в природный круговорот веществ. Культивирование устойчивой микрофлоры // Бутлеровские сообщения. 2015. Т. 41. №3. С. 54-81.
- Миндубаев А.З., Волошина А.Д., Бабынин Э.В., Валидов Ш.З., Сапармырадов К.А., Хаяров Х.Р., Бадеева Е.К., Барсукова Т.А., Минзанова С.Т., Миронова Л.Г., Акосах Й.А., Яхваров Д.Г. Обезвреживание белого фосфора посредством микробиологического разложения // Бутлеровские сообщения. 2017. Т. 52, № 12. С. 87-118.