Биологически активные вещества белковой природы с антифунгальным и ростстимулирующим эффектами, выделенные из чеснока посевного (Allium sativum L.)
Автор: Куликова О.Г., Мальцев Д.И., Карташов М.И., Ильина А.П., Ямскова В.П., Ямсков И.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоактивные природные соединения
Статья в выпуске: 5 т.51, 2016 года.
Бесплатный доступ
Биологически активные вещества, которыми богат чеснок посевной ( Allium sativum L., семейство Амариллисовые, подсемейство Луковые), получают как из его листьев, так и из луковицы. Вещества, выделенные из чеснока посевного, преимущественно используются для лечения различного рода заболеваний человека, но мало что известно о применении настоев и отваров этого растения для борьбы с фитопатогенами. В настоящее время созданию эффективных средств защиты сельскохозяйственных культур от болезней на основе природных биологически активных соединений отдается предпочтение. В представленной работе из луковицы чеснока посевного A. sativum L. (сорт Подмосковный) были выделены два вещества белковой природы - описанный в литературе лектин-аллиназный комплекс (ЛАК), состоящий из фермента аллиназы (молекулярная масса 54 кДа) и маннозоспецифичного лектина чеснока (ASA - A. sativum allinase) (молекулярная масса 6,4 кДа), который образуется при повреждении клеток тканей луковицы растения, и не описанный ранее пептид с молекулярной массой 4392 Да (П 4392 Да), который был получен впервые. В доступной литературе мы не обнаружили каких-либо сведений о биологической активности этих веществ. При изучении влияния ЛАК на жизнеспособность возбудителя пирикуляриоза риса (гриб Magnaporthe grisea ) было показано, что этот комплекс защищает растения риса от пирикуляриоза (доля незараженных листьев увеличилась с 15 % в контроле до 75 % в опыте). В то же время ЛАК не подавлял прорастание спор у M. grisea (прорастание спор как в контроле, так и в опыте - 80-90 %). Таким образом, протекторное действие ЛАК может быть обусловлено активацией защитных реакций растения. Испытывая П 4392 Да в концентрации, соответствующей 10-11 мг/мл, против другого грибного патогена - возбудителя гельминтоспориоза Вipolaris sorokiniana на листьях пшеницы и ячменя, мы наблюдали ингибирование развития болезни. Поскольку при этом пептид не подавлял рост колоний B. sorokiniana, можно предположить, что П 4392 Да тоже способен активировать защитные функции у зараженного фитопатогеном растения. При оценке влияния пептида из чеснока посевного на семена и стимуляцию роста у ряда сельскохозяйственных культур (горох, огурец, горчица, подсолнечник и чеснок) было показано увеличение всхожести семян (на 13,6 % при р
Чеснок посевной, лектин, аллиназа, пирикуляриоз, рис, пептид, гельминтоспориоз, стимуляция роста
Короткий адрес: https://sciup.org/142213974
IDR: 142213974 | УДК: 632.4:632.938.1:57.053:577.19:635.262 | DOI: 10.15389/agrobiology.2016.5.705rus
Текст научной статьи Биологически активные вещества белковой природы с антифунгальным и ростстимулирующим эффектами, выделенные из чеснока посевного (Allium sativum L.)
Среди средств защиты растений от грибных болезней преобладающими остаются химические. Они эффективны, но имеют ряд недостатков, к которым относится нарушение биологического равновесия, накопление остаточных количеств химикатов в сельскохозяйственной продукции, прогрессирующая устойчивость к ним у патогенных организмов, высокая стоимость фунгицидов и катастрофическое загрязнение окружающей среды (13, 14). Несмотря на появление на рынке новых химических фунгицидов, общая ситуация по проблеме защиты растений от болезней и увеличения 705
урожайности принципиально не меняется. Распространение таких опасных инфекций, как корневые гнили, мучнистая и ложномучнистая роса огурца, фузариозы и ржавчина зерновых культур, фитофтороз картофеля, бактериозы овощных и плодовых культур часто имеет эпифитотийный характер и приводит к чрезвычайно высоким потерям урожая и снижению его качества. В последние годы возрастает интерес к препаратам на основе микроорганизмов-антагонистов, повышающих устойчивость к стрессорам, а также к белкам и низкомолекулярным соединениям, проявляющим биологическую активность. Считается, что эти средства лучше вписываются в интегрированные системы защиты растений: они эффективны, селективны и сравнительно безопасны для природы и человека (15, 16).
На сегодняшний день спектр препаратов, способных ингибировать развитие болезней у растений, сохраняя или повышая урожайность, достаточно широк. Однако б о льшая их часть представлена синтетическими соединениями. К ним относятся производные тетрагидрофурана, тиазолил-5-карбонамида, композиция 2-(5-фенил-3,6-диаза-2,7-диоксаокта-3,5-дифе-нил)фенилакриламида и анилинопиримидина (17-19).
Фермент аллиназа, выявленный у чеснока, катализирует образование аллицина — биологически активного соединения, ответственного за характерный чесночный запах. Аллиназа, содержащая 5,5-6,0 % остатков нейтральных сахаров, может формировать комплекс с маннозоспецифичным лектином чеснока (ASA — A . sativum allinase). Однако пока что изучен только способ образования и условия существования этого комплекса (20, 21). Данные об его действии на живые системы отсутствуют.
Мы впервые показали наличие биологической активности (подавление развития пирикуляриоза и гельминтоспориоза у зерновых культур, стимулирование прорастания семян и развития проростков чеснока) у лектин-аллиназного комплекса, а также у выделенного нами пептида с молекулярной массой 4392 Да, которые содержатся в чесноке.
Цель работы — выделение веществ пептидной природы из чеснока посевного и оценка их антифунгального и ростстимулирующего эффекта.
Методика . Очищенные луковицы (3 кг) чеснока посевного ( Allium sativum L.) сорта Подмосковный измельчали на фрагменты размером 1½1 см, заливали 10 л водно-солевого раствора (2,06^10 — 2 М NH 4 NO 3 , 1,88x10 — 2 М KNO 3 , 3,0x10 — 3 М CaCl2, 1,5x10 — 3 М MgSO 4 , 1,25 x10 - 3 М KH 2 PO 4 ) и выдерживали в холодильнике 4-5 ч при 4 °С. К полученному таким образом экстракту после центрифугирования (3000 g, 30 мин) при постоянном перемешивании добавляли кристаллический сернокислый аммоний до получения насыщенного раствора (780 г/л) для осаждения (высаливания) белков (22). Смесь инкубировали в течение 20 сут при 4 °С. После 30-минутного центрифугирования при 10000 g для удаления солей осадок диализовали при 4 °С против 0,05 М фосфатного буфера (соотношение объемов диализуемой фракции и буфера — 1:50), супернатант — против воды.
Обессоленный белковый осадок растворяли в минимальном объеме 0,05 М фосфатного буфера и фракционировали с помощью высокоэффективной гель-проникающей хроматографии на колонке Bio-Sil TSK-125 300 ½7,5 мм («Bio-Rad Laboratories», США) с использованием хроматографа высокого давления Agilent 1200 («Agilent Technologies», США). Элюцию осуществляли 0,05 М фосфатным буфером со скоростью 0,5 мл/мин в течение 12 мин. Детекцию проводили при X = 280 нм. Собирали фракцию, выходящую с колонки первой, поскольку именно она содержала наиболее высокомолекулярные белки. Полученную фракцию анализировали электрофо-ретически в 12,5 % полиакриламидном геле с добавлением SDS. По ре-706
зультатам анализа наблюдали наличие двух окрашенных полос в геле, соответствующих молекулярным массам 6400 и 54000 Да. Затем для этих полос проводили триптический гидролиз белка с последующим MALDI-TOF масс-спектрометрическим анализом (UltraFlex 2 «Bruker Daltonic GmbH», Германия). Идентификацию полученных белков осуществляли при помощи баз данных SWISS PROT и NCBI. Последовательными 10-кратными разведениями водой концентрацию лектин-аллиназного комплекса (ЛАК) доводили до 10-11 мг/мл (по белку), что соответствует среднему значению диапазона сверхмалых концентраций (10-8-10-15 мг/мл); полученный таким образом препарат использовали в экспериментах.
Обессоленный супернатант концентрировали при 36-40 °С и разделяли на фракции с помощью обращенно-фазовой высокоэффективной хроматографии (ВЭЖХ) на гидрофобной колонке Kromasil С18 (Россия) (4,6½250 мм) с использованием хроматографа высокого давления Agilent 1200. Элюцию осуществляли в градиенте концентраций ацетонитрила (296 %) в 0,1 % водном растворе трифторуксусной кислоты (pH 2,2) со скоростью 1 мл/мин в течение 60 мин. Детекцию проводили при X = 214 нм. Полученные ВЭЖХ-фракции анализировали методом масс-спектрометрии на времяпролетном масс-анализаторе UltraFlex 2 («Bruker Daltonic GmbH», Германия) с использованием а-циано-4-гидроксикоричной кислоты в качестве матрицы. Среди ВЭЖХ-фракций, в большинстве которых пептид 4392 Да (П 4392 Да) был основным компонентом, для дальнейшей работы отбирали фракцию объемом 1 мл с пиком концентрации 40 мкг/мл (по белку). Полученный пептид последовательными 10-кратными разведениями водой доводили до концентрации 10-11 мг/мл (по белку).
Возбудители пирикуляриоза риса Magnaporthe grisea (штамм H5-3, раса 007 с генами вирулентности Av-ks+ , Av-a+ , Av-i+ ) и гельминтоспориоза пшеницы и ячменя Вipolaris sorokiniana (штамм Тул-12-1-3) были получены из Государственной коллекции фитопатогенных микроорганизмов Всероссийского НИИ фитопатологии. M. grisea выращивали на агаризованной морковной среде 7-10 сут при 24 °С, после чего в ламинарном боксе готовили смыв спор (конидий) (40-50 мл стерильной дистиллированной воды — СДВ, 2-4 чашки Петри). Суспензию концентрировали центрифугированием (10 мин, 8000 об/мин), определяли плотность подсчетом в камере Горяева и при необходимости разбавляли до 105/мл. В. sorokiniana выращивали на картофельно-глюкозном агаре (КГА) 10-12 сут при температуре 24 °С. В ламинарном боксе в чашки с патогеном наливали по 10-15 мл СДВ и микробиологической петлей сбивали споры с воздушного мицелия. Споровую суспензию фильтровали через стерильный ватный фильтр и разводили СДВ до плотности 103 и 105 спор/мл.
Влияние ЛАК на развитие пирикуляриоза риса оценивали в вегетационном опыте с растениями восприимчивого сорта риса ( Oryza sativa L.) Sha-tiao-tsao (содержит гены полной устойчивости Pi-ks ). Активность П 4392 Да при гельминтоспориозе пшеницы и ячменя определяли в биотесте с растениями пшеницы сорта Лада и ячменя сорта Зазерский 85. Ростстимулирующий эффект П 4392 Да изучали на следующих культурах: огурец сорта Феникс, горох сорта Сахарный, горчица сорта Радуга, подсолнечник сорта Мастер, чеснок сорта Подмосковный.
При определении активности лектин-аллиназного комплекса (ЛАК) против M. grisea в лунки 96-луночного планшета Cellstar ( « Greiner Bio-One » , Германия) для культур тканей помещали по 45 мкл СДВ или ЛАК и 5 мкл споровой суспензии (105 спор/мл). Образцы инкубировали 24 ч в темноте при 23 °С. В пяти выборках из 100 спор подсчитывали долю проросших.
Определяли среднее по трем опытам. Достоверность различий оценивали по t -критерию Стьюдента. Результаты документировали, используя инвертированный микроскоп Leitz Diavert ( « Leica Microsystems GmbH » , Германия).
В вегетационном опыте по оценке влияния ЛАК на развитие пи-рикуляриоза у риса 2-3-суточные проростки высаживали в пластиковые сосуды с нестерильным универсальным питательным грунтом марки «Садовая земля» (объем 0,5 л) и выращивали в теплице 21-24 сут при 18-часовом световом дне, температуре 22/30 °С (ночь/день) и хорошем увлажнении. По достижении стадии 3-го листа растения опрыскивали ЛАК (10-11 мг/мл по белку; контроль — дистиллированная вода) в количестве 0,5 мл на сосуд и оставляли в тех же условиях. В опыте и контроле использовали по 3 сосуда (по 8 растений в каждом). Через 7 сут после обработки, когда появлялся 4-й лист, его помещали средней частью (длиной 6 см) в инокуляционную камеру. Суспензию спор M. grisea (105/мл; три капли по 20 мкл каждая) наносили на лист с помощью капледержателей (23). Растения выдерживали 22-24 ч в темноте при 23 °С в термостате, затем снимали капледержатели и инокуляционные камеры и возвращали в теплицу. Через 7 сут после инокуляции оценивали симптомы визуально и сканировали листья, используя планшетный сканер Epson Perfection 3200 Photo («EPSON», Япония). Тип реакции растений определяли по 5-балльной шкале F.M. Laterell (24): отсутствие пятен или слабые некрозы — 0, бурые точечные пятна — 1, бурые пятна диаметром 0,5-1 мм с неровными краями — 2, ромбовидные пятна длиной 2-3 мм с коричневым центром — 3, большие ромбовидные серокоричневые пятна со спороношением в центре — 4, распространение токсического эффекта на все растение — 5. Подсчитывали долю (%) капель инокулюма, образовавших совместимые (балл 4, признак восприимчивости) и несовместимые инфекционные пятна (баллы 1-3, признак устойчивости) или не вызвавших симптомов (балл 0, признак устойчивости) (25).
Действие пептида П 4392 Да на В. sorokiniana изучали методом диффузии в агаре (26). По 100 мкл споровой суспензии (103/мл) помещали в чашки Петри с картофельно-глюкозным агаром (КГА) и стеклянным шпателем растирали по всей поверхности. В агаре делали три лунки диаметром 8 мм, в которые вносили по 100 мкл раствора пептида (10-11 мг/мл; контроль — 100 мкл СДВ), и инкубировали в термостате при 26 °С. На 3-и сут измеряли диаметр зон задержки роста. Опыт проводили дважды в 3-кратной повторности. Развитие гельминтоспориозной инфекции при обработке пептидом П 4392 определяли в биотесте по модифицированной методике (26, 27). Отрезки первых полностью развернувшихся листьев пшеницы и ячменя длиной 5-6 см помещали на 1 % агар с бензимидазолом (8-10 шт. на чашку Петри, по 3 чашки в опыте и контроле). На одну половину отрезков наносили по 10 мкл суспензии спор B. sorokiniana в растворе П 4392 Да (концентрация протеина 10-11 мг/мл, плотность полученной споровой суспензии — 105/мл), на другую — по 10 мкл водной суспензии спор той же плотности (контроль). Результаты учитывали через 7 сут после заражения по числу типичных пятен.
При оценке влияние пептида П 4392 (10-11 мг/мл) на всхожесть семян и стимуляцию роста проростков выборка по каждой культуре состояла из четырех проб по 100 семян (у крупносемянных — по 50). Семена проращивали в чашках Петри на подложке из 2-3 слоев простерилизован-ной фильтровальной бумаги, пропитанной раствором пептида, располагая рядами на расстоянии не менее 0,5-1,5 см. Чашки помещали в термостат и инкубировали при 25 °С в течение 7-10 сут. Рассчитывали долю проросших семян от их общего числа и измеряли длину корней и стеблей у проростков. 708
Достоверность данных оценивали по t -критерию Стьюдента (STA-TISTICA 6.0, «StatSoft. Inc.», США).
Результаты. При выделении лектин-аллиназного комплекса экстракцию проводили при пониженной температуре (4 °С), что позволило предотвратить неспецифический протеолиз белков. Триптический гидролиз фракций 6400 Да и 54000 Да, полученных после электрофоретического разделения первого хроматографического пика в денатурирующих условиях, и последующая масс-спектрометрия продуктов трипсинолиза показали, что белок с молекулярной массой 6400 Да гомологичен А-цепи маннозоспецифичного агглютинина (лектина) чеснока, а протеин с молекулярной массой 54000 Да представлял собой фермент аллиназу. Таким образом, в указанных условиях нами был выделен лектин-аллиназный комплекс.
Определяя, оказывает ли этот комплекс непосредственное влияние на патоген, выяснили, что как в контроле, так и при обработке ЛАК жизнеспособность спор M. grisea не различалась (80-90 % из них прорастали).
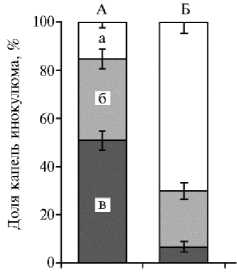

Рис. 1. Развитие некрозов на 4-м листе растений риса ( Oryza sativa L.) сорта Sha-tiao-tsao, чувствительного к пирикуляриозу, в ответ на инокуляцию Magnaporthe grisea при обработке водой (А) и лектин-аллиназным комлексом из растений чеснока посевного ( Allium sativum L.) сорта Подмосковный (Б) : а — капли, не вызвавшие симптомов (балл 0, признак устойчивости), б — образовавшие несовместимые инфекционные пятна (баллы 13, признак устойчивости), в — образовавшие совместимые инфекционные пятна (балл 4, признак восприимчивости) (вегетационный тест; все различия с контролем достоверны при p < 0,01).
Эксперимент, в котором исследовали возможность развития у риса системной устойчивости к пирируляриозу под влиянием ЛАК, показал, что обработка этим комплексом 3-го листа снижала развитие болезни на появившемся позже 4-м листе, что выражалось в уменьшении числа некрозов при сравнении с листьями контрольных (обработка водой) растений (рис. 1).
При фракционировании водно-солевого экстракта из луковиц чеснока посевного высаливанием происходило осаждение крупных белков, тогда как пептиды оставались в растворе (18). С помощью обращенно-фазовой ВЭЖХ из супернатанта был выделен основной пептид с молекулярной массой 4392 Да (рис. 2.) Изучая влияние этого пептида (П 4392 Да) в концентрации, соответствующей 10-11 мг белка/мл, на В. sorokiniana, мы не обнаружили ингибирования роста колоний. Однако в биотесте на изо- лированных листьях пшеницы и ячменя П 4392 Да демонстрировал способность полностью подавлять или значительно снижать проявление симптомов заболевания на 7-е сут после заражения В. sorokiniana (рис. 3).
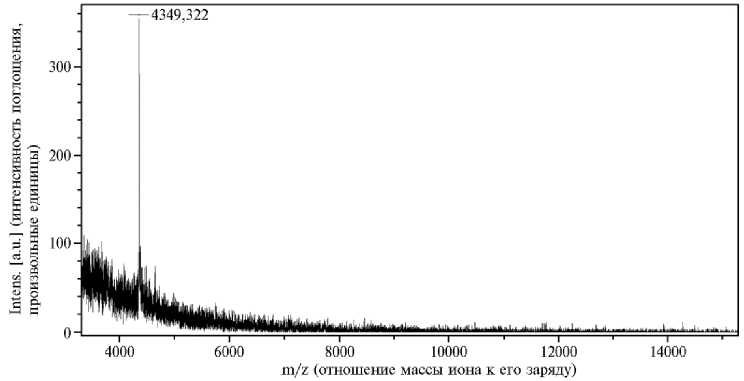
Рис. 2. Масс-спектр пептида П 4392 Да, выделенного из растений чеснока посевного ( Allium sativum L.) сорта Подмосковный (Matrix-assisted laser desorption/ionization-Time of flight mass spectrometry — MALDI-TOF; времяпролетный масс-анализатор UltraFlex 2, «Bruker Daltonic GmbH», Германия; матрица — α -циано-4-гидроксикоричной кислота).
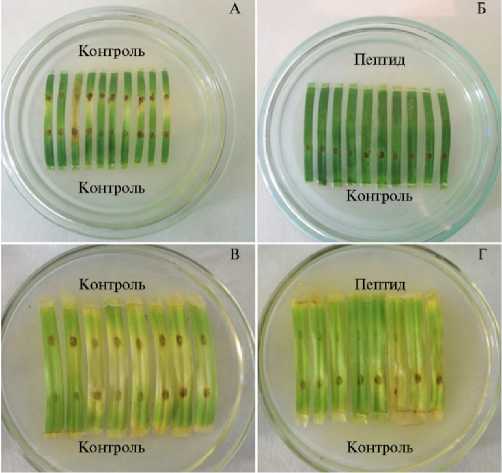
Рис. 3. Развитие темно-бурого гельминтоспориоза на листьях пшеницы сорта Лада (верхний ряд) и ярового ячменя сорта Зазерский 85 (нижний ряд) в ответ на инокуляцию Вipolaris sorokiniana в присутствии пептида П 4392 Да из растений чеснока посевного ( Allium sativum L.) сорта Подмосковный: А, В — контроль (водная споровая суспензия), Б, Г — совместное нанесение спор и П 4392 Да (учет на 7-е сут).
Пептид П 4392 Да не обладал фитотоксичностью по отношению к растениям пшеницы и ячменя, а также гороха, огурца, горчицы, подсолнечника и чеснока (данные не приведены). При этом пептид не влиял на всхожесть семян гороха, подсолнечника, горчицы и огурца, и их проращивание в присутствии пептида не приводило к увеличению длины стеблей и корней проростков. В то же время добавление пептида в концентрации, соответствующей 10-11 мг белка/мл, оказало достоверный положительный 710
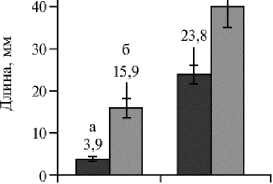
эффект при проращивании семян чеснока (повышение всхожести на 13,6 %, р < 0,05). Важно отметить, что при добавлении пептида длина стеблей проростков увеличивалась на 65,5 %, а длина корней была в 4 раза больше кон- трольной (рис. 4).
504 4°.*
К о
Рис. 4. Длина корней (а) и стеблей (б) у 10-суточных проростков чеснока посевного ( Allium sativum L.) сорта Подмосковный в присутствии пептида П 4392 Да, выделенного из растений чеснока: К — контроль (вода), О — опыт (раствор пептида).
В литературе описаны разнообразные растительные пептиды с защитными, антимикробными и антифунгальными свойствами (28-31). В основном они представлены катионными пептидами, богатыми цистеином, которые обладают широким спектром действия в отношении растительных патогенов и насекомых-вредителей. Большинство из известных антифунгальных пептидов проявляют прямое действие в микромолярных количествах. Пептид П 4392 Да, выделенный нами из чеснока посевного, отличается от известных намного более низкой эффективной действующей концентрацией и, по-видимому, способностью активировать защитные механизмы растения при заражении патогеном.
Таким образом, из луковиц чеснока посевного ( Allium sativum L.) выделены биологически активные вещества белковой природы, обладающие активностью против ряда фитопатогенов. Как показано в представленной работе, описанный ранее в литературе лектин-аллиназный комплекс (ЛАК) в концентрации, соответствующей 10-11 мг белка/мл, не оказывает прямого действия на Magnaporthe grisea (возбудитель пирикуляриоза), но снижает поражение листьев риса при заражении этим патогеном, что можно рассматривать как свидетельство в пользу способности индуцировать защитные реакции растения, приводящие к развитию системной устойчивости. Кроме того, нами выявлен пептид с молекулярной массой 4392 Да, который в биотесте в концентрации, соответствующей 10-11 мг белка/мл, эффективно препятствовал развитию гельминтоспориозной инфекции (возбудитель Вipolaris sorokiniana ) , а также заметно стимулировал прорастание семян и рост проростков у чеснока посевного.
Список литературы Биологически активные вещества белковой природы с антифунгальным и ростстимулирующим эффектами, выделенные из чеснока посевного (Allium sativum L.)
- Van Damme E.J.M., Allen A.K., Peumans W.J. Related mannose-specific lectins from different species of the family Amaryllidaceae. Physiologia Plantarum, 1998, 73: 52-57 ( ) DOI: 10.1111/j.1399-3054.1988.tb09192.x
- Lanzotti V., Scala F., Bonanomi G. Compounds from Allium species with cytotoxic and antimicrobial activity. Phytochemistry Reviews, 2014, 13: 769-791 ( ) DOI: 10.1007/s11101-014-9366-0
- Kopec A., Platkowska E., Leszczynska T., Sikora E. Healthy properties of garlic. Current Nutrition & Food Science, 2013, 9(1): 59-64 ( ) DOI: 10.2174/157340113804810888
- Van Damme E.J.M., Peumans W.J., Barre A., Rouge P. Plant lectins: a composite of several distinct families of structurally and evolutionary related proteins with diverse biological roles. Crit. Rev. Plant Sci., 1998, 17: 575-692 ( ) DOI: 10.1080/07352689891304276
- Borlinghaus J., Albrecht F., Gruhlke C.H., Nwachukwu I.D., Slusarenko A.J. Allicin: Chemistry and biological properties. Molecules, 2014, 19: 12951-12618 ( ) DOI: 10.3390/molecules190812591
- Silagy C.A., Neil H.A. A meta-analysis of the effect of garlic on blood pressure. J. Hypertens., 1994, 12: 463-468 ( ) DOI: 10.1097/00004872-199404000-00017
- Harris J.C., Cottrell S.L., Plummer S., Lloyd D. Antimicrobial properties of Allium sativum (garlic). Applied Microbiology and Biotechnology, 2001, 57: 282-286 ( ) DOI: 10.1007/s002530100722
- Lin X.Y., Liu J.Z., Milner J.A. Dietary garlic suppresses DNA adducts caused by N-nitroso compounds. Carcinogenesis, 1994, 15: 349-352 ( ) DOI: 10.1093/carcin/15.2.349
- Warshafsky S., Kamer R.S., Sivak S.L. Effect of garlic on total serum cholesterol. A meta-analysis. Ann. Intern. Med., 1993, 119(7): 599-605 (doi: 10.7326/0003-4819-119-7_Part_1-199310010-00009).
- Kiesewetter H., Jung F., Pindur G., Jung E.M., Mrowietz C., Wenzel E. Effect of garlic on thrombocyte aggregation, microcirculation, and other risk factors. Int. J. Clin. Pharmacol. Ther. Toxicol., 1991, 29: 151-155.
- Dorant E., Van den Brandt P.A., Goldbohm R.A., Hermus R.J., Sturmans F. Garlic and its significance for the prevention of cancer in humans: A critical view. Br. J. Cancer, 1993, 67: 424-429 ( ) DOI: 10.1038/bjc.1993.82
- Смирнова А.В. Пути повышения экологической безопасности при возделывании капусты в Приамурье. Автореф. канд. дис. Хабаровск, 2011.
- Бондаренко Н.В. Биологическая защита растений. М., 1986.
- Великанов Л.Л., Сидорова И.И. Экологические проблемы защиты растений от болезней. Итоги науки и техники. Т. 6. М., 1988.
- Гренье А., Пепэн Р. Производные тетрагидрофурана, способ их получения и способ борьбы с грибками. RU 2079274. МПК6 A01N43/08, A01N43/50, A01N43/707, C07D307/18, C07D307/20, C07D405/06. Заявитель Рон-Пуленк Агрошими (FR). Заявл. 22.04.1987. Опубл. 20.05.1997.
- Егоров Н.С. Основы учения об антибиотиках. М., 1986.
- Кнауф-Байтер Г., Цурфлю Р., Гзелл Б. Способ борьбы с фитопатогенными болезнями культурных растений, фунгицидная композиция. RU 2193847. МПК A01N37/50, A01N37/52, A01N43/40, A01N43/54, A01N43/653, A01N43/828. Заявитель Байер АГ (DE). Заявл. 22.04.1997. Опубл. 27.08.1998.
- Краснов М.С., Ямскова В.П., Куликова О.Г., Ильина А.П., Маргасюк Д.В., Рыбакова Е.Ю., Ямсков И.А. Изучение новой группы биорегуляторов, выделенных из подорожника большого. Прикладная биохимия и микробиология, 2011, 47(2): 146-153.
- Куликова О.Г., Ямскова В.П., Ильина А.П., Маргасюк Д.В., Молявка А.А., Ямсков И.А. Идентификация в луке репчатом нового биорегулятора, действующего в сверхмалых дозах. Прикладная биохимия и микробиология, 2011, 47(4): 1-5.
- Rabinkov A., Wilchek M., Mirelman D. Alliinase (alliinlyase) from garlic (Alliium sativum) is glycosylated at ASN 146 and forms a complex with a garlic mannose-specific lectin. Glycoconjugate J., 1995, 12: 690-698 ( ) DOI: 10.1007/BF00731266
- Smeets K., Van Damme E.J., Van Leuven F., Peumans W.J. Isolation and characterization of lectins and lectin-alliinase complexes from bulbs of garlic (Allium sativum) and ramsons (Allium ursinum). Glycoconjugate J., 1997, 14(3): 331-343 ( ) DOI: 10.1023/A:1018570628180
- Mirica A.K., Lockett M.R., Snyder P.W., Shapiro N.D., Mack E.T., Nam S., Whitesides G.M. Selective precipitation and purification of monovalent proteins using oligovalent ligands and ammonium sulfate. Bioconjugate Chem., 2012, 23(2): 293-299 ( ) DOI: 10.1021/bc200390q
- Лапикова В.П., Аверьянов А.А., Пасечник Т.Д. Устройства для получения капельных диффузатов листьев злаков. Микология и фитопатология, 1995, 29(2): 44-47.
- Latterell F.M., Marchetti M.A., Grove B.R. Coordination of effort to establish an international system for race identification in Pyricularia oryzae. In: The rice blast disease. The Johns Hopkins University Press, Baltimore, 1965.
- Webster T.M. The southern states 10 most common and troublesome weeds in rice. Proceedings Southern Weed Science Society, 2000, 53: 247-274.
- Пыжикова Г.В., Санина А.А., Супрун Л.М., Курахтанова Т.И., Гогаева Т.И., Мепаришвили С.У., Анциферова Л.В., Кузнецов Н.С., Игнатов А.Н., Кузьмичев А.А. Методы оценки устойчивости селекционного материала и сортов пшеницы к септориозу. М., 1989.
- Складнев Д.А. Метилотрофные бактерии как основа биотехнологического получения стабильно меченых биологически активных соединений. Докт. дис. М., 2000.
- Oparin P.B., Mineev K.S., Dunevsky Ya.E., Arseniev A.S., Belozersky M.A., Grishin E.V., Egorov T.A., Vassilevski A.A. Buckwheat trypsin inhibitor with helical hairpin structure belongs to a new family of plant defense peptides. Biochem. J., 2012, 446(1): 69-77 ( ) DOI: 10.1042/BJ20120548
- Slavokhotova А.А., Rogozhin Е.А., Musolyamov А.К., Andreev Y.A., Oparin P.B., Berkut A.A., Vassilevski A.A., Egorov T.A., Grishin T.V., Odintsova T.I. Novel antifungal a-hairpinin peptide from Stellaria media seeds: structure, biosynthesis, gene structure and evolution. Plant Mol. Biol., 2014, 84(1-2): 189-202 ( ) DOI: 10.1007/s11103-013-0127-z
- Egorov T.A., Odintsova T.I., Pukhalsky V.A., Grishin E.V. Diversity of wheat antimicrobial peptide. Peptides, 2005, 26: 2064-2073 ( ) DOI: 10.1016/j.peptides.2005.03.007
- Odintsova T.I., Egorov Ts.A., Musolyamov A.Kh., Odintsova M.S., Pukhalsky V.A., Grishin E.V. Seed defensins from T. kiharae and related species: genome localization of defensin-encoding genes. Biochimie, 2007, 89: 605-612 ( ) DOI: 10.1016/j.biochi.2006.09.009


