Биологические и физико-химические свойства изолятов вируса огуречной мозаики в странах Дальневосточного региона
Автор: Козловская З.Н., Романова С.А., Леднева В.А., Волков Ю.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.38, 2003 года.
Бесплатный доступ
Определяли круг растений-хозяев, симптомы поражения, накопление вируса, а также физические и физико-химические свойства шести изолятов вируса огуречной мозаики, выявленных в КНР, КНДР и Приморском крае России на растениях картофеля, сои и овощных культур. Обсуждается возможность идентификации изолятов по этим показателям.
Короткий адрес: https://sciup.org/142132847
IDR: 142132847 | УДК: 632.03.01/08:578.856.1
Текст научной статьи Биологические и физико-химические свойства изолятов вируса огуречной мозаики в странах Дальневосточного региона
Вирус огуречной мозаики (ВОМ) характеризуется широким спектром дикорастущих и культурных растений-хозяев и одновременно штаммовой специализацией. Популяции штаммов этого вируса формируются в различных природно-экологических условиях произрастания растений-резерваторов ВОМ (1). Ранее был описан ряд штаммов ВОМ, выделенных на Дальнем Востоке России и различающихся между собой по происхождению и симптомам (2).
В задачу настоящей работы входило изучение биологических и физикохимических свойств шести изолятов ВОМ, идентифицированных в Корее, Китае и на юге Дальнего Востока России: выявление круга растений-хозяев и определение симптомов заболевания, молекулярной массы, температуры инактивации, а также периода сохранения инфекционности вирусных частиц и капсидных белков.
Методика. Объектом исследования служили изоляты ВОМ, идентифицированные на картофеле сорта Аноста (ВОМан), кабачке (ВОМкаб) в Приморском крае, на картофеле (ВОМк/кор), огурце (ВОМо/кор), сое (ВОМс/кор) в Корее* и картофеле (ВОМк/кит), завезенном из Китая. Для получения моноинфекции семядольные листья здоровых растений огурца сортов Авангард, Каскад и Миг механически инокулировали — натирали разбавленным соком растений, зараженных изолятами ВОМ; некротические пятна вырезали и реинокулировали другие растения огурца. Для оценки круга растений-хозяев выделенных изолятов ВОМ растения из различных семейств ( Ama-ranthaceae, Chenopodiaceae, Cucurbitaceae, Fabaceae, Solanaceae ) также механически инокулировали. При этом в качестве индикаторов штаммов ВОМ мы использовали табак Nicotiana tabacum L. сорта Xanthi, марь гигантскую Chenopodium amaranticolor Coste et Reyn., марь киноа ( Ch. quinoa Willd.) и гомфрену шаровидную ( Gomphrena globosa L.). При отсутствии видимых симптомов у этих растений их проверяли на скрытую инфекцию посредством обратной инокуляции мари гигантской (некротическая реакция на ВОМ), а также методом двойной диффузии в агаре (РДД). Физические свойства изолятов вируса (точку термической инактивации, предельное разведение сока, период сохранения инфекционности) определяли по общепринятым методикам (3).
Вирус из растений табака сорта Xanthi выделяли по модифицированной нами методике Lot с соавт. (4, 5). Концентрацию и чистоту вируса в препарате оценивали спектрофотометрическим методом, наличие примесей во время очистки — электрофорезом в ПААГ. Электрофорез капсидных белков проводили в денатурирующих условиях в вертикальных пластинах 12 % полиакриламидного геля ДСН (додецил сульфат натрия) по методу Laemmli (6); соотношение акриламид:бис-акриламид составляло 30,0:0,8, согласно методике Weber и Osborn (7). В качестве маркеров использовали лизоцим, химотрипсиноген, овальбумин и бычий сывороточный альбумин с молекулярной массой соответственно 14,3; 25,7; 47,0; 67,0 кД. Препараты белков очищенных вирусных изолятов и маркеров обрабатывали ДСН и меркаптоэтанолом и нагревали на водяной бане в течение 1 мин при температуре 100 оС. Молекулярную массу капсидных белков определяли по методу Weber и Osborn (7); мобильность белков (Rm) рассчитывали по соотношению расстояний перемещения белка и лизоцима.
Результаты. По кругу растений-хозяев изоляты ВОМ не отличались друг от друга, однако по характеру проявления симптомов на системно заражаемых растениях между ними наблюдались существенные различия (табл.).
* Любезно предоставлены коллегами из Института физиологии растений (г. Пхеньян, КНДР).
Симптомы поражения тест-растений при инфицировании различными изолята-ми вируса огуречной мозаики
|
Семейство, вид, сорт растений |
Вид поражения (симптом) |
|||||
|
ВОМан |
ВОМкаб |
ВОМк/кит |
ВОМк/кор |
ВОМс/кор |
ВОМо/кор |
|
|
Сем. Cucurbitaceae Juss. Cucumis sativus L.: Авангард |
S(M) |
S(M) |
S(M) |
S(M) |
S(M) |
S(M) |
|
Дальневосточный 6 |
S(O) |
S(O) |
S(M) |
S(M) |
S(M) |
S(M) |
|
Дальневосточный 27 |
S(M) |
S(M) |
S(M) |
S(M) |
S(M) |
S(M) |
|
Миг |
S(M) |
S(M) |
S(M) |
S(M) |
S(M) |
S(M) |
|
Уссурийский |
S(M) |
S(M) |
S(M) |
S(M) |
S(M) |
S(M) |
|
Cucurbita pepo L.: Грунтовый грибовский 1 |
L(N), S(M) |
L(N), S(M) |
L(N), S(M) |
L(N), S(M) |
L(N), S(M) |
L(N), S(M) |
|
Ролик 1 |
L(N), S(M) |
L(N), S(M) |
L(N), S(M) |
L(N) |
L(N), S(M) |
L(N), S(M) |
|
Сем. Solanaceae Juss. Nicotiana glutinosa L. L(N), S(M) |
L(N), S(M) |
L(N), S(M) |
L(N), S(M) |
S(M, Dis) |
S(M) |
|
|
N. tabacum L.: Xanthi |
S(M) |
S(M) |
S(M, Vn, Dis) |
S(M, Vn, Dis) S(M, Olp,Dis) S(M) |
||
|
Samsun |
S(M) |
S(M) |
S(M, Vn, Dis) |
S(M, Vn, Dis) S(M, Olp,Dis) S(M) |
||
|
N. paniculata L. |
S(M) |
S(M, Vn) |
S(M) |
S(M) |
S(M) |
S(M) |
|
N. sanderae L. |
S(M) |
S(M) |
S(M, Cl, Vn) |
S(M, Vc, Dis) |
S(M, Vn, Dis) |
S(M, Vn, Dis) |
П р и м е ч а н и е: L — локальное поражение; S — системное поражение; M — мозаика; N — некроз; O — бессимптомно; Cl — хлороз; Sp — пятнистость; Vc — светлая окраска жилок; Vn — некроз жилок; Dis — деформация черешков стеблей и жилок; Olp — дуболистный узор. Описание изолятов ВОМ см. в разделе «Методика».
На растениях табака все изоляты ВОМ вызывали системное поражение в виде хлоротичной мозаики, деформации и пузырчатости листовой пластинки, однако эти симптомы различались. Так, при заражении изолятами ВОМан, ВОМк/кор, ВОМк/кит и ВОМс/кор на 9-10-е сут проявлялась системная некротизация нижних листьев, которая исчезала по мере старения листьев при заражении ВОМан и ВОМк/кор и сохранялась при заражении ВОМк/кит и ВОМс/кор, в последнем случае некрозы проявлялись в виде дубовидного рисунка, уменьшалась длина междоузлий, в результате чего верхняя часть растения приобретала форму розетки.
На инокулированных листьях гомфрены все изоляты вызывали диффузные некрозы, на вновь отрастающих листьях через 7-10 сут после заражения проявлялись некротические пятна более мелких размеров, наблюдалось измельчение листа, укорачивание междоузлий, постепенное отставание растений в развитии по сравнению со здоровыми. На растениях мари все изоляты вызывали локальное поражение: через 5-7 сут на инокулированных листьях появлялись некрозы, имеющие серую окраску. Изоляты ВОМ поражали растения всех сортов огурца, используемых в опыте, но в наибольшей степени сорта Миг; растения сорта Дальневосточный 6 сильно поражались изолятом ВОМк/кит.
На растениях табака клейкого N. glutinosa L. было выявлено системное поражение (в виде мозаики) при заражении всеми изолятами; по локальной реакции отмечены различия. Так, изоляты ВОМан, ВОМк/кит, ВОМк/кор и ВОМкаб в отличие от ВОМс/кор и ВОМо/кор вызывали некрозы на инокулированных листьях. Наиболее выраженные симптомы проявлялись при заражении ВОМс/кор: мозаика с системной некротизацией нижних листьев и стягивание розетки через 12 сут после заражения, что вызывало гибель растения.
Изоляты ВОМан, ВОМк/кит и ВОМс/кор на 7-9-е сут вызывали на инокулированных листьях растений махорки N. rustica L. междужилковый хлороз, переходящий в кольца неправильной формы; системная реакция на молодых отрастающих листьях была неодинаковой. На верхних листьях растений наблюдалась легкая или сильная пузырчатость листовой пластинки, либо резкая деформация с ярко выраженным хлорозом в зависимости от изолята. Изоляты ВОМо/кор и ВОМкаб вызывали четко выраженную жилковую мозаику на верхних листьях растений махорки, а первый изолят, кроме того, — пузырчатость молодых листьев. На инокулированных листьях не отмечено выраженных симптомов заболевания.
По поражению растений табака сандера N. sanderae L. проводили дифференциацию изолятов: ВОМан вызывал системную мозаику, ВОМк/кит — дополнительный хлороз и некроз жилок, ВОМк/кор — посветление жилок и деформацию листовой пластинки.
Под влиянием всех изолятов ВОМ на инокулированных листьях растений конских бобов ( Faba bona Medik . , сорт Русские черные) и вигны ( Vigna unguiculata L.) возникали первичные некрозы, которые сливались через 5-10 сут, затем наблюдались некротизация стебля, поражение верхних листьев, постепенное почернение стебля и гибель растений.
Точка термической инактивации (ТТИ) изолятов ВОМан, ВОМк/кит, ВОМк/кор, ВОМкаб и ВОМо/кор составляла 67 оС, ВОМс/кор — 60 оС. Период сохранения инфек-ционности (ПСИ) для изолятов ВОМк/кит, ВОМк/кор, ВОМан, ВОМкаб, ВОМо/кор, ВОМс/кор составлял соответственно 3, 3, 4, 4, 7-9 и 13-11 сут. По показателю предельного разведения сока (ПРС = lO^IQ-4) изоляты ВОМан, ВОМкаб, ВОМо/кор и ВОМс/кор были близки приморским изолятам, выделенным на растениях декоративных культур. Инфекционность ВОМк/кор сохранялась при разведении 10–2-10–3; наибольшие значения ПРС отмечены у изолята ВОМк/кит (10–4-10–5).
Полученные препараты имели характерный для ВОМ нуклеопротеидный спектр поглощения в ультрафиолетовой области. Выход вируса у изолятов ВОМк/кит, ВОМо/кор, ВОМс/кор, ВОМк/кор, ВОМан и ВОМкаб составлял соответственно 330, 290, 250, 190, 200 и 230 мг/кг листьев (в среднем по трем-пяти повторностям), что свидетельствует о высокой концентрации накопления вирусов.
При электрофорезе в ПААГ капсидных белков всех изолятов ВОМ в составе вирионов был обнаружен один полипептид, у изолята ВОМо/кор — два полипептида. Для того чтобы проверить возможность деградации капсидного белка этого изолята, очищенный вирусный препарат в течение 1 мес с интервалом в 1 нед обрабатывали мочевиной, ДСН и меркаптоэтанолом по методу Paul (8). При электрофорезе полученных проб по методу Laemmli не нашло подтверждения наше первоначальное предположение об образовании двух полипептидов за счет деградации основного капсидного белка ВОМо/кор.
По данным литературы, штаммы, относящиеся к разным группам, имеют различную молекулярную массу капсидных белков. В нашем исследовании этот показатель у различных изолятов имел следующие значения:
|
Изолят |
Молекулярная масса капсидных белков, кД |
|
ВОМк/кит |
26,500±0,320 |
|
ВОМс/кор |
24,500±0,255 |
|
ВОМо/кор |
24,700±0,255 22,500±0,240 |
|
ВОМк/кор |
25,900±0,250 |
|
ВОМан |
25,700±0,250 |
|
ВОМкаб |
25,400±0,275 |
Сопоставление молекулярной массы капсидных белков всех изолятов ВОМ, распределение которой отражено на диаграмме, наглядно свидетельствует о возможности их группировки по этому показателю (рис.).
22(кД) 23 24 25 26 27
ВОМо/кор2 ВОМан ВОМк/кит
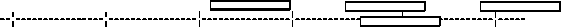
ВОМк/кор
ВОМо/кор1 ВОМс/кор ВОМкаб
Распределение молекулярной массы капсидных белков изолятов вируса огуречной мозаики (ВОМ) .
Наличие двух видов структурных белков в изоляте ВОМо/кор позволяет рассматривать его как популяцию двух штаммов, один из которых (ВОМо/кор1) обладает наименьшей молекулярной массой и в значительной мере обособлен от других. Наибольшая молекулярная масса отмечена у изолята ВОМк/кит, что дает возможность отнести его к самостоятельному штамму. Другие пять изолятов образовали две группы: I — ВОМан, ВОМкаб, ВОМк/кор; II — ВОМс/кор, ВОМо/кор2.
По данным ряда исследователей, при электрофорезе в ПААГ молекулярная масса капсидных белков ВОМ значительно различается — 24,0-30,9 кД, что объясняется полимеризацией субъединиц капсидного белка, а также присутствием гидрофильных N-концевых доменов из 30-32 аминокислотных остатков. Возможно, аномально высокая электрофоретическая мобильность ВОМо/кор1 в нашем опыте также была вызвана этими причинами.
Таким образом, нами показано, что дальневосточные изоляты вируса огуречной мозаики, выделенные на растениях картофеля, сои и овощных культур, различаются по молекулярной массе и могут быть разделены по этому показателю на две группы, в которые не входят ВОМо/кор1 и ВОМк/кит. Биологические и физические свойства вирусов подтверждают правомочность такого разделения. Можно предположить, что изоляты ВОМан и ВОМкаб являются одним штаммом, так как они вызывают бессимптомное заражение растений огурца сорта Дальневосточный 6 и аналогичные симптомы на растениях Nicotiana sanderae , имеют близкие значения показателей предельного разведения сока, температуры инактивации и выхода вируса при выделении. Для изолятов II группы и ВОМк/кор характерны близкие показатели молекулярной массы, точки термической инактивации и периода сохранения инфекционности, но они различаются по симптомами проявления заболевания на растениях табака разных видов и огурца сорта Дальневосточный 6, а также показателям инфекционности при разведении сока и выхода вируса при выделении. Следовательно, изолят ВОМк/кор можно рассматривать в качестве самостоятельного штамма. Сходные симптомы заболевания на растениях N. sanderae вызывают изоляты ВОМс/кор и ВОМо/кор (близкая молекулярная массы, но различаются по точке термической инактивации). Возможно, что ВОМс/кор и один из изолятов, входящих в популяцию ВОМо/кор (ВОМо/кор2) являются родственными или же одним штаммом, а ВОМо/кор1 — самостоятельным штаммом, так как имеет наиболее низкую молекулярную массу. Наибольшая молекулярная масса, высокий выход вируса при выделении, сохранение инфек-ционности при разведении сока позволяют выделить изолят ВОМк/кит в самостоятельный штамм.
Л И Т Е Р А Т У Р А
-
1. М о л д о в а н М.Я. Вирусные болезни табака и меры борьбы с ними. Кишинев, 1979.
-
2. Р о м а н о в а С.А., Л е д н е в а В.А., Г н у т о в а Р.В. Биологические свойства штамма
вируса огуречной мозаики, выделенного из картофеля на Дальнем Востоке России. Докл. РАСХН, 2000, 5: 16-18.
-
3. Ш о й м о ш и Ф. Вирусология. Методы фитопатологии. М., 1974.
-
4. L o t H., M a r r o u J., Q u i o t J.B. e.a. Contribution a l’etude de virus de la mosaique du con-
combre (CMV). I. Methode de purification du virus. Ann. Phytopathol., 1972, 4: 25-38.
-
5. К о з л о в с к а я З.Н., Г н у т о в а Р.В. Иммунологическая характеристика дальневосточно
го и европейских серотипов кукумовирусов. Докл. ВАСХНИЛ, 1989, 8: 14-18.
-
6. L a e m m l i U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 277, 5259: 680-685.
-
7. W e b e r K., O s b o r n M. The reliability of molecular weight determinations by dodecyl sulfate polyacrylamide gel electrophoresis. Biol. Chem., 1969, 224: 4406- 4410.
-
8. P a u l H.Z. SDS-polyacrylamide gel electrophoresis of virion proteins as a tool for detection the presence of virus in plant. I. Testing of methods. Phytopathol. Z., 1974, 80: 330-339.
Биолого-почвенный институт ДВО РАН Поступила в редакцию
690022, Владивосток, просп. 100-летия Владивостока, 159 31 июля 2001 года
BIOLOGICAL AND PHYSICO-CHEMICAL PROPERTIES
OF CUCUMBER MOSAIC VIRUS ISOLATES
FROM FAR EASTERN REGION
S u m m a r y
It is determined that isolates of cucumber mosaic virus (CMVpot, CMVsq, CMVpot/ch, CMVpot/kor, CMV c/kor, CMVs/kor) differ from each other by following biological and physico-chemical characteristics: molecular weights of capsid proteins, symptoms induced on test plants, TIP, DEP and LIV in vitro. According to these characteristics the isolates can be divided into two groups differing from others: I — CMVs/kor, CMVc/kor2; II — CMVsq, CMVpot, CMVpot/kor. The CMVpot/ch and CMVc/kor1 are different from others isolates. According to the obtained data conclusions were made that one of the isolates contains 2-strain population, two isolates are likely to be one and the same strain and other two isolates are independent strains. The next two isolates are insufficient for identification with obtained data.


