Биологические системы для получения специфических гипериммунных сывороток к респираторно-синцитиальному вирусу крупного рогатого скота
Автор: Строганова И.Я.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария
Статья в выпуске: 6, 2012 года.
Бесплатный доступ
Представлены результаты исследований по подбору биологической системы для получения специфических гипериммунных сывороток к респираторно-синцитиальному вирусу крупного рогатого скота.
Респираторно-синцитиальный вирус крупного рогатого скота, гипериммунные сыворотки, белые мыши, морские свинки, бараны, кролики
Короткий адрес: https://sciup.org/14082455
IDR: 14082455 | УДК: 619:616.988:75:636.22/28
Текст научной статьи Биологические системы для получения специфических гипериммунных сывороток к респираторно-синцитиальному вирусу крупного рогатого скота
Введение. В настоящее время в России возрастает удельный вес хозяйств по производству молока. Высокая молочная продуктивность коров часто сопровождается нарушением обмена веществ, что приводит к активизации различных инфекционных агентов [1,2].
Широкое распространение в молочных хозяйствах получили респираторные болезни животных [3,4].
Одним из этиологических агентов данной патологии является респираторно-синцитиальный вирус крупного рогатого скота (РСВ КРС), относящийся к семейству Paramyxoviridae рода Pneumovirus. Во многих зарубежных странах его относят к числу наиболее важных патогенов молочного скота [5,6].
Первые сообщения о РСИ КРС в нашей стране относятся к 1975 году [7].
Изучение этой инфекции длительное время сдерживалось из-за высокой лабильности вируса и слабой его способности к размножению в культурах клеток, что, в свою очередь препятствовало разработке диагностических препаратов.
При разработке и применении диагностических тест-систем РНГА и РН необходимо наличие положительного контроля, то есть специфических сывороток к РС-вирусу крупного рогатого скота.
Цель исследований . Подбор биологической системы для получения специфических гипериммунных сывороток к РСВ крупного рогатого скота.
Материалы и методы исследований . Для получения специфических сывороток использовали биологические системы: белых мышей линии ВАLB/C; морских свинок; баранов и кроликов.
Гипериммунизацию проводили культуральной вируссодержащей суспензией и концентрированным очищенным вирусом штамма «РС-Б» РС-вируса крупного рогатого скота.
Вирус культивировали в перевиваемых линиях клеток: почки эмбриона овцы (FLK); почки теленка (Т-1); почки зеленой мартышки (46/47); почки теленка (ПТ).
Для культивирования вируса применяли питательные среды Игла, Игла МЕМ с добавлением 2%-й фетальной сыворотки крупного рогатого скота и антибиотиков по 100 ЕД/мл.
Инфекционную активность вируса определяли титрованием в чувствительной культуре клеток по ци-топатическому действию. Титр вируса рассчитывали по методу Рида и Менча (1937). Концентрировали и очищали РС-вирус по методу М.Trudel et al.[8]. Электронную микроскопию осуществляли методом негативного контрастирования. Иммунизировали белых мышей линии BALB/c и морских свинок с учетом схемы, предложенной Л.Н. Астахавой и М.Г. Брайнингер [9].
Активность полученных гипериммунных сывороток определяли в реакции нейтрализации (РН) и реакции непрямой гемагглютинации (РНГА). РН ставили по общепринятой методике, РНГА в соответствии с наставлением.
Результаты исследований и их обсуждение . Гипериммунизация белых мышей линии BALB/с ви-руссодержащей культуральной суспензией РСВ с титром инфекционности 4,0 lg ТЦД 50/мл желаемых результатов не принесла. Поэтому в дальнейшем с этой целью использовали концентрированный и очищенный препарат PC-вируса по методу М. Trudel et al. [8].
Вирус концентрировали полиэтиленгликолем (ПЭГ-6000) с последующим ультрацентрифугированием в 20–60%-м градиенте плотности сахарозы и хранили при минус 70°С. Контроль препарата осуществляли электронной микроскопией (рис.).
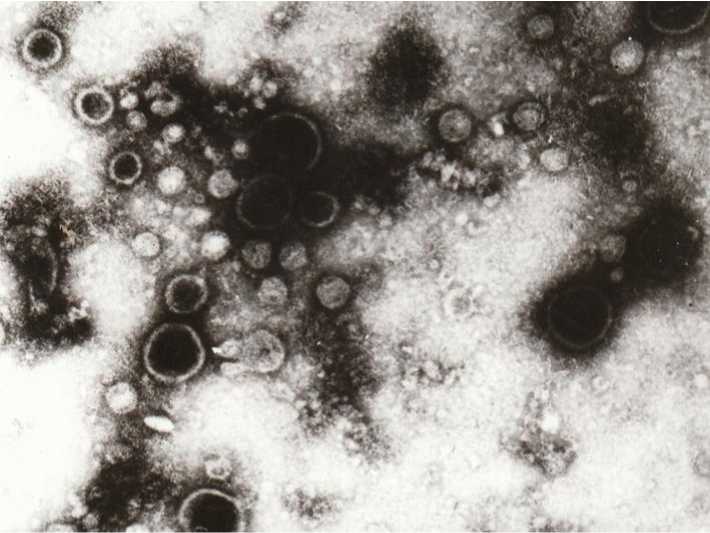
Препарат концентрированного и очищенного вируса. Негативное контрастирование. Увеличение 30000
Иммунизировали морских свинок с учетом схемы, предложенной Л.Н. Астаховой и М.Г. Брайнингер [9].
Полученный PC-вирусный антиген вводили интраназально четыре раза по 0,2 мл в каждый носовой ход с интервалом в 7 дней. Сыворотку от животных получали через 14 дней после последней иммунизации.
В сыворотках крови морских свинок до иммунизации антител к PC-вирусу крупного рогатого скота в РНГА не обнаруживали.
Из полученных данных следует, что концентрированный и очищенный препарат вируса «РС-Б» не обладал ярко выраженной антигенной активностью для морских свинок при указанном способе иммунизации. На его введение у животных синтезировались вируснейтрализующие антитела в разведениях 1:4 – 1:16 и средний титр составил 2,22±0,11 lg 2 .
Учитывая недостаточный титр антител в полученных сыворотках на мышах и морских свинках, необходимо было подобрать другую биологическую систему для получения специфических сывороток к РСВ КРС. По имеющимся данным Г.Д. Метревели [10], для получения гипериммунных сывороток к штамму «М82» РСВ КРС автор использовала телят, овец, коз, кроликов и морских свинок.
В наших исследованиях для получения гипериммунных сывороток мы использовали баранов и кроликов (табл.).
Перед введением вируса штамма «РС-Б» РСВ КРС исследовали сыворотки крови баранов и кроликов в РНГА на наличие антител к РСВ и получили отрицательные результаты.
Первый раз барана иммунизировали культуральной вируссодержащей суспензией с титром вируса 3,0–4,0 lg ТЦД 50/мл, что желаемых результатов не принесло. Затем использовали концентрированный препарат РСВ КРС с 5%-м полиэтиленгликолем с последующим центрифугированием при 6,5 тыс. об/мин в тече- ние 40 мин, который вводили с адъювантом Фрейнда 1/1. Иммунизировали дважды, вводили препарат по 20 мл внутримышечно с интервалом 14 дней. В дальнейшем иммунизировали трижды с интервалом в 14 дней. Через две недели после последней иммунизации брали кровь для получения сыворотки, которую исследовали в РНГА и РН. Титр антител к РСВ КРС составил 11,02±0,05 lg2 и 6,08±0,09 lg2 соответственно.
Титры антител в сыворотках крови баранов и кроликов, гипериммунизированных РС-вирусом крупного рогатого скота (n=3)
|
Биологические системы |
Количество |
Титры антител lg |
2 М±m; Р<0,05 |
|
РНГА |
РН |
||
|
Бараны: до иммунизации осле иммунизации |
3 3 |
11,02±0,05 |
0 6,08±0,09 |
|
Кролики: до иммунизации после иммунизации |
3 3 |
10,05±0,07 |
0 5,38±0,16 |
Примечание: - – не выявлены антитела; 0 – не исследовали.
Кроликов гипериммунизировали трижды: с интервалом 14 дней вводили препарат концентрированного вируса, обработанного ультразвуком с адъювантом Фрейнда 1/1 по 2 мл внутримышечно. Через две недели после последней иммунизации брали кровь, получали сыворотку и исследовали в РНГА и РН, титр антител составил 10,05±0,07 lg 2 и 5,38±0,16 lg 2 соответственно.
Выводы. Были подобраны биологические системы для получения специфических гипериммунных сывороток к РСВ КРС – бараны и кролики, на них получали сыворотки с титром антител в реакции нейтрализации 6,08±0,09 lg 2 и 5,38±0,16 lg 2 , которые и использовали в дальнейшей работе.


