Биологический контроль вредителей сельскохозяйственных культур с использованием метода автодиссеминации энтомопатогенных нематод семейства Steinermatidae (Nematoda: Rhabditida)
Автор: Пушня М.В., Исмаилов В.Я., Балахнина И.В., Родионова Е.Ю., Снесарева Е.Г., Команцев А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоконтроль и биозащита
Статья в выпуске: 3 т.56, 2021 года.
Бесплатный доступ
В настоящее время разработка приемов биологизированной защиты агроценозов от вредных членистоногих составляет одну из важнейших проблем при создании агросистем будущего, которая затрагивает множество аспектов - от эффективности и продуктивности растениеводства до социального и экологического благополучия и природосбережения. Эффективная биозащита агроценозов невозможна без сочетания разнообразных биоагентов и приемов регулирования численности вредителей. Одним из элементов улучшения ситуации в агроценозах служит применение патогенов вредных организмов и синтетических половых феромонов. В предлагаемой работе показана возможность использования энтомопатогенных нематод (ЭПН) семейства Steinernematidae Filipjev, 1934 как агента автодиссеминации в агроэкосистемах сои, кукурузы и яблоневого сада и описано влияние этих патогенов на разные группы организмов, населяющих биоценозы (в частности, продемонстрировано снижение численности вредных насекомых и повышение активности природных полезных энтомопатогенов). Суть метода заключается в направленном введении в агроценоз энтомопатогенов-биоагентов посредством их аппликации на привлеченных насекомых, отловленных в ловушки, и создании таким образом эпизоотий в популяциях целевых видов. Ранее энтомопатогенные нематоды не использовались в качестве агентов автодиссеминации в борьбе с супердоминантными видами - яблонной плодожоркой Cydia pomonella L ., 1758 и жуками-щелкунами семейства Elateridae Leach, 1815, кроме того, их влияние на других представителей энтомофауны агроэкоценозов также не изучалось. Цель этой работы - оценка эффективности метода автодиссеминации ЭПН на различных культурах. Предпосылкой для проведения представляемого исследования стала успешная апробация метода диссеминации вируса гранулеза, проведенная ранее в яблоневом саду, и предварительные испытания метода автодиссеминации ЭПН для борьбы со щелкунами. В работе применяли два вида патогенов из семейства Steinernematidae - Steinernema carpocapsae (Weiser, 1955) и St. feltiae (Filipiev, 1934), размноженных в лабораторных условиях на разных насекомых-хозяевах. Выполненные эксперименты показали, что энтомопатогенные нематоды, инокулируемые в агроценозы с помощью специально разработанных авторских препаративных форм и модификаций феромонных ловушек, поражали нематодно-бактериальным комплексом 60,0-100 % жуков-щелкунов семейства Elateridae и 34,0-35,3 % имаго яблонной плодожорки C. pomonella и восточной плодожорки Grapholitha molesta (Busck, 1916), что предполагает при дополнительном внесении дальнейшее накопление агентов биологической борьбы в почве защищаемых агроценозов. Заметный положительный эффект автодиссеминации ЭПН проявлялся в снижении поврежденности плодов яблони плодожоркой на 10,0 % и всходов кукурузы и сои на 13,2 % в сравнении с участками, где проводились химические обработки. При использовании рассматриваемого метода не выявлено отрицательного воздействия энтомопатогенных нематод на энтомофагов, таких как златоглазки ( Chrysopidae Schneider, 1851), и перепончатокрылых паразитов из семейств Braconidae Latreille, 1829 и Ichneumonidae Latreille, 1802, поражающих насекомых-вредителей. При этом в саду, где проводились испытания, регистрировалось увеличение зараженности гусениц C. pomonella перепончатокрылыми (+15 %). Установлено стимулирующее воздействие энтомопатогенов на активность аборигенных почвенных нематод, присутствующих в почве исследуемых ценозов, что проявлялось в увеличении числа энтомопатогенных нематод, отловленных на тест-объект (в 1,5-2,0 раза в сравнении с пробами перед обработками). Важен и тот факт, что эффект автодиссеминации оказался пролонгированным и проявился и на следующий год после ее применения как в яблоневом саду, так и в севообороте сельскохозяйственных культур.
Биоконтроль, энтомопатогенные нематоды, автодиссеминация, почвенные нематоды, яблонная плодожорка, жуки-щелкуны, проволочники, феромонные ловушки, яблоня, кукуруза
Короткий адрес: https://sciup.org/142231368
IDR: 142231368 | УДК: 634.11 | DOI: 10.15389/agrobiology.2021.3.523rus
Текст научной статьи Биологический контроль вредителей сельскохозяйственных культур с использованием метода автодиссеминации энтомопатогенных нематод семейства Steinermatidae (Nematoda: Rhabditida)
Избыточное применение химических пестицидов в России вызывает
∗ Исследования выполнены в рамках Государственного задания Министерства науки и высшего образования РФ по теме ¹ 0686-2019-0010.
тревогу за безопасность продукции и чистоту окружающей среды, поэтому в современных условиях новой стратегией защиты растений от вредных организмов становится использование природных регуляторов биоценотиче-ских отношений в агросистемах (1).
Управление численностью вредителей важнейших сельскохозяйственных культур с использованием биологических средств и методов, развитие которых в настоящее время составляет научный приоритет, невозможно без широкого использования синтетических половых феромонов насекомых (1-5). Применение этих аттрактантов для мониторинга, массового отлова и нарушения репродуктивных связей (дезориентации) фитофагов имеет широкое распространение во вс е м мире, однако этот подход еще не исчерпал себя (6-11). Например, для многих видов насекомых установлено, что при повышении концентрации синтетического полового феромона в агроценозе отмечается уменьшение яйцепродукции у самок, удлинение периода развития и уменьшение выживаемости преимагинальных стадий, что, в частности, успешно продемонстрировано в саду против яблонной и восточной плодожорок (4, 12-15). Поиск новых приемов применения половых феромонов насекомых с целью управления их численностью привел к открытию оригинальных методов биологического контроля вредителей на основе диссеминации феромонов и автодиссеминации энтомо-патогенов целевых видов с помощью феромонных ловушек с апплицирую-щими устройствами (15, 16).
К числу эффективных природных биоагентов принадлежат энтомо-патогенные нематоды (ЭПН) семейств Steinernematidae Filipjev, 1934 и Hete-rorhabditidae Poinar, 1976. Эти организмы способны заражать более тысячи видов членистоногих, многие из которых относятся к опасным вредителями важнейших сельскохозяйственных культур (17-20). Среди биосредств, производимых в мире, нематодные препараты находятся на втором месте после бактериальных (21-25). ЭПН обладают способностью самостоятельно проникать в жертву, сохраняться в погибших насекомых и способствуют инвазии в тело насекомых других патогенов (в частности, вирусов и бактерий) энтомопатогенных паразитов. Высокая скорость развития нематод (в организме живого хозяина в течение 6-10 сут) позволяет им распространяться с личинками и имаго вредителей (26-31). Единственный фактор, лимитирующий широкое распространение препаратов на основе ЭПН, — их высокая гигрофильность. В связи с этим для увеличения жизнеспособности таких используемых биоагентов создаются различные препаративные формы, обеспечивающие достаточное и пролонгированное влагообеспечение нематод (17, 23-26). Важно и то, что указанные патогены, взаимодействуя с другими консорбентами биоценоза, могут также выполнять микрорегулятор-ную роль в формировании почвенной структуры (32, 33). Особенности биологии ЭПН предполагают возможность насыщения ими почв агроценозов с помощью самцов, отловленных феромонными ловушками с устройствами (аппликаторами), заражающими привлеченных насекомых энтомопа-тогенными нематодами (метод автодиссеминации энтомопатогенов). Во многих исследованиях показана высокая биологическая эффективность ЭПН против проволочников (личинки жуков-щелкунов семейства Elateridae ) и яблонной плодожорки Cydia pomonella , L ., 1758, причем рассматривались различные способы их применения (23, 34-36).
На этой основе нами был предложен новый способ применения эн-томопатогенных нематод методом их автодиссеминации, обеспечивающим 524
их большую продолжительность жизни, активность и скорость распространения в стации. Метод основан на внутри- и межвидовой химической коммуникации и положительном светотаксисе видов насекомых, привлекаемых с помощью синтетических половых феромонов или света в разработанные апплицирующие устройства (16). Покидающие аппликатор насекомые выступают в качестве агентов — носителей ЭПН, применяемых для защиты сельскохозяйственных культур от доминантных вредителей (16, 35).
Цель представленных исследований состояла в изучении возможности использования феромонных ловушек для автодиссеминации энтомопа-тогенных нематод в качестве агентов биоконтроля яблонной плодожорки Cydia pomonella L., 1758 и жуков—щелкунов семейства Elateridae Leach, 1815 и их влияния на представителей полезной фауны изучаемых агроценозов.
Ìåòîäèêà. В экспериментах использовали энтомопатогенных нематод семейства Steinernematidae трех видов и четырех варитетов: Steinernema feltiae (Filipiev, 1934), St. kraussei Steiner, 1923, St. carpocapsae (Weiser, 1955), St. carpocapsae var. “ agriotes ” (Weiser, 1955) из коллекции полезных организмов ФНЦБЗР (Федеральный научный центр биологической защиты растений). Вид St. kraussei исходно получен из коллекции Всероссийского НИИ фундаментальной и прикладной паразитологии животных и растений РАН (ВНИИП, г. Москва), виды St. feltiae и St. carpocapsae var. “ agriotes ” — из коллекции Всероссийского НИИ защиты растений (ВИЗР, г. Санкт-Пе-тербург—Пушкин); St. carpocapsae — местный варитет, обнаруженный в яблоневом саду в станице Ленинградской (Краснодарский край).
Накопление ЭПН осуществляли в камере искусственного климата MLR 35 OH («Panasonic», Япония) с использованием лабораторных насекомых-хозяев — большой восковой моли Galleria melonella (Linnaeus, 1758) и большого мучного хрущака Tenebrio molitor Linnaeus, 1758. Применяли способы, описанные Л.Г. Даниловым (24), с предложенными нами модификациями (35, 36).
Обнаружение энтомопатогенных нематод в почвенных образцах из изучаемых биотопов осуществлялось по методике, предложенной С.Э. Спиридоновым (27), с использованием гусениц G. melonella (по 10 экз. в каждом варианте), которых помещали в образцы почв, отобранные на контрольных участках, а также на участках, где проводилась автодессеминация. Через 1 нед гусениц извлекали и выявляли наличие энтомопатогенов с помощью микроскопа при 90-кратном увеличении (Биолам, «ЛОМО», Россия); образцы почв также просматривали под бинокулярным микроскопом при 10-кратном увеличении (МБС-10, «ЛЗОС», Россия) (27).
Энтомопатогенов после автодиссеминации выявляли в имаго, личинках и гусеницах с помощью так называемых «нематодных ловушек» и при просмотре биоматериала под микроскопом при 90-кратном увеличении (Биолам, «ЛОМО», Россия).
Для заражения трех видов щелкунов — кубанского Agriotes tauricus Heyden, 1882, посевного A. sputator (Linnaeus, 1758) и степного A. gurgistanus (Faldermann, 1835) использовали стандартные модифицированные ловушки типа Эстрон (производство ФГБНУ Всероссийский центр карантина растений, Московская обл.) в насекомоприемники которых помещали поролоновую губку размером 45½95 мм, пропитанную суспензией ЭПН (титр инвазионных личинок — 2,5½106/мл). Чтобы обеспечить свободную миграцию отловленных насекомых в окружающую среду, в насе-комоприемнике проделывали летное отверстие диаметром 35 мм. Ловушки
(по 10 шт. в каждом варианте) выставляли в зависимости от начала л¸та каждого из изучаемых видов жуков-щелкунов, распределяли равномерно на участках сои и кукурузы на расстоянии 30-40 м друг от друга методом конверта. Для изоляции вариантов опыта друг от друга соответствующие участки размещали на расстоянии 200 м. Нанесение свежеприготовленной суспензии нематод на губки и отбор проб проводили каждые 7-10 сут в течение всего периода л¸та насекомых. Для учета отловленных самцов щелкунов половину ловушек оставляли без летного отверстия, далее из них отбирали жуков и в лабораторных условиях определяли число зараженных особей и число выделившихся из них инвазионных личинок эн-томопатогенных нематод.
Для диссеминации ЭПН в яблоневом саду использовали стандартные модифицированные ловушки типа Атракон-А (изготовлены нами в лаборатории из бумаги типа Тетрапак). Повторность опытов также составляла по 10 ловушек в каждом варианте. С целью аппликации нематод на поверхность вкладыша помещали поролоновую губку размером 20½20 мм, содержащую суспензию энтонематод с титром инвазионных личинок 2,5½106/мл. Для определения числа зараженных нематодами гусениц мы использовали ловушки с клеевыми вкладышами, для дальнейшего распространения ЭПН в агроценозе в половине ловушек клей на вкладыши не наносили.
Нанесение свежеприготовленной суспензии нематод на губки и отбор проб проводили каждые 7-10 сут (такая периодичность смены биопрепарата для обеспечения эффективности воздействия нами была определена ранее в исследованиях со щелкунами) (35). Для учета числа пораженных эн-томопатогенами насекомых их отбирали из ловушек и ловчих поясов, степень зараженности имаго и личинок определяли в лабораторных условиях.
Полевые исследования для яблонной плодожорки проводили в яблоневых садах учхоза «Кубань» (ФГБОУ ВО Кубанский государственный аграрный университет им. И.Т. Трубилина, г. Краснодар и ФНЦБЗР), для жуков-щелкунов — в научном севообороте ФНЦБЗР в течение 2011-2015 годов. Зараженных насекомых отлавливали на площади 1 га. Данные по числу отловленных зараженных насекомых сравнивали с аналогичными показателями на контрольных участках, где применялась химическая защита, которые находились на расстояние не менее 500 м от опытных участков.
Энтомофагов выделяли после отбора гусениц яблонной плодожорки из ловчих поясов с последующим индивидуальным выведением.
Идентификацию собранного биоматериала проводили с использованием фундаментальных определителей Зоологического института РАН (г. Санкт-Петербург) и Дальневосточного отделения РАН (г. Владивосток) (37, 38), применяя камеры искусственного климата MLR 35 OH для содержания гусениц и куколок яблонной плодожорки, что обеспечивало либо вылет энтомофагов из зараженных насекомых, либо вылет бабочек, и микроскопирование (бинокулярный микроскоп МБС-10 с 8-кратным увеличением, «ЛЗОС», Россия).
Полученные результаты обрабатывали по общепринятым методикам статистического анализа по Б.А. Доспехову (39) и с применением программы Statistica 12.6 («StatSoft, Inc.», США). В таблицах и на рисунках представлены средние ( М) и стандартные ошибки среднего (±SEM). Достоверность различий между вариантами определяли с помощью t -критерия Стьюдента при Р ≥ 0,95.
Результаты. Широкий лабораторный скрининг энтомопатогенных нематод из коллекции ФНЦБЗР, отобранных из различных биотопов Крас- нодарского края, позволил нам выявить наибольшую активность трех видов патогенов — St. carpocapsae, St. feltiae и St. kraussei в отношении гусениц G. pomonella и двух видов — St. carpocapsae var. “agriotes” и St. feltiae — в отношении проволочников (35, 36). В соответствии с этим указанные виды использовали в дальнейших исследованиях.
Поскольку энтомопатогенные нематоды достаточно широко распространены в некоторых биоценозах, а основным местом их обитания служит почва, для изучения влияния привносимых патогенов на аборигенную патофауну предварительно проанализировали почвы из биотопов, где планировалось проведение экспериментов. В образцах из яблоневого сада ФНЦБЗР, который активно эксплуатируется в течение нескольких лет, были выявлены энтомопатогенные нематоды семейства Steinernematidae — St. carpocapsae и Steinernema sp . , поэтому для диссеминации мы выбрали вид St. feltiae, который не встречается в выбранной для эксперимента экосистеме. По нашим наблюдениям и данным, полученным ранее (40), для пропашных культур в севообороте характерны низкая численность или практически полное отсутствие этих патогенов. Сходная ситуация наблюдалась в 2013 году в саду учхоза «Кубань», который был выведен из эксплуатации за 2 года до проводимых исследований: число ЭПН видов St. carpocapsae и Steinernema sp., отловленных на приманочное насекомое, здесь было ниже, чем в саду ФНЦБЗР.
Результаты проведенных испытаний автодиссеминации ЭПН против жуков-щелкунов показали, что наибольшую опасность для всходов сои и кукурузы представляет кубанский щелкун. Число отловленных в феромонные ловушки особей в опытных вариантах составляло в 2011 году на кукурузе — 405,0±3,5 экз., на сое — 231,3±5,7 экз., в 2012 году на кукурузе — 275,3±8,3 экз., на сое — 109,4±7,6 экз., в 2013 году на кукурузе — 119,7±7,6 экз., на сое — 86,7±7,6 экз. (рис. 1). Число особей щелкуна посевного было ниже и составляло в 2011 году на кукурузе — 101,3±2,4 экз., на сое — 65,7±6,2 экз., в 2012 году на кукурузе отловили 76,6±6,0 экз. A. spu-tator , а на сое — 38,7±3,6 экз., в 2013 его численность составила 42,0±5,6 экз. на кукурузе и 32,0±3,6 экз. на сое (см. рис. 1). Уловистость самцов степного щелкуна в опытные феромонные ловушки была минимальной и составляла в 2011 году 7,6±2,5 экз. на кукурузе и 5,0±1,7 экз. на сое, число отловленных особей в 2012 году достигало 6,3±1,5 экз. на кукурузе и 3,7±0,6 экз. сое, в 2013 году число отловленных особей снизилось до 2,6±1,5 экз. на кукурузе и 1,3±0,5 экз. на сое (см. рис. 1).
Таким образом, при применении метода автодиссеминации в течение 3 лет наблюдалось снижение числа насекомых, пойманных в феромонные ловушки, тогда как в контроле численность щелкунов либо не изменялась, как в случае со степным щелкуном (число особей, отловленных в 20112013 годах на кукурузе, составляло 6,0±1,0-6,6±1,5 экз., на сое — 4,3±1,15,3±0,6 экз.), либо возрастала, что отмечали для кубанского и посевного щелкунов. Так, численность кубанского щелкуна возросла на кукурузе с 430,0±8,3 экз. в 2011 году до 457,3±6,4 экз. в 2013 году, численность посевного — возросла на кукурузе с 66,6±3,7 экз. в 2011 году до 111,4±3,9 экз. в 2013 году, на сое мы также наблюдали увеличение числа самцов посевного щелкуна с 32,3±1,2 экз. в 2011 году до 66,6±5,7 экз. в 2013 году (см. рис. 1). Также происходило некоторое снижение числа отловленных самцов кубанского щелкуна в контроле на сое (с 276,6±5,7 экз. в 2011 году до 240,0±9,6 экз. в 2013 году), однако различия с опытными вариантами оставались статистически значимыми при Р ≥ 0,95 (см. рис. 1).
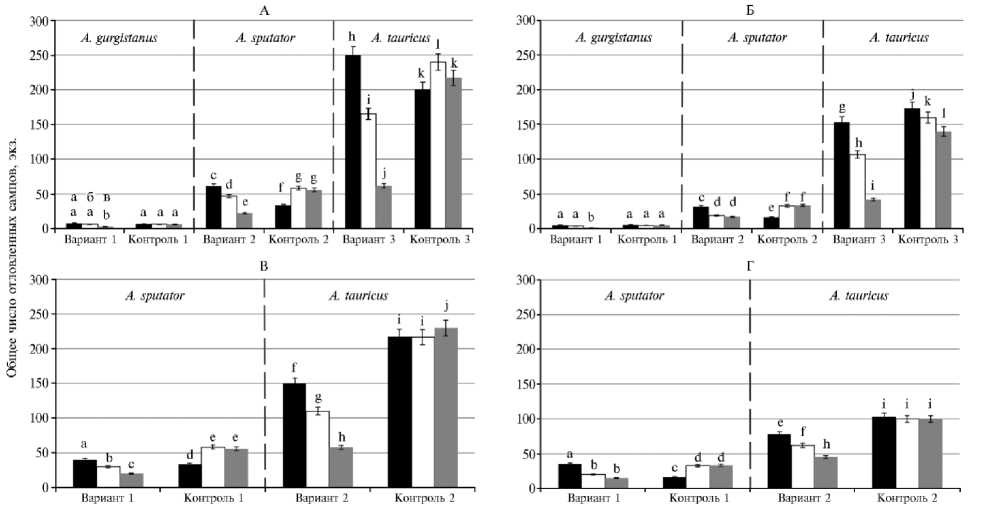
Рис. 1. Численность щелкунов рода Agriotes при внесении нематод методом автодиссеминации на посевах в разные годы: А и Б — нематода Steinernema carpocapsae , соответственно посевы кукурузы и сои, В и Г — нематода St. feltiae , соответственно посевы кукурузы и сои; 1-3 — варианты с внесением нематод, контроль — без внесения; а, б, в — соответственно 2011, 2012 и 2013 годы ( n = 10, M ±SEM, севооборот ФНЦБЗР, Краснодарский край). Разными буквами отмечены статистически значимые различия между вариантами при Р ≥ 0,95. Описание вариантов см. в разделе «Методика».
1. Результативность метода автодиссеминации энтомопатогенных нематод Steinernema carpocapsae и St. feltiae против щелкунов рода Agriotes на посевах кукурузы и сои в разные годы ( n = 10, M ±SEM, севооборот ФНЦБЗР, Краснодарский край)
|
Вид щелкунов |
Вид нематод |
Отловлено самцов, экз. |
||||||||
|
2011 год |
2012 год |
2013 год |
||||||||
|
всего, экз. |
заражены |
всего, экз. |
заражены |
всего, экз. |
заражены |
|||||
|
всего, экз. 1 |
% |
всего, экз. 1 |
% |
всего, экз. 1 |
% |
|||||
|
A. sputator |
St. ñarpocapsae |
73,0±7,0 |
65,0±5,6 |
К 89,0 |
укуруза 54,0±5,6 |
54,0±5,6 |
90,0 |
55,0±4,6a |
47,0±6,0 |
85,4 |
|
Контроль |
63,0±4,6 |
0 |
0 |
75,0±6,0 |
0 |
0 |
87,0±5,0 |
0 |
0 |
|
|
A. sputator |
St. feltiae |
40,0±5,0 |
32,0±3,5 |
80,0 |
26,0±1,8 |
26,0±1,8 |
86,7 |
23,0±2,6c |
20,0±3,3 |
86,9 |
|
Контроль |
40,0±4,0 |
0 |
0 |
50,0±5,5 |
0 |
0 |
60,0±6,2 |
0 |
0 |
|
|
A. tauricus |
St. ñarpocapsae |
150,0±10,3 |
147,0±7,8 |
98,0 |
88,0±2,7 |
88,0±2,7 |
97,7 |
60,0±7,2e |
57,0±5,2 |
95,0 |
|
Контроль |
150,0±8,0 |
0 |
0 |
160,0±9,3 |
0 |
0 |
160,0±9,6 |
0 |
0 |
|
|
A. tauricus |
St. feltiae |
68,0±4,6 |
61,0±6,2 |
89,7 |
33,0±3,6 |
33,0±3,6 |
94,2 |
25,0±4,3g |
23,0±4,3 |
92,0 |
|
Контроль |
70,0±4,3 |
0 |
0 |
79,0±6,2 |
0 |
0 |
85,0±6,5 |
0 |
0 |
|
|
A. gurgistanus |
St. ñarpocapsae |
7,0±1,8 |
6,0±3,6 |
85,7 |
4,0±1,0 |
4,0±1,0 |
80,0 |
4,0±2,5i |
3,0±1,2 |
75,0 |
|
Контроль |
5,0±2,5 |
0 |
0 |
6,3±1,5 |
0 |
0 |
7,0±1,0 |
0 |
0 |
|
|
A. sputator |
St. ñarpocapsae |
30,0±6,1 |
27,0±4,3 |
90,0 |
Соя 23,0±3,6 |
23,0±3,6 |
92,0 |
15,0±2,6 |
15,0±2,6 |
83,3 |
|
Контроль |
31,0±4,8 |
0 |
0 |
38,0±3,6 |
0 |
0 |
43,0±6,9 |
0 |
0 |
|
|
A. sputator |
St. feltiae |
17,0±3,6 |
15,0±2,8 |
88,2 |
8,0±1,6 |
8,0±1,6 |
80,0 |
7,0±1,6 |
7,0±1,6 |
87,5 |
|
Контроль |
15,0±4,2 |
0 |
0 |
21,0±2,6 |
0 |
0 |
25,0±3,6 |
0 |
0 |
|
|
A. tauricus |
St. ñarpocapsae |
130,0±6,2 |
122,0±6,9 |
93,8 |
63,0±7,9 |
63,0±7,9 |
90 |
47,0±5,3 |
47,0±5,3 |
79,6 |
|
Контроль |
130,0±7,9 |
0 |
0 |
146,0±8,5 |
0 |
0 |
150,0±6,6 |
0 |
0 |
|
|
A. tauricus |
St. feltiae |
50,0±4,9 |
45,0±5,3 |
90,0 |
26,0±4,0 |
26,0±4,0 |
92,8 |
21,0±2,1 |
21,0±2,1 |
95,4 |
|
Контроль |
48,0±5,2 |
0 |
0 |
53,0±6,3 |
0 |
0 |
60,0±6,5 |
0 |
0 |
|
|
A. gurgistanus |
St. ñarpocapsae |
5,0±1,5 |
3,0±0,8 |
60,0 |
2,0±0,4 |
2,0±0,4 |
66,7 |
2,0±0,2 |
2,0±0,2 |
100 |
|
Контроль |
4,0±1,3 |
0 |
0 |
6,0±1,8 |
0 |
0 |
5,0±1,3 |
0 |
0 |
|
Примечание. Контроль — без внесения нематод. Разными буквами отмечены статистически значимые различия по числу отловленных насекомых между опытными и контрольными вариантами в разные годы и на разных культурах при Р ≥ 0,95.
Период гибели имаго составлял 4-5 сут, что создавало условия для распространения инфекции. Доля особей, зараженных нематодами St. car-pocapsae , достигала для A. sputator 83,3-92,0 %, для A. tauricus — 79,6-98,0 %, для A. gurgistanus — 60,0-100 %, для насекомых, зараженных St. feltiae , значения составили для A. sputator — 80,0-88,2 %, A. tauricus — 9,7-94,2 % (табл. 1). Число инвазионных личинок нематод, выделившихся из одного насекомого, составило для A. sputator 8,8½104 экз., для A. gurgistanus — 9,1½104 экз., тогда как для A. tauricus — 1,25½105 экз., что предполагает привнесение в окружающую среду более 10 млн особей энтомопатогенов и активацию природных популяций ЭПН.
Дополнительное внесение нематод в почву, по нашим наблюдениям и как это ранее отмечал Л.Г. Данилов с соавт. (41), может вызывать изменение этологии у насекомых. У проволочников это выражается в том, что зараженные нематодами личинки выползают на поверхность почвы, становясь в результате более доступными для энтомофагов (хищных жужелиц) и позвоночных животных.
Необходимо отметить, что в 2011-2013 годах наблюдалось снижение численности отловленных в феромонные ловушки самцов жуков-щелкунов, а также поврежденности растений кукурузы и сои вредителями на 13,2 % по сравнению с участками, где применялась традиционная система защиты с использованием химических инсектицидов (обработка семян препаратом Cruiser®, КС, «Syngenta», Швейцария), и не были обнаружены личинки щелкунов в почвенных раскопах, что стало результатом проведенной в 20112013 годах диссеминации энтомопатогенных нематод.
Автодиссеминацию ЭПН в яблоневых садах осуществляли также в течение 3 лет на двух участках с разной интенсивностью проводимых ранее химических обработок. Наши исследования показали возможность использования нематод для автодиссеминации против яблонной плодожорки в саду, поскольку в ловушках по контролю численности в обоих садовых агроценозах были обнаружены бабочки яблонной плодожорки Cydia pomo-nella , зараженные патогенами, а в саду ФНЦБЗР — и восточной плодожорки Grapholitha molesta (Busck, 1916) (табл. 2). Процент чешуекрылых, в которых были выявлены энтомопатогены, оказался примерно одинаков —30,335,3 %. Число гельминтов, выделившихся из одного насекомого, составляло для C. pomonella 1½104, для G. molesta — 1½103 экз. инвазионных личинок.
2. Эффективность метода автодиссеминации энтомопатогенных нематод Stei-nernema carpocapsae и St. feltiae в яблоневом саду ( n = 10, M ±SEM, Краснодарский край, 2013-2015 годы)
|
Вариант |
Число отловленных насекомых |
|||
|
всего, экз. |
из них зараженных нематодами, % |
|||
|
фитофагов |
энтомофагов |
фитофаги |
энтомофаги |
|
|
ЯП ВП |
З ПП |
ЯП ВП |
З ПП |
|
|
Сад учхоза «Кубань» |
|
Опыт 20,0±1,7a 0 0 20,0±0,6c 30,3 0 0 0 |
|
Контроль 40,0±2,2b 0 0 10,0±0,8d 0 0 0 0 |
|
Сад ФНЦБЗР |
|
Опыт 37,0±3,5a 99,0±3,5e 9,0±1,1g 62,0±1,9i 35,3 34,0 0 0 |
|
Контроль 45,0±3,3b 120,0±4,1f 2,0±0,6h 10,0±1,7j 0 0 0 0 |
Примечание. Контроль — без внесения нематод. ЯП — яблонная плодожорка Cydia pomonella, ВП — восточная плодожорка Grapholitha molesta, З — златоглазка Chrysoperla carnea, ПК — перепончатокрылые Hymenoptera. Разными буквами отмечены статистически значимые различия по числу отловленных насекомых между опытными и контрольными вариантами при Р ≥ 0,95.
В результате испытаний в саду, как и в севообороте пропашных культур, было выявлено снижение числа насекомых, отловленных в ловушки.
Отмечалось уменьшение поврежденности плодов (примерно на 10 %) по сравнению с участками, где применялись стандартные системы защиты, учитывая, что даже в экологических садах проводится как минимум 4-5 обработок различными химическими препаратами (6).
При этом среди отловленных энтомофагов — златоглазок Chrysoperla carnea St. и перепончатокрылых (отряд Hymenoptera Linnaeus, 1758) семейства Braconidae Latreille, 1829, в частности Ascogaster quadridentatus Wesmael, 1835, A. rufidens Wesmael, 1835, Microdus rufipas Nees, 1814, а также семейства Ichneumonidae Latreille, 1802, которое было представлено видами Liotryphon crassisetus (Thomson, 1877), L. caudatus (Ratzeburg, 1848) и L. punctulatus (Ratzeburg, 1848), насекомых, зараженных нематодами, мы не выявили.
Иными словами, определенные группы энтомофагов оказались толерантными к воздействию энтомонематод. Еще в 2008 году С.Г. Даниловым и соавт. (41) было высказано предположение о том, что постоянное, проводившееся в течение ряда лет применение ЭПН в яблоневом саду способствует повышению как количественного, так и качественного разнообразия видового состава энтомофагов. В нашем исследовании эта гипотеза нашла подтверждение. Так, число представителей Hymenoptera , выявленных во второй половине августа, было значительно больше. При этом в саду ФНЦБЗР, где проводились испытания метода, мы регистрировали увеличение видового разнообразия перепончатокрылых (с четырех видов до шести) и зараженности гусениц C. pomonella с 6 % до 15 % (рис. 2).
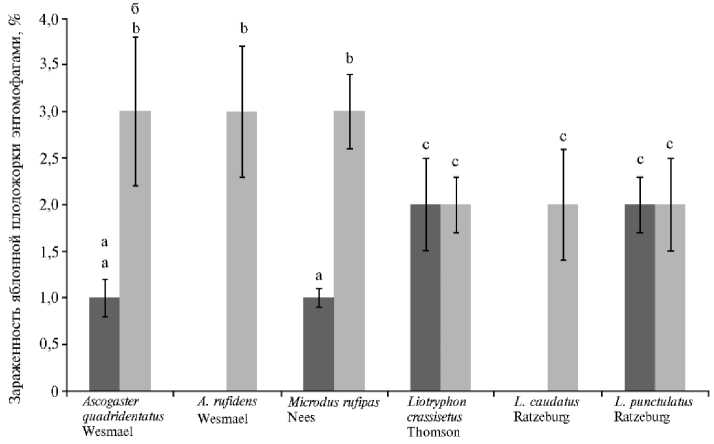
Рис. 2. Зараженность яблонной плодожорки Cydia pomonella энтомофагами семейств Braconidae и Ichneumonidae (отряд Hymenoptera ) в 2013 году (а) и в 2015 году (б) (общий объем выборки — 100 особей, число повторностей — 4; M ±SEM, сад ФНЦБЗР, Краснодарский край). Разными буквами отмечены статистически значимые различия по числу энтомофагов в разные годы исследований при Р ≥ 0,95.
В ряде работ сообщается (16, 42, 43), что в качестве агентов автодис-семинации, причем довольно успешно, в ловушках различного типа (феромонных, световых и т.д.) используются преимущественно энтомопатоген-ные грибы и вирусы. Внесение энтомопатогенных нематод осуществляется в основном традиционными методами — при опрыскивании, внесении в почву перед посевом сельскохозяйственных культур, при поливе, обработке приствольных кругов в садах и другими способами (21, 44, 45). Предлагаемый нами метод биологического контроля вредителей посредством автодиссе-минации ЭПН позволяет расширить набор приемов для применения этих энтомопатогенов.
Результаты наших исследований продемонстрировали, что автодис-семинация ЭПН благоприятно сказывалась и на повышении инвазионной активности природных популяций энтомогельминтов в яблоневом саду. Так, почвенные биотесты с использованием G. melonella показали увеличение числа инвазионных личинок ЭПН вида St. ñarpocapsae в расчете на одну гусеницу через 2 мес после проведения автодиссеминации по сравнению с результатами, полученными перед проведением экспериментов (табл. 3). Увеличение активности местных популяций патогенов при внесении в почву новых для агроценоза видов отмечали еще Л.Г. Данилов c соавт. (41), но в этом случае в яблоневом саду применяли обработку приствольных кругов биопрепаратами на основе суспензий энтомопатогенных нематод. Имеются данные, например сообщение N. Somasekhar c соавт. (46), о положительном влиянии вносимых при обработках штейнерматид на аборигенные виды нематод, обитающих в почвах агроценозов.
После проведения экспериментов нематоды St. ñarpocapsae были также выявлены в почве зернопропашного севооборота ФНЦБЗР, причем патогены сохранялись не только в течение всего периода проведения исследования: в результате был создан устойчивый очаг инфекции, действующий на протяжении нескольких лет (см. табл. 3).
При сравнении числа нематод St. ñarpocapsae , отловленных на тест-объект, с аналогичными показателями на участках, где проводилась традиционная защита от вредителей, прослеживалась положительная динамика, тогда как в контроле этого не наблюдалось (см. табл. 3).
3. Численность личинок Steinernema ñarpocapsae , отловленных в почве (биотест с Galleria melonella ) , при применении автодиссеминации с использованием нематод семейства Steinernematidae ( M ±SEM, Краснодарский край, 20112015 годы)
|
Вариант |
Глубина, см |
|
|
5 1 |
10 |
|
Севооборот ФНЦБЗР (2011-2013 годы)
|
Перед экспериментом, экз. |
0 |
0 |
|
После эксперимента, экз.: |
||
|
через 2 мес |
50,0±4,2 |
20,0±2,3 |
|
через 1 год |
40,0±2,1 |
20,0±1,5 |
|
Контроль (без автодиссеминации), экз. |
0 |
0 |
|
Сад учхоза «Кубань» (2013-2014 годы) |
||
|
Перед экспериментом, экз. |
20,0±2,6 |
0 |
|
После эксперимента, экз.: |
||
|
через 2 мес |
50,0±3,1 |
30,0±1,8 |
|
Контроль (без автодиссеминации), экз. |
17,0±2,2 |
0 |
|
Сад Перед экспериментом, экз. |
ФНЦБЗР (2014-2015 годы) 90,0±3,3 |
50,0±2,9 |
|
После эксперимента, экз.: |
||
|
через 2 мес |
150,0±4,0 |
100,0±3,9 |
|
через 1 год |
140,0±4,6 |
110,0±4,1 |
|
Контроль (без автодиссеминации), экз. |
80,0±3,3 |
40,0±1,9 |
Таким образом, мы изучили возможность применения энтомопато-генных нематод семейства Steinernematidae для защиты кукурузы, сои и яблоневого сада от ряда вредителей с помощью метода автодиссеминации. Установлено, что распространяемые путем автодиссеминации энтомопато-генные нематоды заражали 60,0-100 % самцов жуков-щелкунов семейства Elateridae и 30,3-5,5 % бабочек яблонной и восточной плодожорок, то есть предложенный метод пригоден для использования наряду с традиционными 532
приемами внесения патогенов в агроэкосистемы. Это особенно актуально для органического сада, где запрещены любые химические инсектициды. Важно отметить, что использование автодиссеминации в яблоневом саду и севооборотах позволило затронуть определенные группы насекомых, не причиняя вреда полезным организмам, кроме того, на всех участках, где проводились испытания автодиссеминации, выявлено, что внесение в агроценоз нового вида патогена благоприятно влияло на инвазионную активность местных популяций энтомопатогенных нематод.
Мы выражаем благодарность к.б.н. В.В. Костюкову за помощь в установлении видовой принадлежности энтомофагов из семейств Braconidae и Ichneumonidae.
Список литературы Биологический контроль вредителей сельскохозяйственных культур с использованием метода автодиссеминации энтомопатогенных нематод семейства Steinermatidae (Nematoda: Rhabditida)
- Исмаилов В.Я., Агасьева И.С. Практическое использование синтетических феромонов основных вредителей яблони. Агро ХХI, 2003, 1-6: 72-74.
- Kirsch Ph. Pheromones: their potential role in control of agricultural insect pests. American Journal of Alternative Agriculture,1988, 3(2-3): 83-97 (doi: 10.1017/S0889189300002241).
- Płuciennik Z. The control of codling moth (Cydia pomonella L.) population using mating disruption method. Journal of Horticultural Research, 2013, 21(1): 65-70 (doi: 10.2478/johr-2013-0009).
- Stelinski L.L., Gut L.J., Haas M., McGhee P., Epstein D. Evaluation of aerosol devices for simultaneous disruption of sex pheromone communication in Cydia pomonella and Grapholita molesta (Lepidoptera: Tortricidae). Journal of Pest Science, 2007, 80(4): 225-233 (doi: 10.1007/s10340-007-0176-7).
- Vernon R.S., Toth M. Evaluation of pheromones: a new trap for monitoring Agriotes lineatus and Agriotes obscurus in the Fraser Valley of British Columbia. Journal of Chemical Ecology, 2007, 33(2): 345-351 (doi: 10.1007/s10886-006-9217-6).
- Надыкта В.Д., Ниязов О.Д., Иванова Т.С., Пастарнак И.Н., Пачкин А.А. Дезориентация как метод регулирования численности яблонной плодожорки. Политематический электронный журнал КубГАУ, 2012, 1(36): 106-109.
- Charmillot P.-J., Degen Th., Pasquier D., Briand F. New pheromone-based methods for grape moth control. Journal of Pest Science, 2005, 73(5): 283-288 (doi: 10.1007/s10886-016-0722-y).
- Tokumaru S., Abe Y. Interspecific hybridization between Liriomyza sativae Blanchard and L. trifolii (Burgess) (Diptera: Agromyzidae). Applied Entomology and Zoology, 2005, 40(4): 551-555 (doi: 10.1303/aez.2005.551).
- Howse P., Armsworth C., Baxter I. Autodissemination of semiochemicals and pesticides: a new concept compatible with the sterile insect technique. In: Area-wide control of insect pests /M.J.B. Vreysen, A.S. Robinson, J. Hendrichs (eds.). Springer, Dordrecht, 2007: 275-281 (doi: 10.1007/978-1-4020-6059-5_26).
- Шамшев И.В., Гричанов И.Я. Место феромонов в фитосанитарных технологиях. Защита и карантин растений, 2008, 7: 22-23.
- Цветкова В.П., Поддубная Е.Н., Исмаилов В.Я., Журавлев С.В. Феромониторинг яблонной плодожорки — основа защитных мероприятий в садах Западной Сибири. Вестник Новосибирского ГАУ, 2008, 7: 12-22.
- Sukovata L., Czokajlo D., Kolk A., Ślusarski Sł., Jabłoński T. An attempt to control Cameraria ohridella using an attract-and-kill technique. Journal of Pest Science, 2010, 11: 111-115 (doi: 10.1007/s10340-010-0342-1).
- Sumedrea M., Marin F.C., Calinescu M., Sumedrea D., Iorgu A. Researches regarding the use of mating disruption pheromones in control of apple codling moth — Cydia pomonella L. Agriculture and Agricultural Science Procedia, 2015, 6: 171-178 (doi: 10.1016/j.aaspro.2015.08.055).
- Сугоняев Е.С., Дорошенко Т.Н., Яковук В.А., Балахнина И.В., Шевченко О.С., Васильева Л.А. Апробация программы экологического управления популяциями вредных и полезных видов членистоногих в экосистеме яблоневого сада. Наука Кубани, 2010, 2: 42-47.
- Джадд Г.Дж.Р. Применение семиохимических соединений в целях автодиссеминации энтомопатогенов, применяемых в целях контроля яблонной плодожорки: возможности и ограничения. Мат. межд. науч.-практ. конф. «Биологическая защита растений — основа стабилизации агроэкосистем». Краснодар, 2006, вып. 4: 92-93.
- Исмаилов В.Я., Пачкин А.А., Агасьева И.С. Новые технологии управления численностью вредных видов с помощью феромонов и энтомопатогенов. Мат. межд. науч.-практ. конф. «Биологическая защита растений — основа стабилизации агроэкосистем». Краснодар, 2012, вып. 7: 221-224.
- Данилов Л.Г. Методические подходы к изучению особенностей биологии энтомопатогенных нематод (Rhabditida: Steinernematidae, Haterorhabditidae) и технологические решения их эффективного использования в качестве средств биологической защиты растений. СПб, 2003.
- Штерншис М.В. Энтомопатогены — основа биопрепаратов для контроля численности фитофагов. Новосибирск, 2010.
- Mohan Sh. Entomopathogenic nematodes and their bacterial symbionts as lethal bioagents of Lepidopteran pests. Biocontrol of Lepidopteran Pests, 2015, 43(1): 273-288 (doi: 10.1007/978-3-319-14499-3_13).
- Divya K., Sankar M. Entomopathogenic nematodes in pest management. Indian Journal of Science and Technology, 2009, 2(7): 53-60 (doi: 10.17485/ijst/2009/v2i7/29499).
- Спиридонов С.Э. Применение энтомопатогенных нематод в защите растений. В сб.: Прикладная нематология /Под ред. С.В. Зиновьева, В.Н. Чижова. М., 2006: 291-311.
- Shapiro-Ilan D.I., Morales-Ramos J.A., Rojas M.G. In vivo production of entomopathogenic nemаtodes. Methods in Molecular Biology, 2016, 1477: 137-158 (doi: 10.1007/978-1-4939-6367-6_11).
- Koneru S.L., Salinas H., Flores G.E., Hong R.L. The bacterial community of entomophylic nematodes and host beetles. Molecular Ecology, 2016, 25(10): 2312-2324 (doi: 10.1111/mec.13614).
- Данилов Л.Г. Особенности инвазирования и последующего развития нематод Neoaplectana carpocapsae штамм «агриотос» при свободном контакте паразита с хозяином. В сб.: Гельминты насекомых. М., 1980: 42-46.
- Данилов Л.Г., Айрапетян В.Г. Инсектициды на основе энтомопатогенных нематод. Защитаикарантинрастений, 2012, 8: 39-43.
- Liu J., Poinar G.O. Jr., Berri R.E. Control of insect pests with entomopathogenic nematodes: the impact of molecular biology and phylogenetic reconstruction. Annual Review of Entomology, 2000, 45(1): 287-306 (doi: 10.1146/annurev.ento.45.1.287).
- Спиридонов С.Э. Энтомопаразитические и энтомопатогенные нематоды. В кн.: Патогены насекомых: структурные и функциональные аспекты /Под ред. В.В. Глупова. М., 2001.
- Эль-Диб А.М.А. Получение препаратов энтомопатогенных нематод и оценка их эффективности. Вестник Российского университета дружбы народов. Серия: Агрономия и животноводство, 2010, 3: 24-28.
- Navaneethan Th., Strauch O., Besse S., Bonhomme A., Ehlers R.-U. Influence of humidity and a surfactant-polymer-formulation on the control potential of the entomopathogenic nematode Steinernema feltiae against diapausing codling moth larvae (Cydia pomonella L.) (Lepidoptera: Tortricidae). BioСontrol, 2010, 55(6): 777-788 (doi: 10.1007/s10526-010-9299-5).
- Cruz-Martínez H., Ruiz-Vega J., Matada Mas-Ortíz P.T., Cortés-Martínez C.I., Osas-Diaz J.R. Formulation of entomopathogenic nematodes for crop pest control — a review. Plant Protection Science,2017, 53(1): 15-24 (doi: 10.17221/35/2016-PPS).
- Штерншис М.В., Андреева И.В., Цветкова В.П. Проблемы оптимизации энтомопатогенных биопрепаратов для защиты растений. ВестникНовосибирскогоГАУ, 2011, 1(17): 7-12.
- Lavelle P. Diversity of soil fauna and ecosystem function. Biology International, 1996, 33: 3-16.
- Yeates G.W. Nematodes as soil indicators: functional and biodiversity aspects. Biology and Fertility of Soils, 2003, 37(4): 199-210 (doi: 10.1007/s00374-003-0586-5).
- Grubisic D., Gotlin T., Juran I. Biological control of codling moth, Cydia pomonella Linnaeus 1785 (Lepidoptera: Tortricidae) using entomopathogenic nematode Steinernema carpocapsae Weiser 1955 (Rhabditida: Steinernematidae). Еntomologia Сroatica, 2010, 14 (3-4): 63-74.
- Исмаилов В.Я., Пушня М.В. Перспективы использования метода автодиссеминации для защиты сельскохозяйственных культур от щелкунов рода Agriotes. Мат. межд. науч.-практ. конф. «Биологическая защита растений — основа стабилизации агроэкосистем». Краснодар, 2012, вып. 7: 228-230.
- Агасьева И.С., Пушня М.В. Культивирование энтомопатогенной нематоды Neoaplectana carpocapsae на различных насекомых-хозяевах. Мат. Всероссийского науч.-практ. сов. «Экологически безопасные и беспестицидные технологии получения растениеводческой продукции». Краснодар, 1994: 220-223.
- Атанасов А.З. Семейство Ichneumonidae — Ихневмониды. В кн.: Определитель насекомых европейской части СССР /Под ред. А.З. Атанасова, В.П. Йонайтиса, Д.Р. Каспаряна, В.С. Куслицкого, А.П. Расницына, У.В. Сийтана, В.П. Толканица. Л., 1981, Т. III, Ч. 3.
- Белокобыльский С.А.Семейство Braconidae — Бракониды. В кн.: Определитель насекомых Дальнего Востока России /Под ред. С.А. Белокобыльского, В.И. Тобиаса. Владивосток, 2000, Т. IV, Ч. 4.
- Доспехов Б.А. Методика полевого опыта. М., 1985.
- Ивахненко О.А., Иванова Т.С. Оценка эффективности энтомопатогенных нематод в регулировании численности вредителей сельскохозяйственных культур в Краснодарском крае. Мат. межд. науч.-практ. конф. «Биологическая защита растений — основа стабилизации агроэкосистем». Краснодар, 2006, вып. 4: 234-235.
- Данилов Л.Г., Махоткин А.Г., Васильев С.В., Турицин В.С. Взаимодействие Steinernemacarpocapsae с фауной членистоногих и природными популяциями энтомопатогенных нематод в биотопе плодового сада. Паразитология, 2008, 42(1): 129-137.
- El-Sufty R., Al Bgham S., Al-Awash S., Shahdad A., Al Bathra A. A trap for auto-dissemination of the entomopathogenic fungus Beauveria bassiana by red palm weevil adults in Date Palm Plantations. Egyptian Journal of Pest Control, 2011, 21(2): 271-276.
- Benvenuti C., Barzanti G.P., Marianelli L., Sabbatini Peverieri G., Paoli F., Bosio G., Venanzio D., Giacometto E., Roversi P.F. A new device for auto-disseminating entomopathogenic fungi against Popillia japonica: a study case. Bulletin of Insectology, 2019, 72(2): 219-225.
- Shapiro-Ilan D.I., Han R., Dolinksi C. Entomopathogenic nematode production and application technology. Journal of Nematology, 2012, 44(2): 206-217.
- Cortés-Martínez C.I., Chavarría-Hernández N. Production of entomopathogenic nematodes in submerged monoxenic culture: a review. Biotechnology and Bioengineering, 2020, 117(12): 3968-3985 (doi: 10.1002/bit.27515).
- Somasekhar N., Grewal P.S., De Nardo E.A.B., Stinner B.R. Non-target effects of entomopathogenic nematodes on the soil nematode community. Journal of Applied Ecology,2002, 39(5): 735-744 (doi: 10.1046/j.1365-2664.2002.00749.x).


