Биомаркеры алюмотолерантности у зимостойких форм Triticum aestivum L. из коллекции ВИР им. Н.И. Вавилова
Автор: Лысенко Н.С., Малышев Л.Л., Пузанский Р.К., Шаварда А.Л., Шеленга Т.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Метаболиты, метаболомные профили
Статья в выпуске: 1 т.59, 2024 года.
Бесплатный доступ
Кислые почвы составляют около 50 % от всех посевных угодий мира, что ограничивает производство возделываемых культур. Площадь сельскохозяйственных угодий с повышенной кислотностью ежегодно увеличивается, в России она составляет примерно 30 %. В кислых почвах ионы алюминия (Al3+) - основной стрессор для растений, в том числе для пшеницы, которая считается одним из основных и экономически значимых продуктов питания. Большинство устойчивых к Al3+ генотипов представлено гексаплоидными видами пшениц с геномом D, к которым относится Triticum aestivum L. Отличительная черта озимой мягкой пшеницы заключается в сочетании устойчивости к низким температурам с хорошими хлебопекарными качествами муки. С учетом этого поиск алюмотолерантных форм T. aestivum и выявление признаков, связанных с алюмотолерантностью, которые могли бы послужить ее биомаркерами при селекции, остаются актуальной задачей. В коллекции ФИЦ Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР) большая часть гексаплоидных пшениц (44 тыс. образцов) относится к T. aestivum . Изучение генетического потенциала коллекции T. aestivum, представленной в ВИР, позволит выявить новые источники алюмотолерантности. В этом сообщении мы впервые сравнили метаболомные профили коллекционных образцов T. aestivum разного эколого-географического происхождения, адаптированных к условиям северо-запада России, и выявили их особенности у форм с низкой чувствительностью к воздействию ионов алюминия для обнаружения метаболитов - потенциальных маркеров устойчивости к ионам алюминия. Метаболомные профили (МП) 20 образцов T. aestivum (коллекция ВИР) с разной степенью чувствительности к Al3+ изучили методом неспецифического метаболомного профилирования с использованием газовой хроматографии, сопряженной с масс-спектрометрией. МП анализировали в тканях корешков 7-суточных проростков. В МП генотипов с низкой чувствительностью к Al3+ были представлены полиолы, нуклеозиды, лактонные формы органических кислот, свободные жирные кислоты и их производные, триозы, пентозы, гексозы, олигосахара, фенолсодержащие вещества, терпены, фитостеролы. Воздействие стрессора предположительно вызывает изменения в цикле Кребса, синтезе карбогидратов, растительных гормонов, других защитных факторов, глицеролипидов и триглицеридов мембранного комплекса. Методом дисперсионного анализа установлены достоверные отличия МП форм с более выраженной устойчивостью к Al3+ от остальных образцов по содержанию основных соединений, перечисленных выше. Классический дискриминантный анализ с последующим каноническим корреляционным анализом позволил выделить 11 компонентов со 100 % достоверностью разделяющих образцы T. aestivum с разной степенью алюмотолерантности. Наиболее информационно значимыми факторами, характеризующими устойчивые формы T. aestivum, оказались фосфорная, яблочная, янтарная кислоты, четырехатомный (RI = 1537) и пятиатомный (RI = 1735) спирты, метиловый эфир линолевой кислоты, которые можно рассматривать как статистически подтвержденные маркеры алюмоустойчивости (р 3+, для использования при селекции адаптированных к производству в условиях северо-запада России высокопродуктивных сортов T. aestivum с комплексной устойчивостью к стрессорам.
Triticum aestivum, алюмоустойчивость, неспецифическое метаболомное профилирование, биомаркеры, газовая хроматография с масс-спектрометрией
Короткий адрес: https://sciup.org/142241609
IDR: 142241609 | УДК: 633.111.1:631.522/.524:581.192 | DOI: 10.15389/agrobiology.2024.1.116rus
Текст научной статьи Биомаркеры алюмотолерантности у зимостойких форм Triticum aestivum L. из коллекции ВИР им. Н.И. Вавилова
Кислые почвы составляют около половины всех посевных угодий мира (1). При этом самые большие площади с избыточной кислотностью почв находятся в России (2-4), что ограничивает производство значимых сельскохозяйственных культур (5-7). Основным эдафическим стрессором кислых дерново-подзолистых почв служат катионы Al3+, или так называемый подвижный алюминий (8, 9). Кислая реакция почвы в присутствии ионов водорода и алюминия приводит к ухудшению ее физических свойств и увеличивает растворимость токсичных соединений (4). При таких усло-
∗ Работа выполнена при финансовой поддержке проекта Минобрнауки России «Национальная сетевая коллекция генетических ресурсов растений для эффективного научно-технологического развития РФ в сфере генетических технологий» по соглашению ¹ 075-15-2021-1050 от 28.09.2021.
виях макро- и микроэлементы переходят в малодоступную для растений форму (9-15). Основной симптом токсического действия ионов алюминия — ингибирование роста корней, приводящее к нарушению развития растения (6, 9-11).
Площадь сельскохозяйственных угодий с повышенной кислотностью ежегодно растет (1, 5), что обусловлено высокой миграционной способностью ионов алюминия. Это особенно важно для регионов с повышенной влажностью воздуха, где даже при умеренных осадках в почве может скапливаться избыточное количество воды (6, 11). К подобным территориям относится северо-запад Российской Федерации.
Основная часть посевов в России занята под производство озимой и яровой пшеницы (16). H. Raman с соавт. (17) показали, что устойчивые к Al3+ генотипы чаще всего встречаются среди гексаплоидных видов пшениц с геномом D.
В коллекции ФИЦ Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (коллекция ВИР) широко представлены гекса-плоидные виды пшеницы, основная часть которых относится к T. aestivum (44 тыс. образцов). Следует отметить, что отличительная особенность озимой мягкой пшеницы заключается в сочетании устойчивости к низким температурам с хорошими хлебопекарными свойствами муки, чем определяется частое использование этого вида в селекционных программах. Изучение генетического потенциала образцов T. aestivum из коллекции ВИР позволяет выявить среди форм, обладающих другими экономически значимыми признаками, новые источники алюмотолерантности. Такие формы в дальнейшем могут быть использованы в селекции высокопродуктивных сортов T. aestivum с комплексной устойчивостью к стрессовым факторам .
Ионы Al3+ действуют на проницаемость клеточных мембран, влияя на растворимость липидных и протеиновых мембранных комплексов. В результате ингибируется межклеточный транспорт, нарушается работа ионных каналов, вплоть до полной их блокировки (18, 19). Это приводит к нарушению синтеза ДНК и деления клеток, замедлению роста корней и надземных частей растения (20).
Было установлено, что обезвреживание ионов алюминия может происходить либо в апопласте (6, 8, 21-25), куда экскретируются органические кислоты, либо в цитозоле с последующей изоляцией образовавшихся хелатов в вакуоли (6, 8). Поступление органических кислот в межклеточное пространство происходит c участием анионного канала, который активируется воздействием Al3+ на TaALMT1 протеин (стимулируемый алюминием переносчик малата у T. aestivum ) (5, 26).
В связывании ионов алюминия участвуют органические кислоты, олигосахара, корневая слизь, действующая как диффузионный барьер (6). В ряде публикаций (6, 26-28) выявлено повышение содержания органических кислот (особенно яблочной и фумаровой), глюкозы, сахарозы и снижение количества фруктозы в корнях алюмоустойчивых образцов кукурузы. Сообщалось о повышенном содержании свободных жирных кислот (в том числе линолевой и линоленовой), флавоноидных гликозидов (рутин, кемп-ферол-3-O-гликозид, лютеолин-6-C-гексозил-гексозид) у алюмоустойчи-вых сортов пшеницы (29).
Таким образом, алюмотолерантность хозяйственно значимых растений остается предметом интенсивного изучения, в том числе сравнения ме-таболомных профилей. Но несмотря на то, что метаболомные исследования ведутся достаточно активно, работ по анализу алюмотолерантности у зимостойких форм, устойчивых к другим абиотическим стрессам, в доступной литературе мы не обнаружили.
В настоящем сообщении впервые приведены данные об особенностях метаболомных профилей у проростков зимостойких образцов T. aestivum с низкой чувствительностью к воздействию ионов алюминия. Выявлены метаболиты — потенциальные маркеры устойчивости к ионам алюминия.
Цель работы — методом неспецифического метаболомного профилирования с применением газовой хроматографии, сопряженной с масс-спектрометрией, выявить биомаркеры алюмоустойчивости у зимостойких образцов T. aestivum .
Методика . В исследовании использовали 20 зимостойких образцов T. aestivum из коллекции ВИР (30-33). Проростки получали из семян (от 16 до 35 шт. каждого образца в каждом варианте опыта) разных лет репродукции (коллекция ВИР) в вегетационном опыте (2019 год) в условиях Пушкинских лабораторий ВИР согласно методике (30).
Лабораторную оценку зародышевых корешков на чувствительность к ионам Al3+ проводили по методу A. Aniol в модификации (33, 34) без добавления эриохромцианинового красителя в среду. Алюмовосприимчивость у образцов определяли на ранних этапах развития растений по отрастанию корней после повреждения (34). Степень чувствительности образцов к токсическому воздействию ионов алюминия определялась по разнице средних значений длин корешков 7-суточных проростков в опыте и контроле. Для измерения визуально отбирали те проростки образца, которые имели наиболее длинные корешки.
Для определения метаболомных профилей (МП) с помощью газожидкостной хроматографии, сопряженной с масс-спектрометрией (ГХ-МС), отбирали по пять 7-суточных проростков каждого образца с диной корешка в среднем 2 см. Корешки отделяли с помощью скальпеля, взвешивали, помещали в пластиковые пробирки объемом 2 мл и заливали жидким азотом для разрушения растительных клеток. К пробам добавляли охлажденный метанол (+4 °С) до полного погружения биоматериала в растворитель и инкубировали в течение 24 ч при +4 °С. Полученный экстракт центрифугировали, надосадочную жидкость переносили в стеклянные пробирки для газовой хроматографии, помещали в вакуумный концентратор CentriVap Labconco («Labconco», США) и выпаривали до сухого остатка. Для получения летучих термостабильных триметилсилильных производных к сухому остатку добавляли 20 мкл N,O-бис(триметилсилил)трифторацета-мида с 1 % триметилхлорсиланом и нагревали в течение 15 мин при 100 °С на установке Digi-Block («Laboratory Devices, Inc.», США). В качестве внутреннего стандарта к каждой пробе добавляли 20 мкл раствора трикозана в пиридине (индекс удержания RI = 2288, концентрация 1 мкг/мкл). Для каждой пробы измерения проводили в трех аналитических повторностях. Смесь триметилсилилильных эфиров разделяли с помощью капиллярной колонки Agilent HP-5MS (30 м; 0,25 мм в диаметре; стационарная фаза: 5 % дифенил, 95 % диметилполиоксан с толщиной пленки 0,25 мкм, «Agilent Technologies», США) на газовом хроматографе Agilent 6850A, сопряженном с масс-селек-тивным детектором Agilent 5975 («Agilent Technologies», США), согласно протоколу (35). Начальная температура капиллярной колонки составляла 70 °С, конечная — 320 °С при скорости нагревания: 6 °С/мин. Скорость потока газа-носителя (гелия) соответствовала 1,5 мл/мин. Температура инжектора составляла 300 °С. Объем вводимой пробы 1 мкл, режим ввода пробы — «без сброса». Ионизацию электронным ударом проводили при 70 эВ и температуре источника ионов 230 °С. Запись хроматограммы начинали через 4 мин (время выхода растворителя) и продолжали 62 мин при режиме сканирования ионов от 70 до 600 атомных единиц массы с регистрацией полного ионного тока; скорость сканирования — 2 спектра/с. Метаболиты (триметилсилилильные производные) идентифицировали по масс-спектрам и индексам удерживания Ковача (RI) с использованием программы AMDIS (Automated Mass Spectral Deconvolution and Identification System, National Institute of Standards and Technology, USA, Version 2.69, , библиотеки масс-спектров NIST 2010 (National Institute of Standards and Technology, USA, и in-house библиотек Научного парка Санкт-Петербургского университета и Ботанического института РАН им. В.Л. Комарова (27, 36). Индексы удерживания оценивали с помощью калибровки по нормальным алифатическим углеводородам с длиной углеродной цепи С10-С40. Метаболит считали идентифицированным, если коэффициент совпадения (match factor) полученного и библиотечного масс-спектра был более 800. Полуколичественный анализ полученных метаболитных профилей проводили с помощью программы AMDIS по полному ионному току с учетом внутреннего стандарта. Данные представлены в мВ.
Статистическую обработку данных выполняли с помощью программы Statistica 12 («StatSoft, Inc.», США; 2019) . При оценке роста и развития корешков как показателя чувствительности к хлориду алюминия учитывали минимальные и максимальные значения (min-max), рассчитывали средние (М) и стандартные ошибки средних (±SEM). Достоверность влияния массы корешка проростка и разницы в длине корешка у образца в присутствии и в отсутствие хлорида алюминия в среде (опыт и контроль) на распределение образцов T. aestivum по чувствительности к ионам алюминия оценивали с помощью однофакторного дисперсионного анализа с использованием F-критерия Фишера. Для выявления компонентов, достоверно дифференцирующих образцы T. aestivum на группы с разной степенью алюмотолерантности, использовали классический дискриминантный анализ с последующим каноническим корреляционным анализом. Информационно значимыми считали метаболиты, для которых была достоверно установлена принадлежность образцов к группе восприимчивых или чувствительных к ионам алюминия, что подтверждалось F-критерием Фишера (р не менее 0,05).
Результаты . Из коллекции ВИР мы отобрали для изучения следующие образцы T. aestivum (табл. 1):
1. Зимостойкие образцы Triticum aestivum из коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР) , отобранные для исследования (2019 год)
|
¹ в каталоге ВИР |
1 Сорт |
1 Происхождение |
^ Год репродукции |
|
к-29466 |
РПГ 27/36 |
Россия, Саратовская область |
2019 |
|
к-32715 |
Без названия |
Россия, Владимирская область |
2019 |
|
к-45885 |
Мироновская юбилейная |
Украина (до 1991 года) |
2019 |
|
к-57573 |
Белоснежная |
Россия, Ростовская область |
2019 |
|
к-58321 |
Стремнина |
Россия, Самарская область |
2019 |
|
к-59261 |
Северная заря |
Россия, Омская область |
2019 |
|
к-59269 |
Немчиновская 52 |
Россия, Московская область |
2019 |
|
к-62431 |
Казанская 84 |
Россия, Республика Татарстан |
2019 |
|
к-63040 |
Зимородок |
Россия, Краснодарский край |
2019 |
|
к-63353 |
Majoral |
Франция |
2019 |
|
к-63401 |
Руфа |
Россия, Краснодарский край |
2019 |
|
к-63521 |
Agassir |
США |
2019 |
|
к-63523 |
Vista |
США |
2019 |
|
к-63562 |
S89-142 |
Канада |
2019 |
|
к-63568 |
Родник тарасовский |
Россия, Ростовская область |
2019 |
|
к-63930 |
Арфа |
Россия, Ростовская область |
2019 |
|
к-64032 |
Fazit |
Германия |
2019 |
Продолжение таблицы 1
к-64163 CDC Harrier к-64180 Fatima к-64278 Безенчукская 616
Канада2019
Венгрия2019
Россия, Самарская область2019
Это зимостойкие образцы, которые выделили в результате полевых испытаний, проведенных в период с 2007 по 2019 год в Северо-Западном регионе РФ (г. Пушкин, Ленинградская обл., N59 ° 41‘ E30 ° 20‘) (31, 32). Степень зимостойкости определяли по изреженности всходов на делянках в октябре перед уходом в зиму и в апреле после зимовки с использованием шкалы, разработанной в ВИР (30). Полная гибель растений оценивалась как 0 баллов, очень низкая зимостойкость (сохранилось < 30 % всходов) — 1 балл, низкая зимостойкость (31-50 %) — 3 балла, средняя (51-70 %) — 5 баллов, высокая (71-90 %) — 7 баллов и очень высокая (> 90 %) — 9 баллов (21). Зимостойкими считались образцы, оценка которых была выше 7 баллов (32). В опыт мы брали образцы со средней, высокой и очень высокой степенью зимостойкости.
К наиболее показательным признакам токсического действия ионов алюминия на проростки T. aestivum относят длину и массу корней (9, 23). По чувствительности корешков проростков T. aestivum к ионам алюминия образцы в нашем опыте разделились на три группы (табл. 2). Первая группу включала 2 образца с наименьшей разницей между опытом и контролем по длине корешков (2,2-3,0 см) и низкой чувствительностью к Al3+, вторая — 13 образцов со средней величиной разницы (3,1-3,9 см) и средней чувствительностью к Al3+, третья — 5 образцов с максимальной разницей (4,04,5 см) и высокой чувствительностью к Al3+.
2. Распределение изученных зимостойких образцов Triticum aestivum (коллекция ВИР) по длине корешков у 7-суточных проростков и массе корешков в присутствии Al3+ (лабораторный опыт, 2022 год)
|
¹ в каталоге ВИР |
Группа |
n |
Длина корешков, см; min-max, M ±SEM |
Масса корешков, г (опыт) |
||
|
контроль |
опыт |
разница |
||||
|
57573 |
1-я |
24 |
2,2-8,3 5,9±0,4 |
2,0-5,7 3,6±0,2 |
2,3 |
0,109 |
|
63523 |
1-я |
27 |
2,4-7,0 5,3±0,5 |
1,2-4,4 2,8±0,3 |
2,5 |
0,133 |
|
29466 |
2-я |
30 |
7,2-10,2 8,8±0,2 |
3,4-6,8 5,1±0,1 |
3,7 |
0,131 |
|
32715 |
2-я |
30 |
6,7-10,5 8,0±0,2 |
3,6-5,5 4,3±0,1 |
3,8 |
0,118 |
|
45885 |
2-я |
27 |
3,7-9,2 7,0±0,3 |
2,2-5,4 3,6±0,1 |
3,4 |
0,140 |
|
58321 |
2-я |
24 |
6,7-10,8 8,4±0,2 |
2,5-6,9 5,0±0,2 |
3,4 |
0,106 |
|
59261 |
2-я |
32 |
6,7-10,0 8,4±0,2 |
3,0-6,1 4,8±0,2 |
3,6 |
0,102 |
|
59269 |
2-я |
24 |
3,7-9,3 7,4±0,4 |
2,1-5,2 3,6±0,2 |
3,8 |
0,139 |
|
63040 |
2 я |
28 |
5,1-10,0 8,1±0,3 |
3,2-5,8 4,5±0,1 |
3,5 |
0,151 |
|
63401 |
2 я |
30 |
4,5-9,0 7,7±0,2 |
3,1-10,0 4,3±0,3 |
3,4 |
0,153 |
|
63521 |
2 я |
29 |
3,7-9,3 7,4±0,4 |
2,1-5,2 3,6±0,2 |
3,8 |
0,154 |
|
63568 |
2 я |
27 |
4,4-8,2 7,0±0,3 |
2,1-5,2 3,4±0,1 |
3,7 |
0,144 |
|
63930 |
2 я |
28 |
6,3-15,2 9,2±0,5 |
4,0-7,3 5,8±0,2 |
3,5 |
0,156 |
|
64032 |
2 я |
16 |
5,0-11,5 8,7±0,3 |
3,0-8,3 5,6±0,3 |
3,1 |
0,076 |
|
64163 |
2 я |
29 |
5,0-9,3 7,7±0,2 |
3,0-8,3 4,3±0,2 |
3,4 |
0,123 |
|
64180 |
3 я |
30 |
6,6-11,0 8,4±0,2 |
2,7-5,5 3,9±0,1 |
4,5 |
0,234 |
Продолжение таблицы 2
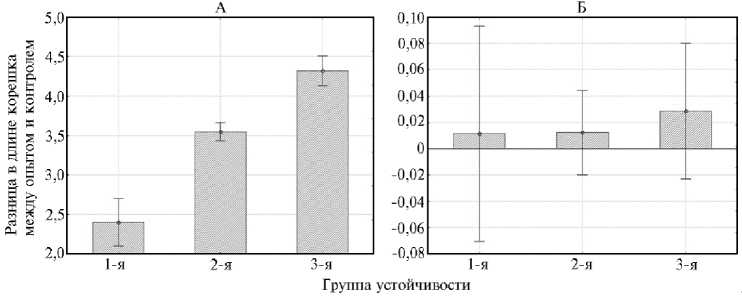
Рис. 1. Дисперсионный анализ разницы в длине корешка у 7-суточных зимостойких проростков Triticum aestivum (коллекция ВИР) в присутствии и в отсутствие Al3+ (соответственно опыт и контроль) (А) и массы корешков (Б) (лабораторный опыт, 2022 год). Размеры выборок соответствуют указанным в таблице 2.
|
64278 |
3 я |
28 |
6,9-11,2 9,2±0,2 |
2,5-7,5 4,7±0,2 |
4,5 |
0,190 |
|
62431 |
3 я |
20 |
4,4-9,0 7,3±0,2 |
1,0-4,2 3,3±0,2 |
4,1 |
0,121 |
|
63353 |
3 я |
29 |
5,0-11,1 8,7±0,3 |
2,8-6,3 4,6±0,2 |
4,2 |
0,165 |
|
63562 |
3 я |
25 |
5,5-9,5 8,0±0,2 |
2,2-4,5 3,7±0,1 |
4,3 |
0,160 |
Пр и меч ани е. Образцы T. aestivum разделены на группы по чувствительности к AlCl 3 на основании различий по длине корешка проростков как показателя чувствительности к хлориду алюминия; 1-я группа — образцы с низкой чувствительностью; 2-я группа — образцы со средней чувствительностью, 3-я группа — образцы с высокой чувствительностью к воздействию Al3+. Указана масса корешков (по 5 на образец в опыте), взятых для экстракции.
Достоверность влияния параметров, приведенных в таблице 2, на распределение образцов T. aestivum в соответствии с чувствительностью к ионам алюминия проверили с помощью дисперсионного анализа (рис. 1, А, Б). Оказалось, что на распределение образцов T. aestivum по группам устойчивости к Al3+ достоверно влияет только разница длин корешков между опытом и контролем (см. рис. 1, А, F = 68,68; p = 0,05); влияние массы корешков было недостоверным (см. рис. 1, Б, F = 0,17; p = 0,847). Следует, однако учитывать, что при увеличении размера анализируемой выборки T. aestivum достоверность влияния фактора «группа устойчивости» на массу корешка у проростков, как и влияние массы корешка на распределение образцов по группам устойчивости могут быть выше.
По результатам неспецифического метаболомного профилирования у образцов из разных групп устойчивости к Al3+ мы выявили в МП около 500 пиков. Почти 250 веществ было идентифицировано до класса, 120 — до конечного соединения (табл. 1 Приложения, см. . Идентифицированные вещества были разделены на 19 основных групп (см. табл. 1 Приложения, см. : 33 кислоты, 13 полиолов и их производных, 2 пиридина, 22 свободные жирные кислоты и их производные, 2 моноацилглицерола, 12 свободных аминокислот, циклический амид (2-пирролидинон), 7 метиловых производных моносахаров, 38 моносахаров (триоза, пентозы, гексозы), 90 олигосахаров, 10 фенолсодержащих соединений, 2 терпена, 11 фитостеролов, амиды и амины (дециламин, карбамид), 4 лактонные формы органических кислот, 6 производных органических кислот и фосфорной кислоты, куда вошли эфиры органических и эфиры фосфорной кислот, 2 алкана, 3 нуклеозида и неидентифицированные компоненты.
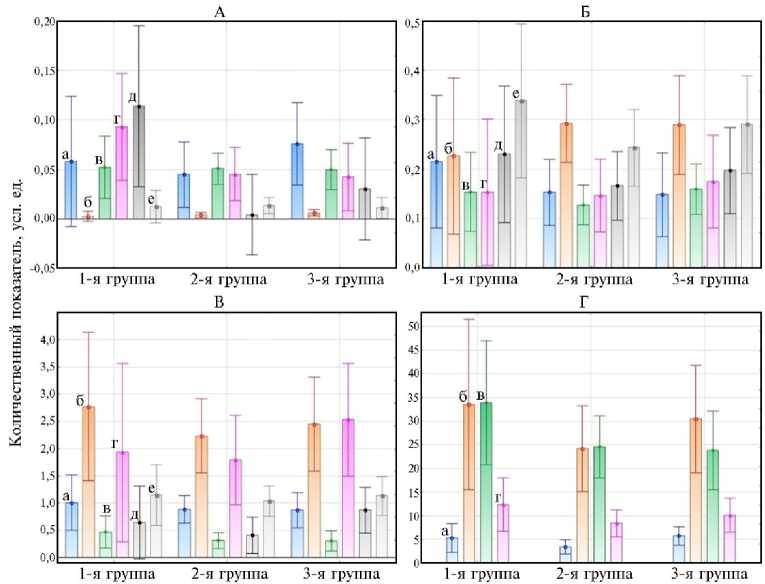
Рис. 2. Основные соединения, выявленные в метаболомных профилях корешков у 7-суточных зимостойких проростков Triticum aestivum (коллекция ВИР) из групп с разной чувствительностью к ионам алюминия : А — пиридины (а), циклический амид (б), алканы (в), триозы (г), терпены (д), амины и амиды (е); Б — лактоны (а), производные (эфиры органических кислот и фосфорной кислоты) (б), моноацилглицеролы (г), пентозы (д), фенолсодержащие соединения (е); В — полиолы и их производные (а), свободные жирные кислоты и их производные (б), нуклеозиды (в), свободные аминокислоты (г), производные моносахаров (д), фитостеролы (е); Г — органические кислоты (а), гексозы (б), олигосахара (в), неидентифицированные компоненты (г) (газовый хроматограф Agilent 6850A, сопряженный с масс-селективным детектором Agilent 5975, «Agilent Technologies», США; 2022 год). Приведены результаты в расчете на массу пяти корешков для каждого образца с усреднением по группе. Размеры выборок соответствуют указанным в таблице 1. Измерения выполнены в 3 аналитических повторностях.
В МП образцов с низкой чувствительностью к ионам алюминия доминировали полиолы, нуклеозиды, лактонные формы органических кислот, свободные жирные кислоты и их производные, моносахара, олигосахара, фенолсодержащие вещества, терпены, фитостеролы; с высокой чувствительностью — органические кислоты, пиридины, моноацилглицеролы, свободные аминокислоты, производные моносахаров. МП образцов со средней чувствительностью к Al3+ не имели выраженных особенностей (рис. 2, А-Г). Метиловые эфиры органических кислот, эфиры фосфорной кислоты и алканы были в равной степени представлены у всех групп образцов T. aestivum .
Несмотря на отмеченные различия, МП образцов с разной устойчивостью к ионам алюминия были в целом сходны. Явным исключением оказалась группа лактонов. Для МП образцов со средней и низкой устойчивостью к Al3+ была характерна более выраженная представленность лактона арабиновой кислоты (RI = 1657) и 1,5-лактона глюконовой кислоты (RI = 1696), тогда как для МП образцов с высокой устойчивостью к Al3+ — только лактона арабиновой кислоты (RI = 1657). Можно предположить, что лактоны сахарных кислот участвуют в защите растения от Al3+, которую чаще всего связывают с образованием хелатных комплексов (6, 8) между ионами алюминия и органическими кислотами, в нашем наблюдении — с лактонными формами сахарных кислот. Кроме того, наличие этих соединений может быть сопряжено с более интенсивным образованием (под воздействием стрессора) корневой слизи, в состав которой они могут входить (6, 8, 21-24).
Дисперсионный анализ всей совокупности метаболитов, кроме не-идентифицированных, показал, что у проростков с более выраженной устойчивостью к Al3+ (1-я группа) МП корешков достоверно отличается от МП других групп значениями для янтарной, каприловой, стеариновой, олеиновой, линолевой кислот, метиловых эфиров фосфорной кислоты, этиловых эфиров пальмитиновой и линоленовой кислот, у образцов со средней чувствительностью (2-я группа) — значениями для ряда олигосахаров (RI = 2730, RI = 294, RI = 3625, RI = 3189). У образцов, чувствительных к воздействию ионов алюминия (3-я группа), мы не выявили достоверных особенностей МП. Однако, учитывая различия, близкие к достоверным (0,1 > ρ > 0,05), можно отметить, что для МП образцов из 3-й группы были характерны более выраженные изменения по сумме терпенов, в том числе люпеола (табл. 2 Приложения, .
У устойчивых образцов увеличение концентрации янтарной и фосфорной кислот в МП может быть связано с их накоплением для нейтрализации Al3+. Есть мнение, что помимо органических кислот в связывании ионов алюминия участвует корневая слизь, выделяемая внешними слоями корневого чехлика (6). С действием этого механизма защиты, возможно, связаны изменения в составе олигосахаров у образцов T. aestivum со средней чувствительностью к Al3+. Олигосахара могут входить в состав корневой слизи, действующей как диффузионный барьер, ограничивая попадание Al3+ внутрь клеток корня растения (6). Кроме того, олигосахара накапливаются в результате разрушения клеточных стенок гидролазами в ответ на действия стрессора (37). Люпеол, как и другие терпеноиды, тоже служит фактором защиты растений от солевого стресса (38), поэтому можно предположить, что установленное нами накопление терпенов в корешках проростков T. aestivum , чувствительных к воздействию ионов алюминия, инициируется воздействием стрессора.
Таким образом, под влиянием ионов алюминия у проростков T. aestivum наблюдаются изменения карбогидратного, энергетического, липидного обмена и биосинтеза вторичных метаболитов. Синтез как некоторых органических кислот, так и всего их пула может быть вызван контактом со стрессором (ионами алюминия) и активацией механизма нейтрализации ионов посредством образования хелатов (5, 6, 8, 26, 39). Накопление свободных жирных кислот и их эфиров также является ответной реакцией на стресс и может отражать изменения в мембранном комплексе (глицероли-пидах, триглицеридах), активизацию синтеза антистрессовых растительных гормонов (жасмоновая кислота, нитроалкены), предшественниками которых они являются (40-43). Суммируя, можно предположить, что в нашем исследовании ионы алюминия оказали наиболее существенное влияние на цикл Кребса, синтез карбогидратов, растительных гормонов, других защитных факторов, глицеролипидов и триглицеридов мембранного комплекса.
Классический дискриминантный анализ с последующим каноническим анализом позволил выделить 11 компонентов, со 100 % достоверностью разделяющих образцы T. aestivum с разной степенью алюмотолерантности
(табл. 3 Приложения, . Это фосфорная, яблочная, 2-деоксирибоновая, янтарная, каприловая кислоты, четырехатомный (RI = 1537) и пятиатомный (RI = 1735) спирты, метиловые эфиры олеиновой, линолевой кислот, моноацилглицерол [16:0/0:0/0:0], олигосахар (RI = 2749), Из перечисленных веществ наиболее информационно значимыми (p < 0,05) оказались фосфорная, яблочная, янтарная кислоты, четырехатомный (RI = 1537) и пятиатомный (RI = 1735) спирты, метиловый эфир линолевой кислоты.
1-я группа
2-я группа
3-я ip'.nii.i
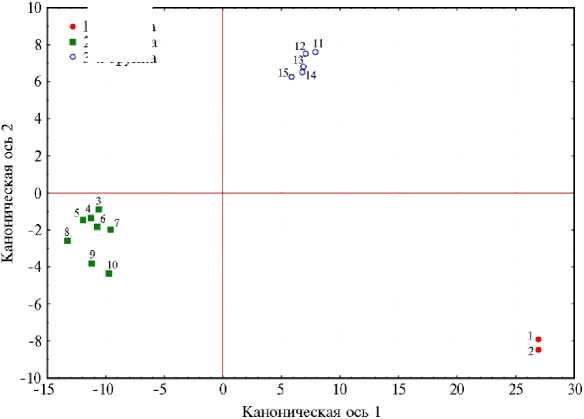
Рис. 3. Распределение 15 образцов Triticum aestivum (коллекция ВИР) из групп с разной чувствительностью к ионам алюминия в пространстве канонических осей: 1-я группа — с высокой алюмотолерантностью, 2-я группа — со средней, 3-я группа — с низкой алюмотолерантностью; 1 — к-45885, 2 — к-64032, 3 — к-64163, 4 — к-59261, 5 — к-32715, 6 — к-59269, 7 — к-63568, 8 — к-63930, 9 — к-63401, 10 — к-29466, 11 — к-62431, 12 — к-61180, 13 — к-63562, 14 — к-62521, 15 — к-64278 (лабораторный опыт, 2022 год). Анализ выполнен по результатам метаболомного профилирования, см. рис. 2, табл. 4 Приложения).
На рисунке 3 представлено распределение образцов T. aestivum с разной чувствительностью к ионам алюминия (1-3-я группы) в пространстве канонических осей. В качестве переменных выступают канонические функции (ось 1 и ось 2, табл. 4 Приложения, по 11 показателям, вошедшим в модель в процессе классического пошагового дискриминантного анализа. По канонической оси 1 (или Root 1), охватывающей 86,5 % дисперсии, 2-я группа образцов (со средним уровнем алюмоустойчивости) обособляется от 1-й и 3-й групп. По оси 2 (или Root 2, 13,5 % дисперсии) разделяются 1-я и 3-я группы анализируемых образцов. При этом 1-я и 3-я группы образуют компактные кластеры в отличие от 2-й группы. Наиболее значимыми дискриминирующими факторами оказались шесть метаболитов: фосфорная, яблочная, янтарная кислоты, четырехатомный (RI = 1537) и пятиатомный (RI = 1735) спирты и метиловый эфир линолевой кислоты (табл. 3 Приложения, , они достоверно (p < 0,05) характеризуют устойчивые к ионам алюминия формы T. aestivum, изученные нами в настоящей работе, и являются статистически подтвержденными маркерами алюмоустойчивости.
Обсуждая полученные нами результаты, следует отметить, что мета-боломные исследования хозяйственно значимых растений с разной степенью устойчивости к ионам алюминия и работы по выявлению маркеров алюмотолерантности немногочисленны, хотя алюмотолерантность остается предметом интенсивного изучения.
Сообщалось (6, 27, 28), что содержание органических кислот (особенно яблочной и фумаровой), глюкозы, сахарозы повышалось, а количества фруктозы снижалось в корнях алюмоустойчивых образцов кукурузы. У изученных нами алюмотолерантных образцов T. aestivum МП отличался от остальных МП по количественным показателям янтарной и каприловой кислот, метиловых эфиров фосфорной кислоты и эфиров свободных жирных кислот, в числе которых есть и предшественники растительных гормонов (40-42). Яблочная кислота не вошла в перечень достоверных признаков, отличающих устойчивые к ионам алюминия формы T. aestivum от неустойчивых, хотя выделение преимущественно этой кислоты — особенность защитной реакции пшеницы в ответ на контакт с Al3+ (26, 37, 44). Поэтому яблочную кислоту все же можно рассматривать в качестве метаболита, маркирующего алюмоустойчивость проростков T. aestivum . Олигосахара оказались характерными для МП образцов со средним уровнем устойчивости к ионам алюминия. То есть при воздействии ионов алюминия изменяется накопление карбогидратов, синтез и транспорт веществ-антистрессоров, энергетический обмен, метаболизм крахмала и сахарозы (27), что в целом соответствует нашим данным. В работах по изучению механизмов алюмоустойчивости отмечается разная активность органических кислот при связывании ионов алюминия: малоновая кислота относится к группе со средней активностью, янтарная и молочная кислоты — к группе с низкой активностью (4). Согласно полученными нами данным, у проростков T. aestivum основной кислотой, способной нейтрализовать Al3+, оказалась янтарная, которую на этом основании мы отнесли к группе со средней активностью связывания ионов алюминия. Тем не менее мы можем предположить, что в защите от этого стрессора участвуют и другие кислоты, которых нет среди перечисленных. Так, мы установили, что в МП устойчивых форм T. aestivum были в большей степени представлены органические кислоты в целом, а также лактонные формы сахарных кислот. Наше предположение согласуется с результатами других исследований (2, 3, 6, 8). Авторы указывают на широкий спектр кислот, участвующих в защите растений от токсического действия Al3+ (13, 15, 4 5). Согласно опубликованным данным (4, 15, 46), аминокислоты и фенольные соединения подобно органическим кислотам способны образовывать с ионами Al3+ не опасные для растения хелатные формы. Количество таких веществ имеет тенденцию к увеличению после воздействия стрессора (19), что подтверждают результаты нашего исследования. Как уже отмечалось, фенолсодержащие соединения преобладали в МП устойчивых форм T. aestivum , свободные аминокислоты — в МП неустойчивых форм . Более интенсивное накопление фосфорной кислоты и метилфосфата в корешках проростков, которое мы наблюдали у образцов, чувствительных к Al3+, также связано с механизмом инактивации ионов алюминия (3, 29).
Выявленное нами увеличение доли нуклеозидов, в частности аденозина, в МП алюмоустойчивых форм может быть вызвано усилением активности S-аденозилметионин-синтетазы, которое связано с изменениями клеточной стенки под воздействием Al3+, о чем сообщали M.W. Oh с соавт. (37). Отмеченное нами уменьшение количества нуклеозидов у неустойчивых к Al3+ форм T. aestivum соответствует механизмам алюмотолерантности, рассмотренным в обзоре Н.В. Амосовой с соавт. (15).
A.L. Garcia-Oliveira с соавт. (6) обнаружили связь между количеством корневой слизи и устойчивостью пшеницы к Al3+. R.K. Sairam с соавт. (47) среди соединений, обеспечивающих стабилизацию макромолекул раститель- ных клеток при абиотическом стрессе, указывают простые сахара (фруктоза и глюкоза), полиолы (глицерол, маннитол, сорбитол, метилированные инозиты, миоинозитол, ононитол), олигосахара (трегалоза, раффиноза, сахароза и фруктаны), пролин, аскорбиновую кислоту. В нашем исследовании особенностью МП образцов T. aestivum со средней устойчивостью к ионам алюминия было повышенное содержание некоторых олигосахаров, которые могут входить в состав слизи, защищающей корешки проростков. Кроме этого, к маркерам алюмоустойчивости мы отнесли четырехатомный (RI = 1537) и пятиатомный (RI = 1735) спирты, усиление синтеза которых, скорее всего, связано с действием стрессора, что также согласуется с приведенными выше данными литературы.
В работе M.D. Mashabela с соавт. (29) показано, что для алюмоустой-чивых сортов пшеницы характерно более высокое содержание свободных жирных кислот (в том числе линолевой и линоленовой), флавоноидных гликозидов (рутин, кемпферол-3-O-гликозид, лютеолин-6-C-гексозил-гек-созид), а для восприимчивых — оксикоричных кислот. Участие вторичных метаболитов в защите растения от Al3+ подтверждается и в ряде других работ (6, 48-50). В МП изученных нами образцов T. aestivum , устойчивых к Al3+, также увеличивалось количество свободных жирных кислот с преобладанием линолевой и фенолсодержащих соединений с доминированием хинной и сирингиновой кислот. Флавоноидные гликозиды у устойчивых к Al3+ образцов T. aestivum были представлены арбутином, а фенолсодержащие соединения восприимчивых образцов — преимущественно хинной кислотой и арбутином. При негативном воздействии ионов алюминия на ткани растения синтез ненасыщенных жирных кислот активируется. Они участвуют в поддержании структуры клеточной мембраны и служат предшественниками при синтезе гормонов стресса — жасмонатов (39-41, 51). Как уже отмечалось, в МП устойчивых форм T. aestivum было выше содержание свободных жирных кислот и их производных, а повышение содержания метиловых и этиловых эфиров ненасыщенных жирных кислот, которые могут быть предшественниками гормонов стресса, по нашим данным, служит достоверным биохимическим признаком изученных зимостойких алюмоустойчивых образцов T. aestivum .
Более интенсивное накопление фосфорной кислоты и метилфосфата мы наблюдали у образцов T. aestivum, чувствительных к Al3+, что, видимо, также связано с механизмом инактивации ионов (3, 29). Отмечено (51), что воздействие ионов алюминия влияет на основные обменные процессы: цикл трикарбоновых кислот, гликолиз и на активность образования вторичных метаболитов, что согласуется с полученными нами данными.
Одной из задач нашего исследования было определение метаболитов — маркеров устойчивости образцов T. aestivum к воздействию Al3+. В работе M.D. Mashabela с соавт. (29) маркерами алюмоустойчивых форм T. aestivum названы хинная, линоленовая, 9,12,13-тригидрокси-10,15-окта-диеновая кислоты, валин, флавон изоориентин. Это не совпадает с полученными нами результатами. На основе неспецифического метаболомного профилирования мы выделяем в качестве маркеров алюмотолерантности проростков T. aestivum фосфорную, яблочную, янтарную кислоты, четырехатомный (RI = 1537) и пятиатомный (RI = 1735) спирты и метиловый эфир линолевой кислоты.
Выделившиеся в нашем исследовании образцы T. aestivum могут стать исходным материалом при селекции как пшеницы, так и устойчивых сортов тритикале (26).
Таким образом, полученные нами результаты и данные других ис- следований в основном согласуются. Имеющиеся расхождения связаны, скорее всего, со свойствами биоматериала, взятого для изучения, и спецификой методик, выбранных для проведения анализа.
Итак, мы выявили особенности метаболомных профилей (МП) у зимостойких образцов Triticum aestivum с разной степенью восприимчивости к ионам алюминия и подтвердили влияние Al3+ на процессы как первичного (цикл Кребса, синтез карбогидратов, глицеролипидов и триглицеридов мембранного комплекса), так и вторичного метаболизма (синтез растительных гормонов и других защитных факторов — гликозидов, терпенов). При анализе МП установлены метаболиты, с высокой степенью достоверности (p < 0,05) отличающие алюмотолерантные образцы T. aestivum от чувствительных. Это фосфорная, яблочная, янтарная кислоты, четырехатомный (RI = 1537) и пятиатомный (RI = 1735) спирты и метиловый эфир линолевой кислоты, содержание которых изменяется под воздействием ионов алюминия. Перечисленные соединения могут быть использованы как биохимические маркеры устойчивости озимой мягкой пшеницы к Al3+ при поиске алюмотолерантных форм и селекции высокопродуктивных и адаптированных к условиям северо-запада России сортов T. aestivum с комплексной устойчивостью к стрессовым факторам. Кроме того, выделившиеся образцы T. aestivum могут стать одной из родительских форм при селекции устойчивых сортов тритикале.
Список литературы Биомаркеры алюмотолерантности у зимостойких форм Triticum aestivum L. из коллекции ВИР им. Н.И. Вавилова
- Hernández M., Borges A.A., Francisco-Bethencourt D. Mapping stressed wheat plants by soil aluminum effect using C-band SAR images: implications for plant growth and grain quality. Pre-cision Agriculture, 2022, 23: 1072-1092 (doi: 10.1007/s11119-022-09875-6).
- Ma J.F., Ryan P.R., Delhaize E. Aluminum tolerance in plants and the complexing role of organic acids. Trends Plant Sciences, 2001, 6: 273-278 (doi: 10.1016/s1360-1385(01)01961-6).
- Gupta N., Gaurav S., Kumar A. Molecular basis of aluminium toxicity in plants: a review. Amer-ican Journal of Plant Sciences, 2013, 4(12): 21-37 (doi: 10.4236/ajps.2013.412A3004).
- Яковлева О.В. Фитотоксичность ионов алюминия. Труды по прикладной ботанике, генетике и селекции, 2018, 179(3): 315-331 (doi: 10.30901/2227-8834-2018-3-315-331).
- Gallo-Franco J.J., Sosa C.C., Ghneim-Herrera T., Quimbaya M. Epigenetic control of plant response to heavy metal stress: a new view on aluminum tolerance. Frontiers Plant Science, 2020, 11:602-625 (doi: 10.3389/fpls.2020.602625).
- Garcia-Oliveira A.L., Chander S., Barcelo J., Poschenrieder C. Aluminium stress in crop plants. In: Recent advances in plant stress physiology /P. Yadav, S. Kumar, V. Jain (eds.). New Delhi, Astral International Pvt., Ltd., 2016: 237-263.
- Liu W., Xu F., Lv T., Zhou W., Chen Y., Jin C., Lu L., Lin X. Spatial responses of antioxidative system to aluminum stress in roots of wheat (Triticum aestivum L.) plants. Science of the Total Environment, 2018, 627: 462-469 (doi: 10.1016/j.scitotenv.2018.01.021).
- Liu H., Zhu R., Shu K., Lv W., Wang S., Wang C. Aluminum stress signaling, response, and adaptive mechanisms in plants. Plant Signaling Behavior, 2022, 17(1): e2057060 (doi: 10.1080/15592324.2022.2057060).
- Agegnehu G., Amede T., Erkossa T., Yirga C., Henry C., Tyler R., Nosworthy M.G., Beyene S., Sileshi G.W. Extent and management of acid soils for sustainable crop production system in the tropical agroecosystems: a review, Acta Agriculturae Scandinavica, Section B — Soil & Plant Sci-ence, 2021, 71(9): 852-869 (doi: 10.1080/09064710.2021.1954239).
- Sarker S., Ghosh S., Hossain M., Ghosh R., Razia S., Sushmoy D., Noor M. Impact of alumin-ium (Al3+) stress on germination and seedling growth of five wheat genotypes. SAARC Journal of Agriculture, 2019, 17(1): 65-76 (doi: 10.3329/sja.v17i1.42762).
- Shovon H., Sagar A., Mia M., Rakhi F., Tajkia J., Kabir M., Shabi T., Dhar M, Hossain A. Boron-mediated aluminium stress tolerance under aluminium toxicity at germination and early seedling stages of wheat. Progressive Agriculture, 2021, 32(2): 127-139 (doi: 10.3329/pa.v32i2.58397).
- Авдонин Н.С. Влияние свойств почв и удобрений на качество растений. М., 1972.
- Baligar V.C. Aluminum toxicity in crop plants. Journal of Plant Nutrition, 1988, 11(3): 303-319 (doi: 10.1080/01904168809363804).
- Алексеева-Попова Н.В. Клеточно-молекулярные механизмы металлоустойчивости расте-ний. В сб.: Устойчивость к тяжелым металлам дикорастущих видов. Л., 1991: 5-15.
- Амосова Н.В., Николаева О.Н., Сынзыныс Б.И. Механизмы алюмотолерантности у куль-турных растений (обзор). Сельскохозяйственная биология, 2007, 1: 36-42.
- Росстат. Сельское хозяйство, охота и лесное хозяйство 2022. Режим доступа: https://ros-stat.gov.ru/enterprise_economy. Дата обращения: 20.04.2023.
- Raman H., Zhang K., Cakir M., Appels R., Garvin D., Maron L., Kochian L., Moroni J. Mo-lecular characterization and mapping of ALMT1, the aluminium-tolerance gene of bread wheat (Triticum aestivum L.). Genome, 2021, 48(5): 781-791 (doi: 10.1139/g05-054).
- Tamas L., Huttova J., Hajasova L., Mistrik I. The effect of aluminium on polypeptide pattern of cell wall proteins isolated from the roots of Al-sensitive and Al-resistant barley cultivars. Acta Physiol. Plant., 2001, 23(2): 161-168 (doi: 10.1007/s11738-001-0004-2).
- Пухальская Н.В. Проблемные вопросы алюминиевой токсичности. Агрохимия, 2005, 8: 70-82.
- Niedziela A., Domżalska L., Dynkowska W.M., Pernisová M., Rybka K. Aluminum stress induces irreversible proteomic changes in the roots of the sensitive but not the tolerant genotype of triticale seedlings. Plants, 2022, 11: 165 (doi: 10.3390/plants110201650).
- Matsumoto H. Cell biology of aluminum toxicity and tolerance in higher plants. International Review of Cytology, 2000, 200: 1-46 (doi: 10.1016/s0074-7696(00)00001-2). 22. Sivaguru M., Fujiwara T., Samaj J., Baluska F. Aluminum-induced 13-beta-D-glucan inhibits cell-to-cell trafficking of molecules through plasmodesmata. A new mechanism of aluminum tox-icity in plants. Plant Physiology, 2000, 124(3): 991-1006 (doi: 10.1104/pp.124.3.991).
- Kochian L.V., Hoekenga O.A., Pineros M.A. How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency: Annual Review of Plant Biology, 2004, 55: 459-493 (doi: 10.1146/annurev.arplant.55.031903.141655).
- Yang G., Wei Q., Huang H., Xia J. Amino acid transporters in plant cells: a brief review. Plants, 2020, 9(8): 967 (doi: 10.3390/plants9080967).
- Kochian L.V. Cellular mechanisms of aluminum toxicity and resistance in plants. Annual Review of Plant Physiology and Plant Mololecular Biology, 1995, 46: 237-260 (doi: 10.1146/annurev.pp.46.060195.001321).
- Ryan P.R. Dong D., Teuber F., Wendler N., Mühling K., Liu J., Xu M., Salvador Moreno N., You J., Maurer H.-P., Horst W.J., Delhaize E. Assessing how the aluminum-resistance traits in wheat and rye transfer to hexaploid and octoploid triticale. Frontiers in Plant Science, 2018, 9: 1334 (doi: 10.3389/fpls.2018.01334).
- Shtark O.Y., Puzanskiy R.K., Avdeeva G.S., Yurkov A.P., Smolikova G.N., Yemelyanov V.V., Kliukova M.S., Shavarda A.L., Kirpichnikova A.A., Zhernakov A.I., Afonin A.M., Tikhono-vich I.A., Zhukov V.A., Shishova M.F. Metabolic alterations in pea leaves during arbuscular my-corrhiza development. PeerJ, 2019, 7: e7495 (doi: 10.7717/peerj.7495).
- Pinto V.B., Almeida V.C., Pereira-Lima Í.A., Vale E.M., Araujo W.L., Silveira V., Viana J.M.S. Deciphering the major metabolic pathways associated with aluminum tolerance in popcorn roots using label-free quantitative proteomics. Planta, 2021, 254: 132 (doi: 10.1007/s00425-021-03786-y).
- Mashabela M.D., Piater L.A., Steenkamp P.A., Dubery I.A., Tugizimana F., Mhlongo M.I. Comparative metabolite profiling of wheat cultivars (Triticum aestivum) reveals signatory markers for resistance and susceptibility to stripe rust and aluminium (Al3+) toxicity. Metabolites, 2022, 12(2): 98 (doi: 10.3390/metabo12020098).
- Пополнение, сохранение в живом виде и изучение мировой коллекции пшеницы, эгилопса и тритикале: методические указания /Под ред. А.Ф. Мережко. СПб, 1999.
- Лысенко Н.С. Характеристика озимой мягкой пшеницы из Европы и России в условиях Ленинградской области. Мат. конф. молодых ученых и аспирантов «Генетические ресурсы растений и селекция». СПб, 2012, 11-18.
- Лысенко Н.С., Лосева В.А., Митрофанова О.П. Зимостойкость мягкой пшеницы коллек-ции ВИР в условиях Северо-Западного и Центрально-Черноземного регионов России. Труды по прикладной ботанике, генетике и селекции, 2019, 180(3): 41-49 (doi: 10.30901/2227-8834-2019-3-41-49).
- Aniol A. Genetics of acid tolerant plant. In: Plant-soil interactions at low pH. Developments in plant and soil sciences /R.J. Wright, V.C. Baligar, R.P. Murrmann (eds.). Springer, Dordrecht, 1991, 45: 1007-1017 (doi: 10.1007/978-94-011-3438-5_113).
- Косарева И.А., Давыдова Г.В., Семенова Е.В. Методические указания по определению кислотоустойчивости зерновых культур. СПб, 1994.
- Perchuk I., Shelenga T., Gurkina M., Miroshnichenko E., Burlyaeva M. Composition of primary and secondary metabolite compounds in seeds and pods of asparagus bean (Vigna unguiculata (L.) Walp.) from China. Molecules, 2020, 25: 3778 (doi: 10.3390/molecules25173778).
- Puzanskiy R., Tarakhovskaya E., Shavarda A., Shishova M. Metabolomic and physiological changes of Chlamydomonas reinhardtii (Chlorophyceae, Chlorophyta) during batch culture devel-opment. Jornal of Applied Phycology, 2018, 30(2): 803-818 (doi: 10.1007/s10811-017-1326-9).
- Oh M.W., Roy S.K., Kamal A.H., Cho K., Cho S.W., Park C.S., Choi J.S., Komatsu S., Woo S.H. Proteome analysis of roots of wheat seedlings under aluminum stress. Molecular Biology Reports, 2014, 41(2): 671-681 (doi: 10.1007/s11033-013-2905-8).
- Zia M., Ali J.S., Hanif S., Sajjad A., Abbasi B.H. Lupeol, a plant triterpenoid mitigates salt induced stress: growth and antioxidative response of Brassica nigra under in vitro condition. Plant Cell, Tissue and Organ Culture, 2023, 154: 327-335 (doi: 10.1007/s11240-022-02405-2).
- Колупаев Ю.Е., Ястреб Т.О. Стресс-протекторные эффекты салициловой кислоты и ее структурных аналогов. Физиология и биохимия культурных растений, 2013, 45(2): 113-126.
- He Y., Fukushige H., Hildebrand D.F., Gan S. Evidence supporting a role of jasmonic acid in Arabidopsis leaf senescence. Plant Physiology, 2002, 128(3): 876-884 (doi: 10.1104/pp.010843).
- He M., Ding N.-Z. Plant unsaturated fatty acids: multiple roles in stress response. Frontiers in Plant Science, 2020, 11: 562785 (doi: 10.3389/fpls.2020.562785).
- Zi X., Zhou S., Wu B. Alpha-linolenic acid mediates diverse drought responses in maize (Zea mays L.) at seedling and flowering stages. Molecules, 2022, 27(3): 771 (doi: 10.3390/molecules27030771).
- Singh S., Parihar P., Singh R., Singh V.P., Prasad S.M. Heavy metal tolerance in plants: role of transcriptomics, proteomics, metabolomics, and ionomics. Frontiers in Plant Science, 2016, 6: 1143 (doi: 10.3389/fpls.2015.01143).
- Rodrigues M., Ganança J.F.T., da Silva E.M., dos Santos T.M.M., Slaski J.J., Zimny J., Pinheiro de Carvalho M.Â.A. Evidences of organic acids exudation in aluminium stress responses of two Madeiran wheat (Triticum aestivum L.) landraces. Genetic Resources and Crop Evolution, 2019, 66, 857-869 (doi: 10.1007/s10722-019-00754-0).
- Барсукова В.С. Физиолого-генетические аспекты устойчивости растений к тяжелым ме-таллам. Экология. Серия аналитических обзоров мировой литературы. Новосибирск, 1997, 47.
- Delhaize E., Ryan P.R. Aluminum toxicity and tolerance in plants. Plant Physiology, 1995, 107: 315-321 (doi: 10.1104/pp.107.2.315).
- Sairam R.K., Tyagi A. Physiology and molecular biology of salinity stress tolerance in plants. Current Science, 2004, 86(3): 407-421.
- Schmitt M., Boras S., Tjoa A., Watanabe T., Jansen S. Aluminium accumulation and intra-tree distribution patterns in three arbor aluminosa (Symplocos) species from Central Sulawesi. PLoS ONE, 2016, 11: e0149078 (doi: 10.1371/journal.pone.0149078).
- Ito D., Shinkai Y., Kato Y., Kondo T., Yoshida K. Chemical studies on different color develop-ment in blue and red-colored sepal cells of Hydrangea macrophylla. Biosci. Biotechnol. Biochem., 2009, 73: 1054-1059 (doi: 10.1271/bbb.80831).
- Nigro D., Grausgruber H., Guzman C., Laddomada B. Phenolic compounds in wheat kernels: genetic and genomic studies of biosynthesis and regulation. In: Wheat quality for improving pro-cessing and human health /G. Igrejas, T.M. Ikeda, C. Guzman (eds.). Springer Nature, Basing-stoke, UK, 2020: 225-253 (doi: 10.1007/978-3-030-34163-3_10).
- Shabir H.W., Vinay K., Varsha Sh., Saroj K.S., Phytohormones and their metabolic engineering for abiotic stress tolerance in crop plants. The Crop Journal, 2016, 4(3): 162-176 (doi: 10.1016/j.cj.2016.01.010).


