Биомаркеры при благоприятном и неблагоприятном течении постковидного синдрома, астенический постковидный синдром у пациентов молодого возраста, на регулярной основе занимающихся физической культурой
Автор: Малевич Р.М., Сумная Д.Б., Быков Е.В., Григорьева Н.М., Кулешова М.В., Николаева И.В.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Восстановительная и спортивная медицина
Статья в выпуске: 2 т.25, 2025 года.
Бесплатный доступ
Цель: для определения прогностической значимости содержания белка S-100, активности системы ПОЛ-АОС у пациентов с постковидным синдромом изучить их содержание в сыворотке крови при благоприятном и неблагоприятном течении заболевания, а также разработать программу реабилитации пациентов с постковидным астеническим синдромом на основании выявленных патогенетических факторов неблагоприятного течения постковидного синдрома.
Постковидный синдром, биомаркеры, белок s-100, система пол-аос, реабилитация, «карбоник»-терапия, проспекта
Короткий адрес: https://sciup.org/147251198
IDR: 147251198 | УДК: 616.98-036-07-08 | DOI: 10.14529/hsm250220
Текст научной статьи Биомаркеры при благоприятном и неблагоприятном течении постковидного синдрома, астенический постковидный синдром у пациентов молодого возраста, на регулярной основе занимающихся физической культурой
Введение. Пост-COVID-19 относится к последствиям, которые могут возникнуть после того, как человек выздоровеет от COVID-19, заболевания, вызываемого вирусом SARS-CoV-2. Эти последствия могут варьироваться от физических до психических и эмоциональных и могут сохраняться в течение нескольких месяцев или даже лет после первоначального заражения. Некоторые из распространенных симптомов после COVID-19 включают усталость, одышку, боль в груди, суставах и проблемы со сном. Психические и эмоциональные симптомы могут включать тревогу, депрессию и когнитивные нарушения [4, 32, 35]. Важно отметить, что долгосрочные последствия COVID-19 все еще изучаются, и необходимы дополнительные исследования, чтобы полностью понять синдром после COVID-19 [9].
«Пугающими становятся длительно существующие постковидные симптомы в виде длительной астении, резкого снижения памяти, эмоциональные расстройства в виде появления всевозможных фобий, повышенный уровень тревожности, изменение пищевого поведения, потеря обоняния, нарушение вкусовых ощущений, восприятия цветов и оттенков, периферические нейропатии, встречается снижение либидо, нарушения сна и сексуальных функций. Особенно «возмутительна» слабость, не проходящая даже после отдыха. И здесь дело не только в потере физических сил, страдает одна из функций лобных долей головного мозга: снижение воли – безволие, малодушие, нежелание что-то делать. Пугающим является то, что данная проблема возникает не только у пожилых пациентов, а даже у 20–30-летних молодых людей, которые перенесли ковид «в неяркой форме» [8]. Хронобиологические расстройства также возникают в структуре постковидного синдрома: нарушение сна в виде трудности засыпания, бессонницы или сон без «чувства сна»; чуткость, тревожность сна, чувство усталости после сна; раннее пробуждение с ощущением тревоги, внутреннего беспокойства и грядущего несчастья; инверсия сна (сонливость днем, бессонница ночью); синдром апноэ во сне, бессонница, храп, никтурия. Предыдущие иссле- дования показали взаимосвязь психического здоровья и сна с состоянием иммунитета [15]. Системный иммунный ответ, отражаемый антителами к SARS-CoV-2, сильно коррелирует с тяжестью постковидной усталости [22]. Проявления указанного постковидного симп-томокомплекса могут либо возникать после выздоровления пациента с острым эпизодом COVID-19, либо сохраняться после первичного заболевания. Патофизиология синдрома после интенсивной терапии многофакторна и включает микрососудистую ишемию, неподвижность и метаболические изменения во время критического периода заболевания [26]. В настоящее время до конца не выяснены патогенетические механизмы развития неврологической симптоматики после COVID-19. Высказываются предположения о прямом влиянии вируса SARS-CoV-2 на нервную систему, а также вторичном поражении нервной системы и головного мозга вследствие эндотелиальной дисфункции, гипоксии или иммуно-опосредованного повреждения. Имеются данные о проникновении SARS-CoV-2 в головной мозг через гематоэнцефалический барьер. Предположительно, вирус поражает астроциты, в результате чего в коре головного мозга формируются значимые изменения вплоть до атрофии отдельных областей.
Следует отметить, что 52 % молодых людей в возрасте от 16 до 30 лет, у которых были легкие и умеренные симптомы COVID-19, лечившиеся дома, в конечном итоге имели постковидный синдром [14, 28]. В ряде исследований у большой когорты пациентов выявлено отсутствие диагностической значимости большинства стандартных исследований, в связи с чем необходимым является внедрение специфических лабораторных тестов, позволяющих дифференцировать потенциальные симптомы постковидного синдрома от иной патологии [37, 38]. В многофакторном патогенезе постковидного синдрома (АС) можно рассматривать также следующие звенья [2]:
-
1) активация перекисного окисления липидов приводит к накоплению свободных радикалов и гидроперекисей в ткани мозга и крови, малонового диальдегида в крови;
-
2) активация в результате тканевой гипоксии анаэробных путей метаболизма в ткани мозга и мышцах;
-
3) нейромедиаторные нарушения, развивающиеся в результате ослабления функций биогенных аминов норадренергической, дофаминергической и серотонинергической систем в структурах ретикулярной активирующей системы мозга и лимбической системы, приводят к разобщению нейрофункциональных связей с гиппокампом – центром регуляции когнитивных процессов и эмоциональных реакций. В основе нейрометаболического механизма развития АС лежат гипоксия и гипоксемия, влекущие за собой энергодефицит нейрональных структур, ослабление биосинтеза макроэргических соединений, нарушение тканевого дыхания и активацию процессов свободно-радикального окисления с последующим повреждением нейрональных и митохондриальных мембран клеток [2, 8, 34]. Дополнительными аспектами патогенеза по-стковидного синдрома, в том числе постко-видной астении, являются изменения легких, включающие легочный фиброз, рестриктивное поражение легких, легочную гипертензию и хроническое тромбоэмболическое заболевание легких, перенесенный острый миокардит (10 % пациентов отделения интенсивной терапии), проявляющийся диастолической дисфункцией, снижением фракции выброса с систолической дисфункцией, аритмиями [1]. Одним из самых серьезных осложнений COVID-19, вызванных коронавирусом SARS-CoV-2, является спонтанное тромбообразова-ние в микрососудах легких. Это состояние приводит к нарушению кислородного обмена (гипоксии) и усугубляет воспалительные процессы. В особо тяжелых случаях развивается диссеминированное внутрисосудистое свертывание (ДВС-синдром), которое сопровождается множественными кровоизлияниями. На сегодняшний день механизмы нарушений в системе гемостаза при COVID-19 остаются предметом активного изучения [18, 42]. Кроме того, фиброз легких, возникающий как следствие заболевания, вызывает необратимое повреждение легочной ткани. Степень выраженности фиброза напрямую влияет на эффективность реабилитации пациентов и их дальнейшее восстановление [12]. Эти состояния нарушают толерантность к физической нагрузке, вызывают усталость и уменьшение работоспособности [8].
Перспективным направлением исследований является изучение роли кальций-связы-вающих белков группы S-100 в нейроиммун-ных механизмах, особенно их влияние как про-воспалительных нейропептидов в развитии постковидного синдрома [11, 17]. Белок S-100 был открыт в 1965 году Б.В. Муром [31], и с тех пор его изучение продолжается уже более полувека. На сегодняшний день известно более 20 подтипов этого белка [27, 30], три из которых играют ключевую роль в работе врожденного иммунитета: S-100A8 (кальгранулин А, или MRP8), S-100A9 (кальгранулин В, или MRP14) и S-100A12 (кальгранулин С). Эти белки обнаруживаются в гранулоцитах, моноцитах и макрофагах на ранних этапах их дифференцировки. Белки S-100A8 и S-100A9 образуют гетеродимер S-100A8/S-100A9, состоящий из одной легкой и двух тяжелых полипептидных цепей, и обладают выраженными антибактериальными свойствами [12].
Кальцийсвязывающие белки группы S-100 играют разнообразную и важную роль в различных физиологических и патологических процессах. Эти белки участвуют в регуляции внутриклеточных и внеклеточных функций, особенно в контексте передачи сигналов кальция, воспаления и клеточного гомеостаза. Ниже приведены некоторые из их ключевых ролей:
-
1. Регуляция кальциевой сигнализации. Белки S-100 связывают ионы кальция, что вызывает конформационные изменения, позволяющие им взаимодействовать с белками-мишенями. Это взаимодействие модулирует кальций-зависимые сигнальные пути, влияя на такие процессы, как пролиферация, дифференцировка и апоптоз клеток.
-
2. Воспаление и иммунный ответ. Несколько белков S-100, таких как S-100A8, S-100A9 и S-100A12, известны как алармины или молекулярные структуры, связанные с повреждениями (DAMPs). Они высвобождаются во время клеточного стресса или травмы и играют провоспалительную роль, активируя иммунные клетки (например, нейтрофилы, моноциты и макрофаги) и способствуя высвобождению цитокинов и хемокинов. Гетеродимер S-100A8/S-100A9 (кальпротектин) обладает антимикробными свойствами и участвует во врожденных иммунных реакциях.
-
3. Регуляция клеточного цикла. Некоторые белки S-100, такие как S-100B, участвуют в регуляции клеточного цикла, взаимодейст-
- вуя с такими белками, как p53, влияя на рост клеток и апоптоз [16].
-
4. Функция и патология нейронов S-100B, вырабатываемых в основном астроцитами головного мозга, в низких концентрациях действуют как нейротрофический фактор, поддерживая выживание и восстановление нейронов. Однако при высоких концентрациях он становится нейротоксичным и связан с нейродегенеративными заболеваниями, травмами головного мозга и нейровоспалением. Белки S-100 также участвуют в развитии хронических неврологических заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и рассеянный склероз [6, 19].
-
5. Рак. Белки S-100 часто нарушают регуляцию при раке и могут способствовать прогрессированию опухоли, метастазированию и ангиогенезу. Например, S-100A4 связан с повышенной инвазивностью опухоли и плохим прогнозом при некоторых видах рака. Они также могут модулировать микроокружение опухоли, влияя на активность иммунных клеток и ремоделирование внеклеточного матрикса.
-
6. Регуляция костной и хрящевой ткани. Белки S-100, такие как S-100A4 и S-100A6, участвуют в ремоделировании костей и разрушении хрящей, играя важную роль в таких заболеваниях, как остеоартрит и ревматоидный артрит.
-
7. Сердечно-сосудистая система. S-100A1 высоко экспрессируется в сердечной мышце и регулирует сократительную способность сердца, модулируя поступление кальция в кардиомиоциты. Нарушение его регуляции связано с сердечной недостаточностью и другими сердечно-сосудистыми заболеваниями.
-
8. Биомаркеры заболеваний. Из-за их специфических паттернов экспрессии и роли в развитии заболеваний белки S-100 используются в качестве биомаркеров при различных состояниях. Например: S-100B является биомаркером черепно-мозговой травмы, инсульта и нейроде-генеративных заболеваний. S-100A8/A9 (каль-протектин) используется в качестве маркера воспалительных заболеваний кишечника (ВЗК) и ревматоидного артрита [5, 7, 20, 21, 25].
-
9. Внеклеточные функции. Некоторые белки S-100 секретируются и действуют вне-клеточно, связываясь с такими рецепторами, как RAGE (рецептор конечных продуктов повышенного гликирования) и TLR4 (Toll-подобный рецептор 4). Это взаимодействие
запускает сигнальные пути, которые усиливают воспалительные реакции и способствуют повреждению тканей при хронических заболеваниях.
Резюме. Семейство белков S-100 отличается высокой универсальностью, поскольку их представители участвуют в широком спектре клеточных процессов. Их роль в гомеостазе кальция, воспалении, иммунном ответе и патологических процессах делает их важными объектами исследований и потенциальных терапевтических вмешательств. Нарушение регуляции белков S-100 часто связано с хроническими воспалительными заболеваниями, нейродегенерацией, раком и другими патологическими состояниями, что подчеркивает их важность как для здоровья, так и для болезней.
Кальций-связывающие белки S-100 составляют большое семейство малых кислых протеинов размером 10–12 kDa, представленных субъединицами А и В. Для ЦНС характерен S-100B, который синтезируют астроциты, олигодендроциты и шванновские клетки [21]. Отмечено, что накопление в крови S-100 происходит не всегда одновременно, отражая повреждение преимущественно глии или нейронов соответственно [39]. Ряд сообщений указывает на высокую диагностическую или прогностическую информативность определения S-100 в сыворотке крови и/или ЦСЖ пациентов нейроинфекциями разной этиологии [21, 23, 24, 36, 40, 41, 43]. Как отмечают S. Mandal, J. Barnett, S.E. Brill et al. (2021 г.), «Систематическое наблюдение после госпитализации пациентов с COVID-19 определяет траекторию физического и психологического бремени симптомов, восстановления показателей биомаркеров крови и визуализации, которые могут быть использованы для информирования о необходимости реабилитации и/или дальнейшего исследования» [9]. Несмотря на накопленные данные, убедительных доказательств эффективности различных методов реабилитации пока недостаточно, что подчеркивает необходимость дальнейших исследований и разработки персонализированных подходов к лечению после COVID-19, что требует оптимизации имеющихся или создания новых алгоритмов и стандартов по медицинской реабилитации у данных больных [29].
Цель: для определения прогностической значимости содержания белка S-100, активности системы ПОЛ-АОС у пациентов с постко-видным синдромом изучить их содержание в сыворотке крови при благоприятном и неблагоприятном течении заболевания. Разработать программу реабилитации пациентов с постко-видным астеническим синдромом на основании выявленных патогенетических факторов неблагоприятного течения постковидного синдрома.
На начальном этапе наших исследований были изучены данные 80 пациентов, проходивших лечение в ОКБ № 3 и Челябинском областном инфекционном центре, а затем направленных на реабилитацию в санатории «Сосновая горка», «Смолино» и ООО «Центр нейромышечной стабилизации». Целью исследования было выявление биохимических маркеров, связанных с благоприятным и неблагоприятным течением постковидного психоневрологического синдрома. Критерии включения пациентов в исследование: наличие изменений, характерных для COVID-19, с подтвержденным диагнозом методом ПЦР, а также прохождение реабилитации после получения отрицательного результата ПЦР. Наличие психоневрологических нарушений, возникших в постковидный период или сохраняющихся после перенесенной инфекции, как при благоприятном, так и при неблагоприятном течении заболевания. Возраст пациентов от 18 до 44 лет. Всем участникам исследования (как с благоприятным, так и с неблагоприятным течением постковидного синдрома) проводилось определение уровня белка S-100 в сыворотке крови с использованием метода твердофазного иммуноферментного анализа. Также оценивалось состояние системы перекисного окисления липидов и антиоксидантной защиты (ПОЛ-АОС) спектрофотометрическим методом. Критерии исключения: беременные женщины, пациенты с выраженными постко-видными нарушениями со стороны дыхательной, сердечно-сосудистой, желудочно-кишечной систем, а также с изменениями в системе гемостаза.
Таким образом, исследование было направлено на анализ специфических биохимических показателей, которые могли бы помочь в прогнозировании течения постковид-ного синдрома и разработке эффективных реабилитационных мер.
Постковидный синдром вызывает огромный спектр симптомов, которые могут стать серьезной проблемой для здоровья пациентов. В своей работе мы рассмотрели астенический постковидный синдром – состояние психофи- зиологического истощения. Проявления указанного симптомокомплекса могут либо возникать после выздоровления пациента с острым эпизодом COVID-19, либо сохраняться после первичного заболевания. Это частое и значительно снижающее качество жизни состояние, которое обусловлено не только потерей физических сил, страдает одна из функций лобных долей головного мозга: снижение воли – безволие, малодушие, нежелание что-то делать. Для улучшения качества жизни необходима правильная клиническая оценка, которая поможет определить причины возникновения симптомов, а также составить план лечения и выбрать рациональные методы реабилитации.
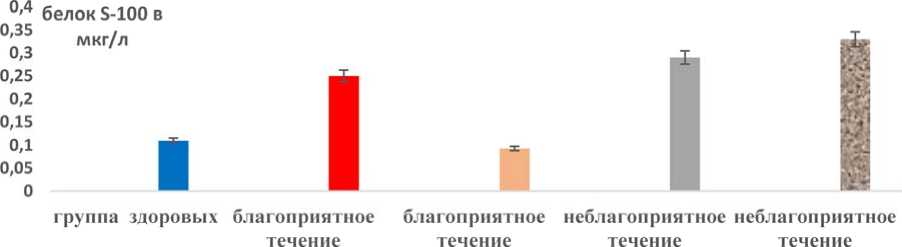
Мы проанализировали биохимические показатели при благоприятном и неблагоприятном течении постковидного синдрома. Клинически благоприятным течением считали регресс или уменьшение жалоб, имеющихся после перенесенного ковида в течение месяца реабилитации. Клинически неблагоприятным течением считали сохранение или нарастание жалоб, несмотря на проводимые реабилитационные мероприятия. Содержание белка S-100 в сыворотке крови до реабилитации при благоприятном течении достоверно превышало значения группы здоровых в 2,27 раза, а при неблагоприятном течении постковидного синдрома – в 2,64 раза. До реабилитации содержание белка S-100 в сыворотке крови у пациентов с благоприятным и неблагоприятным течением достоверных различий не имело, при этом при неблагоприятном течении содержание белка S-100 в сыворотке крови было в 1,16 раза выше, чем при благоприятном течении.
Но через месяц после начала реабилитации различия в группах с благоприятным и неблагоприятным течением становятся значимыми и достоверными: в 3,55 раза содержание белка S-100 при неблагоприятном течении постковидного синдрома превышают значения при благоприятном течении заболевания (рис. 1). И направленность изменений содержания белка S-100 в сыворотке крови при благоприятном и неблагоприятном течении разная. При благоприятном течении к месяцу реабилитации он снижается в 2,69 раза, а при неблагоприятном течении, наоборот, нарастает в 1,14 раза (отличия до и после реабилитации в группе не достоверны, имеет место тенденция к нарастанию его значений). При этом отмечается высокая степень прямой корреля- тивной зависимости между выраженностью клинических симптомов и степенью повышения содержания белка S-100 в сыворотке крови. Направленность изменений содержания в сыворотке крови первичных, вторичных и конечных продуктов ПОЛ идентична изменениям содержания белка S-100 при благоприятном и неблагоприятном течении заболевания (рис. 1–4).
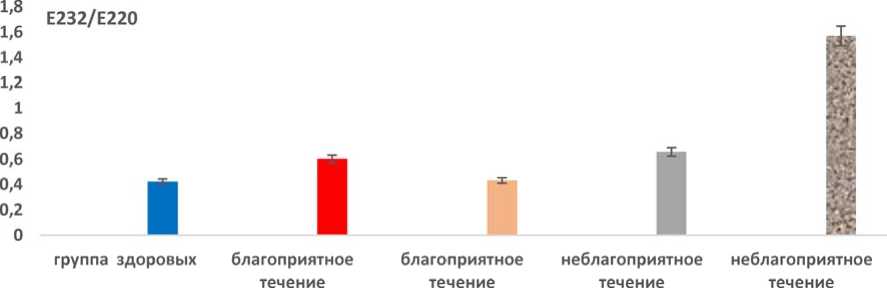
До реабилитации все категории продуктов ПОЛ в сыворотке крови были повышены у пациентов и с благоприятным, и неблагоприятным течением постковидного синдрома. Наиболее демонстративны изменения при анализе содержания первичных продуктов ПОЛ в сыворотке крови (см. рис. 2).
При благоприятном течении первичные продукты ПОЛ после реабилитации достоверно (p < 0,05) снижались в 1,39 раза. При неблагоприятном течении они, наоборот, достоверно нарастали (p < 0,05) в 2,39 раза.
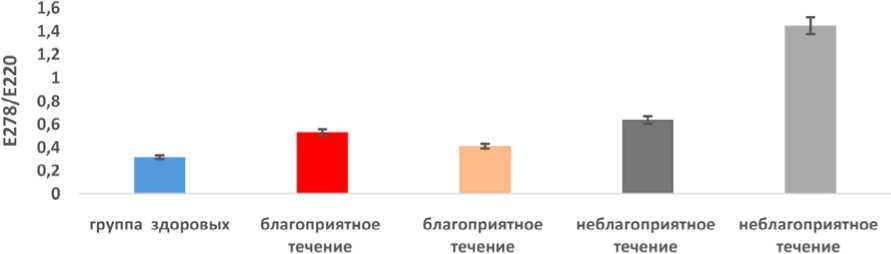
Таким образом, при неблагоприятном течении постковидного синдрома значения содержания первичных продуктов ПОЛ в сыворотке крови были достоверно (p < 0,05) выше в 3,63 раза, чем при благоприятном течении. Содержание в сыворотке крови вторичных продуктов ПОЛ (см. рис. 3) после реабилитации при благоприятном течении постковидного синдрома достоверно (p < 0,05) снижались в 1,29 раза.
При неблагоприятном течении содержание вторичных продуктов ПОЛ достоверно
постковидного постковидного синдрома до синдрома после реабилитации реабилитации
постковидного постковидного синдрома до синдрома после реабилитации реабилитации
Рис. 1. Содержание в сыворотке крови белка S-100 при благоприятном и неблагоприятном течении постковидного синдрома до и после реабилитации
Fig. 1. Serum S-100 protein levels in favorable and unfavorable post-COVID syndrome before and after rehabilitation
постковидного синдрома до реабилитации постковидного синдрома после реабилитации постковидного синдрома до реабилитации постковидного синдрома после реабилитации
Рис. 2. Содержание в сыворотке крови первичных продуктов ПОЛ при благоприятном и неблагоприятном течении постковидного синдрома до и после реабилитации Fig. 2. Serum levels of primary LPO products in favorable and unfavorable post-COVID syndrome before and after rehabilitation
(p < 0,05) увеличивалось к концу реабилитационного периода в 2,27 раза, что сочеталось с клиническим ухудшением состояния или сохранением жалоб и требовало продолжения реабилитации.
Содержание вторичных продуктов ПОЛ в сыворотке крови к окончанию реабилитации при неблагоприятном течении заболевания достоверно (p < 0,05) превышало значения при благоприятном течении в 2,73 раза.
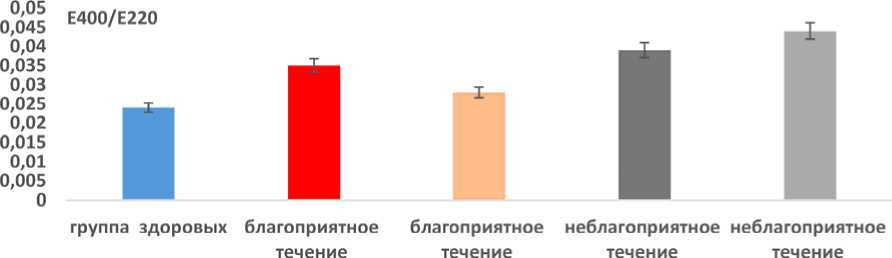
Содержание в сыворотке крови конечных продуктов ПОЛ (рис. 4) после реабилитации при благоприятном течении ПКАС достоверно (p < 0,05) снижалось в 1,25 раза. При неблагоприятном течении содержание конечных продуктов ПОЛ достоверно (p > 0,05) увели- чивалось к концу реабилитационного периода в 1,13 раза, что сочеталось с клиническим ухудшением состояния или сохранением жалоб и требовало продолжения реабилитации. Содержание конечных продуктов ПОЛ в сыворотке крови к окончанию реабилитации при неблагоприятном течении заболевания достоверно (p < 0,05) превышало значения при благоприятном течении в 1,57 раза.
Антиокислительная активность сыворотки крови при благоприятном течении постко-видного синдрома достоверно (p < 0,05) нарастала в 1,57 раза. При неблагоприятном течении достоверно снижалась после реабилитации в 1,49 раза, что сопровождалось ухудшением или отсутствием улучшения состояния
постковидного синдрома до реабилитации постковидного синдрома после реабилитации постковидного синдрома до реабилитации постковидного синдрома после реабилитации
Рис. 3. Содержание в сыворотке крови вторичных продуктов ПОЛ при благоприятном и неблагоприятном течении постковидного синдрома до и после реабилитации Fig. 3. Serum levels of secondary LPO products in favorable and unfavorable post-COVID syndrome before and after rehabilitation
постковидного синдрома до реабилитации постковидного синдрома после реабилитации постковидного постковидного синдрома до синдрома после реабилитации реабилитации
Рис. 4. Содержание в сыворотке крови конечных продуктов ПОЛ при благоприятном и неблагоприятном течении постковидного синдрома до и после реабилитации Fig. 4. Serum levels of LPO end products in favorable and unfavorable post-COVID syndrome before and after rehabilitation
П0СТК08ИДН0Г0 постковидного синдрома до синдрома после реабилитации реабилитации постковидного постковидного синдрома до синдрома после реабилитации реабилитации

20 0
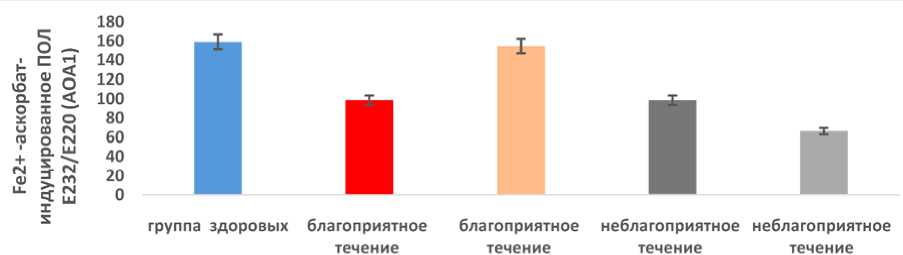
Рис. 5. АОА1 сыворотки крови при благоприятном и неблагоприятном течении постковидного синдрома до и после реабилитации
Fig. 5. Serum levels of АОА1 in favorable and unfavorable post-COVID syndrome before and after rehabilitation

благоприятное течение неблагоприятное течение неблагоприятное течение группа здоровых благоприятное течение
постковидного синдрома до реабилитации
постковидного синдрома после реабилитации
постковидного синдрома до реабилитации
постковидного синдрома после реабилитации
Рис. 6. АОА2 сыворотки крови при благоприятном и неблагоприятном течении постковидного синдрома до и после реабилитации
Fig. 6. Serum levels of АОА2 in favorable and unfavorable post-COVID syndrome before and after rehabilitation пациентов. После реабилитации различия в антиокислительной активности АОА1 при неблагоприятном и благоприятном течении заболевания достоверны(p < 0,05). При благоприятном течении АОА1 выше в 2,33 раза, чем при неблагоприятном течении. АОА2 так же, как и АОА1, демонстрирует общую закономерность: при благоприятном течении постковидного синдрома после реабилитации значения АОА2 достоверно (p < 0,05) повышаются в 1,35 раза, а при неблагоприятном течении АОА2 снижается после реабилитации в 1,31 раза (рис. 5, 6). Различия после реабилитации в Fe2+-аскорбатиндуцирован-ном ПОЛ (Е278/Е220) АОА2 при благоприятном и неблагоприятном течении в 2,37 раза.
Таким образом, содержание в сыворотке крови белка S-100 и липопероксидов, а также 174
антиокислительной активности сыворотки крови имеет достоверные отличия при благоприятном и неблагоприятном течении заболевания, между ними и клиническими признаками постковидного синдрома имеет место корреляция высокой степени и возможно их использование для планирования реабилитационного процесса. Связанное с карантином снижение иммунной системы в результате развития депрессии или тревоги, астенического синдрома можно предотвратить и/или ослабить. Действительно, воспалительный процесс, вызванный вирусом COVID19, может быть более эффективно излечен антиоксидантными системами в различных органах, включая мозг хорошо адаптированных к физическим тренировкам людей. Для формирования эффективного инструмента предупрежде- ния тяжелых отсроченных эффектов инвазии SARS-CoV-2 в настоящее время продолжается поиск ранних маркеров как скрытых, так и персистирующих повреждений различных функциональных систем. С учетом выявленных прогностических маркеров благоприятного и неблагоприятного течения постковидного синдрома мы составили план реабилитации с использованием немедикаментозных средств, повышающих антиоксидантую активность, и использованием препарата модифицированных аффинно очищенных антител к мозгоспецифическому белку S-100 – ПРОСПЕКТА. Существует и определенный дефицит публикаций, в которых было бы документировано различие в частоте возникновения нейропсихологических нарушений и астенического синдрома у пациентов с постковидным синдромом у лиц с малоподвижным образом жизни и активно занимающихся на регулярной основе физической культурой. Серьезным препятствием для эффективной реабилитации является необходимость восстановления не какого-то конкретного органа, а организма в целом. Основная проблема – формирование так называемого порочного круга – пациент ослаблен, ему тяжело заниматься с реабили-тологом. Но в то же время отсутствие физической активности приводит к развитию мышечной гипо- и атонии, что, в свою очередь, еще больше усугубляет состояние пациента и еще сильнее сказывается на его физической форме. Это побудило нас исследовать протекание восстановительных процессов, выраженности астенического синдрома у лиц, ведущих малоподвижный образ жизни, и лиц, на регулярной основе занимающихся физической культурой.
На втором этапе нашего исследования обследовано 120 человек молодого возраста (18–44 года) с клиникой астенического постко-видного синдрома (60 человек, на регулярной основе занимающихся физической культурой, и 60 человек, ведущих малоподвижный образ жизни, не занимающихся спортом).
Критериями включения в группы было: постковидный астенический синдром; возраст от 18 до 44 лет. Критерии исключения: острые и хронические заболевания в стадии обострения. В течение недели до участия в исследовании и на его протяжении не было разрешено использование ноотропов, антидепрессантов, транквилизаторов и снотворных средств. Все пациенты проходили физическую реабилитацию (ЛФК, массаж). Группа А – 30 человек – получала физическую реабилитацию и ПРОСПЕКТУ по 2 табл. 2 раза в день в течение месяца. Группа Б – 30 человек – дополнительно к физической реабилитации, получала «Карбоник»-терапию и ПРОСПЕКТУ по 2 табл. 2 раза в день в течение месяца. Группа В – 30 человек – получала дополнительно к физической реабилитации, «Карбо-ник»-терапию. Группа Г – 30 человек – получала только физическую реабилитацию. Каждая группа подразделялась на две подгруппы: Лица, занимающиеся физической культурой на регулярной основе, – подгруппа 1 по 15 человек в каждой группе. Лица, ведущие малоподвижный образ жизни, – подгруппа 2 – по 15 человек в каждой группе. При тестировании обследуемых по многомерной шкале оценки астении (MFI) мы выявили, что выраженность общей астении до обследования достоверно не отличалась в группах (p > 0,05) (рис. 7). После лечения и реабилитации общая астения
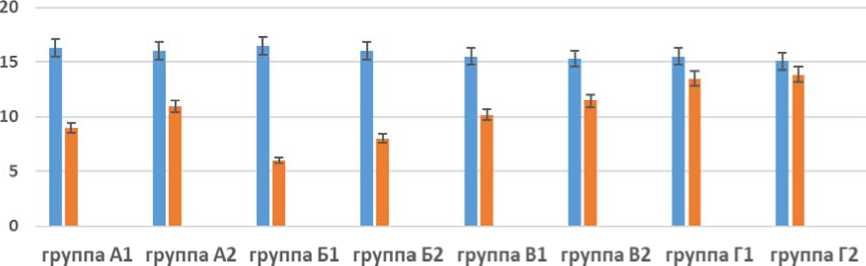
Рис. 7. Результаты тестирования обследуемых по многомерной шкале оценки астении (MFI) – общая астения
Fig. 7. Multidimensional fatigue inventory assessment results – general fatigue
достоверно (p < 0,05) снижалась в 1,81 раза в подгруппе А1 – лица, занимающиеся физической культурой на регулярной основе, получавшие физическую реабилитацию и ПРОСПЕКТУ, и в 1,45 раза в подгруппе А2 – лица, ведущие малоподвижный образ жизни, получавшие физическую реабилитацию и ПРОСПЕКТУ.
Более значительное – в 2,75 раза (p < 0,05) – снижение общей астении выявлялось после реабилитации в подгруппе Б1 – лица, занимающиеся физической культурой на регулярной основе, дополнительно к физической реабилитации получавшие «Карбоник»-терапию и ПРОСПЕКТУ; и в 2 раза в подгруппе Б2 – лица (р < 0,05), ведущие малоподвижный образ жизни, получавшие дополнительно к физической реабилитации «Карбоник»-терапию и ПРОСПЕКТУ. В подгруппах В1 и В2 снижение общей астении (р < 0,05) после реабилитации было в 1,52 и 1,33 раза. Наименьшее уменьшение общей астении после реабилитации было в подгруппах Г1 (в 1,15 раза; р < 0,05) и Г2 (в 1,09 раза; p > 0,05).
Заключение. Проведенное на начальном этапе наших исследований определение прогностического значения содержания белка S-100 в сыворотке крови при благоприятном и неблагоприятном течении постковидного синдрома побудило нас использовать в комплексах реабилитации препарат ПРОСПЕКТА. Мишенью препарата Проспекта® является специфичный для мозга Са2+-связывающий белок S-100 (S-100B), который широко представлен в центральной нервной системе. S-100B регулирует следующие фундаментальные процессы в головном мозге: генерация и проведение нервных импульсов, передача синаптических сигналов; стимуляция дифференцировки и пролиферации нейронов; на системном уровне S-100B изменяет соотношение процессов активации и торможения, положительно влияя на интегративную активность мозга. Благодаря этому S-100B обладает защитой от стресса, в том числе оказывает успокаивающее, нейропротекторное и ноо- тропное действие. Клиническая эффективность использования дыхательного тренажера пятого поколения «КАРБОНИК», разработанного профессором В.П. Куликовым, исследовалась на базе кафедры спортивной медицины и физической реабилитации ФГБОУ ВО «УралГУФК»: ООО «CNS» и ООО «СОНАР», а также в НИИ ОС ФГБОУ ВО «УралГУФК» при различных заболеваниях и доказала свою эффективность. Каждый из авторов, в том числе И.В. Николаева, М.О. Косарев, Д.Д. Косарева, М.В. Кулешова, А.А. Кинзерский, Е.А. Беседина, В.А. Садова, Р.М. Малевич, Л.Г. Крылова, в своих работах представлял часть своего исследования «Карбоник»-терапии при различных заболеваниях у лиц различных возрастных групп, у спортсменов и пациентов, исследуется также его значение в спортивной реабилитации и тренировке [3, 10, 13]. После перенесенного даже с минимальными клиническими проявлениями или даже бессимптомного COVID-19 может обнаружиться последствие в виде психологической подавленности, тревожности, панических атак и астенического синдрома, снижающих качество жизни пациентов. При аналогичной степени тяжести поражений в остром периоде, а также отсутствии достоверных различий в выраженности постковидных астенических нарушений результаты реабилитации значительно лучше у обследованных на регулярной основе занимающихся физической культурой, чем у пациентов, ведущих малоподвижный образ жизни. Эффективность лечебно-реабилитационного комплекса в виде снижения общей астении, тревожности, панических атак – наибольшая в группе Б, дополнительно к физической реабилитации получавшей «Карбоник»-терапию и ПРОСПЕКТУ по 2 табл. 2 раза в день в течение месяца; на втором месте по эффективности располагается группа А, получающая физическую реабилитацию и ПРОСПЕКТУ по 2 табл. 2 раза в день в течение месяца, имеющая небольшое преимущество перед группой В, дополнительно к физической реабилитации получавшей «Карбоник»-терапию.


