Биомолекулярная оценка почечной функции при различных видах оперативного лечения почечно-клеточного рака
Автор: Попков В.М., Тарасенко А.И., Маслякова Г.Н., Россоловский А.Н., Захарова Н.Б., Березинец О.Л., Ломакин Д.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 1 т.13, 2017 года.
Бесплатный доступ
Цель: оценка возможности использования маркеров острого почечного повреждения для прогнозирования на дооперационном этапе риска последующего снижения скорости клубочковой фильтрации (СКФ) при различных видах оперативного лечения почечно-клеточного рака (ПКР). Материал и методы. Исследованы 60 пациентов с гистологически подтвержденным ПКР T1-3M0N0, оперированных в клинике урологии Саратовского ГМУ им. В. И. Разумовского в объеме нефрэктомии или резекции почки. Перед операцией всем больным проведено стандартное обследование, предусмотренное для больных с опухолью почки: УЗИ, МРТ, экскреторная урогра-фия и динамическая реносцинтиграфия, определялись периоперационные значения сКр и СКФ. Методом ИФА произведено исследование концентраций экскретирующегося с мочой NGAL и IL-18 в пробах сыворотки крови на дооперационном этапе, на 5-е сутки и через 1 месяц послеоперационного наблюдения. Различия в клинических данных и клинические переменные сравнивали с помощью ранговых корреляций Спирмена и t-критерия. Результаты. Определяемые показатели маркеров ОПП IL-18 и NGAL в раннем послеоперационном периоде повышены у пациентов после открытой нефрэктомии. Кроме того, при корреляционном анализе по методу Спирмена выявлена сильная достоверная корреляция между дооперационным уровнем IL-18 и СКФ после операции (г=1; р
Биомолекулярные маркеры, острое почечное повреждение, почечно-клеточный рак
Короткий адрес: https://sciup.org/14918425
IDR: 14918425
Текст научной статьи Биомолекулярная оценка почечной функции при различных видах оперативного лечения почечно-клеточного рака
-
1 Введение. Почечно-клеточный рак (ПКР) занимает десятое место среди наиболее распространенных и злокачественных новообразований во всем мире, а также является наиболее распространенным типом рака почки у взрослых [1]. На его долю приходится около 97% всех опухолей почек. Среди урологических опухолей рак почки занимает третье место после новообразований простаты и мочевого пузыря, а по смертности находится на первом месте. Заболеваемость и смертность от ПКР растут со скоростью 2-3% в десятилетие, причем примерно 35% пациентов умирают в течение первых пяти лет после постановки диагноза [2].
Несмотря на различные подходы к диагностике и ведению пациентов с ПКР, основой лечения данной патологии по-прежнему является хирургическое вмешательство в объеме нефрэктомии, резекции опухоли или применения аблационных процедур. Последние служат альтернативой для опухолей небольших размеров у пациентов с наличием противопоказаний к традиционной хирургической технике [3, 4].
Широкое внедрение в клиническую практику методов ультразвукового исследования, компьютерной и магнитно-резонансной томографии значительно увеличило процент выявления ранних стадий рака почки, что делает актуальным применение малоинвазивных хирургических методов лечения данной патологии [5]. При наличии определенного опыта операционное время при эндоскопической нефрэктомии не превышает время открытой операции. Кроме того, традиционно лапароскопический доступ не только обеспечивает существенное сокращение реабилитационного периода и косметический эффект, но и исключает массивную травму тканей. Доказано, что операционная травма и обширная раневая поверхность при открытых оперативных вмешательствах оказывают отрицательное влияние на функциональное состояние контралатеральной почки вследствие активации процессов нефрофиброза с последующим снижением почечной функции.
Прогрессирование почечной недостаточности в значительной степени зависит от характера повреждающего воздействия на паренхиму почек. В случае хирургической травмы послеоперационное течение, как правило, сопровождается ишемией почки с последующими функциональными нарушениями, особенно при наличии исходных признаков почечной недостаточности [6]. Эпизоды острого почечного повреждения (ОПП) приводят к развитию клеточного ответа, сопровождающегося каскадом иммунологических реакций, с исходом в нефросклероз. ОПП всегда связано с повышенным риском прогрессирования хронического заболевания почек или смерти [7]. Именно поэтому ранняя диагностика ОПП при хирургическом лечении становится первоочередной задачей.
Классические методы оценки функции почек не являются достаточно чувствительными, особенно в условиях ранней диагностики ОПП. Традиционно в клинической практике ОПП диагностируется на основании гиперкреатинемии и снижения СКФ, как правило сопровождающихся олигурией или анурией [8, 9].
В настоящее время в литературе обсуждается возможность использования некоторых биомаркеров для прогнозирования развития и исходов ОПП
[10–13]. В первом официальном документе, регламентирующем возможность их использования для ограниченного применения в доклинических и клинических исследованиях, были рекомендованы семь биомаркеров почечного повреждения: креатинин сыворотки, N-Acetyl-β-D-glucosaminidase, NGAL, KIM-1, IL-18, netrin-1 и MCP-1 [14].
Цель исследования: оценка возможности использования маркеров ОПП для прогнозирования на до-операционном этапе риска последующего снижения скорости клубочковой фильтрации (СКФ) при различных видах оперативного лечения.
Материал и методы. Проспективно обследованы 60 пациентов с гистологически подтвержденным ПКР Т1-3М0N0, оперированных в клинике урологии Саратовского ГМУ им. В. И. Разумовского в объеме нефрэктомии или резекции почки. Пациенты рандомизированы в три группы: 1) больные после нефрэктомии, выполненной по поводу рака почки традиционной хирургической техникой; 2) пациенты после лапароскопической нефрэктомии; 3) после лапароскопической резекции опухоли.
Перед операцией всем больным проведено стандартное обследование, предусмотренное для больных с опухолью почки: УЗИ, МРТ, экскреторная урография и динамическая реносцинтиграфия. Собранные данные включали: возраст, пол, демографические сведения, анамнез, сопутствующую патологию, периоперационные значения сКр и СКФ.
Методом твердофазного ИФА произведено исследование концентраций экскретирующегося с мочой липокалина-2 или NGAL и IL-18 с использованием коммерческих наборов реагентов фирм «Hycult Вiotech» и «Вектор Бест» в пробах сыворотки крови на дооперационном этапе, на 5-е сутки и через 1 месяц послеоперационного наблюдения. Почечная функция изучена с помощью динамической нефрос-цинтиграфии и дополнительно оценена с помощью расчетного уравнения СКФ (CKD-EPI, 2009). Исходы функции почек стратифицированы на основе классификации ХБП по стадиям. Различия в клинических данных и клинические переменные сравнивали с помощью ранговых корреляций Спирмена и t-критерия.
Результаты. Сравнивали изменения в СКФ через 1 месяц после оперативного лечения в группах наблюдения. Послеоперационная СКФ была значительно выше у пациентов, проходящих нефрэктомию, выполнененную как традиционной, так и лапароскопической техникой. СКФ (CKD-EPI) составила 45,4, 55,2 и 82,3 ммоль/л в 1-й, 2-й и 3-й группах соответственно. У пациентов 1-й группы отмечалось снижение функции почек на 22%, во 2-й группе на 20%, а у больных 3-й группы функция почек улучшилась на 23% (р<0,05) (рис. 1).
-
IL-18 является провоспалительным цитокином, структурно подобным IL-1, вырабатывающимся эпителиальными клетками дистальных канальцев. Более того, эти клетки содержат три основных компонента, необходимых для высвобождения активной формы IL-18, а именно про-IL-18, P2X7 и внутриклеточные протеазы цистеин каспазы-1, которые преобразуют проформу IL-18 в его активную форму, которая затем выходит из клеток и может экскретироваться с мочой.
Определяемые показатели маркера ОПП IL-18 в раннем послеоперационном периоде были повышены у пациентов после открытой нефрэктомии. Кроме того, при корреляционном анализе по методу Спирмена выявлена сильная достоверная корреляция
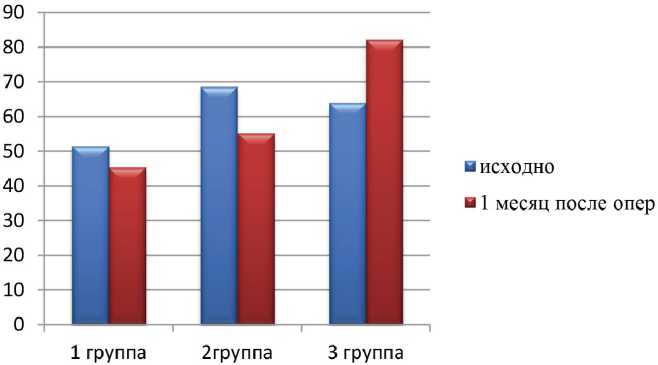
Рис. 1. Сравнительная оценка функционального состояния (СКФ-СKD-EPI) почек при различных видах оперативного лечения ПКР (исходно и через 1 месяц после хирургического лечения), ммоль/л
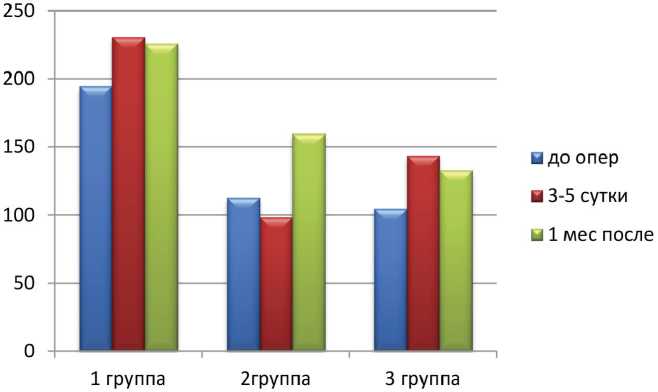
Рис. 2. Сравнительная оценка уровней ИЛ-18 в сыворотке крови при различных видах оперативного лечения ПКР (исходно, на 5–7-е сутки и через 1 месяц после хирургического лечения), пг/мл
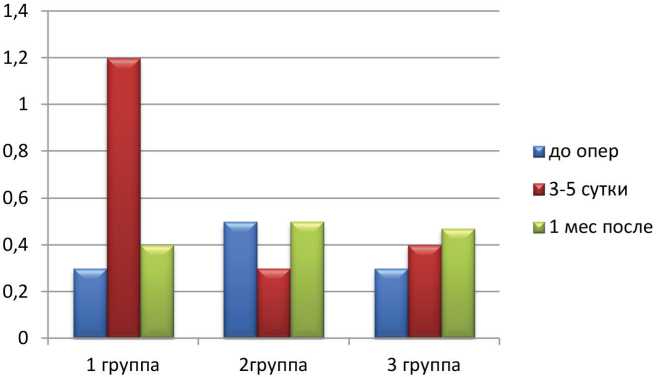
Рис. 3 Сравнительная оценка уровней NGAL в моче при различных видах оперативного лечения ПКР (исходно, на 5–7-е сутки и через 1 месяц после хирургического лечения), пг/мл между дооперационным уровнем IL-18 и СКФ после операции (r=1; р≤0,05) (рис. 2).
Разнонаправленная динамика наблюдалась при определении в раннем послеоперационном периоде маркера ОПП NGAL. Самый высокий его уровень наблюдался у пациентов после открытой нефрэктомии на 3–5-е сутки послеоперационного периода, однако к месяцу его показатели снижались до самых низких значений по сравнению с другими группами. Во 2-й группе к 5-м суткам наблюдали снижение уровня NGAL, однако к месяцу он достигал начального уровня. Другая тенденция изменения показателей данного маркера наблюдалась в 3-й группе у больных с лапароскопической резекций опухоли, когда мы наблюдали повышение уровня NGAL к 5-м суткам и через месяц после проведенной операции (рис. 3).
Известно, что уровень NGAL при развитии повреждений ренального эпителия является показателем восстановления эпителия и фактором, характеризующим предотвращение дальнейшего развития ОПП. Обусловливается это тем, что NGAL обладает способностью в ответ на ренальные повреждения специфически связывать сидерофоры (железо переносящие белки), уровень NGAL в плазме, в почках и в моче резко возрастает, что играет определяющую роль в обеспечении выживания поврежденных ренальных клеток и их дальнейшей пролиферации.
Обсуждение. Нефрэктомия на протяжении 50 лет уже является основой для лечения ПКР [15, 16]. В последнее десятилетие наблюдается тенденция к увеличению использования органосохраняющей хирургии. В 2009 г. впервые процент частичных нефрэктомий превысил процент радикальных нефрэктомий у пациентов с ПКР, имеющих опухоль размером менее 4 см [17].
Совершенствование и широкое применение технологий визуализации привели к уменьшению размера и стадии вновь выявленных опухолей почки, что позволило более широко использовать резекции почки. У пациентов с небольшой почечной кортикальной опухолью радикальная нефрэктомия является независимым фактором риска для развития хронической болезни почек (ХБП), чем ПН [18]. У большинства пациентов с небольшими (до 3 см) опухолями почечной паренхимы следует рассматривать органосберегающие варианты оперативного пособия, поскольку снижение функции почек увеличивает риск сердечно-сосудистых событий и общей смертности в долгосрочной перспективе [19].
Минимально инвазивная лапароскопическая нефрэктомия, по сравнению с открытой лапаротомией, позволяет минимизировать сроки госпитализации и время оперативного вмешательства, обеспечивает более быстрое восстановление и уменьшает объем кровопотери, снижает интенсивность болевого синдрома и возможность последующей инвалидизации и стоимость лечения; сохраняет почечную массу и долгосрочную почечную функцию в перспективе [20].
Проведенные за последнее десятилетие экспериментальные и клинические исследования указывают на то, что при наличии технической возможности резекция почки обеспечивает эквивалентные нефрэктомии онкологические результаты, максимально сохраняя при этом функцию почек, что приводит к предотвращению или замедлению начала хронического заболевания почек (ХБП) и связанной с ней сердечнососудистой заболеваемости и смертности [21].
С другой стороны, резекция является более технически сложной операцией по сравнению с радикальной нефрэктомией. В одном из исследований J. Simhan et al. (2011), используя послеоперационную систему классификации осложнений Clavien — Dindo, показали, что даже частичная нефрэктомия имеет как малые, так и большие осложнения, которые составляют 26,7 и 11,5% соответственно [22]. Это исследование также показало, что серьезные осложнения коррелируют с анатомическими особенностями расположения опухоли, затрудняющими ее иссечение.
В исследовании E. Scosyrev et al. (2014) отмечалось значительное уменьшение числа случаев почечной дисфункции у больных c ПКР, подвергнутых органсохраняющему вмешательству, в сравнении с радикальной нефрэктомией через 6,7 года наблюдения. Однако благотворное влияние на конечную СКФ не привело к улучшению общей выживаемости в течение среднего периода наблюдения 9,3 года в группе пациентов, подвергнутых органсохраняюще-му вмешательству [23]. В то же время данные об изменениях функции почек после хирургического лечения у пациентов с ПКР, особенно с использованием современных биомаркеров, в настоящее время ограниченны [24].
В ряде исследований показано, что при повреждении почечных канальцев происходит повышение уровня NGAL как в сыворотке крови (в 7–16 раз), так и в моче (в 25–1000 раз) [25–27].
Экспериментальными исследованиями установлено, что NGAL является одним из наиболее быстро реагирующих маркеров ранней фазы ишемического-го повреждения почек (в течение 2 ч), коррелирующих с длительностью ишемии [28].
-
IL -18 оказывает выраженный эффект на активацию T-клеток и является модулятором инфекционных, аутоиммунных и воспалительных процессов. Данный маркер весьма специфичен для ОПП, и на его уровень не влияют большинство нефротокси-нов, хроническая болезнь почек, инфекция мочевого тракта, нефротический синдром или преренальная азотемия [29, 30].
Определение повышенного уровня IL-18 в моче предсказывает наличие острого почечного повреждения за 24 часа до роста уровня сКр [31].
-
IL -18 может служить в качестве маркера травмы проксимальных канальцев при остром канальцевом некрозе и более точной количественной оценки степени острого ишемического и/или канальцевого повреждения [32]. Раннее измерение IL-18 в моче коррелирует с тяжестью ОПП, а также со смертностью, однако не обладает способностью прогнозировать последующее развитие почечной недостаточности [33].
Таким образом, данные исследования могут быть полезны при выборе принципов лечения и позволят индивидуализировать хирургические процедуры, подходящие для конкретных групп населения, чтобы улучшить общую выживаемость и качество жизни пациента [34].
Заключение. Лапароскопическая резекция ПКР является методом выбора хирургического лечения ПКР. В качестве предиктора неблагоприятного прогноза может быть использован уровень IL-18 в сыворотке крови. Его повышение коррелирует со снижением функции почек в послеоперационном периоде, а по некоторым данным, IL-18 также является независимым предиктором неблагоприятного прогноза у пациентов с локализованным ПКР. Сравнительная оценка уровней NGAL в моче при различных видах оперативного лечения ПКР отражает различную динамику развития острого почечного повреждения при различных видах оперативного вмешательства и указывает, что наиболее выраженным повреждающим воздействием на паренхиму почки является операция нефрэктомии, выполненной по поводу рака почки традиционной хирургической техникой.
Список литературы Биомолекулярная оценка почечной функции при различных видах оперативного лечения почечно-клеточного рака
- Solarek W, Czarnecka AM, Escudier B. Insulin and IGFs in renal cancer risk and progression. Endocr Relat Cancer 2015 Oct; 22 (5): 253-64
- Chinello C, L'imperio V, Stella M. The proteomic landscape of renal tumors. Expert Rev Proteomics 2016; 13 (12): 1103-1120
- Аляев Ю.Г., Глыбочко П.В., Григорян З.Г. и др. Органосохраняющие операции при опухоли почки. М.: ГЭОТАР-Медиа, 2009; 264 с.
- TraczAF, Szczylik С, Porta С, Czarnecka AM. Insulin-like growth factor-1 signaling in renal cell carcinoma. ВМС Cancer 2016; 16(1): 453
- Гасанов M.3., Батюшин M.M., Терентьев В.П. и др. Молекулярные аспекты патогенеза рака почки. Фундаментальные исследования 2012; 12 (2): 244-249
- Kozachenko AV. Tread and regenerative therapy for acute and chronic kidney damage: DSc abstract. M., 2009. Russian (Казаченко А. В. Протекторная и регенерационная терапия при остром и хроническом повреждении почки: автореф. дис.... д-ра мед. наук. М., 2009)
- Ariarajah N, Gerstel Е, Martin PY, Ponte В. Biomarkers in acute kidney injury: an update. Rev Med Suisse 2011; 7 (284): 490-4
- Mehta RL, Kellum JA, Shah SV, et al. Acute Kidney Injury Network. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007; (11): 31
- Hoste EA, Clermont G, Kersten A, et al. RIFLE criteria for acute kidney injury are associated with hospital mortality in critically ill patients: a cohort analysis. Crit Care 2006; 10 (3): 73
- Rosner MH. Urinary biomarkers for the detection of renal injury. Adv Clin Chem 2009; (49): 73-97
- Nguyen MT, Devarajan P. Biomarkers for the early detection of acute kidney injury. Pediatr Nephrol 2008; 23 (12): 2151-7
- Waanders F, Timmeren MM van, Stegeman CA, et al. Kidney injury molecule-1 in renal disease. J Pathol 2010; 220 (1): 7-16
- Маслякова Г.H., Россоловский A.H., Напшева A.M., Захарова Н.Б. Методы оценки тубулоинтерстициальных изменений при хирургическом лечении больных мочекаменной болезнью. Вестник урологии 2014; (1): 3-10)
- Dieterle F, Sistare F, Goodsaid F, et al. Renal biomarker qualification submission: a dialog between the FDA-EMEA and Predictive Safety Testing Consortium. Nat Biotechnol 2010; (28): 455-462
- Huang WC, Atoria CL, Bjurlin M, et al. Management of small kidney cancers in the new millennium: contemporary trends and outcomes in a population-based cohort. JAMA Surgery 2015; 150 (7): 664-672
- Meeks JJ, Gonzalez CM. Standard of care for small renal masses in the 21st century. JAMA Surgery 2015; 150 (7): 672-673
- Ha SC, Zlomke HA, Cost N, Wilson S. The Past, Present, and Future in Management of Small Renal Masses. J Oncol 2015; (20): 364807
- Kim SH, Lee SE, Hong SK, et al. Incidence and risk factors of chronic kidney disease in korean patients with T1 a renal cell carcinoma before and after radical or partial nephrectomy Jpn J Clin Oncol 2013; (43): 1243-1248
- Huang WC, Elkin EB, Levey AS, et al. Partial nephrectomy versus radical nephrectomy in patients with small renal tumors -is there a difference in mortality and cardiovascular outcomes? J Urol 2009; (181): 55-61
- Rini Bl, Campbell SC, Escudier B. Renal cell carcinoma. Lancet 2009; 373 (9669): 1119-1132
- Ghoneim TP, Sjoberg DD, Lowrance W. Partial nephrectomy for renal tumors in solitary kidneys: postoperative renal function dynamics. World J Urol 2015 Dec; 33 (12): 2023-9
- Simhan J, Smaldone MC, Tsai KJ, et al. Objective measures of renal mass anatomic complexity predict rates of major complications following partial nephrectomy. European Urology 2011; 60 (4): 724-73
- Scosyrev E, Messing EM, Sylvester R, et al. Renal function after nephron-sparing surgery versus radical nephrectomy: results from EORTC randomized trial 30904. European Urology 2014; 65 (2): 372-377
- Kim CS, Bae EH, Ma SK. Impact of partial nephrectomy on kidney function in patients with renal cell carcinoma. ВМС Nephrol2014; 19(15): 181
- Mishra J, Dent C, Tarabishi R, et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet 2005; (365): 1231 -1238
- Wagener G, Jan M, Kim M, et al: Association between increases in urinary neutrophil gelatinase-associated lipocalin and acute renal dysfunction after adult cardiac surgery. Anesthesiology 2006; (105): 485-491
- Mishra J, Ma Q, Kelly C, et al: Kidney NGAL is a novel early marker of acute injury following transplantation. Pediatr Nephrol, 2006; (21): 856-863
- Supavekin S, Zhang W, Kucherlapati R, et al. Differential gene expression following early renal ischemia/reperfusion. Kidney Int2003; (63): 1714-1724
- МОЛЕКУЛЯРНЫЕ МАРКЕРЫ ОСТРОГО ПОЧЕЧНОГО ПОВРЕЖДЕНИЯ И ФИБРОЗА В ОЦЕНКЕ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ПОЧЕК У БОЛЬНЫХ НЕФРОЛИТИАЗОМ Россоловский А.Н., Глыбочко П.В., Попков В.М., Полозов А.Б., Понукалин А.Н., Захарова Н.Б., Березинец О.Л., Блюмберг Б.И. Медицинский вестник Башкортостана. 2010. Т. 5. № 5. С. 31-38.
- Lisowska-Myjak B. Serum and urinary biomarkers of acute kidney injury. Blood Purif 2010; 4 (29): 357-65
- Zang ZD, Huang YZ, Yang Y, Guo FM, Qiu HB. Urinary neutrophil gelatinase-associated lipocalin and urinary interleukin-18 in early diagnosis of acute kidney injury in critically ill patients. Zhonghua Nei Ke Za Zh 2010; 5 (49): 396-399
- Parikh CR, Jani A, Melnikov VY, et al. Urinary interleukin-18 is a marker of human acute tubular necrosis. Am J Kidney Dis Lane BR. Molecular markers of kidney injury. Urol Oncol 2011; 30 (43): 405-414
- Urbschat A, Nicholas Obermuller N, HaferkampA. Biomarkers of kidney injury 2011; 16(1): 22-30
- The Ha SC, Zlomke HA, Cost N, et al. Past, Present, and Future in Management of Small Renal Masses. J Oncol 2015; 20 (15): 364.


