Биопрепарат на основе штамма Escherichia coli ZP. Сообщение I. Оценка эффективности колицина при конъюгативной доставке colE7 в клетки APEC in vitro и in vivo
Автор: Кузнецова М.В., Масленникова И.Л., Гизатуллина Ю.С., Gur Bertok D., Stari Erjavec M.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная медицина
Статья в выпуске: 2 т.55, 2020 года.
Бесплатный доступ
Обеспечение защиты сельскохозяйственных животных от инфекционных болезней - приоритетное направление ветеринарной медицины. Широкое распространение в птицеводческих хозяйствах патогенных и условно-патогенных бактерий, устойчивых к антибиотикам, требует разработки современных способов поддержания здоровья птицы при ее промышленном производстве. В качестве меры по предупреждению и ограничению распространения возбудителей с устойчивостью к противомикробным агентам перспективно использование бактериальных препаратов направленного действия - пробиотиков. В настоящей работе в экспериментальных моделях in vitro и in vivo мы впервые показали антагонистическое действие генно-модифицированного штамма Escherichia coli ŽP против возбудителей эшерихиозов у птиц - АPEC (avian pathogenic Escherichia coli ). Установлено, что in vitro конъюгативный перенос гена сolE7 в клетки APEC проходит эффективно в условиях как планктонного роста, так и формирующейся биопленки. In vivo штамм E. coli ŽP способен активно заселять кишечник крыс и маньчжурских перепелов и сохраняться там, способствуя нормализации микробиоты животных. Цель исследования - оценка эффективности киллинга клеток APEC при конъюгативном переносе гена колицина E7 и определение конкурентоспособности штамма E. coli ŽP in vitro и in vivo . В работе использовали ColE7-опосредованную kill-anti-kill систему на основе пробиотического штамма Nissle 1917, включающую генно-модифицированный штамм E. coli ŽP (киллерный донор), несущий на конъюгативной плазмиде pOX38а ген колицина E7 ( сolE7 ) с ДНКазной активностью, а также ген immE7 в хромосоме, и штамм E. coli N4i без colE7 на плазмиде (контрольный донор). В качестве реципиентов использовали устойчивые к ампициллину штаммы APEC ( n = 6), изолированные из внутренних органов инфицированных цыплят-бройлеров. Филогенетическую принадлежность культур определяли методом мультиплексной полимеразной цепной реакции (quadriplex PCR). Конъюгативный перенос осуществляли в среде Луриа-Бертани (LB) в течение 6 и 24 ч в планктонной культуре и в биопленке в полистироловых плоскодонных иммунологических 96-луночных планшетах. Опыты на крысах (линия Wistar) и маньчжурских перепелах ( Coturnix coturnix ) выполняли в виварии (ГБОУ ВО Пермский государственный медицинский университет им. академика Е.А. Вагнера МЗ РФ). Нами экспериментально подтверждена конкурентоспособность E. coli ŽP при совместном культивировании с клетками APEC штаммов, в том числе продуцентами бактериоцинов, в различных моделях. Доказан конъюгативный перенос гена сolE7 в клетки APEC in vitro в условиях планктонного роста и формирующейся биопленки: в экспериментах с донорным штаммом E. coli N4i частота конъюгации варьировала в пределах 10-6-10-2. Эксперимент in vivo показал, что штамм E. coli ŽP способен эффективно заселять кишечник крыс и маньчжурских перепелов, сохраняясь там, как минимум, в течение 1 мес. Введение клеток E. coli ŽP с питьевой водой увеличивало общее содержание комменсальных эшерихий в кишечнике, подавляя развитие патогенных представителей этого вида без заметного влияния на молочнокислую и бифидофлору. Доказана возможность конъюгативного переноса плазмиды от донора E. coli N4i в условиях кишечного тракта обоих видов животных, который происходил с высокой частотой (в среднем 10-2). В экспериментах in vitro и in vivo с E. coli ŽP трансконъюганты обнаружены не были, то есть клетки реципиентов, получившие ген сolЕ7 посредством конъюгативного переноса, экспрессировали его и были лизированы вследствие ДНКазной активности колицина. В группах, получавших штамм ŽP, также отмечено снижение числа реципиентов АРЕС. Полученные результаты свидетельствуют, что штамм E. coli ŽP способен эффективно заселять кишечник животных и обладает антибактериальной активностью против энтеропатогенов за счет конъюгативного механизма передачи гена колицина. Он эффективно действует на резистентные и толерантные к бактериоцинам клетки, что позволяет предположить возможность создания на его основе высокоэффективного пробиотического препарата нового поколения.
Колицины, сole7, конъюгативный перенос, anti-kill система, альтернатива антибиотикам, пробиотики, патогенные escherichia coli птиц (apec), подопытные животные
Короткий адрес: https://sciup.org/142226302
IDR: 142226302 | УДК: 579.62:[573.6.086.83+577.21] | DOI: 10.15389/agrobiology.2020.2.364rus
Текст научной статьи Биопрепарат на основе штамма Escherichia coli ZP. Сообщение I. Оценка эффективности колицина при конъюгативной доставке colE7 в клетки APEC in vitro и in vivo
Птицеводство — один из наиболее быстрорастущих сегментов сельского хозяйства (1, 2). Для повышения эффективности производства птицы широко используются различные кормовые добавки, такие как синтетические гормоны и антибактериальные препараты (3). Многолетнее применение антибиотиков привело к формированию устойчивых к этим веществам грамположительных и грамотрицательных микроорганизмов, которые становятся основной причиной гибели молодняка на птицефабриках (4, 5). Кроме того, инфицированные особи промышленного стада служат резервуаром возбудителей острых кишечных инфекций для человека (6). В 2014 году Всемирной организацией здравоохранения (ВОЗ, World Health Organization, WHO) принята стратегия, предусматривающая ограничение использования антибактериальных препаратов для профилактики инфекционных заболеваний в сельском хозяйстве (7). В 2017 году к этой программе присоединилась Россия (8).
Перспективным направлением в рамках совершенствования мер по предупреждению и ограничению распространения возбудителей с устойчивостью к противомикробным агентам считается использование пробиотиков — бактериальных препаратов направленного действия, которым отводится ведущая роль при замене антибиотиков (9, 10). Пробиотики представляют собой моновидовую или смешанную культуру живых клеток микроорганизмов, которые применяются в качестве кормовых добавок и действуют как стимулятор роста, а также благотворно влияют на физиологические параметры и микробиоту хозяина (11, 12). Уже в первые часы жизни животных их кишечник искусственно заселяют штаммами бактерий и/или биокомплексами, обеспечивающими антагонистическое действие в отношении патогенных или условно-патогенных микроорганизмов. Такой эффект достигается за счет конкурентного вытеснения последних бактериями, продуцирующими антибактериальные вещества — бактериоцины, которые угнетают представителей близкородственных таксонов. Имеется значительное количество сообщений о положительном опыте применения пробиотиков для профилактики и лечения инфекций у птицы (1, 13-15). Существенное внимание уделяется искусственно сконструированным штаммам с множественной продукцией бактериоцинов (16-19). Например, в связи с утратой антагонистических свойств пробиотическим штаммом Escherichia coli M17 предложено восстановить его конкурентоспособность в условиях кишечника животных с помощью рекомбинантных плазмид, детерминирующих продукцию колицина E1 (20) или микроцина С51 (21). Тем не менее даже эти препараты могут быть недостаточно эффективными из-за появления бактериоциноустойчивых бактерий (22) с модифицированными поверхностными рецепторами и транслокационными системами. Возможным решением этой проблемы может стать использование альтернативного механизма доставки колицинов на основе горизонтального переноса col -генов при участии конъюгативных плазмид (23), что позволит воздействовать на резистентные и толерантные к бактериоцинам штаммы бактерий.
Антимикробная бактериальная kill—anti-kill система была апробирована с референтным (E. coli K-12 TG1) и уропатогенным (E. coli DL82) штаммами. С помощью ПЦР в реальном времени, биолюминесцентного метода и проточной цитометрии подтверждено, что плазмида pOX38a переносит сolЕ7 в клетку реципиента, где начинается его немедленная тран- скрипция и синтез бактериоцина, который убивает получателя (24).
В настоящей работе в экспериментальных моделях in vitro и in vivo мы впервые показали антагонистическое действие генно-модифицированного штамма E. coli ZP против возбудителей эшерихиозов у птиц — APEC (avian pathogenic Escherichia coli ). Установлено, что in vitro конъюгативный перенос гена сolE7 в клетки APEC проходит эффективно в условиях как планктонного роста, так и формирующейся биопленки. In vivo штамм E. coli ZP способен активно заселять кишечник крыс и маньчжурских перепелов и сохраняться там, способствуя нормализации микробиоты животных. Выявлено, что в условиях кишечного тракта конъюгативный перенос плазмиды от донора в штаммы APEC происходит с высокой частотой, в результате чего колицин действует на резистентные и толерантные к бак-териоцинам клетки, что позволяет предположить возможность создания на этой основе высокоэффективного пробиотического препарата нового поколения.
Цель нашего исследования — оценка эффективности киллинга клеток APEC (avian pathogenic Escherichia coli ) при конъюгативном переносе гена колицина E7, а также конкурентоспособности штамма Escherichia coli ZP in vitro и in vivo .
Методика . В работе использовали ColE7-опосредованную kill—anti-kill систему на основе пробиотического штамма Nissle 1917, включающую генно-модифицированный штамм E. coli ZP pOX38а GmrCmr (киллерный донор, KD), несущий на конъюгативной плазмиде ген колицина E7 ( colE7 ) с ДНКазной активностью, а также ген immE7 в хромосоме, и штамм E. coli N4i pOX38 GmrCmr (контрольный донор, D) без colE7 на плазмиде (25). Реципиентами (R) были устойчивые к ампициллину штаммы E. coli ( n = 6), выделенные из внутренних органов инфицированных цыплят-бройлеров (APEC). Культуры имели индивидуальный генетический профиль согласно rep-ПЦР типированию с праймерами ERIC 1R/ERIC 2 (26). Филогенетическую принадлежность изолятов определяли методом мультиплексной полимеразной цепной реакции (quadriplex PCR) (27). Праймеры, использованные в работе, синтезированы в ООО «Синтол» (г. Москва). Амплификацию проводили на термоциклере DNA Engine Dyad Thermal Cycler («Bio-Rad», США). Визуализацию полос и документирование данных осуществляли с помощью системы гель-документации Gel-Doc XR («Bio-Rad», США).
Штаммы были сохранены в коллекции культур промышленных микроорганизмов (Zbirka industrijskih mikroorganizmov, ZIM) биотехнологического факультета Университета Любляны (Univerza v Ljubljani, Словения).
Скрининг культур APEC на чувствительность к бактериоцинам проводили с использованием коллекции индикаторных штаммов-продуцентов бактериоцинов и микроцинов BZB (Университет Любляны) с помощью техники двойного слоя по методу отсроченного антагонизма (22). В качестве контрольного (чувствительного к бактериоцинам) штамма использовали E. coli DH5 α . Продукцию бактериоцинов штаммами АРЕС и чувствительность E. coli ZP к бактериоцинам исследуемых штаммов оценивали аналогичным методом (22).
Конъюгативный перенос осуществляли в среде Луриа-Бертани (LB) («Amresco», США) в течение 6 и 24 ч в планктонной культуре и в биопленке в полистироловых плоскодонных иммунологических 96-луночных планшетах («Ленполимер», Россия).
Конъюгативную смесь формировали из 100-кратно разведенных ночных культур (стандартизованных до 2,0 по стандарту мутности McFarland) донора и реципиента в соотношении 1:4. Предварительно отмытые 366
(0,89 % NaCl) биопленки разрушали ультразвуком (37 Гц, Elmasonic 30S, «Elma Schmidbauer GmbH», Германия) в 100 мкл физиологического раствора в течение 1 мин (5 циклов). Число колониеобразующих единиц (КОЕ) подсчитывали на селективных агаризованных средах с учетом разведения: трансконъюганты учитывали на LB-среде с добавлением антибиотиков хлорамфеникола (50 мкг/мл) и ампициллина (50 мкг/мл), клетки реципиента — на LB-среде с ампициллином (50 мкг/мл), клетки донора — на LB-среде с гентамицином (40 мкг/мл). Частоту конъюгативного переноса (Y) оценивали как отношение числа КОЕ клеток-трансконъюгантов (Т) к количеству КОЕ клеток-реципиентов (R) (28).
Биомассу биопленок определяли по методике J.H. Merritt с соавт. (29) на микропланшетном ридере Benchmark Plus («Bio-Rad», США) при X = 570 нм в единицах оптической плотности (OD).
Совместный рост бактерий оценивали с использованием богатой (LB) и бедной (М9) сред в лунках полистиролового плоскодонного иммунологического 96-луночного планшета при 37 ° С с 1-х по 3-и сут. Высев проводили из децимальных разведений бактериальной суспензии на соответствующие селективные агаризованные среды с антибиотиками.
Опыты на крысах (линия Wistar) и маньчжурских перепелах ( Co-turnix coturnix ) выполняли в виварии на базе ГБОУ ВО Пермский государственный медицинский университет им. академика Е.А. Вагнера МЗ РФ. Условия содержания (плотность посадки, фронт кормления и поения, температура, влажность, освещенность) были в пределах норм, рекомендуемых ВНИТИП. Общий уход за крысами и птицей осуществляли в соответствии с ГОСТ 34088-2017 (30).
Эксперимент по конъюгативному переносу in vivo проводили в два этапа. В первом эксперименте использовали самцов 30-суточных крыс массой 175,25±10,31 г, разделенных на три группы по 10 особей в каждой. Крыс содержали 21 сут в пластиковых клетках (по 5 особей в клетке) в отапливаемом (температурный режим 21-23 ° С) и вентилируемом помещении с естественным освещением, доступ к корму и воде ad libitum. Живые клетки контрольного (I группа) и киллерного (II группа) донора вводили с водой в концентрации 108 бактерий/гол. в течение 7 сут. Заселение кишечника на 3-и и 6-е сут эксперимента определяли, высевая фекалии на селективные среды. С 8-х до 21-х сут в обеих опытных группах с водой вводили живые клетки штамма APEC, устойчивого к ампициллину (реципиент), в концентрации 108 бактерий/гол., через 6 ч меняли воду и вводили донорные штаммы. Контрольная группа не получала ни один из штаммов E. соli . Наличие в кишечнике ампициллиноустойчивых реципиентов, контрольного/киллерного донора и трансконъюгантов определяли на 10-е, 14-е и 21-е сут эксперимента.
На втором этапе эксперимента использовали маньчжурских перепелов массой 114,0±7,50 г, которых разделили на три группы по 5 особей в каждой и содержали в условиях, аналогичных таковым на первом этапе, в течение 1 нед. Живые клетки контрольного (группа I) и киллерного (группа II) донора вводили с водой (108 бактерий/гол.) в течение 3 сут, ежесуточно контролируя заселение кишечника высевом фекалий на селективные среды. Со 2-х по 6-е сут эксперимента в обеих опытных группах вводили живые клетки штамма APEC, устойчивого к ампициллину (108 бак-терий/гол.), через 6 ч меняли воду и вводили донорные штаммы. Контрольная группа не получала ни один из штаммов E. соli . Присутствие в кишечнике устойчивых к ампициллину реципиентов и трансконъюгантов определяли на 2-е, 3-и и 6-е сут.
На обоих этапах эксперимента число жизнеспособных клеток рассчитывали на 1 г фекалий, частоту конъюгации определяли аналогично эксперименту in vitro .
Статистический анализ осуществляли в программах Microsoft Office Excel и STATISTICA 10 («StatSoft, Inc.», США). Результаты представлены в виде среднего арифметического ( M ) и его ошибки (±SEM). Достоверность различий средних величин оценивали с помощью t -критерия Стьюдента при p < 0,05, связь между количественными значениями — с использованием линейного коэффициента корреляции Пирсона ( rр ).
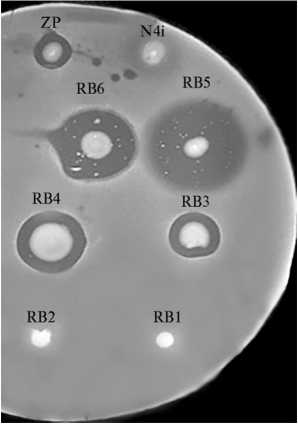
Результаты . Согласно quadriplex ПЦР, использованные в работе штаммы APEC принадлежали к филогенетическим группам В1, В2 и Е. Колициногения была выявлена у четырех культур, одна из которых оказалась нечувствительной к бактериоцину ColE7 (рис. 1, табл. 1). Все APEC были устойчивы к десяти и более бактериоцинам, в том числе с пороформирующим, ДНКазным, рРНКазным, тРНКазным механизмами действия.
А
Б

Рис. 1. Продукция бактериоцинов (А) и чувствительность к бактериоцинам (Б) у штаммов APEC (avian pathogenic Escherichia coli ) : А — штаммы E. coli ZP, N4i, APEC RB1-RB6, после выращивания тестируемых штаммов поверх них выращивали индикаторный штамм E. coli DH5a, Б — штамм ZP, верхний слой — разные штаммы APEC RB1-RB6 (метод отсроченного антагонизма).
1. Характеристика штаммов Escherichia coli , изолированных из внутренних органов инфицированных цыплят-бройлеров (avian pathogenic E. coli , APEC)
|
Штамм APEC |
Филогруппа |
Продукция бактериоцинов |
Резистентность к колицинам |
Резистентность к микроцинам |
|
RB1 |
В1 |
Нет |
A, B, D, E1, E3, E5, E7, Ia, Ib, K, N, M, S4 |
B17, C7, V |
|
RB2 |
Е |
Нет |
A, B, D, E1, E5, E7, Ia, Ib, K, N, M, S4 |
C7, V |
|
RB3 |
Е |
Есть |
A, B, D, E1, E2, E3, Ia, Ib, K, N, M, S4 |
B17, C7, V |
|
RB4 |
Е |
Есть |
A, B, D, E1, E, E5, E7, E8J, Ia, Ib, K, N, M |
B17, C |
|
RB5 |
В1 |
Есть |
A, B, D, E1, E5, E6, Ia, Ib, K, N, M, S4 |
B17, C7, V |
|
RB6 |
В2 |
Есть |
A, B, D, Ia, Ib, N, M, S4 |
B17, C7, V |
В экспериментах с контрольным донорным штаммом E. соli N4i частота конъюгативного переноса в течение 6 ч варьировала в пределах 10 - 6-10 - 2 и оказалась выше в формирующейся биопленке, чем в планктоне (соответственно 1,73½10 - 2±2,24½10 - 2 и 2,27½10 - 5±2,40½10 - 5), а в течение 24 ч была сопоставима в обеих моделях (4,45½10 - 4±5,46½10 - 4 против 6,25½10 - 3±8,63½10 - 3) (табл. 2). Модель биопленки была необходима, поскольку in vivo, в том числе в кишечном тракте, микроорганизмы существуют в основном в составе прикрепленных сообществ. При переносе в течение 24 ч корреляция между передачей плазмиды в планктоне и био-368
-
2. Число клеток доноров, реципиентов, трансконъюгантов (КОЕ/мл) и частота конъюгации в планктоне и биопленке в экспериментах по конъюгативному переносу плазмиды pOX38 в штаммы APEC (avian pathogenic Escherichia coli ) in vitro ( M ±SEM)
|
Штамм APEC |
I группа, E. coli N4i (контрольный донор) |
II группа, E. coli Ž P (киллерный донор) |
||||||
|
D |
□ R |
1 T 1 |
Ƴ |
KD |
R 1 |
T 1 |
Y |
|
|
RB1 |
1,04½107±1,13½106 |
1,70½108±2,50½107 |
Планктон 2,10½105±7,25½104 1,33½10 - 3±6,22½10 - 4 |
3,14½107±2,13½106 |
9,13½107±3,75½106 |
0,00 |
0,00 |
|
|
RB2 |
1,76½106±6,63½105 |
1,16½108±1,13½107 |
2,62½106±2,21½106 |
2,46½10 - 2±2,13½10 - 2 |
8,43½107±5,08½107 |
3,86½107±3,63½106 |
0,00 |
0,00 |
|
RB3 |
5,71½107±2,79½107 |
5,50½107±2,25½107 |
2,16½105±2,01½105 |
2,92½10 - 3±2,46½10 - 3 |
1,70½108±3,40½107 |
6,80½107±1,45½107 |
0,00 |
0,00 |
|
RB4 |
1,74½106±5,63½105 |
3,65½108±1,56½107 |
1,84½105±1,66½105 |
5,03½10 - 4±4,55½10 - 4 |
2,03½107±1,45½107 |
1,59½108±3,63½107 |
0,00 |
0,00 |
|
RB5 |
2,36½107±7,63½106 |
2,89½108±4,88½107 |
1,13½104±1,25½103 |
3,94½10 - 5±2,31½10 - 6 |
6,83½107±4,75½107 |
1,88½108±3,25½107 |
0,00 |
0,00 |
|
RB6 |
3,88½107±1,13½107 |
2,79½107±1,46½107 |
2,80½105±2,20½105 |
8,13½10 - 3±3,63½10 - 3 |
2,35½108±1,84½108 |
3,58½107±2,34½107 |
0,00 |
0,00 |
|
RB1 |
1,15½107±6,15½106 |
1,15½107±1,04½106 |
Био 5,13½102±3,63½102 |
пленка 4,89½10 - 5±2,06½10 - 5 |
7,94½106±1,29½106 |
3,04½107±2,67½107 |
0,00 |
0,00 |
|
RB2 |
4,07½106±3,81½106 |
7,76½106±3,56½106 |
7,38½103±6,88½103 |
1,60½10 - 3±3,42½10 - 4 |
3,43½107±2,22½107 |
3,03½107±2,62½107 |
0,00 |
0,00 |
|
RB3 |
5,32½106±3,93½106 |
4,78½106±8,75½105 |
1,13½103±7,75½102 |
2,13½10 - 4±1,23½10 - 4 |
4,70½106±2,08½106 |
5,25½106±2,00½106 |
0,00 |
0,00 |
|
RB4 |
8,16½106±3,44½106 |
3,96½107±7,56½106 |
2,49½104±1,91½104 |
5,58½10 - 4±3,76½10 - 4 |
1,48½106±3,25½105 |
2,83½107±2,50½107 |
0,00 |
0,00 |
|
RB5 |
7,43½106±3,07½106 |
2,02½107±1,73½107 |
2,50½101±2,50½101 |
8,47½10 - 6±8,47½10 - 6 |
1,55½106±3,00½105 |
2,96½106±1,16½106 |
0,00 |
0,00 |
|
RB6 |
7,82½106±3,20½106 |
2,01½107±1,75½107 |
1,10½103±1,00½102 |
2,40½10 - 4±2,13½10 - 4 |
9,38½106±3,63½106 |
7,74½106±5,26½106 |
0,00 |
0,00 |
П р и м е ч а н и е. D — контрольный донор, КD — киллерный донор, R — реципиент, Т — трансконъюгант, Y — частота конъюгативного переноса.
пленке составила rр = 0,905 (p = 0,05). Во всех вариантах конъюгации с киллерным донором E. coli ZP и штаммами-реципиентами трансконъюганты не были детектированы. То есть клетки реципиентов, получившие сolЕ7 ген посредством конъюгативного переноса, экспрессировали его и были лизированы из-за ДНКазной активности колицина.
Дополнительно через 24 ч в смешанных культурах определяли биомассу биопленки. Для разных штаммов величина OD варьировала от 0,100 до 0,187 ед. и составила в среднем 0,144±0,007 ед. Была выявлена обратная умеренная связь между биомассой биопленки и частотой конъюгации в прикрепленной модели ( rр = - 0,630, р = 0,05).
Необходимо отметить, что число клеток контрольного и киллерно-го доноров в конъюгативной смеси через 24 ч в планктоне составило в среднем 2,22½107±2,03½107 и 1,02½108±7,69½107 КОЕ/мл, в биопленке — 7,38½106±2,33½106 и 9,89½106±1,13½107 КОЕ/мл, что может свидетельствовать о высокой конкурентоспособности доноров в полимикробных сообществах. Это предположение было проверено в опытах при совместном выращивании киллерного донора и штаммов APEC в смешанной культуре.
Кривые роста культур киллерного донора E. coli Z P и трех штаммов APEC — RB2 (не продуцирующий бактериоцины и нечувствительный к СolE7), RB3 (продуцирующий бактериоцины и чувствительный к СolE7) и RB4 (продуцирующий бактериоцины и нечувствительный к СolE7) на богатой (LB) и бедной (M9) средах представлены на рисунке 2.
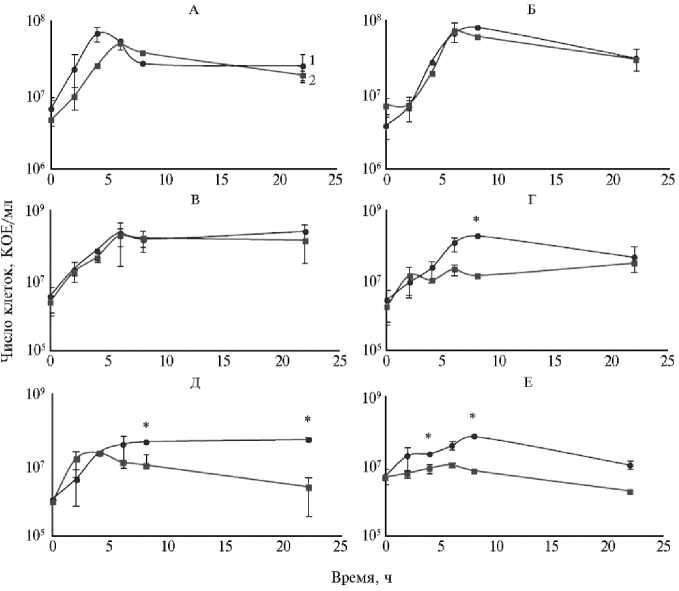
Рис. 2. Рост клеток штаммов APEC (avian pathogenic Escherichia coli ) в смешанных культурах c E. coli ZP на богатой (LB) среде (слева) и минимальной (М9) среде (справа) : 1 — реципиент (АРЕС), 2 — киллерный донор (ZP); А, Б — штамм RB2, В, Г — штамм RB3, Д, Е — штамм RB4. Звездочками ( ∗ ) отмечены статистически значимые различия (р ≤ 0,05) между ростом реципиента и киллерного донора в соответствующие периоды времени.
Конкурентная динамика между E. coli ZP и штаммами APEC в условиях богатой среды (см. рис. 2, А, В, Д) существенно различалась. В отсутствие антагонизма между штаммами (реципиент RB2) сразу же после инокуляции увеличивалась численность клеток обеих культур, а некоторое изменение в соотношении бактерий конкурирующих штаммов было обусловлено, скорее всего, преимуществом в скорости роста природного штамма RB2. Через 5 ч совместного роста число клеток E. coli ZP было стабильным. Отмечалась тенденция к снижению числа бактерий E. соli RB2 за счет их лизиса в результате конъюгативного переноса плазмиды, который был достаточно эффективным (частота 2,46½10-2±3,02½10-2). При совместном росте E. coli ZP и RB4 число клеток E. coli ZP к достижению стационарной фазы, напротив, снижалось. По-видимому, на этом этапе проявлялась антагонистическая активность штамма APEC, обусловленная синтезом бактериоцина, который индуцируется увеличением плотности культуры, начиная с конца логарифмической фазы роста. Учитывая, что бактерии E. coli RB4 нечувствительны к ColE7, а частота конъюгации была невысока, соотношение клеток через 24 ч в этой паре вполне объяснимо. Интересно, что в смешанной культуре E. coli ZP и RB3, в которой RB3 также продуцирует бактериоцины, но чувствителен к СolE7, антагонистической активности между штаммами не наблюдалось.
На среде М9 (см. рис. 2, Б, Г, Е) соотношение между E. coli ZP и RB2 не менялось, в то время как APEC, продуцирующие колицины (RB3 и RB4), подавляли рост киллерного донора в конце логарифмической— начале стационарной фазы. Однако отсутствие достоверных различий между ассоциантами в конце культивирования, по-видимому, может быть связано с неэффективной конъюгацией со стороны E. coli ZP и низкой интенсивностью синтеза колицинов реципиентами (RB3 и RB4) при росте на бедной культуральной среде.
В предварительных исследованиях по конъюгативному переносу плазмиды in vivo в кишечнике крыс и перепелов не были обнаружены бактерии E. coli , устойчивые к ампициллину, хлорамфениколу и гентамицину. На крысиной модели в I группе на 3-и сут после введения штаммов число жизнеспособных клеток контрольного донора и реципиента в среднем составило соответственно 3,50½104±2,15½103 и 3,54½103±1,23½103 КОЕ/г (табл. 3). Трансконъюгантные E. coli с фенотипом AmprCmr были детектированы на 3-и сут после введения реципиента, в среднем их число составило 2,15½102±1,75½102 КОЕ/г, частота конъюгации — 6,07½10 - 2±5,58½10 - 2. В этой группе наблюдался рост числа клеток как донора, так и реципиента в течение всего времени эксперимента. Во II группе число жизнеспособных клеток киллерного донора и реципиента на 3-и сут составляло соответственно 1,50½104±1,25½103 и 2,19½103±1,25½103 КОЕ/г. В последующие сроки количество клеток E. coli Z P увеличивалось до 10 7 КОЕ/г, в то время как число клеток реципиентов после первого введения возросло незначительно. Трансконъюганты в этой группе не обнаружили ни в один из контрольных сроков. В группе животных, которые не получали донорные штаммы, во все сроки бактерии E. coli , устойчивые к ампициллину, хлорамфениколу и гентамицину, не были детектированы.
Учитывая результаты колонизации кишечника крыс донорными штаммами в предварительном эксперименте, в модели с маньчжурскими перепелами введение реципиента и оценку конъюгативного переноса проводили на более ранних сроках. Уже через 2 сут после применения бактериальной суспензии численность клеток донорного и киллерного штаммов E. coli в кишечнике птицы составила соответственно 2,70½106±2,01½105 и 8,12½105±2,22½105 КОЕ/г. Частота конъюгативного переноса в I группе
-
3. Число клеток доноров, реципиентов, трансконъюгантов (КОЕ/г) и частота конъюгации в условиях кишечного тракта крыс линии Wistar и маньчжурских перепелов в экспериментах по конъюгативному переносу плазмиды pOX38 в штаммы APEC (avian pathogenic Escherichia coli ) ( M ±SEM)
|
Срок, сут |
I группа, E. coli N4i (контрольный донор) |
II группа, E. coli Z P (киллерный донор) |
|
D R T Y |
KD R T Y |
Крысы
|
3-и |
3,50½104±2,15½103 |
н.о |
н.о |
н.о |
1,50½104±1,25½103 |
н.о |
н.о |
н.о |
|
6-е |
7,21½105±5,29½104 |
н.о |
н.о |
н.о |
2,34½105±1,74½105 а |
н.о |
н.о |
н.о |
|
10-е |
2,96½106±2,01½106 а |
3,54½103±1,23½103 |
2,15½102±1,75½102 |
6,07½10-2±5,58½10-2 |
5,97½105±2,58½105 а |
2,19½103±1,25½103 |
0,00 |
0,00 |
|
14-е |
1,26½107±8,64½106 а |
5,21½105±2,13½104 |
4,11½104±4,00½103 |
7,87½10-2±8,32½10-3 |
5,64½107±8,96½106 а |
4,22½104±2,36½104 |
0,00 |
0,00 |
|
21-е |
7,25½107±2,35½107 а |
8,69½106±5,55½106 а |
6,15½104±1,02½103 |
7,08½10-3±9,64½10-4 Перепела |
2,23½107±1,00½107 а |
5,91½104±4,98½103 b |
0,00 |
0,00 |
|
1-е |
8,00½103±5,21½103 |
н.о |
н.о |
н.о |
5,04½104±1,22½104 |
н.о |
н.о |
н.о |
|
2-е |
2,70½106±2,01½105 а |
5,00½105±4,55½105 |
5,00½103±1,12½103 |
1,00½10-2±1,12½10-1 |
8,12½105±2,22½105 |
4,68½104±2,25½104 |
0,00 |
0,00 |
|
3-и |
4,45½106±3,05½106 а |
3,05½106±2,41½105 |
1,05½104±1,11½104 |
3,44½10-3±2,46½10-3 |
1,74½106±1,96½106 а |
7,39½105±5,57½105 |
0,00 |
0,00 |
|
6-е |
6,42½107±6,16½107 а |
9,12½106±7,15½106 а |
4,18½105±4,00½105 |
4,58½10-2±2,12½10-1 |
2,57½107±3,01½107 а |
8,29½105±5,55½105 b |
0,00 |
0,00 |
П р и м еч а ни е. D — контрольный донор, КD — киллерный донор, R — реципиент, Т — трансконъюгант, Y — частота конъюгативного переноса, н.о. — не определяли.
а Различия с показателями на начало эксперимента статистически значимы при р ≤ 0,05 (D — по группам относительно соответственно 3-х и 1-х сут, R — относительно 10-х и 2-х сут, KD – относительно 3-х и 1-х сут).
b Различия с показателями в группе с контрольным донором статистически значимы при р ≤ 0,05.
(контрольный донор) оставалась равной 10 - 2-10 - 3 в течение 6 сут наблюдения. Аналогично эксперименту с крысиной моделью, трансконъюганты во II группе (киллерный донор) не были обнаружены ни в один из сроков. В контроле бактерии E. соli , устойчивые к ампициллину, хлорамфениколу и гентамицину, обнаружены не были.
Создание новых методов и средств специфической профилактики и/или терапии бактериальных инфекций сельскохозяйственных животных активно осуществляется в России и за рубежом (31). Поддержание эффективного симбиоза между организмом птицы и кишечной микробиотой — необходимый компонент успешной кормовой стратегии и сохранения поголовья. Разрабатываются высокоэффективные пробиотические препараты, способные контролировать размножение возбудителей эшерихиозов, сальмонеллезов, кампилобактериозов и других инфекций в кишечнике птицы. Представлены доказательства того, что бактериоцины могут заменить антибиотики в сельском хозяйстве.
Поиск микроорганизмов — продуцентов бактериоцинов, которые можно использовать в качестве пробиотиков, ведется исследователями постоянно. M.A.C. Torshizi с соавт. (32) провели скрининг молочнокислых бактерий, выделенных из образцов кишечника цыплят, и обнаружили два изолята ( Lactobacillus fermentum и Lactobacillus rhamnosus ), способных ингибировать рост эшерихий in vitro. S.T. Ogunbanwo с соавт. (33) изучили потенциальную терапевтическую эффективность бактериоциногенного штамма Lactobacillus plantarum при экспериментальной инфекции E. coli у цыплят-бройлеров. Штамм E. coli S5/98, продуцирующий микроцин В 5/98 с широким спектром антагонистической активности против бактерий родов Escherichia , Salmonella , Klebsiella , выделенный из фекалий взрослой свиньи, уже используют для производства пробиотика микроцикола в жидкой и сухой форме (34). Испытание микроцикола при выращивании цыплят-бройлеров показало, что препарат представляет собой эффективное средство регуляции кишечной микрофлоры, повышения неспецифической резистентности, сохранности и продуктивности птицы, а также улучшения качества мяса (35). Колицины, класс бактериоцинов, продуцируемых E. coli и действующих против представителей близкородственных таксонов, были исследованы в качестве возможной альтернативы антибиотикам: колицин Е1 ингибировал рост штаммов энтеропатогенной E. coli (ETEC) (36), а его добавление в рацион животных снижало частоту и тяжесть экспериментальной диареи, вызванной ETEC (37). Эти результаты показывают, что использование бактерий-продуцентов или чистых бактериоцинов при выращивании животных может положительно влиять на безопасность продуктов животноводства и птицеводства — основного источника диареегенных штаммов E. coli , вызывающих эшерихиозы и токсикоинфекции у человека.
Считается, что биопрепараты медицинского и ветеринарного назначения на основе рекомбинантных микроорганизмов с доказанной безопасностью можно направленно и эффективно использовать для лечения и профилактики разнообразных заболеваний (16). На сегодняшний день обосновано применение комбинированных пробиотических препаратов, сочетающих несколько культур с различными свойствами или искусственно сконструированных штаммов с множественной продукцией бактерио-цинов. Основу для разработки новых пробиотических препаратов составляют представители естественной желудочно-кишечной микробиоты, такие как молочнокислые бактерии (Lactobacillus и Bifidobacterium) и эшери- хии, например E. сoli Nissle 1917 (38). Будучи комменсальными микроорганизмами, они обычно оказывают терапевтический эффект сами по себе и выступают отличным материалом для инженерной синтетической биологии (39, 40). На основе штамма E. coli M17 и природного продуцента E. coli S5/98 с использованием векторов pColap и pPAL3 созданы рекомбинантный штамм E. coli M17 (pPAL4), продуцирующий микроцин В и колицин Е1, и штамм E. coli M17 (pPAL5), синтезирующий микроцин, но устойчивый к колицину Е1 (35). Предложен пробиотик ромакол на основе генноинженерного штамма E. coli M17 (p74), образующего микроцин С51 (21).
Штамм E. coli ZP перспективен в качестве основы пробиотического препарата за счет возможности воздействия на устойчивые к антибиотикам и бактериоцинам энтеробактерии, циркулирующие в условиях птицеводческих и животноводческих комплексов. Введение клеток E. coli ZP увеличит общее содержание комменсальных эшерихий в кишечнике животных, подавляя при этом развитие патогенных представителей этого вида без заметного влияния на молочнокислую и бифидофлору. Эффективность штамма определяется альтернативной системой доставки колицина, что обеспечивает его высокую конкурентоспособность в различных экологических нишах, где могут присутствовать, в том числе, и продуценты бактериоцинов.
Таким образом, в смешанных культурах итог взаимодействия между штаммами Escherichia coli ZP и APEC (avian pathogenic E. coli ) обусловлен не только скоростью роста культур и чувствительностью к бактерио-цинам, но и конъюгативным переносом плазмид. Совокупность этих факторов будет определять конкурентную динамику нового пробиотического штамма E. coli ZP и гетерогенных APEC в условиях желудочно-кишечного тракта птицы. Эксперимент in vivo показал, что штамм E. coli ZP способен эффективно заселять кишечник крыс и маньчжурских перепелов и сохраняться на протяжении длительного времени. Конъюгативный перенос плазмиды от контрольного донора в условиях кишечного тракта происходил с достаточно высокой частотой, в то время как в группе с киллер-ным донором трансконъюганты отсутствовали. Сниженное число клеток реципиентов во второй группе также доказывает эффективность действия изучаемого штамма на патогенные формы E. coli. Использование конъю-гативного механизма при создании нового пробиотического средства в птицеводстве соответствует мировым тенденциям. В полной мере раскрыть биотехнологический потенциал генно-модифицированного штамма E. coli ZP, в том числе его действие на зоотехнические показатели птицы, помогут дополнительные исследования. В частности, представляется важным изучение его эффективности при лечении и профилактике эше-рихиозов у животных и оценка терапевтического и противоэпидемического потенциала.
Список литературы Биопрепарат на основе штамма Escherichia coli ZP. Сообщение I. Оценка эффективности колицина при конъюгативной доставке colE7 в клетки APEC in vitro и in vivo
- Фисинин В.И. Стратегические тренды развития мирового и отечественного птицеводства: состояние, вызовы, перспективы. В сб.: Мат. XIX Межд. конф. "Мировые и российские тренды развития птицеводства: реалии и вызовы будущего". Сергиев Посад, 2018: 9-48.
- Нефедова В.Н., Майорова С.В. Российский рынок мяса птицы в 2001-2017. Экономика и Бизнес: теория и практика, 2017, 8: 60-64.
- Мезенцев С.В., Телегин Н.Г. Профилактика инфекционных болезней птиц. БИО, 2004, 10: 5-8.
- Miles T.D., McLaughlin W., Brown P.D. Antimicrobial resistance of Escherichia coli isolates from broiler chickens and humans. BMC Veterinary Research, 2006, 2(7): 1-9 ( ). DOI: 10.1186/1746-6148-2-7
- Koga V.L., Rodrigues G.R., Scandorieiro S., Vespero E.C., Oba A., de Brito B.G., de Brito K.C.T., Nakazato G., Kobayashi R.K.T. Evaluation of the antibiotic resistance and virulence of Escherichia coli strains isolated from chicken carcasses in 2007 and 2013 from Parana, Brazil. Foodborne Pathogens and Disease, 2015, 12(6): 479-485 ( ). DOI: 10.1089/fpd.2014.1888
- Mora A., Viso S., López C., Alonso M.P., García-Garrote F., Dabhi G., Mamani R., Herrera A., Marzoa J., Blanco M., Blanco J.E., Moulin-Schouleur M., Schouler C., Blanco J. Poultry as reservoir for extraintestinal pathogenic Escherichia coli O45:K1:H7-B2-ST95 in humans. Veterinary Microbiology, 2013, 167(3-4): 506-612 ( ).
- DOI: 10.1016/j.vetmic.2013.08.007
- Antimicrobial resistance: Global report on surveillance. WHO Library Cataloguing-in-Publication Data, 2014.
- Проект Распоряжения Правительства Российской Федерации "Об утверждении Стратегии предупреждения и преодоления устойчивости микроорганизмов и вредных организмов растений к лекарственным препаратам, химическим и биологическим средствам на период до 2030 года и дальнейшую перспективу" (подготовлен Минздравом России 08.06.2017).
- Jadhav K., Sharma K.S., Katoch S., Sharma V.K., Mane B.G. Probiotics in broiler poultry feeds: a review. International Journal of Animal and Veterinary Science, 2015, 2: 4-16.
- Bidarkar V.K., Swain P.S., Ray S., Dominic G. Probiotics: potential alternative to antibiotics in ruminant feeding. Trends in Veterinary and Animal Sciences, 2014, 1: 1-4.
- Parker R.B. Probiotics the other half of the antibiotics story. Animal Nutrition and Health, 1974, 29: 4-8.
- Kavitha R.B., Desai J., Deepika Reddy A.R., Radhakrishna P.M. Effect of probiotics supplementation on the performance of broilers. Indian Journal of Animal Nutrition, 2007, 24(3): 142-146.
- Рождественская Т.Н., Яковлев С.С., Кононенко Е.В. Профилактика сальмонеллеза птиц. Животноводство, 2012, 1(1): 54-56.
- Сушкова В.И., Устюжанинова Л.В. Перспективы развития производства кормовых пробиотиков. Кормопроизводство, 2017, 3: 34-40.
- Higgins J.P., Higgins S.E., Vicente J.L., Wolfenden A.D., Tellez G., Hargis B.M. Temporal effects of lactic acid bacteria probiotic culture on Salmonella in neonatal broilers. Poultry Science, 2007, 86(8): 1662-1666 ( ).
- DOI: 10.1093/ps/86.8.1662
- Старовойтова С.А., Скроцкая О.И. Пробиотики на основе трансгенных микроорганизмов. Biotechnologia Acta, 2013, 6(1): 34-45.
- Лебедева И.А., Проккоева Ж.А., Щепеткина С.В. Эффективность применения в птицеводстве биокомплексов на основе пробиотических штаммов. Мат. Межд. науч.-практ. конф. "Биотехнология и общество в XXI веке". Барнаул, 2015: 370-374.
- Crittenden R., Bird A.R., Gopal P., Henriksson A., Lee Y.K., Playne M.J. Probiotic research in Australia, New Zealand and the Asia-Pacific region. Current Pharmaceutical Design, 2005, 11(1): 37-53 ( ).
- DOI: 10.2174/1381612053382304
- Ушакова Н.А., Некрасов Р.В., Правдин В.Г., Кравцова Л.З., Бобровская О.И., Павлов Д.С. Новое поколение пробиотических препаратов кормового назначения. Фундаментальные исследования, 2012, 1: 184-192.
- Лившиц В.А., Чеснокова В.Л., Алешин В.В., Сокуренко Е.В., Далин М.В., Кравцов Э.Г., Быков В.А. Штамм бактерий Еscherichia coli m17 fimh::kan/p colap, используемый для получения пробиотического препарата. (РФ) МПК7 C 12 N 1/21, A 61 K 35/74. № 2144954. Заявл. 15.01.98. Опубл. 27.01.2000.
- Соколова Н.А., Хмель И.А., Шегидевич Э.А. Использование ромакола в ветеринарии. Ветеринария, 2001, 11: 46-49.
- Budič M., Rijavec M., Petkovšek Ž., Žgur-Bertok D. Escherichia coli bacteriocins: antimicrobial efficacy and prevalence among isolates from patients with bacteraemia. PLoS ONE, 2011, 6(12): e28769 ( ).
- DOI: 10.1371/journal.pone.0028769
- Filutowicz M., Burgess R., Gamelli R.L., Heinemann J.A., Kurenbach B., Rakowski S.A., Shankar R. Bacterial conjugation-based antimicrobial agents. Plasmid, 2008, 60(1): 38-44 ( ).
- DOI: 10.1016/j.plasmid.2008.03.004
- Maslennikova I.L., Kuznetsova M.V., Toplak N., Nekrasova I.V., Žgur-Bertok D., Starčič Erjavec M. Estimation of the bacteriocin ColE7 conjugation-based "kill"-"anti-kill" antimicrobial system by real-time PCR, fluorescence staining and bioluminescence assays. Letters in Applied Microbiology, 2018, 67(1): 47-53 ( ).
- DOI: 10.1111/lam.12884
- Starčič Erjavec M., Petkovšek Z., Kuznetsova M.V., Maslennikova I.L., Žgur-Bertok D. Strain ŽP - the first bacterial conjugation-based "kill"-"anti-kill" antimicrobial system. Plasmid, 2015, 82: 28-34 ( ).
- DOI: 10.1016/j.plasmid.2015.10.001
- Versalovic J., Koeuth T., Lupski J.R. Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes. Nucleic Acids Research, 1991, 19(24): 6823-6831 ( ).
- DOI: 10.1093/nar/19.24.6823
- Clermont O., Christenson J.K., Denamur E., Gordon D.M. The Clermont Escherichia coli phylo-typing method revisited: improvement of specificity and detection of new phylo-groups. Environmental Microbiology Reports, 2013, 5(1): 58-61 ( ).
- DOI: 10.1111/1758-2229.12019
- Guglielmetti E., Korhonen J.M., Heikkinen J., Morelli L., von Wright A. Transfer of plasmid-mediated resistance to tetracycline in pathogenic bacteria from fish and aquaculture environments. FEMS Microbiology Letters, 2009, 293(1): 28-34 ( ).
- DOI: 10.1111/j.1574-6968.2009.01512.x
- Merritt J.H., Kadouri D.E., O'Toole G.A. Growing and analyzing static biofilm. Current Protocols in Microbiology, 2005, 00(1): 1B.1.1-1B.1.18 ( ).
- DOI: 10.1002/9780471729259.mc01b01s00
- ГОСТ 34088-2017. Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за сельскохозяйственными животными. М., 2018.
- Gillor O., Kirkup B.C., Riley M.A. Colicins and microcins: the next generation of antimicrobials. Advances in Applied Microbiology, 2004, 54: 129-146 (
- DOI: 10.1016/S0065-2164(04)54005-4)
- Karimi Torshizi M.A., Rahimi S.H., Mojgani N., Esmaeilkhanian S., Grimes J.L. Screening of indigenous strains of lactic acid bacteria for development of a probiotic for poultry. Asian-Australasian Journal of Animal Science, 2008, 21(10): 1495-1500 ( ).
- DOI: 10.5713/ajas.2008.80081
- Ogunbanwo S.T., Sanni A.I., Onilude A.A. Influence of bacteriocin in the control of Escherichia coli infection of broiler chickens in Nigeria. World Journal of Microbiology and Biotechnology, 2004, 20(1): 51-56 (doi: 10.1023/B:WIBI.0000013311.43842.74).
- Тараканов Б.В. Штамм бактерий Escherichia coli, используемый для производства пробиотика микроцикола В5/98. (РФ) МПК C 12 N 1/20, A 61 K 35/74, C 12 R 1/19. № 2268297. Заявл. 29.12.03. Опубл. 20.01.06. Бюлл. № 02.
- Тараканов Б.В., Алёшин В.В., Николичева Т.А., Полякова Л.Л., Яковлева А.А., Никулин В.Н., Палагина Т.Е. Клонирование генов синтеза микроцина типа В и исследование сукцессии микробиоциноза кишечного тракта животных при введении природных и рекомбинантных продуцентов микроцинов и бактериоцинов. Проблемы биологии продуктивных животных, 2008, 1: 20-36.
- Stahl C.H., Callaway T.R., Lincoln L.M., Lonergan S.M., Genovese K.J. Inhibitory activities of colicins against Escherichia coli strains responsible for postweaning diarrhea and edema disease in swine. Antimicrobial Agents and Chemotherapy, 2004, 48(8): 3119-3121 ( ).
- DOI: 10.1128/AAC.48.8.3119-3121.2004
- Cutler S.A., Lonergan S.M., Cornick N., Johnson A.K., Stahl C.H. Dietary inclusion of colicin E1 is effective in preventing postweaning diarrhea caused by F18-positive Escherichia coli in pigs. Antimicrobial Agents and Chemotherapy, 2007, 51(11): 3830-3835 ( ).
- DOI: 10.1128/AAC.00360-07
- Sonnenborn U. Escherichia coli strain Nissle 1917 - from bench to bedside and back: history of a special Escherichia coli strain with probiotic properties. FEMS Microbiology Letters, 2016, 363(19): fnw212 ( ).
- DOI: 10.1093/femsle/fnw212
- Chua K.J., Kwok W.C., Aggarwal N., Sun T., Chang M.W. Designer probiotics for the prevention and treatment of human diseases. Current Opinion in Chemical Biology, 2017, 40: 8-16 ( ).
- DOI: 10.1016/j.cbpa.2017.04.011
- Álvarez B., Fernández L.A. Sustainable therapies by engineered bacteria. Microbiology and Biotechnology, 2017, 10(5): 1057-1061 ( ).
- DOI: 10.1111/1751-7915.12778


