Биопрепараты пчелиного яда и хитозана, структурированные на наночастицах золота - полифункциональные стимуляторы резистентности
Автор: Корягин А.С., Мочалова А.Е., Смирнова Л.А., Таламанова М.Н., Маленев А.Л., Александрова Е.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Средства коррекции экологического неблагополучия
Статья в выпуске: 1-6 т.11, 2009 года.
Бесплатный доступ
Пероральное введение пчелиного яда и хитозана экспериментальным животным в составе биопрепарата (наночастицы золота - пчелиный яд - хитозан) вызывает возникновение адаптационной реакции устойчивой активации, снижение процессов свободнорадикального окисления в условиях нормы и повышение резистентности к гипоксии и гамма-облучению через неделю после окончания введения препаратов, о чем свидетельствуют индикаторные показатели системы крови.
Наноструктурированный биопрепарат, наночастицы золота, пчелиный яд, хитозан, пероральное применение, гипоксия, радиация, адаптация
Короткий адрес: https://sciup.org/148198493
IDR: 148198493 | УДК: 599:
Текст научной статьи Биопрепараты пчелиного яда и хитозана, структурированные на наночастицах золота - полифункциональные стимуляторы резистентности
Александрова Екатерина Александровна, кандидат медицинских наук, ассистент кафедры скорой и неотложной медицинской помощи биосовместимость, биодеструкция, физиологическая активность при отсутствии токсичности, доступность сырьевых источников [8, 11]. Хитозан способен выполнять функции иммуномодулятора, носителя лекарственных средств, проникать в межклеточное вещество. Ранее на экспериментальных животных нами выявлены ярко выраженные антиоксидантные свойства и терапевтическое действие хитозана при повреждающем действии Y-облучения дозой 5 Гр (снижение активности свободнорадикального окисления, а также ускорение процессов восстановления в пораженном костном мозге) [3]. С другой стороны показано, что зоотоксины пчелы при внутрибрюшинном введении повышают резистентность организма к условиям гипоксии, ионизирующего облучения, обусловленную развитием неспецифической адаптационной реакции устойчивой активации [4]. Необходимо отметить, что из-за высокой антигенной и аллергенной активности яда его парентеральное применение ограничено в практической медицине, а введение зоотоксина per’os не оказывает желаемого эффекта как из-за белковой природы его компонентов так и, по-видимому, возможного их повреждающего действия на слизистую желудочно-кишечного тракта [12]. Проблема защиты зоотоксина от разрушающего действия протеаз, экранирование его токсического действия на слизистую кишечника и транспорта в кровь может быть решена получением комбинированных препаратов на основе пчелиного яда и хитозана.
Направленная доставка комбинированных биополимеров в кровь через барьер слизистой кишечника обеспечивается хитозаном в нанораз-мерной форме. Это может быть достигнуто нанесением биополимеров на наноматрицы, среди которых, на наш взгляд, наиболее предпочтительны наночастицы золота. Золото является индифферентным, нетоксичным металлом, не оказывает повреждающего действия на структуру компонентов клеток. Наночастицы золота, стабилизированные хитозаном, при размере менее 10 нм способны проникать в кровь при пероральном применении и оказывать сами по себе антиоксидантное действие [10]. Можно ожидать кооперативность действия компонентов наносистемы наночастицы золота — пчелиный яд — хитозан и их взаимного усиления.
Цель настоящей работы — исследовать адап-тогенные эффекты наноструктурированных биоматериалов пчелиного яда и хитозана нанесенных на наночастицы золота при профилактическом пероральном введении экспериментальным животным в условиях относительной нормы, гипоксии и действия ионизирующей радиации.
Материалы и методы исследований. В работе использовали хитозан со среднечисловой молекулярной массой 1.3х105 и степенью деацетилирования 80%, пчелиный яд DL50=8-10 мг/кг. Наночастицы золота получали в растворе хитозана при УФ-индуцированном восстановлении золотохлористоводородной кислоты. Средний размер наночастиц золота в биопрепарате составлял менее 10 нм [9]. Эксперименты проводили на белых нелинейных крысах самцах массой 200-250 г. В качестве индикаторных показателей характеризующих функциональное состояние организма (стресс, активация, тренировка) были выбраны параметры системы крови — лейкоцитарная формула и лейкоцитарный коэффициент (отношение процента лимфоцитов к относительному содержанию сегментоядерных нейтрофилов), значение которого снижается при стрессе и увеличивается при устойчивой активации [1]. В плазме крови также определяли показатели активности свободнорадикальных процессов.
В первой серии экспериментов изучали тип неспецифического адаптационного состояния экспериментальных животных при курсовом введении биопрепаратов в виде водного раствора с pH=4,8 в условиях относительной нормы. Для этого животным в течение 7 дней с периодичностью 1 раз в сутки перорально (через рот с помощью зонда) вводили биопрепарат объемом 1 мл, что соответствовало дозам наночастицы золота — 0,5 мг/кг, пчелиный яд — 0,5 мг/кг, хитозан — 100 мг/кг. Контрольным животным вводили раствор хитозана нанесенного на наночастицы золота в тех же дозах и объеме. На 1 и 7 сутки после окончания курса введения производили забор крови из подъязычной вены и определяли основные показатели активности свободнорадикального окисления и периферической крови (количество лейкоцитов, лейкоцитарную формулу, значение лейкоцитарного коэффициента и концентрацию гемоглобина). Определение лейкоцитарной формулы проводили общепринятым методом с окраской мазков по Романовскому-Гимзе [7], при этом были учтены рекомендации Л.Х. Гаркави с соавторами [1] по подсчету лейкоцитарной формулы при использовании ее в качестве сигнального показателя системных неспецифических реакций. На основании лейкоцитарной формулы вычисляли лейкоцитарный коэффициент.
Интенсивность процессов свободнорадикального окисления и активность антиоксидантной системы в плазме крови оценивали, используя метод Fe2+ индуцированной биохемилюминесценции (БХЛ): 1тах-максимальная интенсивность свечения исследуемой пробы, отражающая свободнорадикальную активность образца и S — све-тосумма хемилюминисценции за определенное время, обратно пропорциональна антиоксидантной активности пробы [6]. Концентрацию гемоглобина определяли гемиглобинцианидным методом [7].
Во второй серии экспериментов животных подвергали действию гипобарической гипоксии через неделю после окончания введения биопрепаратов. Данное состояние у лабораторных животных вызывали, помещая их в барокамеру, моделируя в ней подъем на высоту 8000 м над уровнем моря на 30 минут. На следующие сутки после моделирования состояния гипоксии определяли содержание лейкоцитов, лейкоцитарную формулу, лейкоцитарный коэффициент, концентрацию гемоглобина, а также активность индикаторного ключевого фермента энергетического обмена — лактатдегидрогеназы [5].
При изучении радиопротекторных свойств препаратов животных подвергали однократному общему у-облучению (60Co) на терапевтической установке «АГАТ-С» в дозе 5 Гр (мощность дозы 1 Гр/мин), вызывающей развитие костномозговой формы лучевой болезни средней степени тяжести, при которой явно проявляются все признаки лучевого поражения. Облучение проводили через неделю после окончания курсового введения препаратов. Животные группы «контроль на облучение» биопрепараты не получали и подвергались только облучению. Через 3 и 14 сутки после облучения в крови животных определяли содержание лейкоцитов, лейкоцитарную формулу, лейкоцитарный коэффициент и концентрацию гемоглобина.
Результаты исследований статистически обрабатывали с помощью программы BIOSTAT и Statistica 6.0. Независимые выборки сравнивали с помощью однофакторного дисперсионного анализа, t-критерия Стьюдента и непараметрических критериев Крускала-Уоллиса и Ньюмена-Кейлса. При расчете t-критерия Стьюдента применяли поправку Бонферрони, позволяющую устранить ошибку первого рода, возникающую при сравнении более чем двух выборок данного метода [2].
Результаты и обсуждение. В первой серии экспериментов определяли тип адаптационной реакции экспериментальных животных в условиях относительной нормы при курсовом введении биопрепарата содержащего пчелиный яд в дозе 0,5 мг/кг. Анализ параметров крови (общее количество лейкоцитов, лейкоцитарная формула) и интенсивность свободнорадикального окисления выявил, что через сутки после окончания перорального введения биопрепаратов формирование адаптационной реакции развивается не полностью, так как заметного изменения процесса активности свободнорадикального окисления не происходило. Поэтому для выявления сроков полного формирования адаптационной реакции увеличили временной интервал и проводили исследование тех же показателей через неделю после окончания введения биопрепарата, содержащего пчелиный яд.
Изучение показателей белой крови через 7 дней после окончания введения препарата показало, что содержание лейкоцитов в данном эксперименте в исследуемых группах сохранялось на одном уровне с интактными животными (табл. 1). В контрольной группе наблюдалось статистически значимое увеличение количества сегментоядерных нейтрофилов на 21% относительно интактных крыс. Лейкоцитарный коэффициент в контрольной группе относительно интактных животных не изменялся. Вероятно, у крыс контрольной группы формируется неспецифическая реакция тренировки. Количество лимфоцитов в опытной группе статистически значимо увеличивалось на 11%, а относительное содержание сегментоядерных нейтрофилов уменьшалось на 26% относительно интактных животных (р< 0,05). Лейкоцитарный коэффициент статистически значимо повышался на 49% относительно исходного показателя (р<0,05).
Таблица 1. Влияние курсового перорального введения биопрепарата пчелиного яда и хитозана на некоторые показатели периферической крови экспериментальных животных в условиях относительной нормы
|
Показатель |
Сутки |
Группы животных |
||
|
Интактные |
Контроль (хитозан + золото) |
Яд пчелы 0,5 мг/кг + золото + хитозан (биопрепарат) |
||
|
лейкоциты, 109/л |
1 |
15,6±1,47 |
12,8±0,38 |
12,9±0,36 |
|
7 |
14,7±1,17 |
15,4±0,38 |
10,54±0,15 * # |
|
|
сегментоядерные нейтрофилы, % |
1 |
14,7±0,8 |
14,0±0,74 |
10,68±0,83 * # |
|
7 |
13,4±1,6 |
14,0+0,9 |
10,7±1,07 |
|
|
лимфоциты, % |
1 |
64,4±2,7 |
73,98±1,89 |
79,4±0,74 * |
|
7 |
74,66±0,3 |
74,09±1,65 |
82,6±0,74 |
|
|
лейкоцитарный коэффициент, |
1 |
4,9±0,8 |
5,6±0,5 |
7,7±0,7 * |
|
7 |
4,02±0,17 |
3,4±0,32 |
6,1±0,2 |
|
Примечание: * — р < 0,05 по отношению к интактным животным; # — р < 0,05 по отношению к контрольным животным.
Через 7 суток после окончания введения препаратов в контрольной группе не наблюдалось статистически значимых изменений свободнорадикального окисления относительно интактных. Однако в опытной группе отмечалось статистически значимое снижение активности свободнорадикального окисления. Показатель свето-суммы S БХЛ снижался в опытной группе относительно интактных на 14% (рис. 1). Таким образом, через неделю после перорального введения биопрепаратов организм животных находился в состоянии наибольшей степени адаптированно-сти, обусловленной развитием неспецифической адаптационной реакции устойчивой активации. К этому периоду времени наблюдается снижение интенсивности свободнорадикальных процессов как следствие увеличение мощности антиоксидантной системы. В связи с этим моделирование гипобарической гипоксии и Y-облучения осуществляли на 7 сутки после окончания введения биопрепаратов.
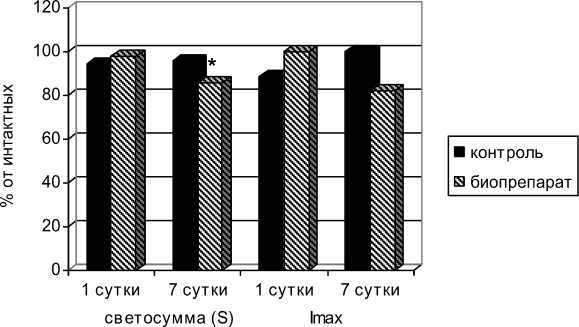
Рис. 1. Показатели свободнорадикального окисления после курсового перорального введения биопрепаратов пчелиного яда и хитозана в условиях относительной нормы
Примечание: *- р < 0,05 по отношению к интактным животным
Во второй серии опытов исследовались адаптационные эффекты пчелиного яда в составе биопрепаратов в условиях гипоксии. Во всех группах животных в крови одинаково повышалось количество лейкоцитов по сравнению с интактными животными (табл. 2), что свидетельствует о реакции организма на гипоксическое воздействие. Лейкоцитарная формула выявила лимфопению и сегментоядерный нейтрофилез, а также снижение значения лейкоцитарного коэффициента (р<0,05) в обеих контрольных группах на гипоксию относительно интактных, что свидетельствует о стресс-реакции. В опытной группе количество лимфоцитов, сегментоядерных нейтрофилов, лейкоцитарный коэффициент оставались на уровне интактных животных. Это указывает на отсутствие стресс-реакции в опытной группе животных и о формировании резистентности к гипоксии. Обращает внимание статистически значимое повышение гемоглобина в контрольных группах по сравнению с интактными животными, в то время как в опытной группе содержание гемоглобина было ниже (p<0,05). Это дополнительно подтверждает резистентность к гипоксии животных, получавших пчелиный яд.
Таблица 2. Влияние курсового перорального введения биопрепарата на некоторые показатели периферической крови экспериментальных животных в условиях гипобарической гипоксии
|
Показатель |
Группы животных |
|||
|
Интактные |
Контроль (гипоксия) |
Контроль (хитозан + золото) |
Яд пчелы 0,5 мг/кг + золото + хитозан (биопрепарат) |
|
|
гемоглобин, г/л |
96,08±4,88 |
152,33±6,7 * |
139,22±5,14 |
115,67±4,8 # |
|
лейкоциты, 109/л |
16,65±1,14 |
27,6±2,41 |
28,44±3,95 |
28,44±1,71 * |
|
сегментоядерные нейтрофилы, % |
12,75±0,92 |
22,5±2,07 * |
16,17±1,17 |
12,5±1,17 # + |
|
лимфоциты, % |
73,5±2,13 |
57,5±4,15 |
64,7±2,97 |
69,3±3,11 # |
|
лейкоцитарный коэффициент, у.е. |
6,01±0,68 |
2,56±0,21 * |
4,0±0,24 * |
5,8±0,69 # + |
Примечание: * - р < 0,05 по отношению к интактным животным; # - р < 0,05 по отношению к группе «гипоксия»; + - р < 0,05 по отношению к контрольным животным
Существенному изменению при гипоксии подвергается активность лактатдегидрогеназы (ЛДГ) в плазме крови. Активность ЛДГ в контрольной группе «гипоксия» увеличивалась на 48% (р < 0,05) (рис. 2). Нарушение метаболизма углеводов, а именно резкое его усиление по пути анаэробного гликолиза, помимо снижения количества синтезируемой АТФ, приводит к накоплению молочной кислоты. Снижение активности фермента ЛДГ при гипобарической гипоксии в контрольной «хитозан+золото» и опытной
«хитозан+золото+пчелиный яд» группах свидетельствует о переключении метаболизма по пути аэробного окисления пирувата в условиях дефицита кислорода и подтверждают ранее выявленные адаптогенные эффекты хитозана [3]. Исследования этой серии показывают, что пероральное введение наноструктурированных биопрепаратов пчелиного яда и хитозана оказывают адаптоген-ный эффект, вызывая развитие резистентности организма животных к гипобарической гипоксии.
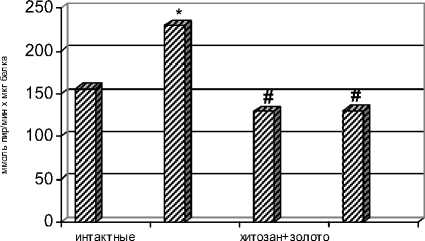
Рис. 2. Активность лактатдегидрогеназы (ммоль пирувата/мин Ч мкг белка) в плазме крыс через неделю после курсового перорального введения биопрепаратов в условиях гипобарической гипоксии
Примечание: *- р < 0,05 по отношению к интактным животным; # - р < 0,05 по отношению к контрольным животным
В третьей серии экспериментов изучались радиозащитные свойства биопрепаратов. В системе белой крови на 3 сутки после облучения в группах «контроль на облучение» и «хито-зан+золото» наблюдалось снижение в 4 раза количества лейкоцитов по отношению к интактным животным, что свидетельствует о повреждающем действии Y-облучения (табл. 3). При этом необходимо отметить, что содержание количества лейкоцитов в группе «хитозан+золото+пчелиный яд», было статистически значимо выше (р<0,05)
показателей животных группы «контроль на облучение» и приближалось к показателям интактных. В течение следующих 2 недель количество лейкоцитов в группе «хитозан+золото+пчелиный яд» достигло уровня интактных животных. У животных контрольных групп через 14 суток после облучения — период максимального проявления повреждающего действия радиации — сохранялась выраженная лейкопения, в 1,8 раза уменьшалось содержание гемоглобина.
Таблица 3. Влияние курсового перорального введения биопрепарата на некоторые показатели периферической крови экспериментальных животных в условиях Y-облучения в дозе 5 Гр
|
Показатель |
Сутки |
Группы животных |
|||
|
Интактные |
Контроль (облучение) |
Контроль (хитозан + золото) |
Яд пчелы 0,5 мг/кг + золото + хитозан (биопрепарат) |
||
|
гемоглобин, г/л |
3 |
164,2±6,8 |
147,8±6,3 |
136,2±4,88 |
114,3±3,1 |
|
14 |
135,3±5,68 |
93,2±6,67 * |
93,75±9,06 * |
114,7±7,63 |
|
|
лейкоциты, 109/л |
3 |
15,36±1,48 |
3,1±0,3 |
4,96±0,37 |
10,5±2,2 # |
|
14 |
14,5±1,2 |
4,85±1,07 * |
5,75±1,1 * |
13,03±1,1 |
|
|
сегментоядерные нейтрофилы, % |
3 |
19,7±1,74 |
56,25±1,78 * |
55,2±1,59 * |
51,0±3,0 * |
|
14 |
26,97±1,44 |
23,4±2,38 |
17,83±2,34 |
21,83±1,85 |
|
|
лимфоциты, % |
3 |
65,5±5,3 |
28,88±1,45 * |
11,8±0,66 * |
22,4±2,34 * |
|
14 |
64,4±2,3 |
66,7±3,65 |
68,83±4,84 |
63,5±3,14 |
|
Примечание: * — р < 0,05 по отношению к интактным животным; # — р < 0,05 по отношению к группе «контроль на облучение»
На 28 сутки после облучения у животных опытной группы «хитозан+пчелиный яд+золото» содержание лейкоцитов, гемоглобина практически не отличалось от значений у интактных животных, что указывало на окончание восстановительных процессов. У животных контрольных групп количество лейкоцитов превышало норму в 2 раза (до 25,45 Ч 109 кл/л), что свидетельствовало о протекании воспалительных процессов в организме животных. Таким образом, результаты этой серии экспериментов свидетельствуют, что курсовое пероральное введение животным наноструктурированных биопрепаратов (пчелиный яд+хитозан+наночастицы золота) сопровождается возникновением радиорезистентности, что с большой долей вероятности связано с развитием у них антистрессорной реакции устойчивой активации. При данном состоянии происходит истинное повышение активной резистентности организма не за счет развития торможения и снижения чувствительности (как при стрессе), а за счет истинного подъема активности защитных подсистем организма [1].
Выводы: полученные результаты показывают, что пчелиный яд в составе комплексного биопрепарата (пчелиный яд+хитозан+наночастицы золота) устойчив к действию протеаз при пероральном введении. Препарат способен проникать через слизистую кишечника и оказывать синергетический энергосберегающий и адапто-генный эффект в условиях действия экологически неблагоприятных факторов: гипоксии и у-излучения (перекрестная резистентность).
Работа выполнена при поддержке гранта Российского фонда фундаментальный исследований № 08-02-97031-р_поволжье_а.
Список литературы Биопрепараты пчелиного яда и хитозана, структурированные на наночастицах золота - полифункциональные стимуляторы резистентности
- Гаркави, Л.Х. Антистрессорные реакции и активационная терапия. Реакция активации как путь к здоровью через процессы самоорганизации/Л.Х. Гаркави, Е.Б. Квакина, Т.С. Кузьменко. -М.: «ИМЕДИС», 1998. -656 с.
- Гланц, С. Медико-биологическая статистика. -М.: Практика, 1999. -459 с.
- Корягин, А.С. Анализ антиоксидантных свойств хитозана и его олигомеров/А.С. Корягин, Е.А. Ерофеева, Н.О. Якимович и др.//Бюл. эксперимент. биологии и медицины. -2006. -Т. 142, № 10. -С. 444-446.
- Корягин, А.С. Адаптогенные свойства пчелиного яда при действии экстремальных факторов различной природы/А.С. Корягин, Е.А. Ерофеева, О.И. Александрова//Вестн. Нижегород. ун-та. -2007. -№ 3. -С. 113-115.
- Кочетов, Г.А. Практическое руководство по энзимологии. -М.: Высш. шк., 1971. -С. 114-115.
- Кузьмина, Е.И. Применение индуцированной ХЛ для оценки свободнорадикальных реакций в биологических субстратах/Е.И. Кузьмина, А.С. Нелюбин, М.К. Щенникова//Биохимия и биофизика микроорганизмов: Межвуз. сб. -Горький, 1983. -С. 179-183.
- Лифшиц, В.М. Медицинские лабораторные анализы. Справочник/В.М. Лифшиц, В.И. Сидельникова. -М.: Триада-Х, 2007. -304 с.
- Скрябин, К.Г. Хитин и хитозан. Получение, свойства и применение/Под ред. К.Г. Скрябина/К.Г. Скрябин, Г.А. Вихорева, В.П. Варламов. -М: Наука, 2002. -С. 7-12.
- Смирнова, Л.А. УФиндуцированное формирование наноразмерных частиц золота в полиметилме-такрилатной матрице/Л.А. Смирнова, А.П. Александров, Н.О. Якимович и др./Докл. РАН. -2005. -Т. 400, № 6. -С. 779-781.
- Якимович, Н.О. Антиоксидантные свойства наночастиц золота в условиях нормы и действия ионизирующей радиации/Н.О. Якимович, Е.А. Ерофеева, Е.А. Александрова и др.//Вестн. Нижегород. ун-та им. Серия химия. -2006. -Вып. 1 (5). -С. 60-68.
- Ravi Kumar, M.N.V. Chitosan Chemistry and Phar-maceutical Perspectives/M.N.V. Ravi Kumar, R.A.A. Muzzarelli, C. Muzzarelli et al.//Chem. Rev. -2004. -V. 104. -P. 6017-6084.
- Matzke, A. Bienenprodukte und Apitherapie/A. Matzke, S. Bogdanov//Der schweizerische Bienen-vater. Winikon: Fachschriftenverlag VDRB, 2001. -104 p.


