Биопротезы в сердечно-сосудистой хирургии. 20-летний опыт Кемеровского кардиологического центра
Автор: Барбараш Л.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Новые технологии в кардиохирургии
Статья в выпуске: 1 т.3, 1999 года.
Бесплатный доступ
Статья посвящена актуальной теме биотехнологических коррекций патологии клапанов сердца и заболеваний сосудов, отражает современные проблемы этого направления. Проведен анализ одного из самых богатых материалов мировой кардиохирургии по 20-летнему опыту изготовления и использования 356 биопротезов клапанов сердца и 213 биопротезов сосудов в Кемеровском кардиологическом центре СО РАМН. Изучение результатов имплантации биопротезов, консервированных по различным технологиям, позволило сделать вывод о значительном преимуществе авторской оригинальной разработки, при которой стабилизация производится эпоксисоединениями. Такая методика, наряду с улучшением прочностных характеристик биопротезов, позволила значительно снизить частоту неудовлетворительных отдаленных результатов, обусловленных кальцификацией и тромбозом. Разработанная методика обработки биопротезов позволяет расширить возрастные границы биопротезирования клапанов сердца, в том числе у детей.
Короткий адрес: https://sciup.org/142233304
IDR: 142233304
Текст научной статьи Биопротезы в сердечно-сосудистой хирургии. 20-летний опыт Кемеровского кардиологического центра
За прошедшие 20 лет в Кемеровском кардиологическом центре было имплантировано 356 биопротезов клапанов сердца и 213 биопротезов артерий. Максимальные сроки наблюдения составляют 17-20 лет, средние — 9-10 лет.
Однако рассматривать всю группу в целом было бы неправильно, так как многолетний опыт доказывает, что течение послеоперационного периода в значительной мере зависит и от тактики ведения больного, и от модели биопротеза.
Наши взгляды на роль и место биопротезов в сердечно-сосудистой хирургии существенно трансформировались по мере накопления опыта. Исторически мы прошли три этапа. •
На первом этапе — с 1978 по 1983 гг. — использовали так называемые «нестандартизованные» биопротезы клапанов сердца. Для производства их применяли преимущественно жесткие опорные каркасы и методику моделирования типа Ionescu. Консервацию биологического материала осуществляли в растворах глутаральдегида различных концентраций — от 0,25 до 1% [2, 3].
Течение послеоперационного периода в сроки до 19 лет прослежено у 52 больных с такими биопротезами в митральной позиции. Средние сроки наблюдения составляют 15 лет. Средний возраст пациентов этой группы — 32,3+1,2 года. Значительная доля больных до операции относилась к IV ФК по NYHA, средний функциональный класс — 3,65.
Выживаемость больных этой группы к 15 годам составила 65%, но лишь у 20% из них не было к этому сроку специфических осложнений.
В структуре осложнений, особенно во втором и третьем пятилетии после операции, преобладающее место занимают первичные дисфункции, которые проявляются в двух клинико-морфологических формах. Наиболее частая форма связана с кальцификацией ксеногенного материала. Клинически она проявляется чистым или преобладающим стенозом.
Вторая форма проявляется, как правило, в третьем пятилетии функционирования протеза в виде недостаточности вследствие перфораций, разрывов или отрывов створок без кальцификации [2,8,9].
Для реконструктивной хирургии артерий на первом этапе были разработаны биопротезы из аллогенных артерий и вен, консервированные глутаральдегидом [4]. 17 больным были имплантированы аллоартериальные биопротезы, 15—алловенозные. Все они были использованы для бедренно-проксимально-подколенных реконструкций. Результаты операций были признаны неудовлетворительными, так как к концу первого года ни один аллоартериаль-ный биопротез не функционировал, а большинство алловенозных также были тромбированы (рис. 1).
Неудовлетворительный опыт, накопленный на первом этапе работы, заставил нас пересмотреть подходы к изготовлению и клиническому применению биопротезов клапанов сердца и кровеносных сосудов.
Известно, что кальцификация биопротезов клапанов сердца чаще развивается у молодых больных [6]. За рубежом биопротезы считаются противопоказанными пациентам моложе 60 лет [10]. Мы также отказались от имплантации биопротезов больным молодого возраста, но наша возрастная планка была поднята до 40 лет [2].
Однако наибольшие изменения в процессе эволюции наших взглядов претерпел сам биопротез [3].
Серьезные конструкторские разработки позволили создать две новые модели гибких опорных каркасов. Экспериментальные исследования показали, что применение этих моделей позволяет снизить механическую нагрузку на комиссуры и купол створки за счет осевых и радиальных перемещений стоек.
Большое внимание уделяли также оптимизации технологии консервации биопротеза. Было установлено, что обработка в потоке 0,625% раствора глутаральдегида обеспечивает максимальное насыщение ткани консервантом и, соответственно, наиболее эффективную сшивку коллагена.
Сочетанное использование симметричного опорного каркаса и консервации в потоке приводит к значительному улучшению гидродинамических характеристик биопротеза. В этом случае эффективная гидравлическая площадь приближается к анатомической за счет синхронной работы и повышения пластичности створчатого аппарата.
Это поколение биопротезов начали применять с 1984 г. Отдаленные результаты прослежены до 13 лет у 113 больных, составивших вторую группу. Средний возраст больных—40,2+0,9 лет. Средний функциональный класс по NYHA — 3,66.
Выживаемость больных в этой группе к 10 годам составила 95% (рис. 2). Столь высокий показатель объясняется своевременностью выполнения повторных операций и более низкой по сравнению с первой группой частотой развития специфических осложнений — 79% к 10-му году после операции. Показатель отсутствия первичных дисфункций также был существенно выше, чем в первой группе, и составил 85% к 10-му году.
Однако эти результаты также нельзя признать удовлетворительными — в основном в связи с необходимостью возрастных ограничений для имплантации биопротезов. Сегодня весь мир признает, что первичные дисфункции — главный лимитирующий фактор в применении биопротезов [7,11]. Однако все видят выход лишь в неуклонном подъеме возрастной планки. Мы же избрали другой путь—путь совершенствования биопротезов.
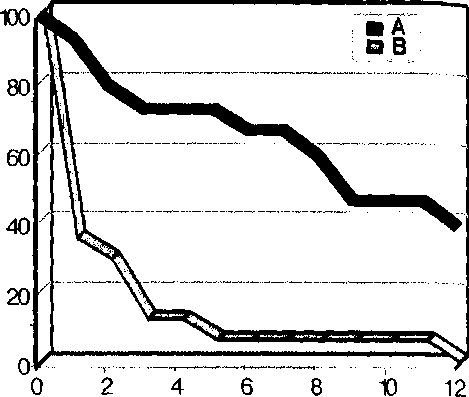
Рис. 1. Актуарное отсутствие тромбозов биопротезов из аллогенных артерий (А) и аллогенных вен (В) в сроки до 12 месяцев после операции (р=0,001)
На основании результатов экспериментальных исследований была разработана и внедрена оригинальная технология стадийной модификации биопротезов [3].
В основе этой технологии лежит первоначальная консервация глутаровым альдегидом, вследствие чего происходит образование поперечных связей в коллагене и денатурация протеогликанов (рис. 3). Затем с помощью протеолитического фермента папаина удаляют протеогликаны, а на освободившиеся реакционные группы коллагена иммобилизуют дифосфонат, профилактирующий кристаллизацию
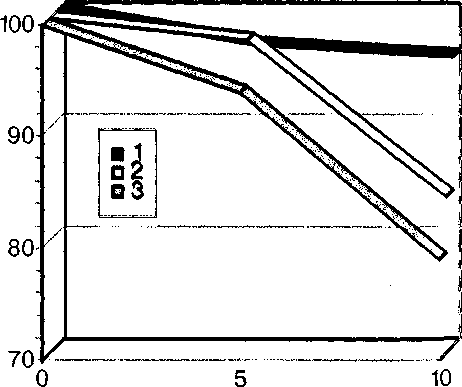
Рис. 2. Актуарные показатели выживаемости больных (1), отсутствия специфических осложнений (3) и первичных дисфункций (2) после биопротезирования митрального клапана в сроки до 10 лет (вторая группа)
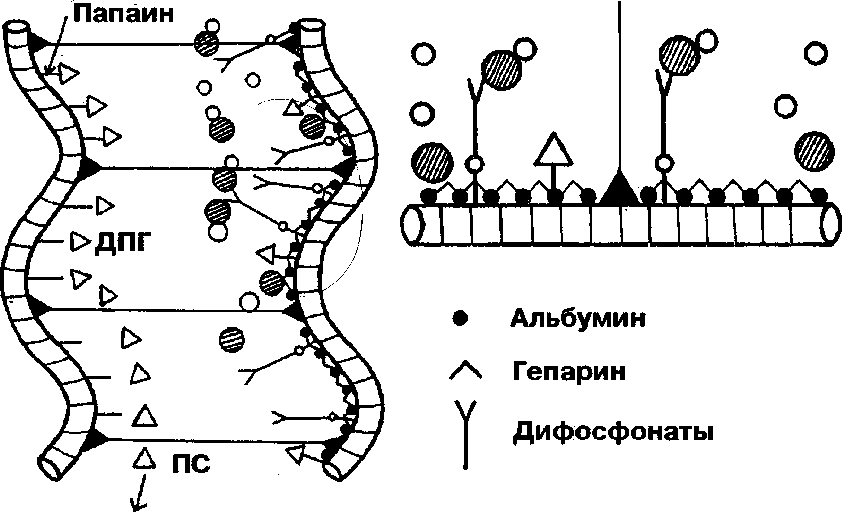
Рис. 3. Изменения в глутаральдегид-обработанной ткани в результате стадийной модификации папаином, дифосфонатами и гепарином. ПС - поперечная связь; ДПГ - денатурированный протеогликан
гидроксиапатита. Заключительный этап—формирование искусственного протеогликанового геля на основе альбумина и гепарина, препятствующего смешиванию ионов кальция и фосфата в пара-фибриллярном пространстве.
Для сосудистых протезов проблема кальцификации не столь актуальна, как проблема тромбооб-разования. Поэтому при обработке биопротезов из вены пупочного канатика человека исключили стадию иммобилизации дифосфонатов, тогда как в остальном технология консервации была аналогичной [4].
Биопротезы из вены пупочного канатика человека, консервированные с использованием папаина и гепарина, были имплантированы 10 больным в бедренно-проксимально-подколенную и 10 больным — в бедренно-дистально-подколенную позицию. .
В целом пятилетние клинические результаты были оценены как неудовлетворительные. К концу первого года в бедренно-дистально-подколеннной позиции функционировал лишь один биопротез (рис. 4). В бедренно-проксимально-подколенной оставались проходимыми 40% шунтов, однако к пятилетнему сроку и в этой позиции 80% биопротезов были тромбированы.
Значительно более хорошие результаты были получены при клинической апробации биопротезов клапанов сердца «Биопакс-1». В основе этой модели также лежит «сэндвичевая» структура, полученная при стадийной модификации биоматериала.
Биопротезы «Биопакс-1» были имплантирова ны в митральную позицию 18 больным, средний возраст которых составил 31,2± 1,5 лет. Максимальные сроки наблюдения составили 10 лет, средние — 7,8+0,2 года. До сих пор в этой группе не наблюдали ни одного случая первичных дисфункций, хотя по возрастному критерию эта группа близка к первой.
Однако в эксперименте было показано, что при стадийной технологии обработки сохраняется потенциальная способность глутаральдегид-обработанной ткани к связыванию кальция [3]. Эта способность проявляется на модели ускоренной кальцификации при больших сроках имплантации. Даже насыщение имплантата огромным количеством полимерного дифосфоната не предотвращает накопления кальция, хотя и в небольших количествах.
Проведенные исследования доказали, что причиной патологической кальцификации биопротезов является сам глутаровый альдегид [5]. Химическая структура этого консерванта и в особенности образуемые им связи с коллагеном имеют повышенное сродство к кальцию. Исходя из этого, мы сочли перспективной замену основного консерванта—глутаральдегида —на диэпоксид. Эпоксисоединения по своим свойствам существенно отличаются от глутаральдегида благодаря принципиальным отличиям в строении реакционных групп и соответственно связей, образуемых с коллагеном.
Диэпоксид, по данным аминокислотного анализа, превосходит глутаральдегид по суммарной плотности поперечной сшивки коллагена. Диэпок-сиобработанная ткань в модельных экспериментах in vivo и in vitro демонстрирует абсолютную резистентность к кальцификации. Кроме того, диэпоксид придает имплантатам высокую тромборезистент-
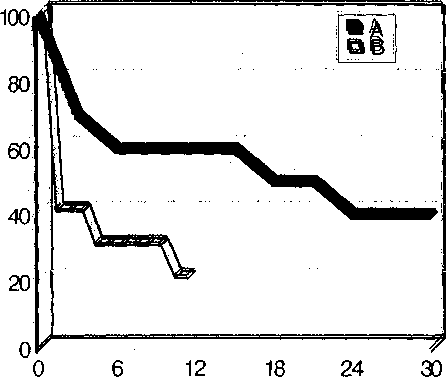
Рис. 4. Актуарное отсутствие тромбозов биопротезов из вены пупочного канатика человека в сроки до 30 месяцев после операции. А — бедренно-проксимальноподколенное; В — бедренно-дистальноподколенное шунтирование
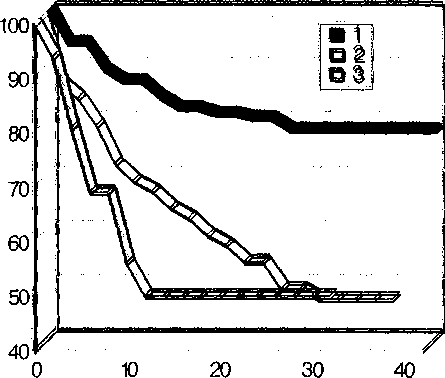
Рис. 5. Актуарное отсутствие тромбозов эпоксиобработанных биопротезов из внутренней грудной артерии КРС. 1 — бедренно-проксимальноподколенное шунтирование (п=83); 2 — бедренно-дистально-подколенное шунтирование (п=44); 3 — бедренноберцовое шунтирование (п=19)
ность, за счет изменения целого ряда свойств поверхности. Такие протезы по пластичности не отличаются от нативного биоматериала, что благоприятно сказывается на их гидродинамических характеристиках. В то же время ткань, консервированная диэпоксидом, обладает высокой прочностью.
Комплекс проведенных исследований привел к созданию биопротеза НеоКор, в основе которого лежит консервация диэпоксидом. Первый клапан этой модели был имплантирован в 1991 г.
Всего за последние 7 лет имплантирован 51 биопротез НеоКор, в том числе 32—в митральную позицию. До настоящего времени не выявлено ни одного случая первичных дисфункций, все биопротезы структурно стабильны и гемодинамически адекватны. Более того, по гемодинамическим показателям эпоксиобработанные биопротезы выгодно отличаются от консервированных глутаральдегидом [1]. Из осложнений в этой группе наблюдали одну нефатальную тромбоэмболию в сосуды головного мозга, связанную с отказом больного от антикоагулянтов в раннем послеоперационном периоде, и два случая инфекционного эндокардита (один из них — эндокардит наркомана).
Хорошие клинические результаты были получены и при имплантации эпоксиобработанных сосудистых биопротезов из внутренней грудной артерии крупного рогатого скота. Для повышения тром- борезистентности на внутреннюю поверхность этих сосудов дополнительно иммобилизован гепарин [4]. Такие протезы применяют в клинике Кемеровского кардиологического центра в течение четырех лет.
Наибольшее количество ксеногенных артерий (146) было использовано для реконструкции инфраингвинальных артерий. Актуарная проходимость бедренно-проксимально-подколенных шунтов к четырем годам составляет 80%, бедренно-дистально-подколенных и бедренно-берцовых — 50% (рис. 5).
После тщательного анализа полученных результатов мы полностью отказались от глутарового альдегида в практике производства биопротезов.
Конечно, делать окончательные выводы еще рано, но мы считаем, что сегодня эпоксисоединения являются оптимальными консервантами. Они помогли нам решить проблему кальцификации биопротезов клапанов сердца и существенно снизить тромбогенность сосудистых заменителей.
На пути дальнейшего совершенствования биопротезов остается нерешенным ряд проблем, например инфекционное поражение биопротезов и протезирование элементов сердечно-сосудистой системы на фоне инфекционных процессов. Решению этой проблемы посвящены основные исследования, проводимые в настоящее время в Кемеровском кардиологическом центре [12].
Список литературы Биопротезы в сердечно-сосудистой хирургии. 20-летний опыт Кемеровского кардиологического центра
- Абалмасов В.Г. Клиника-ультразвуковое исследование ксенобиопротезов аортального клапана сердца в митральной позиции: Дисс.... д-ра мед. наук. -Кемерово, 1997.
- EDN: ZJGMPR
- Барбараш Л. С. Экспериментально-клиническое обоснование применения новых моделей ксенобиопротезов в хирургии митрального порока сердца: Дисс.... д-ра мед. наук. -М., 1985.
- Барбараш Л.С., Барбараш Н.А., Журавлева И.Ю. Биопротезы клапанов сердца: проблемы и перспективы. -Кемерово, 1994. 400 с.
- Барбараш Л. С., Криковцов А. С., Журавлева И.Ю. Биологические протезы артерий. -Кемерово, 1996. 216 с.
- Журавлева И.Ю. Патогенетическое обоснование и разработка новых способов консервации ксенобиопротезов клапанов сердца: Дисс.... д-ра мед. наук. -Кемерово, 1995.


