Биоразнообразие микробных сообществ геотермальных вод и засоленных почв в регионах Прикаспийской низменности (Республика Дагестан)
Автор: Халилова Эсланда Абдурахмановна, Аливердиева Динара Алиевна, Котенко Светлана Цалистиновна, Исламмагомедова Эльвира Ахмедовна, Абакарова Аида Алевтиновна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 5-1 т.19, 2017 года.
Бесплатный доступ
Впервые исследованы микробные сообщества геотермальных вод, соленых озер, солонцово-солончаковых почв и галофитов в регионах Прикаспийской низменности. Из геотермальных источников выделены нокардиоморфные актиномицеты родов Nocardia, Rhodococcus Corynebacterium, Propionibacterium, денитрифицирующие органотрофные непатогенные амилазо- и протеазопродуцирующие штаммы рода Staphylococcus; соленых почв - бактерии рода Bacillus и Salimicrobium; соленых озер - рода Bacillus, Virgibacillus, Halomonas. Выделенные культуры обладают свойствами промышленных микроорганизмов и могут использоваться в технологических схемах очистки воды и почвы, получении биологически активных веществ.
Микробное разнообразие, бактерии, экосистемы прикаспийской низменности республики дагестан, физиология, биохимия, генетика
Короткий адрес: https://sciup.org/148205347
IDR: 148205347 | УДК: 663:550•36
Текст научной статьи Биоразнообразие микробных сообществ геотермальных вод и засоленных почв в регионах Прикаспийской низменности (Республика Дагестан)
Изучение биологического разнообразия экстремофильных микробных сообществ представляет интерес для фундаментальной микробиологии, так как многие обитающие в этих условиях микроорганизмы отно сятся к эволюционно древним ветвям бактерий и архей [15]. Именно они составляют основной генофонд, противостоящий изменениям окружающей среды и различным катаклизмам. Большая заслуга в изучении природных микробных сообществ принадлежит школе российских ученых [6-9]. Однако, несмотря на многочисленные исследования, проводимые в различных регионах мира, подобные исследования в Республике Дагестан проводятся впервые.
Дагестан является уникальной природной провинцией России и обладает многообрази-
ем природных ландшафтов благодаря влиянию тектонических процессов, эрозионной деятельности текучих вод, повторяющихся трансгрессий и регрессий Каспийского моря. В геологическом отношении она располагается на стыке двух крупнейших геолого-тектонических структур (Кавказской геосинклинали и Русской платформы) и занимает юго-восточную часть Восточного Предкавказья [10]. Как правило, с тектонически активными зонами связаны геотермальные источники, чрезвычайно обогащенные минеральными и органическими компонентами; создающие особые ниши для формирования термофильных микробных биоценозов. Северная часть природных экосистем Тарумовского района приурочена к Терско-Кумской низменности с признаками аридизации и опустынивания ландшафтов [11], подвержена активной дефляции и сильному засолению. В пространственном масштабе именно засоленность является главной экологической детерминантой, определяющей видовую структуру почвенных сообществ микроорганизмов. Таким образом, условия формирования и экология изучаемой территории представляют природную лабораторию для изучения биоразнообразия микробных сообществ на региональном уровне.
Целью исследований явилась оценка видового разнообразия микроорганизмов из экстремальных природных ниш Прикаспийской низменности и поиск перспективных для биотехнологии микроорганизмов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования являлись: микрофлора геотермальных вод Кизлярского месторождения скв. № 7-Т, Махачкалинского месторождения скв. № 36; соленого озера Бери-кейского месторождения; солончаковых почв и растительных образцов на территории Терско – Кумской низменности (Республика Дагестан) (рис. 1).
Водоносный горизонт Кизлярского месторождения скв. № 7-Т приурочен к чокракскому месторождению, представленному чередованием мощных пачек высокопроницаемых зернистых слабосцементированных песчаников и глин. Вода высокотермальная, очень жесткая (27,748), сульфатно - хлоридно – гидрокарбонат-но - натриевая. Химический состав представлен, в основном, ионами: Na, Ca, Mg, K, HCO3, Cl, SO4, Br. Состав растворенного газа углекисло – амми-ачно - азотный (50,76:27,40:21,84 %). Содержание органических веществ: битумы нейтральные – 2,0, битумы кислые – 1,4, гумусовые вещества – 4,6, фенолы – 0,54 и ароматические углеводороды – 1,6. Радиоактивность: Rn – 0,78× 10-12 г/л, U – 0,65× 10-7 г/л.
Водоносный горизонт Махачкалинского месторождения скв. № 36 приурочен к отложениям среднемиоценового возраста, свите «А+Б» Чокракского горизонта (на глубине 1292-1047 м), 1-й и 2-й песчаной пачке караганского горизонта. Вода сульфатно – хлоридно – гидрокар-бонатно – натриевая, термальная, слабосолоноватая, жесткая (6,5 г/л). В составе доминируют ионы Na, Ca, Mg, K, HCO3, Cl, SO4, Br. Состав растворенного газа: азотно - углекисло - аммиачный (66,13 : 28,99 : 4,88 %). Содержание органических веществ: битумы нейтральные – 1,0, битумы кислые – 0,7, гумусовые вещества – 3,0. Радиоактивность: Rn – 11,1 г/л, U – 1,7 г/л.
Берикейское месторождение редкометальных промышленных подземных вод расположено в 100 км южнее Махачкалы в Дербентском районе в прибрежной полосе Каспийского моря. В техногенном минеральном озере сосредоточено более 260 неуправляемых газофлюидных грифонов подземных вод, содержащих высокие концентрации нефтепродуктов, фенолов, тяжелых металлов, в том числе преимущественно ценные Na, Ca, K, Mg, Sr, Li, Rb, Cs [12].
Терско – Кумская низменность (Тарумов-ский район) представляет аккумулятивную рав-
Рис. 1. Объекты исследования экстремофильных микроорганизмов на территории Прикаспийской низменности:
а) опустыненный ландшафт солончакового типа Терско-Кумской низменности, б) соленое озеро Берикейского месторождения,

a )

б )

в )
нину, сложенную морскими и континентальными верхнеплиоценовыми и четвертичными осадками морской, речной и эоловой аккумуляции. Химизм засоления региона солончакового опустынивания составляет гидрокарбонатно -натриевый состав солей, обусловленный аллювиально-морским происхождением почвообразующих пород. Пробы почв на территории Терско-Кумской низменности отобраны по горизонтам и с растения Halostachys caspica L., произрастающего в этом же ареале.
Фенотипические свойства микроорганизмов, в том числе амилазную и протеазную активность, изучали с использованием стандартных методов [13]. Для индентификации изучаемых микроорганизмов использовали среды: Мюнца, нитритный агар по Виноградскому, Сотона, Финна II, Финна II с геотермальной водой, Левенштейна – Йенсена, сусло – агар, агар Эндо, МПА, Кит – Та-роцци, мясо-пептонный агар и мясо-пептонный бульон. Для окончательной идентификации использовали определитель Берджи [14]. Выделение ДНК из образцов осуществляли модифицированным методом щелочного выделения ДНК Бирнбойма-Доли [15] и Wizard-технологии фирмы Promega (США). Секвенирование продуктов амплификации проводили (Центр «Биоинженерии» РАН, Москва методу Сэнгера с соавт. [16] на генетическом анализаторе ABI PRIZM 3730 (Applied Biosystems, Inc., USA). Построение филогенетических деревьев исследуемых бактерий осуществляли с помощью методов, реализованных в пакете программ TREECON [17].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение широкого спектра биохимических свойств бактерий, выделенных из геотермальной воды скв. Кизлярского месторождения № 7-Т, позволило идентифицировать виды, относящиеся к группам: нокардиоморфные актиномицеты -бактерии, содержащие миколовые кислоты (гр. 22), грамположительные неспорообразующие палочки неправильной формы (гр. 20) и микобактерии (гр. 21) (см. таблицу). Бактерии рода Сorynebacterium - ферментирующие, нелиполитические, разлагают углеводы. Изоляты нокар-диоморфных актиномицетов родов Nocardia, Rhodococcus и Microbacterium способны разлагать химически инертные соединения при загрязнении природных объетов нефтепродуктами и могут быть использованы для биоремедиации земель. Известны исследования подобных культур нефтеокисляющих бактерий рода Rhodococcus и Pseudomonas sp., выделенных из геотермального источника [18]. Штаммы Rhodococcus благодаря способности метаболизировать в качестве единственных источников углеродного питания н-алканы (пропан, н-бутан) представляют сво- еобразный природный катаболический экран, предотвращающий загрязнение атмосферы газообразными углеводородами. Доминантный в геотермальной воде штамм R. rhodochrous рекомендуется как биоиндикатор газовых углеводородных аномалий. Обнаружен типовой вид Propionibacterium freudenreichi s (гр. 20). У всех пропионовокислых бактерий обнаружены супероксиддисмутазная, каталазная и пероксидазная активности, причем среди актиномицетов широко распространена гетеротрофная фиксация CO2.
Представители Staphylococcus характерны для антропогенных экосистем: геотермальных источников Индии и Японии, вулканических почв Камчатки, засушливых пустынь Атакамы, биотопов Антарктики, Мертвого моря и др. [5, 19-21]. На сегодняшний день в международных базах данных известны результаты секвенирования более 40 полных геномов и 70 видов Staphylococcus (, www. , что делает род одним из наиболее изученным. Выделенные из геотермальной воды Махачкалинского месторождения скв. № 36 солеустойчивые штаммы (10-15 % NaCl) слабо алка-лофильны, обладают амилолитической и протеолитической активностью. Согласно cкринингу секвенированных фрагментов по базе данных GenBank, они относятся к роду Staphylococcus, филогенетической линии Firmicutes. Штаммы Е 1-4 имеют идентичные последовательности генов 16S рРНК (99,9-100 % сходства) и принадлежат к филогенетическому кластеру, включая типовые штаммы двух подвидов: S. hominis subsp. hominis и S. hominis subsp. novobiosepticus (см. таблицу). Установлено, что культуры обнаружили высокий уровень сходства последовательностей (99,9 %) с Staphylococcus hominis M53 JX312632 (рис. 2) из горячего геотермального источника Мanirakan (штат Химачал, Индия) [22].
Как правило, соленые озера и почвы являются основными источниками для изоляции гало-фильных и галотолерантных микроорганизмов [24]. С использованием микробиологических методов и анализа генов 16S рРНК выделены и идентифицированы бактерии различных микробных сообществ (см. таблицу). Из высокоминерализованного озера Берикейского месторождения изолированы галотолерантные бактерии Bacillus cereus, Virgibacillus salaries, Virgibacillus marismortui, Virgibacillus olivae, Halomonas ventosae, Halomonas gomseomensis, Halomonas elongate, выдерживающие высокую температуру и минерализацию воды. В настоящее время продолжаются фенотипические исследования новых микробов.
Дербентский и Тарумовский районы объединяют как природные, так и антропогенные факторы с формировавшимися микробиоценозами. Методом накопительного культивирова-
Таблица. Экстремофильные микроорганизмы, изолированные из природных обьектов Прикаспийской низменности
0.02

Staphylococcus hominis subsp. novobiosepticus ATCC 700236T (AB233326)
Strain E-l
Staphylococcus hominis M53 (.1X312632)
Strain E-2
Strain E-3 = Strain E-4
Staphylococcus hominis subsp. hominis DSM 20328T (X66101)
Staphylococcus haemolyticus M21
Staphylococcus haemolyticus CCM2737T (X66100)
' Staphylococcus devriesei KS-SP 60T (FJ389206) Staphylococcus lugdunensis ATCC 43809T (AB009941) Staphylococcus pasteuri ATCC 51129T (AB009944) ^“ Staphylococcus aureus ATCC 35844T (D83355) Staphylococcus saprophyticus ATCC 15305T AP008934)
Staphylococcus succinus SB72T (AJ320272) Staphylococcus succinus M40 (JX312627)
Staphylococcus auricularis ATCC 33753T (D83358)
100 | Staphylococcus lutrae ATCC 700373T (X84731)
^“ Staphylococcus intermedius ATCC 29663T (D83369) ^^^^^^“ Staphylococcus massiliensis CCUG 55927T (EU707796) — Staphylococcus lentus ATCC 29070T (D83370)
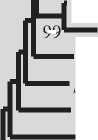
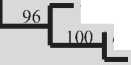
Рис. 2. Филогенетическое положение изучаемых штаммов 1-4.
Исследуемые штаммы отмечены жирным [23]. Штаммы стафилококков, выделенные из индийского геотермального источника, отмечены розовым [22]. Масштаб показывает эволюционное расстояние, соответствующее 2 нуклеотидным заменам на каждые 100 нуклеотидов.
Цифрами показана достоверность ветвления, установленная с помощью “bootstrap” – анализа 100 альтернативных деревьев
а) б ) в ) r)
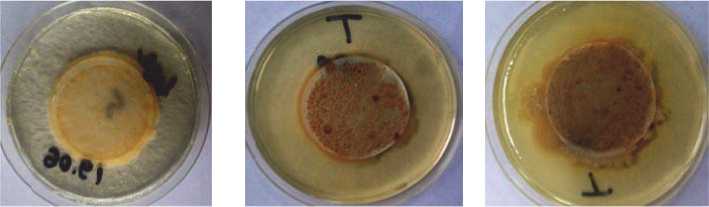
Д)
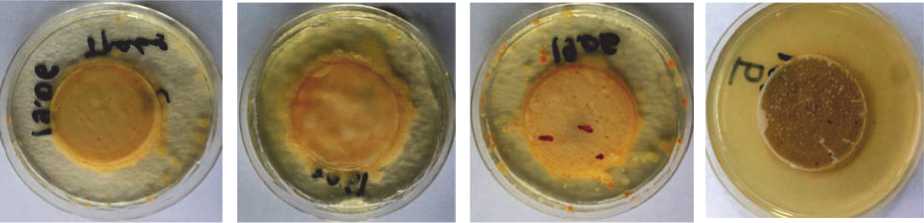
ж )
Рис. 3. Колонии культур галофильных бактерий, выделенных из различных биотопов Прикаспийской низменности: а) (трава), б) (почва), д) (вода), е) (почва), ж) (растение) – фильтраты из биотопов Тарумовского района; в), г) – фильтраты проб воды из соленого озера Берикейского месторождения (Дербентский район)
галофильным и галотолерантным микроорганизмам родов Alcaligenes, Bacillus, Halobacillus, Micrococcus, Salinibacterium и Pseudomonas. В верхних горизонтах пухлых солончаков разно- образие микробных сообществ резко обеднено из-за высоких концентраций солей, причем в их отсутствии спороношение микробов практически не наблюдается. Выявлено более 40 видов и форм бактерий. Преобладающее положение в образцах анализируемых почв и растения H. сaspica занимают изоляты олиготрофных бактерий родов Salinibacterium и Bacillus (см. таблицу) с экономным метаболизмом и активным ферментативным аппаратом, что подтверждает их физиологическую устойчивость в аридных условиях. Salimicrobium halophilum рассматривается как умеренно галофильный микроорганизм, генетические особенности которого идентичны микробам из засоленных почв района Юнь-чэн, Китай [25]. Штамм Bacillus pumilus способен разлагать ксилан, активно восстанавливать сульфат до каталазы, синтезировать ряд других биологически активных веществ, способствующих сохранению биохимического потенциала аридных экосистем. Алкалофильные бактерии B. clausii могут использоваться в производстве экзоферментов, щелочной протеазы и ксилана-зы, способны синтезировать антибиотики, необходимые для защиты растений от патогенных микроорганизмов и острозасушливых климатических условий. Одним из основных признаков хлоридно – сульфатного типа засоления является произрастание соляноколосника каспийского Halostachys caspica как одного из основных ландшафтных фреатофитов и полупустынь (рис. 1). Изолированный с растения H. caspica, Bacillus licheniformis принимает участие в структуроо-бразовании и дезинфекции почвы, используется в составе сельскохозяйственных удобрений. Действительно, галофильные бактерии играют важную роль в биорекультивации нарушенных засоленных почв, управлении биотическими и абиотическими стрессами.
ВЫВОДЫ
Впервые исследованы микробные сообщества геотермальных вод, соленых озер, солонцово-солончаковых почв и галофитов в регионах Прикаспийской низменности (Республика Дагестан). Из геотермальных источников выделены нокардиоморфные актиномицеты родов Nocardia, Rhodococcus Corynebacterium, Propionibacterium, денитрифицирующие орга-нотрофные непатогенные амилазо - и протеазопродуцирующие штаммы рода Staphylococcus; соленых озер и солончаков - бактерии рода Bacillus, Salimicrobium, Virgibacillus, Halomonas. Изолированные культуры обладают свойствами промышленных микроорганизмов и могут быть использованы для получения биологически активных веществ. Исследование разнообразия аборигенных экстремофильных микробных сообществ из природных экосистем Прикаспийской низменности представляет большой научный интерес с точки зрения поиска новых штаммов, эффективных в биотехнологической практике. Результаты исследований позволяют расширить знания об экологии и фенотипическом разнообразии экстремофильных бактерий.
Список литературы Биоразнообразие микробных сообществ геотермальных вод и засоленных почв в регионах Прикаспийской низменности (Республика Дагестан)
- Yadav A.N., Verma P., Kumar V., Sachan S.G., Saxena A.K. Extreme Cold Environments: A Suitable Niche for Selection of Novel Psychrotrophic Microbes for Biotechnological Applications//Biotechnology&Microbiology. 2017. V. 2. № 2. P. 1-4.
- Gutiérrez R.T., Medin B.R., Pérez A.C., Freile J.R., Ramos J.R., Chiliquinga R.M, Lozada M.D., Llerena D.G. Quantification and characterization of native microorganisms under contrasting rainforest environment in Ecuadorian Amazon//In Proceedings of the MOL2NET, International Conference on Multidisciplinary Sciences. 2016. V. 2. P. 2016-2025.
- Likar M., Stres,B., Rusjan D., Potisek M., Regvar M. Ecological and conventional viticulture gives rise to distinct fungal and bacterial microbial communities in vineyard soils//Applied Soil Ecology. 2017. V. 113. P. 86-95.
- Andrew M., Andrew M. Sea ice, extremophiles and life on extra-terrestrial ocean worlds//International Journal of Astrobiology. 2017. P. 1-16 DOI: 10.1017/S1473550416000483
- Johnson R.M., Ramond J.B., Gunnigle E., Seely M., Cowan D.A. Namib Desert edaphic bacterial, fungal and archaeal communities assemble through deterministic processes but are influenced by different abiotic parameters//Extremophiles. 2017. V. 21 (2). P. 381-392.
- Заварзин Г.А. Изучение микробного разнообразия в Институте микробиологии им. С.Н. Виноградского//Микробиология. 2004. Т. 73. № 5. С. 598-612.
- Slobodkina G.B. Baslerov R.V., Novikov A.A., Viryasov M.B., Bonch-Osmolovskaya E.A., Slobodkin A.I. Inmirania thermothiophila gen. nov., sp. nov., a thermophilic, facultatively autotrophic, sulfur-oxidizing gammaproteobacterium isolated from a shallow-sea hydrothermal vent//International Journal of Systematic and Evolutionary Microbiology. 2016. T. 66. № 2. P. 701-706.
- Bonch-Osmolovskaya E.A., Atomi H. Editorial overview: Extremophiles: from extreme environments to highly stable catalysts//Current Opinion in Microbiology. 2015. V. 25. P. 88-96.
- Namsaraev Z.B., Babasanova O.B., Dunaevsky Y.E., Akimov V.N., Barkhutova D.D., Gorlenko V.M., Namsaraev B.B. Anoxybacillus mongoliensis sp. nov., a novel thermophilic proteinase producing bacterium isolated from alkaline hot spring, Central Mongolia//Microbiology. 2010. V. 79. № 4. P. 491-499.
- Идрисов И.А. О структуре рельефа юго-запада Прикаспийской низменности//Аридные экосистемы. 2013. Т. 19. № 1 (54). С. 36-43.
- Залибеков З.Г. Почвы Дагестана. Махачкала: Прикаспийский институт биологических ресурсов ДНЦ РАН, Дагестанский государственный университет. 2010. 244 с.
- Курбанов М.К. Геотермальные и гидроминеральные ресурсы Восточного Кавказа и Предкавказья: монография. М.: Наука, Маик «Наука/Интерпериодика», 2001. 260 с.
- Практикум по микробиологии: учебное пособие для студентов высших учебных заведений/А.И. Нетрусов, М.А. Егорова, Л.М. Захарчук, Н.Н. Колотилова . М.: Академия. 2005. 608 с.
- Определитель бактерий Берджи. В 2-х т. Т. 2. Пер. с англ. . М.: Мир. 1997. 368 с.
- Birnboim H.C., Doly J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA//Nucleic Acids Res. 1979. V. 7. № 6. P. 1513-1523.
- Sanger F., Nicklen S., Coulson A.R. DNA sequencing with chain-terminating inhibitors//Proc. Natl. Acad. 1977. Sci. USA. V. 84. P. 5463-5467.
- Van de Peer Y. TREECON for Windows: a software package for the construction and drawing of evolutionary trees for the Microsoft Windows environment//Comput. Applic. Biosci. 1994. V. 10. P. 569-570.
- Перспективы использования бактерий рода Rhodococcus и микробных поверхностно-активных веществ для деградации нефтяных загрязнений/Е.В. Карпенко, Р.И. Вильданова-Марцишин, Н.С. Щеглова, Т.П. Пирог, И.Н. Волошина//Прикладная биохимия и микробиология. 2006. Т. 42. № 2. С. 175-179.
- Dickinson I., Goodall-Copestake W., Thorne M.A., Schlitt T., Ávila-Jiménez M.L., Pearcе D.A. Extremophiles in an Antarctic Marine Ecosystem//Microorganisms. 2016. V. 4 (1). P. 8-18.
- Aszalós J.M., Krett G., Anda D., Márialigeti K., Nagy B., Borsodi A.K. Diversity of extremophilic bacteria in the sediment of high-altitude lakes located in the mountain desert of Ojos del Salado volcano, Dry-Andes//Extremophiles. 2016. V. 20. № 5. P. 603-620.
- Zyl L.J, Nemavhulani S., Cass J., Cowan D.A., Trindade M. Three novel bacteriophages isolated from the East African Rift Valley soda lakes//Virol J. 2016. V. 13. № 1. P. 204-214.
- Kumar М., Nath Yadav А., Rameshwar T., Prasanna R., Kumar A., Saxena A.K. Deciphering the diversity of culturable thermotolerant bacteria from Manikaran hot springs//Annalis of Microbiology. 2014. V. 64. № 2. Р. 741-751.
- Амилазо-и протеазопродуцирующие бактерии Staphylococcus в геотермальном источнике Махачкалинского месторождения (Дагестан)/Э.А. Халилова, Т.П. Турова, С.Ц. Котенко, Э.А. Исламмагомедова, Д.А. Аливердиева//Микробиология. 2016. Т. 85. № 2. С. 219-222.
- Delgado-García М. Isolation and Screening of Halophilic Bacteria for Production of Hydrolytic Enzymes//Halophilic. Biodiversity and Sustainable Exploitation. 2015. V. 6. P. 379-401.
- Yoon J.H., Kang S.J. Salimicrobium luteum sp. Nov//Int. J. Syst. Evol. Microbiol. 2007. V. 57. P. 2406-2411.


