Биосинтез 2-С-метил-D-эритрит-2,4-циклодифосфата коринеподобными бактериями
Автор: Санданов А.А., Цыренов В.Ж., Островский Д.Н.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 3 (30), 2010 года.
Бесплатный доступ
В статье рассмотрен процесс биосинтеза 2-С-метил-D-эритрит-2,4-циклодифосфата различными кори- неподобными бактериями. Установлен наиболее эффективный продуцент и определен выход данного продукта.
2-с-метил-d-эритрит-2, 4-циклодифосфат, немевалонатный путь, био- синтеза изопреноидов, окислительный стресс
Короткий адрес: https://sciup.org/142142211
IDR: 142142211 | УДК: 615.9+577.472(28):614+577.4
Текст научной статьи Биосинтез 2-С-метил-D-эритрит-2,4-циклодифосфата коринеподобными бактериями
2-С-метил-D-эритрит-2,4-циклопирофосфат - (МЭЦ) – интермедиат немевалонатного пути биосинтеза изопреноидов. 2-С-метил-D-эритрит-2,4-циклодифосфат способствует возврату дормантных клеток Mycobacterium smegmatis в активное состояние[1]. Поскольку у человека безмевалонатный путь синтеза изопреноидов отсутствует, то этот путь привлек внимание многих исследователей как мишень для поиска антибиотиков, так как ингибиторы этого пути могли бы стать прекрасным средством избирательного подавления бактериальных возбудителей инфекционных заболеваний [2]. Поэтому 2-С-метил-D-эритрит-2,4-циклодифосфат и его производные могут оказаться полезными при поиске и создании новых антибиотиков. Установлено, что 2-С-метил-D-эритрит-2,4-циклодифосфат в значительных количествах образуется у Corynebacterium ammoniagenes в условиях окислительного стресса [3].
В данной работе была поставлена задача изучить способность отдельных штаммов коринеподоб-ных бактерий синтезировать 2-С-метил-D-эритрит-2,4-циклодифосфат.
Материалы и методы
Микроорганизмы, хранение и культивирование .
Объектом исследования явились представители группы коринебактерий: Corynebacterium ammoni-agenes ВСТИ 403, Corynebacterium flavum ВСТИ 301, Corynebacterium species ВСТИ 4, из коллекции ФГУП «ГосНИИгенетика» и коллекции кафедры биотехнологии ВСГТУ, Corynebacterium ammoniagenes ATCC 6872, Micrococcus lysodelkticus (luteus) коллекции Института биохимии им. А.Н.Баха. Длительное хранение штамма (до 6 месяцев) проводилось под слоем вазелинового масла. Культуру после роста при 30° на скошенном мясопептонном агаре МПА заливали маслом на 1 см выше края питательной среды и сохраняли при 4°. До двух недель штамм можно хранить в этих условиях без заливки маслом. Пересев производили каждые 1,5-2 месяца. Петлей брали материал из-под масла, производили разведение клеток в стерильном физиологическом растворе. Для приготовления посевного материала использовался только свежепересеянный косяк, выращенный в течение суток при 30°С.
Подготовка питательной среды.
Посевная среда содержала: 20 г D-глюкозы моногидрата, 10 г пептона, 10 г дрожжевого экстракта и 2,5 г NaCl на 1 литр воды. Перед стерилизацией pH доводили до 7,2 с помощью 3 н NaOH. Инокулят
(10%) готовили на посевной среде. Культуру микроорганизмов объемом по 50 мл. выращивали в колбах Эрленмейера объемом 750 мл.
Ферментационная среда - Nutrient broth M002 (Himedia) содержала 50 г глюкозы моногидрата, 3 г дрожжевого экстракта, 5 г NaCl на 1 литр воды.
Для осуществления биосинтеза МЭЦ ферментационную среду разливали по 200 мл в качалочные колбы на 750 мл, доводили pH 5 н NaOH до 7,6 и стерилизовали в течение 15 мин при 1 атм.
Условия ферментации.
Культуру с 2-суточного косяка петлей переносили в 200 мл посевной среды и помещали на круговую чалку (220 об/мин). После суток роста при 30±1° посевной культурой в количестве 10 об % инокулировали ферментационную среду. Для осуществления синтеза 2-С-метил-D-эритрит-2,4-циклодифосфата в ферментационную среду добавляли бензилвиологен 50 мкг/мл, а также глюкозу 40% 10 мл после 24 часов ферментации. Продолжительность ферментации составляла 48 часов.
Определение роста микроорганизма
Наблюдения за ростом клеток проводили измерением оптической плотности при 578 нм. Отбирали 1 мл аликвоту культуральной жидкости, разбавляли её 3 мл дистиллированной воды. Осадок после низкоскоростного центрифугирования ресуспендировали в 1 мл дистиллированной воды и измеряли мутность. Для вычисления сухого веса пользовались калибровочной кривой.
Хроматография
Бумажную хроматографию нуклеотидов и их производных проводили на бумаге Whatman. Для разделения нуклеотидов использовали систему растворителей изомасляная кислота – 1 М аммиак – вода (20:12:3), для нуклеозидов и оснований – использовали систему растворителей бутанол-1-уксусная кислота-вода (4:1:5) [4]
Высокоэффективная жидкостная хроматография (ВЭЖХ) клеточного экстракта, с градиентной элюцией, выполнялась по методу [5], с использованием хроматографа Agilent 1100 (производство США), оснащенного ультрафиолетовым детектором переменной частоты, установленным на 254 нм. Элюент А содержал 20 мл концентрированной фосфорной кислоты в 800мл деионизованной воды с доведенным до 4,0 pH с помощью 25% NaOH и, объемом, доведенным водой до 1 л. Элюент B содержал равные объемы ацетонитрила и метанола. Все реактивы фильтровали через фильтр (5 мкм). Элюцию нуклеотидов с колонки C18 5 μ проводили при температуре 37°С. Для использования в качестве стандартов в элюенте А растворяли рибонуклеотиды 5`-АМФ и АТФ (0,1 М стандартные растворы нуклеотидов). Скорость элюции – 0,7 мл/мин. В течение первых пяти минут элюция была изократической (100% элюент А), затем в течение 15 минут следовал линейный градиент (85% элюент А и 15% элюент Б). Затем подвижная фаза вновь устанавливалась на 100% элюента А в течение 5 минут. Новый образец наносили после уравновешивания в течение 15 минут 100% элюентом А.
Спектрофотометрический анализ
Содержание нуклеотидов в элюате контролировали, измеряя поглощение при 260 нм каждой фракции против воды. Фракции отдельных нуклеотидов объединяли. Содержание нуклеотидов определяли спектрофотометрически с использованием коэффициентов молярных экстинкций. [4]
Идентификация 2-С-метил-О-эритрит-2,4-циклодифосфата и его количественное определение
Биомассу бактерий осаждали центрифугированием в течение 30 мин при 3800 об/мин и затем экстрагировали 50% раствором этанола при комнатной температуре в течение 1 ч из расчета 10 мл раствора на 1 г биомассы. Экстракт отделяли центрифугированием, лиофильно сушили и растворяли в воде с содержанием D 2 О не менее 20% так, чтобы 1 мл этого раствора соответствовал ~2 г сырой биомассы. Этот раствор использовали для регистрации 31Р-ЯМР (спектрометр фирмы «Bruker» (США), модель AMX-400), внешний стандарт Na-соль этилендиаминтетрафосфоновой кислоты в D 2 О с химическим сдвигом 12,78 м.д. относительно 85%-ной ортофосфорной кислоты. Образцы помещали во вращающиеся лампы диаметром 10 мм при температуре 24ОС. Рабочая частота спектрометра 161,98 МГц, импульс 45°, время задержки 2 с. При двумерной спектроскопии заданный импульс 0°, импульсная последовательность Д1=90°, Д2=45°, время задержки 0 с.
Молярную концентрацию 2-С-метил-D-эритрит-2,4-циклодифосфата рассчитывали по интегралу спектра 31Р-ЯМР путем сравнения со спектром известной навески NADP при отнесении интегралов к интенсивности сигналов стандарта. Количественное значение 2-С-метил-D-эритрит-2,4-циклодифосфата рассчитывали в микрограммах на 1 мл культуральной жидкости.
Для выделения и очистки 2-С-метил-D-эритрит-2,4-циклодифосфата с сигналом 31Р-ЯМР с химическим сдвигом – 14,8 м.д. клетки выращивали в присутствии радиоактивного фосфата (10 Мбк на 1 мл) либо [14C] гидролизата белка (0,2 Мбк на 1 мл), экстракты наносили на колонку с анионобменником
Dowex 1х4 (Serva) в формиатной форме, проводя затем элюцию в градиенте 0-1,7 М формиата аммония pH 4,0.
Элюат с колонки анализировали на содержание радиоактивности и поглощение при 260 нм, а также на наличие сигналов 31Р-ЯМР. Радиоактивность измеряли в счетчике SL-4000 Intertechnique (Франция), помещая 0,1 мл образца во флаконы с 5 мл сцинтилляционной жидкости ЖС-8
В опытах использовали препарат 2-С-метил-D-эритрит-2,4-циклодифосфата, полученный в лаборатории биохимии стрессов микроорганизмов Института биохимии им. А.Н. Баха РАН.
Результаты
На рисунке 1 изображена хроматография препарата 2-С-метил-D-эритрит-2,4-циклодифосфата, используемого нами в качестве стандарта.
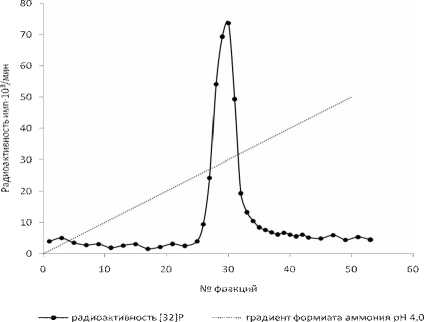
Рис. 1. Хроматография препарата 2-С-метил-D-эритрит-2,4-циклодифосфата на колонке Dowex 1x4 (НСОО-, 1,6х23 см.) в градиенте 0 – 1,7 М формиата аммония, объем фракций 5 мл, скорость элюции 1 мл/мин, температура 20°С
Как видно на рисунке 1, имеется один пик по радиоактивности. При анализе ультрафиолетового поглощения при 260 нм во фракциях не было обнаружено нуклеотидов, нуклеозидов и оснований.
На рисунке 2 показана хроматография экстракта клеток Corynebacterium flavum ВСТИ 301.
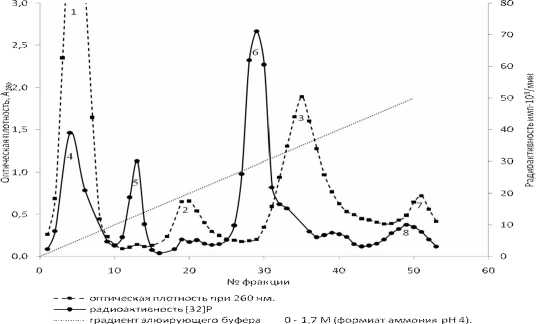
Рис. 2. Хроматография экстракта клеток Corynebacterium flavum ВСТИ 301 на колонке Dowex 1x4 (НСОО-, 1,6х23 см.) в градиенте 0 – 1,7 М формиата аммония, объем фракций 5 мл, скорость элюции 1 мл/мин, температура 20°С, 1,2,3,7 – пики по оптической плотности при 260 нм, 4,5,6,8 – пики по радиоактивности 32Р
При анализе радиоактивности по 32Р обнаружено 4 пика (пики 4,5,6,8 на рис.2), из них пик 6 соответствует по Rf положению 2-С-метил-D-эритрит-2,4-циклодифосфата на рисунке 1 и идентифицирован как 2-С-метил-D-эритрит-2,4-циклодифосфат. При регистрации оптической плотности при 260 нм в элюатах обнаружены 4 пика (пики 1,2,3,7 на рис. 2). Методом бумажной хроматографии веществ, соответствующих пикам 1,2,3 на рисунке 2, и последующим анализом УФ спектров веществ установлено следующее: вещества, обусловливающие появление пика 1, соответствуют нуклеозидам и основаниям, вещества пика 3 являются нуклеотидами, главным образом производными аденина. Вещества, соответствующие пикам 7 и 8, не идентифицированы.
В таблице 3 показаны выходы 2-С-метил-D-эритрит-2,4-циклодифосфата, синтезированного различными штаммами коринеподобных бактерий в условиях их окислительного стресса. Эти выходы являются усредненными данными, полученными на основе результатов шести опытов. Видно, что у всех испытуемых в условиях их окислительного стресса (добавление бензилвиологена в ферментационную среду) наблюдается накопление 2-С-метил-D-эритрит-2,4-циклодифосфата. Уровень накопления данного метаболита различается у разных микроорганизмов. Было обнаружено, что биосинтез 2-С-метил-D-эритрит-2,4-циклодифосфата штаммом C.flavum ВСТИ 301 протекает интенсивнее и с большим выходом, чем у ранее использованного C.ammoniagenes ATCC 6872. Наименьший выход 2-С-метил-D-эритрит-2,4-циклодифосфата был обнаружен у штамма C.species ВСТИ 4
Таблица 1
Выходы 2-С-метил-D-эритрит-2,4-циклодифосфата у различных штаммов коринеподобных бактерий в условиях их окислительного стресса
|
Микроорганизм |
Биомасса, г/л |
Выход МЭЦ, мкг/мл культуральной жидкости |
|
Corynebacterium ammoniagenes ATCC 6872 |
8,2 |
0,68 |
|
Corynebacterium ammoniagenes ВСТИ 403 |
7,9 |
0,41 |
|
Corynebacterium flavum ВСТИ 301 |
8,1 |
0,77 |
|
Corynebacterium species ВСТИ 4 |
6,5 |
0,27 |
|
Micrococcus luteus |
4,9 |
0,36 |
Заключение
Испытание коринеподобных бактерий в условиях их окислительного стресса показало, что происходит накопление 2-С-метил-D-эритрит-2,4-циклодифосфата. Уровень накопления данного метаболита различен у различных штаммов. В условиях окислительного стресса биосинтез 2-С-метил-D-эритрит-2,4-циклодифосфата штаммом C.flavum ВСТИ 301 осуществляется интенсивнее и с большим выходом, чем у C.ammoniagenes ATCC 6872.


