Биосинтез каучука и инулина в зависимости от спектрального состава света и активности фотосинтетического аппарата при аэропонном культивировании Taraxacum kok-saghys E. Rodin
Автор: Мартиросян Л.Ю., Мартиросян Ю.Ц., Кособрюхов А.А., Гольдберг В.М., Гачок И.В., Мартиросян В.В., Гладченко М.А., Гайдамака С.Н., Америк А.Ю., Миних А.А., Варфоломеев С.Д.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Нетрадиционные культуры и технологии
Статья в выпуске: 1 т.58, 2023 года.
Бесплатный доступ
В связи с интенсивным развитием промышленности и новых технологий повышается спрос на натуральный каучук. Этот биополимер не может быть полностью заменен синтетическим каучуком, поскольку обладает уникальными потребительскими и эксплуатационными характеристиками. Наряду с традиционным источником производства натурального каучука из латекса гевеи бразильской Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg. ведутся работы по его получению из растений кок-сагыза Taraxacum kok-saghys E. Rodin, которые можно выращивать как в естественных, так и в контролируемых условиях. Определение наиболее благоприятного светового режима с учетом физиологического состояния растений - важный элемент при разработке технологий, обеспечивающих высокий выход целевых продуктов. В представленном исследовании впервые показано повышение скорости биосинтеза каучука при облучении растений кок-сагыза светом с большей долей синей части спектра, а также описан характер изменения скорости световых и темновых реакций фотосинтетического аппарата, концентраций сахарозы и глюкозы при изменении светового режима выращивания растений в течение нескольких часов. Цель работы - изучение влияния световых условий на физиолого-биохимические процессы и биосинтез каучука и инулина у растений кок-сагыза, выращиваемых в контролируемых условиях фитотрона. Растения кок-сагыза коллекционной формы 391 из коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР), выращенные из семян в стерильных условиях, на 19-20-е сут (в фазу 3-4-х настоящих листьев) высаживали в аэропонные фитотроны, в две камеры с полноспектральным светодиодным (СД) облучением в области фотосинтетически активной радиации ФАР400-700 нм 400±28 мкмоль фотонов·м-2·с-1. В первой камере облучение в области ФАР400-500 нм синего спектра (λmax = 460 нм, СД СС) составляло 255,6 мкмоль фотонов·м-2·с-1, в области ФАР600-700 нм красного спектра (λmax = 660 нм, СД КС) - 75,6 мкмоль фотонов·м-2·с-1, соотношение КС/СС - 0,30. Во второй камере интенсивность облучения КС в области ФАР600-700 нм составляла 259,6 мкмоль фотонов·м-2·с-1, интенсивность облучения в области ФАР400-500 нм СС - 71,8 мкмоль фотонов·м-2·с-1, соотношение КС/СС - 3,6. Анализ ростовых и фотосинтетических процессов, определение содержания глюкозы и сахарозы в листьях, каучука и инулина в корнях растений в условиях длительного роста при различных спектральных режимах, а также при смене режима облучения показали, что при выращивании кок-сагыза в течение 28 сут в камерах фитотрона при повышенной доле КС содержание каучука увеличивалось в 3,0 раза, инулина - в 4,1 раза по сравнению с первоначальными значениями тех же параметров у исходных растений. При повышении доли СС в области ФАР показатели увеличивались соответственно в 5,4 и 4,6 раза. В конечном итоге при облучении светом с большей долей СС растения накапливали в 1,75 раза больше каучука. Изменение спектра облучения растений с СС на КС приводило к кратковременному повышению концентрации глюкозы и сахарозы в листьях по сравнению с исходными значениями. Такая зависимость сохранялась в течение 2 ч, после чего содержание сахарозы не изменялось, но снижалось содержание глюкозы. При переключении с КС на СС наблюдали противоположные эффекты. Изменение концентрации растворимых углеводов связано с переменой спектрального состава облучения растений и, как результат, с модуляцией активности фотосинтетического аппарата. Показано снижение активности фотосинтетического аппарата при смене режима облучения растений с СС на КС: скорость фотосинтеза уменьшалась с 26,7 до 15,2 мкмоль СО2·м-2·с-1 (при световом насыщении), скорость темнового дыхания - с 2,80 до 2,38 мкмоль СО2·м-2·с-1, квантовый выход фотосинтеза - с 0,066 до 0,055. При изменении облучения с КС на СС наблюдалось повышение скорости фотосинтеза и активности фотосистемы II, но снижение накопления глюкозы и сахарозы в течение первых 2 ч с возвращением к исходным значениям через 3 ч.
Тaraxacum kok-saghyz, кок-сагыз, рост, скорость фотосинтеза, скорость темнового дыхания, квантовый выход фотосинтеза, каучук, инулин, светодиодные источники света, фитотрон, аэропоника
Короткий адрес: https://sciup.org/142238089
IDR: 142238089 | УДК: 633.91:633.913.322:581.192:577.344.3:577.355 | DOI: 10.15389/agrobiology.2023.1.100rus
Текст научной статьи Биосинтез каучука и инулина в зависимости от спектрального состава света и активности фотосинтетического аппарата при аэропонном культивировании Taraxacum kok-saghys E. Rodin
Вторичные метаболиты растений выполняют множество важных функций и широко используются человеком. Хорошо известны такие соединения, как алкалоиды, полифенолы, включая флавоноиды и терпеноиды, инулин, каучук. Многие из них незаменимы (невозможен искусственный синтез) и активно применяются в медицинских, нутрицевтических целях, а также в промышленности (1, 2). Изучение влияния различных факторов на синтез, накопление и локализацию веществ вторичного метаболизма остается одной из актуальных проблем современной физиологии растений (3-5).
В настоящее время во всем мире в связи с интенсивным развитием промышленности и новых технологий повышается спрос на натуральный каучук (НК), представляющий собой 1-4-цис-полиизопрен. НК на 91-96 % состоит из полиизопрена, содержит белки, аминокислоты и жирные кислоты и далеко не всегда может быть заменен синтетическими аналогами. НК имеет уникальные потребительские и эксплуатационные характеристики (удароустойчивость, износостойкость, эффективное теплорассеива-ние) (6-9), высокоэластичен и даже при действии малых усилий обладает обратимой деформацией растяжения до 1000 %. Эластичность каучука сохраняется в широких температурных пределах, это его характерное свойство, поэтому, например, в автомобильной промышленности используются шины, при производстве которых в состав материалов входит до 20 % натурального каучука, тогда как в авиационных шинах его доля составляет до 100 % (10). НК используется в каркасах шин, где требуется высокая прочность, а синтетические каучуки — в материалах протектора для обеспечения сцепления шин с дорогой (11).
Основным экономически значимым источником промышленного получения НК был и остается латекс из гевеи бразильской Hevea brasiliensis (Willd. ex A. Juss.) Mull. Arg. (12). Однако возрастающий спрос на продукт становится стимулом для поиска альтернативных сырьевых источников для производства натурального каучука (13, 14) и исследования биохимических и молекулярно-генетических аспектов его биосинтеза (15, 16). Одним из перспективных может быть каучуконосное растение кок-сагыз ( Taraxacum kok-saghys E. Rodin), которое широко выращивали на территории СССР в 1930-1950-е годы (17). Кроме каучука, из кок-сагыза можно получать инулин, составляющий до 35 % от сухой массы корней (18). В полевых условиях кок-сагыз культивируют 2 года. В условиях фитотрона период сбора биомассы корней начинается после 2 мес выращивания растений и продолжается достаточно длительное время, в течение которого периодически срезают часть корневой системы. После каждой такой процедуры растения в течение 28-30 сут регенерируют корневую систему до прежних размеров с поддержанием функций активного биосинтеза каучука и инулина. Поэтому, наряду с выращиванием растений в условиях открытого грунта, представляется возможным получение высокого выхода целевого продукта круглогодично, в контролируемых условиях с использованием искусственных источников облучения (19).
В растениях кок-сагыза каучук синтезируется в специализированных структурах — млечниках (латициферах). Часть НК аккумулируется в млечном соке, в основном в корнях. К концу вегетации количество каучука в корнях существенно возрастает. В среднем в корнях растений накапливается от 7 до 15 % каучука, а в некоторых коллекционных образцах — до 25 % от сухой массы корней (20, 21). При этом содержание инулина достигает 30-
35 % от сухой массы корня.
К настоящему времени вопрос о световом режиме (интенсивность, спектральный состав, длительность фотопериода) выращивания кок-сагыза остается открытым, и определение наиболее благоприятных световых условий с учетом физиологического состояния растений рассматривается как важный элемент повышения скорости биосинтеза каучука и инулина.
Результаты, представленные в настоящей работе, дают исходную информацию о влиянии спектрального состава облучения на накопление каучука и инулина, а также на активность фотосинтетического аппарата в условиях длительного выращивания кок-сагыза при облучении светом с различным спектральным составом. Впервые показано повышение скорости биосинтеза каучука при облучении растений светом с большей долей синей части спектра, а также описан характер изменения скорости световых и темновых реакций фотосинтетического аппарата, концентрации сахарозы и глюкозы при модуляции светового режима выращивания растений на протяжении нескольких часов.
Цель работы — изучение влияния световых условий на физиологобиохимические процессы и биосинтез каучука и инулина у растений кок-сагыза, выращиваемых в контролируемых условиях фитотрона.
Методика. Исследования проводили в фитотронах с регулируемыми условиями светового облучения, температуры, влажности, минерального питания, газового состава среды. Растения кок-сагыза коллекционной формы 391 из коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (г. Санкт-Петербург), выращенные из семян в стерильных условиях, на 19-20-е сут (в фазу 3-4 настоящих листьев) высаживали в аэропонные фитотроны, в две камеры с полноспектральным светодиодным (СД) облучением в области фотосинтетически активной радиации ФАР 400-700 нм 400±28 мкмоль фотонов • м - 2 •с - 1. В первой камере облучение в области ФАР 400-500 нм синего спектра (λ max = 460 нм, СД СС) составляло 255,6 мкмоль фотонов• м - 2•с - 1, в области ФАР 600-700 нм красного спектра (X max = 660 нм, СД КС) — 75,6 мкмоль фотонов• м - 2•с - 1. Во второй камере интенсивность облучения КС в области ФАР 600-700 нм составляла 259,6 мкмоль фотонов^м - 2•с - 1, в области ФАР 400-500нм СС — 71,8 мкмоль фотонов^м - 2 •с - 1.
Температуру, относительную влажность, концентрацию CO 2 контролировали с помощью беспроводного датчика E+E EE244 («E+E Elektronik», Австрия), который был интегрирован в систему управления технологическими процессами в фитотроне. Концентрация CO 2 в воздухе в обеих камерах составляла 418±15 мкмоль/моль, влажность воздуха — 60-80 %, температура — 22±1 °C. Спектральные режимы облучения растений определяли с помощью спектрометра ASENSEtek PG100N («UPRtek Corp.», Тайвань). Измерения проводили в динамике (0, 1-й, 2-й, 3-й ч) при стационарном световом режиме с преобладающим синим или красным светом, а также после смены одного преобладающего света на другой.
Скорость фотосинтеза исследовали с помощью инфракрасного газоанализатора CPro+ («ADC BioScientific Ltd.», Великобритания), что позволяло измерять и анализировать СО2-газообмен непосредственно в камерах при заданных световых условиях выращивания растений. Зависимость скорости СО2-газообмена от интенсивности света определяли в диапазоне от 0 до 1600 мкмоль фотонов• м-2•с-1 при концентрации СО2 в воздухе 418±15 мкмоль/моль, последовательно повышая интенсивность света. Для описания световой кривой фотосинтеза использовали уравнение нерегуляр- ной гиперболы (22).
Активность фотосистемы II (ФС II) определяли методом переменной флуоресценции с помощью компактного минифлуориметра JUNIOR-PAM («Heinz Walz GmbH», Германия). Листья растений кок-сагыза оставляли в темноте на 15 мин, затем освещали вспышками света (23, 24). Определяли функциональное состояние ФС II, максимальный квантовый выход ФС II, эффективный квантовый выход ФС II (при интенсивности измерения флуоресценции), нефотохимическое тушение флуоресценции (оценивает часть энергии, которая используется растением для нефотохимических реакций), относительную скорость транспорта электронов (косвенный показатель скорости фотосинтеза).
Для количественного анализа глюкозы и сахарозы средние части (0,5 г) полностью развитых листьев кок-сагыза (без центральной жилки) гомогенизировали вручную в ступке с 4,5 мл воды, после чего центрифугировали в течение 20 мин при 6000 об/мин (FC5718, «OHAUS Corporation», США). Полученный экстракт использовали для оценки содержания водорастворимых низкомолекулярных сахаров. Предварительно было показано, что в осадке отсутствуют низкомолекулярные углеводы.
При количественном определении концентрации глюкозы в качестве реактивов использовали стандартный набор Глюкоза-Ново («Вектор-Бест», Россия), предназначенный для анализа жидких субстратов. После добавления в экстракт реактивов его инкубировали в течение 20 мин при 50 °С. Измеряли оптическую плотность раствора при X = 508 нм и X = 343 нм с использованием спектрофотометра (UV2600, «Shimadzu», Япония) и рассчитывали концентрацию глюкозы. Использовали метод GOPOD (glucose oxidase peroxidase) с измерением интенсивности окраски раствора, возникающей в результате реакции хромогена с перекисью водорода, которая, в свою очередь, служит продуктом окисления глюкозы кислородом воздуха в присутствии глюкопероксидазы (25).
При определении количества сахарозы в образце в экстракт добавляли фермент инвертазу (Available Carbohydrates Assay Kit, Megazyme cat. no. K-AVCHO, «Megazyme, Ltd.», Ирландия) для гидролиза сахарозы на глюкозу и фруктозу, затем инкубировали в течение 30 мин при 30 °С и pH 6,5. После завершения реакции гидролиза проводили специфическое окрашивание глюкозы в растворе. Интенсивность окрашивания была обусловлена суммарным окрашиванием свободной глюкозы и глюкозы, образовавшейся при ферментативном гидролизе сахарозы. Для определения концентрации сахарозы вычисляли разницу между полученной концентрацией и определенной ранее концентрацией свободной глюкозы (26).
Содержание каучука оценивали гравиметрическим способом. Каучук выделяли в соответствии с принципами, описанными D.A. Ramirez-Cadavid с соавт. (27). Свежесобранные корни промывали водой, высушивали в течение 24 ч при 65 °С, растирали в ступке, просеивали порошок на сите с размером отверстий 1½1 мм. Навеску порошка корня (300 мг) использовали для экстракции. Экстракцию хлороформом (40-45 мл, марка ХЧ, ООО ТД «ХИММЕД», Россия) проводили на аппарате Сокслета (ООО «МЛС Клин», Россия) в течение 6 ч. Полученный экстракт концентрировали упариванием при 75 °С до остаточного объема 3-5 мл. Каучук из аликвоты экстракта осаждали тройным объемом этанола при 4 °С в течение 1516 ч в тарированной микропробирке. Осадок отделяли центрифугированием в течение 20 мин при 14500 об/мин (Eppendorf 5424, «Eppendorf», Германия). Из осадка каучука удаляли сопутствующие вещества, последовательно промывая осадок дистиллированной водой, а затем ацетонитрилом («Sigma»,
США) с дальнейшим центрифугированием. Остатки воды и ацетонитрила удаляли 3-кратным промыванием осадка этиловым спиртом с последующим центрифугированием. Очищенный каучук просушивали продувкой аргоном, затем по массе осадка определяли процентное содержание каучука в расчете на сухую биомассу корня.
Для определения количества инулина корни промывали водой, высушивали в течение 24 ч при 65 °С, растирали в ступке, просеивали порошок на сите с размером отверстий 1½1 мм. При получении водного экстракта из навески порошка корня (200 мг) использовали водяную баню (экстракция при 85-90 °С в течение 60 мин). Суспензию центрифугировали при 14500 об/мин в течение 5 мин или фильтровали через мембрану из стекловолокна с размером пор 1 мкм. Проводили кислотный гидролиз инулина с 10 % HCl в соотношении 1:1 (проба:кислота) в течение 60 мин на кипящей (100 °С) водяной бане. Для определения редуцирующих сахаров до и после гидролиза применили метод Шомоди-Нельсона (ГОСТ Р 54905-2012. М., 2013), измерения проводили на спектрофотометре UV-1202 («Shimadzu», Япония) (28).
Эксперименты выполняли в 4-5-кратной аналитической и 3-кратной биологической повторности. Общая закономерность не изменялась по вариантам опыта, поэтому результаты приведены по данным одной биологической повторности. Статистическую обработку результатов проводили с помощью пакета программ Microsoft Excel. На рисунках и в таблице приведены средние арифметические значения ( M ) со стандартной ошибкой (±SEM). Достоверность различий определяли по t -критерию Стьюдента при P = 0,95.
Результаты. Свет — ключевой фактор роста и развития растений, фоторецепторы которых оценивают качество (спектральный состав) и количество (интенсивность) света и адаптируются к нему. Световые сигналы, воспринимаемые в основном фитохромами и криптохромами, регулируют ростовые, метаболические и морфогенетические ответы растений (29).

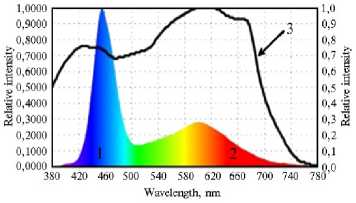
Рис. 1. Спектральные характеристики светодиодных облучателей при длительном выращивании растений кок-сагыза ( Taraxacum kok-saghys E. Rodin) методом аэропоники в камерах аэропонного фитотрона: 1 — область ФАР 400-500 нм синего спектра, 2 — область ФАР 600-700 нм красного спектра, 3 — кривая зависимости интенсивности фотосинтеза от длины волны падающего света (спектр действия фотосинтеза по K.J. McCree). Интенсивность излучения измеряли на уровне посадочного поля.
Повышение доли синего (рис. 1, А, В) или красного (см. рис. 1, Б, Г) света при выращивании растений кок-сагыза в камерах аэропонного фитотрона приводило к изменению соотношения КС/СС в спектре облучения. В первой культивационной камере соотношение КС/СС составило 0,30, во второй — 3,6. При этом практически не наблюдалось различий в скорости фотосинтеза в расчете на единицу листовой поверхности — соответственно 9,4 мкмоль СО 2 •м - 2•с - 1 при начальном КС (рис. 2, А, 0 КС) и 10,9 мкмоль СО 2 •м - 2•с - 1 при начальном СС (см. рис. 2, Б, 0 СС).
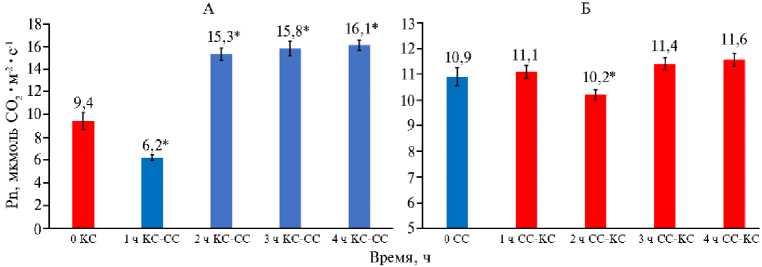
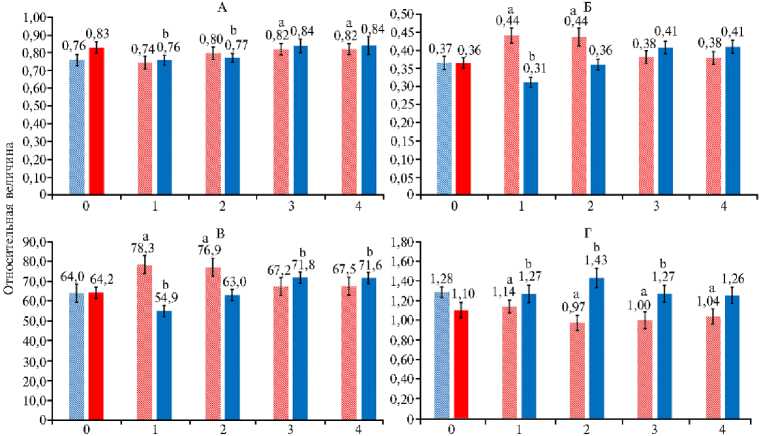
Рис. 2. Скорость фотосинтеза в листьях растений кок-сагыза ( Taraxacum kok-saghys E. Rodin) при длительном выращивании методом аэропоники в камерах аэропонного фитотрона при интенсивности света 400 мкмоль фотонов∕м - 2∕с - 1 с преобладанием красного ( КС) (А) или синего (СС) (Б) света в спектре облучения, а также при изменении спектра облучения с КС на СС (А) и с СС на КС (Б) ( M ±SEM, n = 5) .
* Различия с вариантами КС (А) и СС (Б) статистически значимы при P = 0,95.
Смена светового режима выращивания с преимущественно красного спектра (КС) на преимущественно синий (СС) в 1-й ч после переключения приводила к снижению скорости фотосинтеза, а во 2-й и последующие часы — к ее повышению по сравнению с первоначальными значениями (см. рис. 2, А). При противоположной перемене светового режима (с СС на КС) характер изменений был другой. Небольшое увеличение скорости фотосинтеза сменялось заметным спадом, но на 3-й и 4-й ч наблюдалось повышение скорости процесса, хотя и не такое значительное, как при изменении спектрального режима с КС на СС (см. рис. 2, Б).
Для более детального выяснения характера влияния смены спектрального режима на активность фотосинтетического аппарата были получены световые кривые скорости фотосинтеза растений.
При смене режима облучения с СС на КС наблюдалось снижение скорости фотосинтеза с 26,7 до 15,2 мкмоль СО 2 •м - 2•с - 1 на плато световой кривой (при световом насыщении) (рис. 3, А). При переходе с СС на КС также происходило снижение скорости темнового дыхания с 2,80 до 2,38 мкмоль СО 2 •м - 2•с - 1 (см. рис. 3, Б) и квантового выхода фотосинтеза с 0,066 до 0,055 (см. рис. 3, Г). Изменение светового режима с КС на СС приводило к увеличению скорости процесса при насыщении световой кривой фотосинтеза, к повышению скорости темнового дыхания, квантового выхода фотосинтеза, а также светового компенсационного пункта.
Наблюдаемые изменения активности фотосинтетического аппарата могут быть связаны с активностью световой стадии фотосинтеза. Так, изменение режима с КС на СС первоначально приводило к снижению максимального квантового выхода ФС II, эффективного квантового выхода, снижению скорости электронного транспорта, но повышению нефотохимического тушения флуоресценции (рис. 4). Через 3 ч показатели были сопоставимы с таковыми у растений, облучаемых преимущественно КС, до смены светового режима.
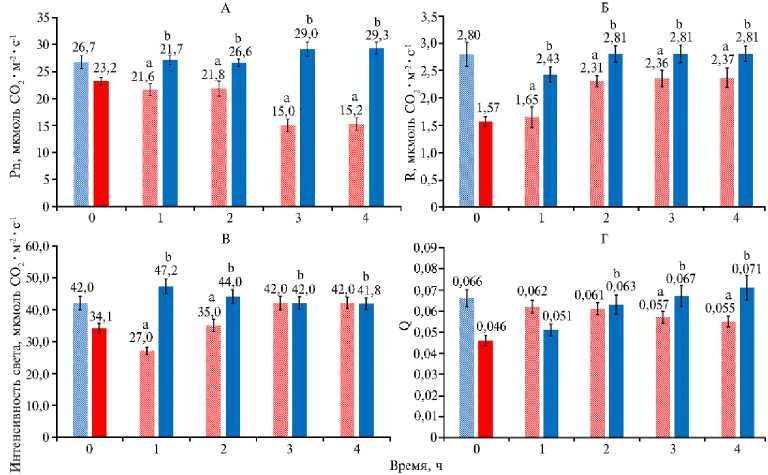
Рис. 3. Скорость фотосинтеза на плато световой кривой (А) , скорость дыхания (Б) , световой компенсационный пункт (В) и квантовый выход фотосинтеза (Г) в листьях растений кок-сагыза ( Taraxacum kok-saghys E. Rodin) при длительном выращивании методом аэропоники в камерах аэропонного фитотрона при интенсивности света 400 мкмоль фотонов∕м - 2∕с - 1 с преобладанием синего (СС, левые столбики крайней левой пары) или красного (КС, правые столбики крайней левой пары) света, а также при изменении спектра облучения с СС на КС (левые столбики остальных пар) и с КС на СС (правые столбики остальных пар) ( M ±SEM, n = 6) .
a, b Различия соответственно с вариантом КС в начальной точке и с вариантом СС в начальной точке статистически значимы при Р = 95 %.
Время, ч
Рис. 4. Максимальный квантовый выход ФС II (А) , эффективный квантовый выход (Б) , скорость электронного транспорта (В) и нефотохимическое тушение (Г) в листьях растений кок-сагыза ( Taraxacum kok-saghys E. Rodin) при длительном выращивании методом аэропоники в камерах аэропонного фитотрона при интенсивности света 400 мкмоль фотонов∕м - 2∕с - 1 с преобладанием синего (СС, левые столбики крайней левой пары) или красного (КС, правые столбики крайней левой пары) света, а также при изменении спектра облучения с СС на КС (левые столбики остальных пар) и с КС на СС (правые столбики остальных пар) ( M ±SEM, n = 6) .
a, b Различия соответственно с вариантом КС в начальной точке и с вариантом СС в начальной точке статистически значимы при Р = 95 %.
Изменение спектрального режима с СС на КС приводило к постепенному повышению максимального квантового выхода ФС II, повышению эффективного квантового выхода и скорости электронного транспорта в течении первых 2 ч и снижению нефотохимического тушения флуоресценции. Через 3 ч показатели были такими же или ниже (для нефотохимического тушения) по сравнению с показателями для растений, облучаемыми преимущественно СС, до смены светового режима.
Механизмы, с помощью которых определенные участки спектра и световые режимы облучения оказывают влияние на первичный и вторичный метаболизм растений, различаются. Влияние спектра облучения при выращивании растений проявляется как в изменении работы фотосинтетического аппарата, так и направленности реакций вторичного метаболизма. Так, смена спектра облучения растений с СС на КС приводило к увеличению концентрации глюкозы и сахарозы по сравнению с исходными значениями. Такая зависимость сохранялась в течение 2 ч, после чего концентрация сахарозы оставалась на том же уровне, а содержание глюкозы снижалось. При переключении с КС на СС наблюдали обратный эффект. Сначала концентрация глюкозы и сахарозы снижалась, а потом повышалась (рис. 5).
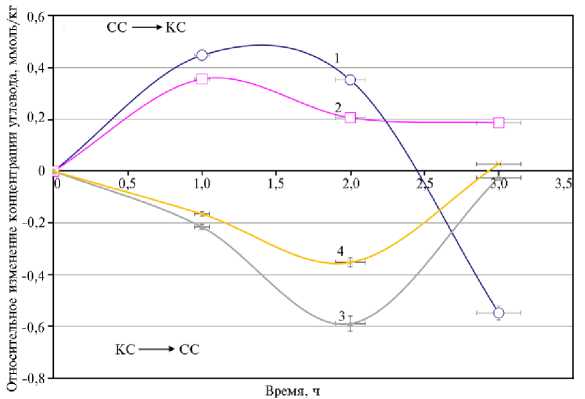
Рис. 5. Динамика изменения концентрации глюкозы (1, 3) и сахарозы (2, 4) в листьях растений кок-сагыза ( Taraxacum kok-saghys E. Rodin) при длительном выращивании методом аэропоники в камерах аэропонного фитотрона при интенсивности света 400 мкмоль фотонов∕м - 2∕с - 1 с преобладанием красного (КС) или синего (СС) света после изменении спектра облучения с СС на КС (1, 2) и с КС на СС (3, 4) ( M ±SEM, n = 8) .
Растворимые углеводы — важные субстраты в метаболизме растений, участвующие в различных физиологических и биохимических процессах, регулируя транспорт и включение углерода в обмен веществ. В листьях растений около половины связанного углерода транспортируется в виде сахарозы или глюкозы в стебель и корни, где они превращаются в полисахариды, а у кок-сагыза — в основном в инулин. Наряду с накоплением инулина происходит синтез и накопление изопентенилпирофосфата (ИПП) — каучукового мономера. Растения используют два пути биосинтеза ИПП: через мевалонат (MVA) и метилэритрит (MEP). Мевалонатный путь происходит в цитозоле клетки, метилэритритный — в пластидах. Ферменты биосинтеза изопентилпирофосфата в обоих путях используют промежуточные продукты, образуемые в результате метаболизма сахарозы через пируват и глицеральдегид-3-фосфат или через ацетил-КоА соответственно для путей
MEP и MVA (30, 31). В цитоплазматическом пути MVA основным субстратом служит цитозольный ацетил-КоА, полученный либо из сахарозы, либо из глюкозы и фруктозы. Изменение биосинтеза этих продуктов (32, 33) может быть эффективным рычагом регулирования роста и накопления биомассы растениями кок-сагыза, а в конечном итоге — синтеза и накопления инулина и каучука.
В корнях растений кок-сагыза, выращиваемых в камерах аэропон-ного фитотрона в течение 28 сут, происходило активное накопление этих соединений (табл.). При облучении растений светом с большей долей КС наблюдалось повышение содержания каучука и инулина соответственно в 3,0 и 4,1 раза, при большей доле СС — в 5,4 и 4,6 раза по сравнению с первоначальными значениями перед посадкой в фитотрон. Действие спектрального состава облучения на 28-е сут достоверно проявлялось в повышении содержания каучука у растений, выращиваемых при большей доле синего света.
Содержание каучука и инулина в корнях растений кок-сагыза ( Taraxacum kok-saghys E. Rodin) при длительном выращивании методом аэропоники в камерах аэропонного фитотрона при интенсивности света 400 мкмоль фотонов∕м - 2∕с - 1 с преобладанием красного (КС) или синего (СС) света ( M ±SEM, n = 5)
|
Интенсивность света в фитотроне1 Длительность выращиваният |
Каучук, % |
Инулин, % |
|
|
400 мкмоль фотонов•м - 2•с - 1 с большей |
Посадка в фитотрон |
2,0±0,1 |
3,8±0,1 |
|
долей КС в спектре облучения |
28 сут |
5,9±0,2* |
15,6±1,1* |
|
400 мкмоль фотонов•м - 2•с - 1 с большей |
Посадка в фитотрон |
1,9±0,1 |
4,0±0,1 |
|
долей СС в спектре облучения |
28 сут |
10,3±0,3* |
18,3±1,2* |
* Различия со значениями при посадке статистически значимы при Р = 95 %.
Функциональные возможности фитотронных технологий на основе аэропонного способа выращивания, создание и контроль всех параметров культивирования (температура, влажность, содержание СО 2 , интенсивность и спектральный состав света, минеральное питание и др.) позволяют создать стратегию управления метаболизмом растений в зависимости от фазы роста и/или целесообразности выбора приоритетного пути направленного биосинтеза вторичных метаболитов, каучука и инулина.
Согласно полученным нами результатам, свет с преобладанием красной или синей составляющей в спектре облучения влияет на биосинтез растворимых сахаров, каучука и инулина в растениях кок-сагыза. Увеличение биосинтеза каучука под воздействием СС может быть связано с корректировкой метаболических путей углеводного обмена в результате специфического действия СС на фотосинтетический аппарат.
По данным литературы, повышение синтеза растворимых углеводов или белков при облучении растений преимущественно в красной или синей области спектра (34) обусловливает изменение скорости появления и роста новых листьев, а также соотношения биомассы надземной части растений и корневой системы (35). При облучении растений СС использование продуктов фотосинтеза не связано с необходимостью быстрого нарастания листовой поверхности, поэтому происходит отток сахарозы или глюкозы в корни, где в результате ряда биохимических реакций в цитоплазматическом пути MVA синтезируются продукты вторичного метаболизма. В нашем случае при преобладании в спектре облучения СС наблюдалось большее накопление каучука в корнях по сравнению с вариантом, где преобладал КС.
Наряду с длительным воздействием на растения КС или СС возможно и периодическое изменение спектра облучения (36), что влияет на скорость синтеза, а также накопление и транспорт продуктов фотосинтеза. В нашем случае изменение спектрального режима облучения растений кок- сагыза в течение нескольких часов с СС на КС не вызывало снижения скорости фотосинтеза (см. рис. 2), однако происходило повышение скорости электронного транспорта и реального квантового выхода, а также снижение нефотохимического тушения флуоресценции. В условиях более эффективной работы ФС II наблюдалось увеличение концентрации глюкозы и сахарозы в листьях.
При переходе с КС на СС резко снижалась скорость фотосинтеза в течение 1-го ч, после чего (через 2-3 ч) происходило повышение скорости поглощения СО 2 , снижение квантового выхода ФС II, скорости электронного транспорта. Также усиливалось нефотохимическое тушение в самом начале перехода с КС на СС, после чего этот показатель возвращался к первоначальным значениям. В этих условиях отмечали снижение концентрации глюкозы и сахарозы в листьях в течение первых 2 ч с последующим возвращением к исходным значениям через 3 ч (см. рис. 5).
Изменение активности фотосинтетического аппарата в ответ на модуляцию спектрального состава облучения развивается в течение нескольких часов, и этот прием может быть использован для регулирования скорости метаболических процессов и выхода конечных продуктов. Подобный подход также может быть применен для повышения накопления продуктов вторичного метаболизма растений кок-сагыза, прежде всего каучука. Однако требуются дальнейшие исследования для понимания ключевых факторов, влияющих на биосинтез целевых веществ, а также изучение экспрессии генов и синтеза белков, участвующих в биосинтезе каучука. В сочетании с генно-инженерными методами улучшения продуктивности каучуконосных растений это позволит существенно повысить выход каучука и инулина до экономически приемлемых значений. Большую роль в коммерциализации аэропонного культивирования кок-сагыза, несомненно, будет играть комплексная переработка всей выращенной растительной биомассы с получением ряда других ценных продуктов.
Таким образом, изменение светового режима при длительном выращивании растений кок-сагыза в контролируемых условиях фитотрона оказывало влияние на активность световых процессов фотосинтетического аппарата — максимальный и эффективный квантовый выход, скорость электронного транспорта, а также на скорость поглощения углекислоты. Увеличение доли красного света (КС) в спектре облучения растений, выращиваемых при преобладании синего света (СС), приводило к повышению скорости электронного транспорта и эффективного квантового выхода, а также к снижению нефотохимического тушения флуоресценции через 3 ч. Полученные данные свидетельствует о повышении эффективности использования красного света фотосинтетическим аппаратом. При переходе с КС на СС наблюдалось повышение скорости фотосинтеза, дыхания. При смене режима облучения растений с СС на КС, наоборот, скорость фотосинтеза уменьшалась с 26,7 до 15,2 мкмоль СО 2 •м - 2•с - 1 (при световом насыщении), скорость темнового дыхания — с 2,80 до 2,38 мкмоль СО 2 •м - 2•с - 1, квантовый выход фотосинтеза — с 0,066 до 0,055. Увеличение доли СС в спектре облучения приводило к повышению (почти в 1,75 раза) накопления каучука в корнях кок-сагыза по сравнению с растениями, выращиваемыми при облучении с большей долей КС. Кроме того, наблюдалось увеличение накопления инулина в 1,17 раза. Основанная на этом технология выращивания кок-сагыза, обеспечивающая биосинтез каучука и инулина в контролируемых условиях фитотрона с оптимизацией всех факторов роста, представляется весьма перспективной.
Список литературы Биосинтез каучука и инулина в зависимости от спектрального состава света и активности фотосинтетического аппарата при аэропонном культивировании Taraxacum kok-saghys E. Rodin
- Евстафьев С.Н., Тигунцева Н.П. Биологически активные вещества одуванчика лекарственного Taraxacum officinale Wigg. (обзор). Известия вузов. Прикладная химия и биотехнология, 2014, 1(6).
- Тихомирова Л.И., Базарнова Н.Г., Ильичева Т.Н., Мартиросян Ю.Ц., Афанасенкова И.В. Получение растительного сырья ириса сибирского (Iris sibirica) методами биотехнологии. Химия растительного сырья, 2018, 4: 235-245.
- Verma N., Shukla S. Impact of various factors responsible for fluctuation in plant secondary metabolites. Journal of Applied Research on Medicinal and Aromatic Plants, 2015, 2(4): 105-113 (doi: 10.1016/j.jarmap.2015.09.002).
- Yang L., Wen K.-S., Ruan X., Zhao Y.-X., Wei F., Wang Q. Response of plant secondary me-tabolites to environmental factors. Molecules, 2018, 23: 762 (doi: 10.3390/molecules23040762).
- Jan R., Asaf S., Numan M., Kim K.M. Plant secondary metabolite biosynthesis and transcrip-tional regulation in response to biotic and abiotic stress conditions. Agronomy, 2021, 11(5): 968 (doi: 10.3390/agronomy11050968).
- Wei Y.-C., Liu G.-X., Zhang L., Zhao F., Liao S., Luo M.-C. Exploring the unique character-istics of natural rubber induced by coordination interaction between proteins and Zn2+. Poly-mer, 2020, 193: 122357 (doi: 10.1016/j.polymer.2020.122357).
- Gronover S.C., Wahler D., Prufer D. Natural rubber biosynthesis and physic-chemical studies of plant derived latex. In: Biotechnology of biopolymers /M. Elnashar (ed.). InTech, Rijeka, 2011: 75-88 (doi: 10.5772/17144).
- Cornish K. Biochemistry of natural rubber, a vital raw material, emphasizing biosynthetic rate, molecular weight and compartmentalization, in evolutionarily divergent plant species. Natural Product Report, 2001, 18(2): 182-189 (doi: 10.1039/a902191d).
- Cornish K. Alternative natural rubber crops: why should we care? Technology and Innovation, 2017, 18: 245-256 (doi: 10.21300/18.4.2017.245).
- Yager T.J., McCarty J.L. Friction characteristics of three 30 ½ 11.5-14.5, Type VIII, aircraft tires with various tread groove patterns and rubber compounds. NASA Technical Paper, 1977, 100: 1.
- Araujo-Morera J., Verdejo R., López-Manchado M.A., Santana M.H. Sustainable mobility: the route of tires through the circular economy model. Waste Management, 2021, 126: 309-322 (doi: 10.1016/j.wasman.2021.03.025).
- Ahrends A., Hollingsworth P.M., Ziegler A.D., Fox J.M., Chen H., Su Y., Xu J. Current trends of rubber plantation expansion may threaten biodiversity and livelihoods. Global Environmental Change, 2015, 34: 48-58.
- Amerik A.Yu., Martirosyan L.Yu., Martirosyan V.V., Martirosyan Yu.Ts. Parthenium argentatum A. Gray, Taraxacum kok-saghyz L.E. Rodin, and Scorzonera tau-saghyz Lipsch. et Bosse as alter-native sources of natural rubber: do we really need them? Sel'skokhozyaistvennaya Biologiya [Ag-ricultural Biology], 2022, 57(1): 3-26 (doi: 10.15389/agrobiology.2022.1.3eng).
- Amerik A.Yu., Martirosyan Yu.Tc., Gachok I.V. Regulation of natural rubber biosynthesis by proteins associated with rubber particles. Russian Journal of Bioorganic Chemistry, 2018, 44(2): 140-149 (doi: 10.1134/S106816201801003X).
- Amerik A.Y., Martirosyan Y.T., Martirosyan L.Y., Goldberg V.M., Uteulin K.R., Varfolo-meev S.D. Molecular genetic analysis of natural rubber biosynthesis. Russian Journal of Plant Physiology, 2021, 68(1): 31-45 (doi: 10.1134/S1021443721010039).
- Ramirez-Cadavid D.A., Cornish K., Michel Jr F.C. Taraxacum kok-saghyz (TK): Compositional analysis of a feedstock for natural rubber and other bioproducts. Industrial Crops and Products, 2017, 107: 624-640 (doi: 10.1016/j.indcrop.2017.05.043).
- Прокофьев А.А. Распределение каучука в корнях тау-сагыза. Советские каучуки, 1934, 3: 4.
- Cherian S., Ryu S.B., Cornish K. Natural rubber biosynthesis in plants, the rubber transferase complex, and metabolic engineering progress and prospects. Plant Biotechnology Journal, 2019, 17(11): 2041-2061 (doi: 10.1111/pbi.13181).
- Мартиросян Л.Ю., Мартиросян Ю.Ц., Варфоломеев С.Д., Гольдберг В.М. Способ аэропонного выращивания каучуконосного растения кок-сагыз Taraxacum kok-saghyz R. Патент РФ № 2779988. Опубл. 16.09.2022. Бюл. № 26.
- Кутузова С.Н., Петросян И.А. Морфо-биологическое изучение кок-сагыза из коллекции ВИР. Труды по прикладной ботанике, генетике и селекции, 2011, 167: 125-132.
- Кутузова С.Н., Брач Н.Б., Конькова Н.Г., Гаврилова В.А. Taraxacum kok-saghyz (Asteraceae, Compositae) — источник ценного растительного сырья для резиновой, пищевой и фармацевтической промышленности. Междисциплинарный научный и прикладной журнал «Биосфера», 2015, 7(3): 391-401.
- Prioul J.L., Chartier P. Partitioning of transfer and carboxylation components of intracellular resistance to photosynthetic CO2 fixation: a critical analysis of the methods used. Annals of Botany, 1977, 41(4): 789-800 (doi: 10.1093/oxfordjournals.aob.a085354).
- Junior-PAM chlorophyll fluorometer: operator’s guide /E. Pfündel (ed.). Germany, Heinz Walz GmbH, 2007.
- Гольцев В.Н., Каладжи Х.М., Кузманова М.А. Аллахвердиев С.И. Переменная и замедленная флуоресценция хлорофилла а — теоретические основы и практическое приложение в исследовании растений. Ижевск-М., 2014.
- Воробьев В.Н., Якушенкова Т.П., Воробьев Г.В. Практикум по физиологии и биохимии растений. Фотосинтез. Казань, 2013.
- McCleary B.V., McLoughlin C. Measurement of available carbohydrates in cereal and cereal products, dairy products, vegetables, fruit and related food products and animal feeds. Journal of AOAC INTERNATIONAL, 2021, 104(6): 1465-1478 (doi: 10.1093/jaoacint/qsab019).
- Ramirez-Cadavid D.A., Valles-Ramirez S., Cornish K., Michel Jr. F.C. Simultaneous quantification of rubber, inulin, and resins in Taraxacum kok-saghyz (TK) roots by sequential solvent extraction. Industrial Crops and Products, 2018, 122: 647-656 (doi: 10.1016/j.indcrop.2018.06.008).
- Nelson N. A photometric adaptation of the somogyi method for determination of glucose. J. Biol. Chem., 1944, 153: 375-380.
- Войцеховская О.В. Фитохромы и другие (фото)рецепторы информации у растений. Физиология растений, 2019, 66(3): 163-177 (doi: 10.1134/S0015330319030151).
- Whitted M.G., Geher J.F., Benko A.D., Crvin A.M., Chotani K.G., Mcauliffe C.J., LaDuca J.R., Ben-Shoshan A.E., Sanford J.K. Technology update: development of a gas-phase bioprocess for isoprene-monomer production using metabolic pathway engineering. Industrial Biotechnology, 2010, 6(3): 152-163 (doi: 10.1089/ind.2010.6.152).
- Lange I., Poirier B.C., Herron B.K., Lange B.M. Comprehensive assessment of transcriptional regulation facilitates metabolic engineering of isoprenoid accumulation in Arabidopsis. Plant Phys-iology, 2015, 169(3): 1595-1606 (doi: 10.1104/pp.15.00573).
- Lastdrager J., Hanson J., Smeekens S. Sugar signals and the control of plant growth and devel-opment. Journal of Experimental Botany, 2014, 65(3): 799-807 (doi: 10.1093/jxb/ert474).
- Ruan Y.L. Sucrose metabolism: gateway to diverse carbon use and sugar signaling. Annual Review of Plant Biology, 2014, 65: 33-67 (doi: 10.1146/annurev-arplant-050213-040251).
- Воскресенская Н.П. Регуляторная роль синего света в фотосинтезе. В кн: Физиология фотосинтеза. М., 1982: 203-220.
- Spalholz H., Hernández R. Transplant lettuce response to different blue:red photon flux ratios in indoor LED sole-source lighting production. Acta Horticulturae, 2018, 1227: 555-562 (doi: 10.17660/ActaHortic.2018.1227.70).
- Мартиросян Ю.Ц., Мартиросян Л.Ю., Кособрюхов А.А. Динамика фотосинтетических процессов в условиях переменного спектрального облучения растений. Сельскохозяйственная биология, 2019, 54(1): 130-139 (doi: 10.15389/agrobiology.2019.1.130rus).


