Биосинтез над коринеподобными бактериями
Автор: Санданов А.А., Цыренов В.Ж., Островский Д.Н.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Персоналии
Статья в выпуске: 2 (29), 2010 года.
Бесплатный доступ
В статье рассмотрен процесс биосинтеза НАД различными коринеподобными бактериями. Уста- новлен наиболее эффективный продуцент НАД. Определен выход продукта
Над, биосинтез
Короткий адрес: https://sciup.org/142148033
IDR: 142148033 | УДК: 615.9+577.472(28):614+577.4
Текст научной статьи Биосинтез над коринеподобными бактериями
Нуклеотиды и нуклеотидные коферменты - никотинамидадениндинуклеотид (НАД и его производные) являются ценными биологически активными веществами, которые находят широкое применение в медицине в качестве лекарств и незаменимых компонентов диагностикумов [1]. Нуклеотиды также широко используются в качестве вкусовых добавок [2, 3]. Перспективным методом получения нуклеотидов и нуклеотидных коферментов является de-novo- и salvage (сэлвидж) - синтезы, осуществляемые штаммами-продуцентами из группы коринеподобных бактерий. Эти организмы находят применение за рубежом в промышленности для ферментации нуклеотидов методом de-novo- синтеза нуклеотидов. В России микробиологический синтез нуклеотидов и НАД в настоящее время не осуществляется, нет производства этих соединений. Сэлвидж-синтез все еще остается мало исследованным методом. За рубежом в настоящее время осуществляются интенсивные биохимические и генетические исследования коринеподобных бактерий, проводятся работы по созданию штаммов продуцентов сэлвидж-синтеза [1, 4]. Поэтому исследования, посвященные изучению микробиологического синтеза упомянутых выше соединений, являются актуальными. В данной работе приведены сравнительные исследования различных штаммов коринеподобных бактерий на предмет возможности их использования в качестве биологических объектов для постановки микробиологического синтеза НАД. Ранее был осуществлен синтез НАД с помощью Corynebacterium ammoniagenes АТСС 6872, который в данной работе был использован в качестве контрольного биологического объекта [5].
Материалы и методы
Микроорганизмы, хранение и культивирование .
Объектом исследования явились штаммы коринебактерий Corynebacterium ammo-niagenes ВСТИ 403, Corynebacterium flavum ВСТИ 301, Corynebacterium species ВСТИ 4, коллекция кафедры биотехнологии ВСГТУ, коллекция ФГУП «ГосНИИгенетика». Cory-nebacterium ammoniagenes ATCC 6872 коллекция института биохимии им. А.Н.Баха, а также типичные представители родов коринеподобных бактерий Arthrobacter citreus 278,
Corynebacterium insidiosum 246, Corynebacterium stationis 336, Corynebacterium linens 242, Rhodococcus globerulus 226.
Длительное хранение штамма (до 6 месяцев) проводилось под слоем вазелинового масла. Культуру после 2 суток роста при 30°С на скошенном мясопептонном агаре МПА заливали маслом на 1 см выше края питательной среды и сохраняли при 4°С. До двух недель штамм можно хранить в этих условиях без заливки маслом. Пересев производили каждые 1,5-2 месяца. Петлей брали материал из-под масла, производили разведение клеток в стерильном физиологическом растворе. Для приготовления посевного материала использовался только свежепересеянный косяк, выращенный в течение суток при 30°С.
Подготовка питательной среды.
Посевная среда [6] содержала: 20 г D-глюкозы моногидрат, 10 г казеинового пептона, 10 г дрожжевого экстракта и 2,5 г NaCl на 1 л воды. Перед стерилизацией pH доводили до 7,2 3 н. NaOH. Инокулят (10%) готовили на посевной среде. Культуру микроорганизмов объемом по 50 мл выращивали в колбах Эрленмейера объемом 750 мл.
Ферментационная среда [7] в 1 л содержала: 100 г глюкозы моногидрата, 10 г дрожжевого экстракта, 10 г КН 2 РО 4 , 10 г К 2 НРО 4 , 10 г МgSO 4 ∙7Н 2 О; 6 г мочевины, стерилизованной отдельно и биотин (30 мкг/л) добавляли после фильтрации, начальный pH 7,4. Для удовлетворения потребности C.ammoniagenes в марганце в эту среду добавляли 2 мкМ MnCl 2 .
Среду по 50 мл разливали в качалочные колбы на 750 мл, доводили pH 5 н. NaOH до 7,6 и стерилизовали в течение 15 мин при 1 атм. Мочевину стерилизовали отдельно при 0,5 атм в течение 15 мин и добавляли в колбы (0,6%) после стерилизации. Биотин стерилизовали пропусканием через 0,22 мкм фильтр и добавляли в колбы в количестве 30 мкг/л. Фосфаты (K 2 HPO 4 + KH 2 PO 4 ) готовили отдельно и добавляли в колбы к основной части ферментационной среды.
Условия ферментации.
Культуру с 2-суточного косяка петлей переносили в 50 мл посевной среды и помещали на круговую качалку (220 об/мин). После суток роста при температуре 30±1°С посевной культурой в количестве 10 об % инокулировали среду для биосинтеза. Для осуществления сэлвидж-синтеза в среду для биосинтеза добавляли предшественники: аденин и никотинамид по 2 мг/мл соответственно на вторые сутки ферментации. Продолжительность ферментации составляла 2-4 суток.
Определение роста
Наблюдения за ростом клеток проводили измерением оптической плотности при 578 нм. Отбирали 1 мл аликвоту культуральной жидкости, разбавляли её 3 мл дистиллированной воды и добавляли 100 мкл 2 н. HCl с целью растворения осажденных кристаллов. Для предотвращения слипания клеток бактерий добавляли 5 мкл Твин 80 (20% вес/объем). Осадок после низкоскоростного центрифугирования ресуспендировали в 1 мл дистиллированной воды и измеряли мутность. Для вычисления сухого веса пользовались калибровочной кривой.
Идентификация и количественное определение НАД и нуклеотидов
Идентификацию и количественное определение НАД и нуклеотидов осуществляли после отделения клеток на низкоскоростной центрифуге. Высокопроизводительная жидкостная хроматография (ВЭЖХ) НАД с градиентной элюцией выполнялась по методу [4] с использованием хроматографа Agilent 1100 (производство США), оснащенного ультрафиолетовым детектором переменной частоты, установленным на 254нм. Сольвент А содержал 20 мл концентрированной фосфорной кислоты в 800 мл деионизованной воды с доведенным до 4,0 pH с помощью 25% NaOH, и объемом, доведенным водой до 1 л. Сольвент B содержал равные объемы ацетонитрила и метанола. Все реактивы фильтровали через фильтр (5 мкм). Нуклеотиды элюировали при 370С на колонке C18 5μ. Для использования в качестве стандартов в сольвенте А растворяли рибонуклеотиды 5`-АМФ и АТФ (0,1М стандартный раствор). Скорость элюции во всех опытах устанавливали 0,7 мл/мин.
В течение первых 5 минут элюция была изократической (100% сольвент А), затем в течение 15 минут следовал линейный градиент (85% сольвент А и 15% сольвент Б). Затем подвижная фаза вновь устанавливалась на 100% сольвента А в течение 5 минут. Новый образец наносили после уравновешивания 100% сольвентом А в течение 15 минут.
0,2 мл культуральной жидкости разбавляли водой до 2 мл и центрифугировали при 4000 g в течение 15 минут. Содержание НАД в полученном супернатанте определяли ферментативным методом с дрожжевой алкогольдегидрогеназой. Реакционная смесь имела следующий состав: 0,5 мл разбавленного образца; 0.1 М Na-пирофосфатного буфера (pH 8,8), содержащего 5 мг/мл семикарбазида; 1,5 мл дистиллированной воды; 0,02 мл этанола; 0,02 мл алкогольдегидрогеназы, растворенной в 2,4М растворе сернокислого аммония в концентрации 1мг/мл. Оптическая плотность раствора измерялась при 340 нм сначала без фермента, затем добавляли алкогольдегидрогеназу и через 5 минут вновь измеряли оптическую плотность при той же длине волны. Количество НАД рассчитывали по формуле:
C = ^D • 8,54 , где С - количество НАД (мг/мл); ΔD - разница между поглощением раствора после и до добавления фермента; число 8,54 учитывает коэффициент молярной экстинкции НАД, его молекулярный вес и разведение образца.
Результаты
При микробиологическом синтезе метаболитов важную роль играет уровень и кинетика накопления биомассы, поэтому исследован рост клеток в процессе ферментации. Измерения проводились для каждой культуры, в 3-кратной повторности, согласно методу, описанному выше.
Формы кривых роста у испытуемых бактерий были аналогичными. Наибольший рост был показан у C.ammoniagenes ВСТИ 403, а наименьший – у Arthrobacter citreus 278. В качестве факторов роста для микроорганизмов исследовано влияние дрожжевого экстракта, мясного экстракта, кукурузного экстракта и пептона. Показано что лучшие результаты достигаются при использовании мясного экстракта в концентрации 0,2 % (см. рис. 1).
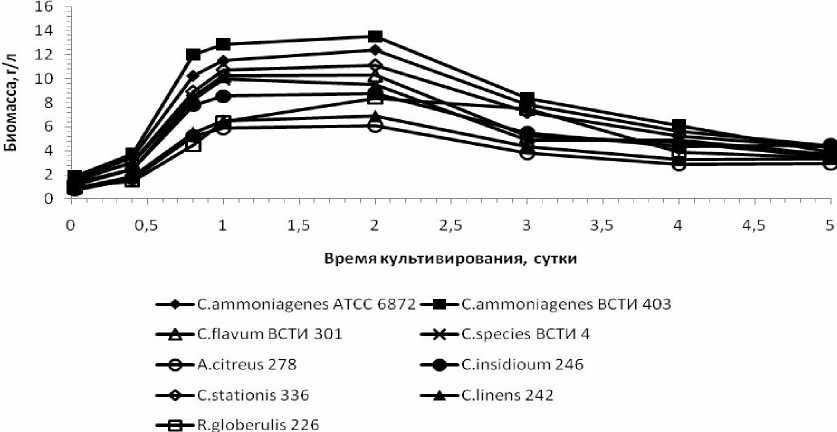
Рис. 1. Рост микроорганизмов при культивировании в ферментационной среде, содержащей в качестве ростового фактора мясной экстракт
На рисунке 2 показано изменение pH при ферментации НАД. Как следует из данного рисунка, в процессе ферментации НАД происходит постепенное увеличение значений pH, начиная с 7,2 до 8,4 у C.species ВСТИ 4 и 8,6 – у C. ammoniagenes ВСТИ 403.
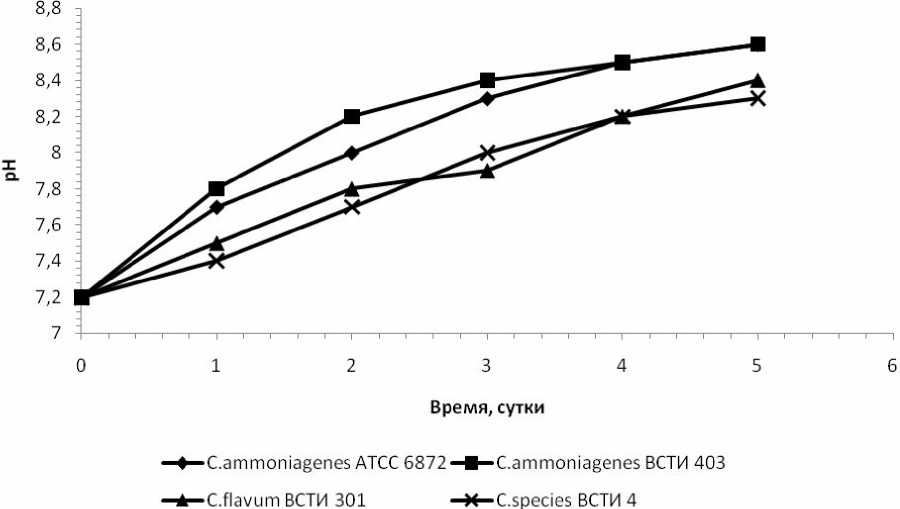
Рис. 2. Изменение pH при ферментации НАД
Была проведена хроматография стандартного раствора НАД, приготовленного из препарата ICN biochemicals (США). На рисунке 3 показан профиль ВЭЖХ стандартного раствора НАД на хроматографе Agilent 1100.
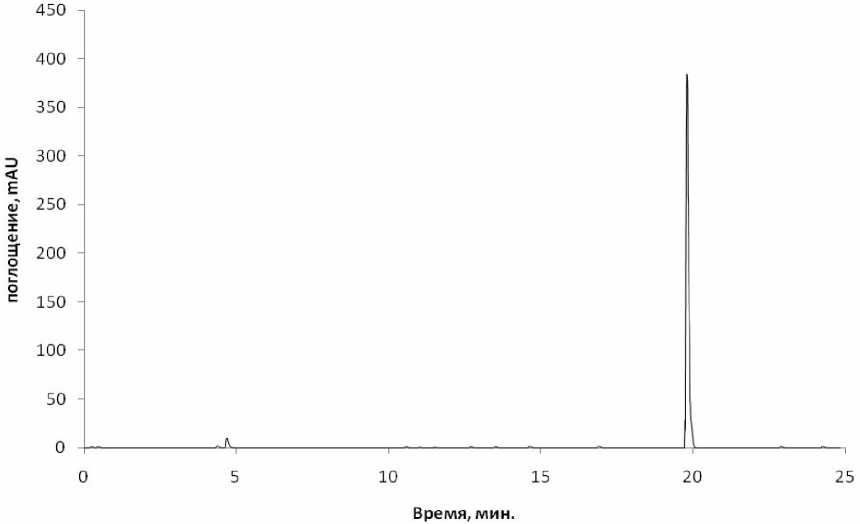
Рис.3. Хроматограмма стандартного раствора НАД. На колонку C18 5μ нанесен
1 мкг НАД ICN Biochemicals.
На рисунке 4 показан профиль культуральной жидкости C. ammoniagenes ВСТИ 403 на вторые сутки после внесения предшественников.
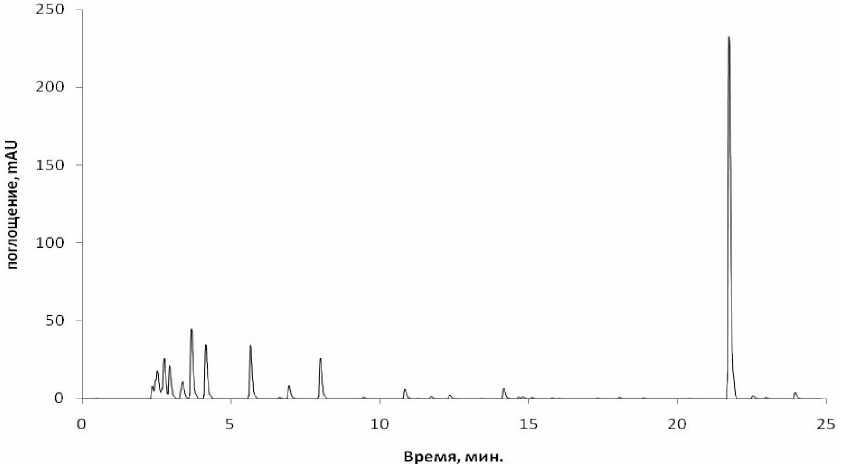
Рис. 4. Хроматограмма культуральной жидкости C.ammoniagenes ВСТИ 403 через 48 часов после внесения предшественников
Предварительное исследование продуцентов НАД и выбор из них штамма для дальнейших исследований.
Была проверена способность культур - представителей родов коринеподобных бактерий к сэлвидж-синтезу НАД. Опыты проводились по схеме, описанной Nara et. al [6, 8]. Аденин и никотинамид вносились в конце логарифмической фазы роста каждой культуры. В это же время в среду добавлялся ксилол в количестве 1% (об/об) для повышения проницаемости бактериальных мембран.
Испытаны и изучены следующие микроорганизмы: Corynebacterium ammoniagenes АТСС 6872, выделенные на кафедре биотехнологии ВСГТУ, штаммы C. ammoniagenes ВСТИ 403, С. flavum ВСТИ 301, C. species 4, а также исследованы типичные представители родов коринеподобных бактерий Arthrobacter citreus 278, Corynebacterium insidiosum 246, Corynebacterium stationis 336, Corynebacterium linens 242, Rhodococcus globerulus 226.
В ферментациях было испытано по шесть колоний каждой культуры. В таблице 1 приведены результаты ферментаций с мясным экстрактом.
Проводились испытания мясного экстракта свежего приготовления в концентрации 0,2% в качестве компонента ферментационной среды. Приводятся средние результаты 12 повторностей (6 колоний по 2 колбы).
Таблица 1
Биосинтез НАД коринеподобными бактериями при использовании мясного экстракта (в концентрации 0,2%) в качестве фактора роста
|
Микроорганизмы |
Выход НАД мг/мл |
|
С.Ammoniagenes ATCC 6872 |
1,1±0,1 |
|
С. Ammoniagenes ВСТИ 403 |
1,3±0,1 |
|
C. flavum ВСТИ 301 |
0,5±0,05 |
|
C. ammoniagenes ВСТИ 3 |
0,1±0,01 |
|
A.citreus 278 |
0,05±0,01 |
|
C.insidiosum 246 |
0,08±0,01 |
|
C.stationis 336 |
0,1±0,01 |
|
C.linens 242 |
0,05±0,01 |
|
R.globerulus 226 |
0,03±0,005 |
Оказалось, что способностью к сэлвидж-синтезу НАД, наряду с продуцентом C.ammoniagenes ATCC 6872, обладали также С. ammoniagenes ВСТИ 403, C. flavum ВСТИ 301. Причем штамм С. ammoniagenes ВСТИ 403 обладал несколько большей синтетической активностью. Остальные культуры синтезировали следовые количества НАД по сэл-видж-пути.
Однако было замечено, что четкой корелляции между выходом НАД и накоплением сухого веса нет. Изучено накопление целевого продукта у микроорганизмов в различные сроки ферментации.
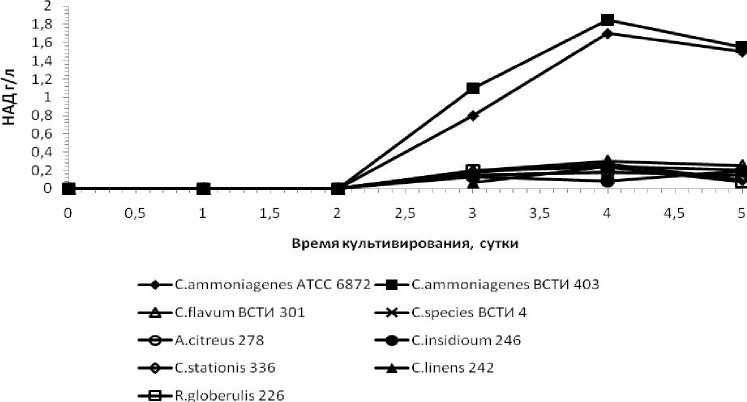
Рис. 5. Динамика накопления НАД в различные сроки ферментации коринеподобными бактериями
Из рисунка 5 следует, что наибольшее накопление НАД происходит в случае использования C. ammoniagenes ВСТИ 403 и C. ammoniagenes АТСС 6872 на 4-е сутки ферментации. Остальные испытуемые организмы обладали незначительным накоплением НАД в этих условиях ферментации.
В следующей серии опытов изучено накопление НАД в условиях более длительных сроков ферментации с использованием C. ammoniagenes ВСТИ 403, C. ammoniagenes 6872 и C. flavum ВСТИ 301.
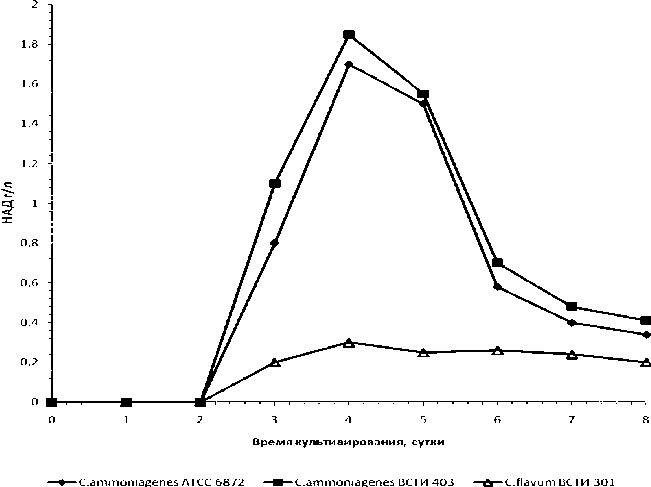
Рис. 6. Динамика биосинтеза НАД коринеподобными бактериями
Заключение
Испытаны на продуктивность биосинтеза НАД различные штаммы коринеподоб-ных бактерий. Установлено, что наибольший выход НАД обеспечивал штамм C.ammoniagenes ВСТИ 403.


