Биотехнологические аспекты сохранения редких видов на примере Iris sibirica L
Автор: Тихомирова Людмила Ивановна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Рассмотрено использование методов биотехнологии для сохранения Iris sibirica L. Данный вид включен в региональные Красные книги Алтайского и Ставропольского краёв, Омской, Тверской, Тюменской областей как редкий, встречающийся в немногих местах.
Культура ткани, биотехнологии, редкие виды, микроклональное размножение
Короткий адрес: https://sciup.org/148202074
IDR: 148202074 | УДК: 575:631.527
Текст научной статьи Биотехнологические аспекты сохранения редких видов на примере Iris sibirica L
Ареал Iris sibirica L. необычайно огромен: с запада на восток от северных областей Италии и востока Швейцарии вплоть до озера Байкал. Самые северные его популяции встречаются в южных областях Архангельской области и республики Коми, а самые южные - на Кавказе и в северной Турции. Ирисы сибирские – перспективные многолетние растения с высокими декоративными качествами.
Данный вид включен в региональные Красные книги в Алтайском и Ставропольском краях, Омской, Тверской, Тюменской областях как редкий, встречающийся в немногих местах. Две популяции находятся под защитой Висимского и Полистов-ского заповедников [1].
В отделе биотехнологии Южно-Сибирского ботанического сада Алтайского государственного университета создана коллекция лекарственных, садовых и редких видов растений, сохраняемых в культуре in vitro . Такие коллекции не только способствуют депонированию ценных генотипов, но и являются основой для изучения процессов морфогенеза и регенерации в культуре ткани для разработки биотехнологий на их основе.
Цель работы – разработать элементы биотехнологии для сохранения и размножения I. sibirica L.
Экспериментальные работы с использованием метода культуры тканей были проведены по общепринятым методикам [2]. Растительные ткани культивировали на питательных средах МS [3]. Питательные среды дополняли фитогормонами цитокининового типа действия 6-бензиламинопурином (БАП) и ауксинового типа действия α-нафтилуксусной кислотой (НУК).
При микроразмножении использовали питательные среды, содержащие 2.5, 5, 7.5 и 10 мкм БАП. Микропобеги культивировали по следующим схемам: а) пассажи без чередования сред; б) пассажи с чередованием сред с высокой концентрацией цитокинина и низкой (1 мкМ БАП). В качестве контроля была использована питательная среда,
содержащая 1 мкМ БАП. Для культуры зародышей использовали питательную среду, содержащую 6 мкМ БАП + 5 мкМ НУК, дополненную L-глутамином и аденинсульфатом в количестве 100 мг/л.
Основными показателями, определяющими эффективность размножения, служили число микропобегов (пазушных и адвентивных), образовавшихся de novo в течение одного пассажа, и их длина. Показателями ризогенеза были число корней, их длина и общая длина корней (произведение числа и средней длины корней). Растения выращивали в лабораторных условиях при искусственном освещении (2000-4000 лк) в условиях фотопериода 16/8 час свет/темнота и при температуре 24-260С.
Анатомическое строение эксплантов изучали на постоянных препаратах, изготовленных по общепринятой методике [4] в нашей модификации.
Традиционно для введения в культуру in vitro дикорастущих видов в качестве эксплантов используют семена [5-6]. В данной работе использованы почки вегетативных побегов, фрагменты цветка и эмбриокультура.
Определён срок введения в культуру in vitro для зародышей ириса ̶ 50-80 сут. Отработан способ стерилизации растительного материала, который обеспечивал на 90% стерильность зародышей и 100% их жизнеспособность. На всех испытанных питательных средах растения ириса имели хорошо развитые листья, а иногда и корни. На среде с 6 мкМ БАП + 5 мкМ НУК, дополненной L-глутамином и аденинсульфатом в количестве 100 мг/л, у зародышей I. sibirica формировались адвентивные побеги. Использование вегетативных почек в качестве эксплантов для введения в культуру in vitro для I. sibirica неэффективно ввиду их высокой инфицированности и низкой регенерационной способности. Высоким морфогенетическим потенциалом обладали экспланты органов цветка. Формирование побегов происходило путём прямой регенерации, минуя каллусную культуру, на средах с 6-8 мкМ БАП и 3-5 мкМ НУК, где содержание цитокининов превышает содержание ауксинов в 1,2 раза и более [7].
На этапе собственно микроразмножения важным является правильный подбор и оптимальная концентрация фитогормонов. Использование БАП показало его высокую эффективность на регенерационную способность ириса сибирского. При наличии в питательной среде этого гормона в широком диапазоне концентраций от 1 до 10 мкМ, регенеранты характеризовались хорошим развитием. При этом БАП влиял как на коэффициент размножения, так и на длину побегов. В концентрации от 1 мкМ до 7,5 мкМ гормональный препарат влиял на число адвентивных побегов, изменяя их от 1 до 6 штук на эксплант за один пассаж. Высокие концентрации БАП (выше 10 мкМ) снижали количество образующихся побегов и вызывали их уродливость.
На всех этапах развития растений в культуре ткани основной задачей является оптимизация питательных сред и схем культивирования для создания условий роста, приближенных к естественным для данного вида. Анатомическое исследование органов регенерантов в сравнении с органами интактных растений позволяет на тканевом уровне определить состояние растений в зависимости от состава питательных сред и подобрать условия для нормального развития регенерантов.
Сравнительное изучение анатомической структуры корневища ириса в культуре in vitro показало, что культивирование на агаровых питательных средах приводит к сокращению площади сечения поперечного среза корневища, уменьшению объёма коровой паренхимы и увеличению доли тканей центрального цилиндра. Вероятно, это свидетельствует об усилении проводящей роли корневища в культуре in vitro и снижении запасающей, в связи с постоянным минеральным и гормональным составом питательной среды и отсутствием влияния сезонных природных явлений.
При изучении анатомического строения побегов I. sibirica, выращенных на питательных средах с разной концентрацией фитогормона, были отмечены особенности, связанные с культивированием в условиях in vitro и содержанием сред. Большое влияние на развитие побегов оказывали концентрация БАП в питательной среде. У побегов, выросших на средах с минимальной концентрацией БАП 1,0 мкМ, цитоплазма клеток была более интенсивно окрашена, плотная, центральный цилиндр занимал ½ часть побега. Регенерационная деятельность слабая, в основном присутствовало корнеобразова-ние. У побегов, выросших на средах с максимальным содержанием БАП (10,0 мкМ), клетки паренхимы были слабо окрашены, геммогенез отмечался в слабой степени, центральный цилиндр занимал 2/3 части побега (рис. 1).
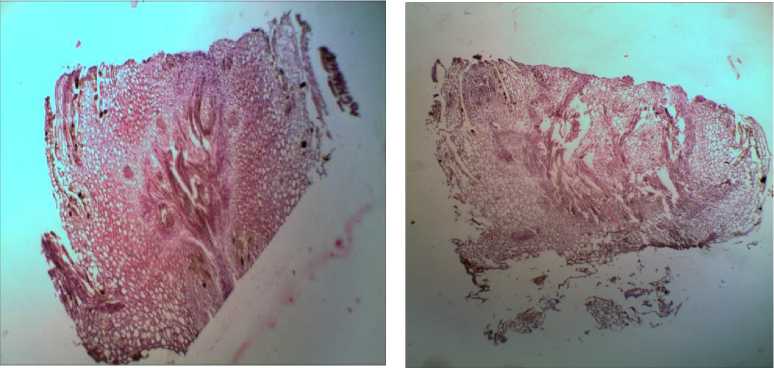
а) б)
Рис. 1. Внутреннее строение побега I. sibirica (продольный срез) на питательной среде MS, содержащей: а) 1,0 мкМ, б) 10,0 мкМ БАП. Увел. ×100
Активный геммогенез можно было наблюдать, если для культивирования микропобегов I. sibirica использовали схему с чередованием сред с высокой и низкой концентрацией цитокинина (БАП). Введение в среды высоких концентраций цитокинина вызывало массовое появление полиад (группы делящихся клеток под общей оболочкой) в центральном цилиндре побега. В том случае, если гормональная нагрузка оставалась на прежнем уровне, полиады, по-видимому, разрушались и формирования меристематических комплексов не происходило. Снижение концентрации БАП до 1,0 мкМ в последующем пассаже не приводило к его накопле- нию в тканях выше физиологической нормы. Растительный организм имел время для инактивации и разрушения гормона, это давало возможность полиадам приступить к образованию массива меристематических клеток, из которого впоследствии дифференцировались многочисленные побеги. Одновременно с этим материнский побег формировал свою проводящую систему, обеспечивающую в необходимой мере дочерние побеги питанием. Анатомическое строение материнских побегов при чередовании сред значительно отличалось от строения побегов, выращенных без чередования.
При гистологическом анализе побегов, вырос- ших при чередовании сред, было отмечено: эпидермальные клетки плотно сомкнуты, таблитчатой формы. Внешняя поверхность побега неровная, на поперечном срезе располагалась в виде извилистой линии. В первичной коре паренхимные клетки рас- полагались плотно. Склеренхима просматривалась отдельными фрагментами. Отмечали массу делящихся клеток в районе перицикла и в центральном цилиндре. Практически во всех пазухах листьев закладывались почки и развивались побеги (рис. 2).
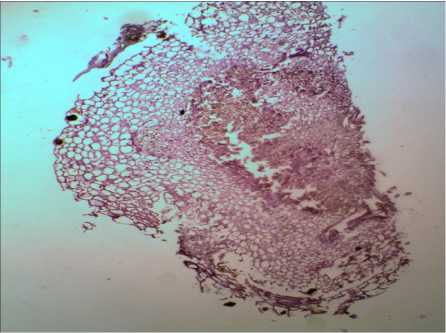
а)
Рис. 2. Внутреннее строение побега I. sibirica на питательной среде MS, содержащей 10,0 мкМ БАП: а) без чередования сред, б) с чередованием сред. Увел. ×100
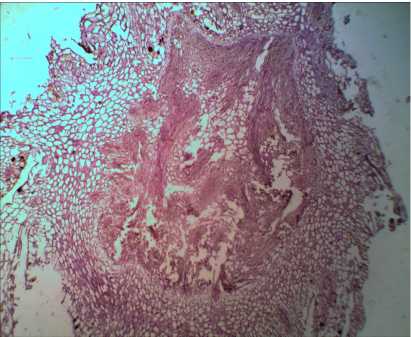
б)
Снятие гормональной нагрузки цитокинина в процессе чередования сред положительно влияло в дальнейшем на укоренение побегов. Было отмечено, что высота у этих растений при укоренении увеличилась на 28,6%, число корней – на 71,6%, длина корней – на 24,4%, а суммарная длина корней увеличилась вдвое (рис. 3). Также было выявлено, что на эффективность процесса ризогенеза на этапе адаптации оказывают влияние концентрации цитокинина, присутствующие в питательных средах на этапе собственно микроразмножения. Для I. sibirica максимальные значения числа корней, их длины и соответственно общей длины корней определяли при концентрации БАП 2,5 мкМ. На средах с более высокой (5,0–10,0 мкМ) концентрацией цитокинина эти показатели были значительно ниже (табл.).
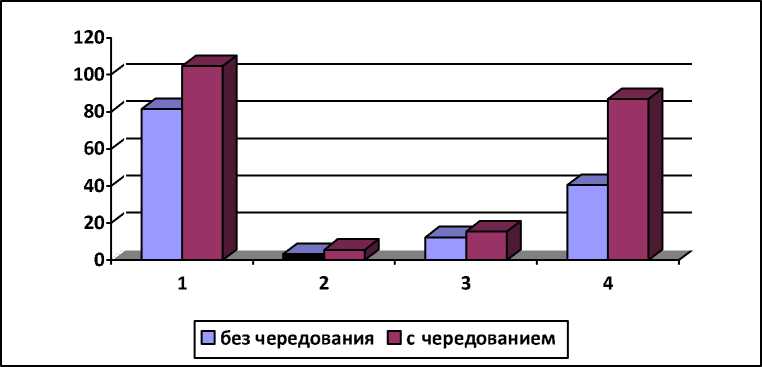
Рис. 3 . Влияние чередования сред с низким и высоким содержанием БАП на этапе размножения I. sibirica на процесс ризогенеза. 1. – высота растений при укоренении (мм), 2. – число корней, 3. – длина коней (мм), 4. – суммарная длина корней (мм)
Таблица . Влияние концентрации БАП на этапе собственно микроразмножения на прирост корней на этапе адаптации у I. sibirica
|
БАП мкМ , этапа собственно микроразмножения |
До адаптации |
После адаптации |
% прироста корней |
||||
|
число корней |
длина корней |
число корней |
длина корней |
||||
|
средняя, мм |
общая, мм |
средняя, мм |
общая, мм |
||||
|
2,5 |
4,0±0,43 |
10,71±0,82 |
42,84 |
4,83±0,25 |
12,92±1,0 |
62,4 |
31,34 |
|
5,0 |
2,4±0,51 |
9,08±1,81 |
21,79 |
2,6±0,55 |
10,6±1,71 |
27,56 |
20,94 |
|
7,5 |
2,0±0,25 |
8,91±0,18 |
17,82 |
2,0±0,15 |
11,5±2,37 |
23,0 |
22,52 |
|
10,0 |
2,0±0,21 |
4,5±0,86 |
9,0 |
2,0±0,19 |
5,0±0,19 |
10,0 |
10,0 |
Разработаны элементы биотехнологии для сохранения и размножения I. sibirica L.: подобраны оптимальные типы эксплантов, определены концентрации БАП на этапе собственно микроразмножения. На основании гистологического анализа доказана необходимость чередования высоких и низких содержаний БАП в питательных средах в процессе микроклонального размножения I. sibirica.
-
1. Алексеева Н.Б . Виды рода Iris во флоре России. Проблемы охраны в природе и интродукции: Автореф. дис. … канд. биол. наук. СПб., 2005. 23 с.
-
2. Калинин Ф.А., Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в физиологии и биохимии растений. Киев, 1980. 488 с.
-
3. Murashige T., Skoog F . A Revised Medium for Rapid Growth and Bioassay with Tobacco Tissue cultures // Phy-
siol. Plant. 1962. V. 15. № 4. Р. 473.
-
4. Барыкина Р.П., Веселова Т.Д., Девятов А.Г. и др. Справочник по ботанической микротехнике. Основы и методы. М.: МГУ, 2004. 312 с.
-
5. Ветчинкина Е.М., Мамаева Н.А. Некоторые аспекты использования культуры семян и зародышей in vitro для изучения и сохранения биоразнообразия рода Iris L. // Биоразнообразие природных и антропогенных экосистем: Сб. статей 3 молод. научн. семинара. Екатеринбург, 2005. С. 21-25.
-
6. Вайновская И.Ф., Фоменко Т.И. Разработка биотехнологических приёмов сохранения и размножения ириса сибирского ( Iris sibirica L.) сем. Iridaceae // Мат. междунар. конф., посв. 80-летию ЦБС НАН Беларуси. Т. 2. Минск, 2012. С. 384-388.
-
7. Тихомирова Л.И. Особенности индукции морфогенеза из различных фрагментов цветка ириса в культуре in vitro // Turczaninowia. 2010. № 13 (3). С. 147-151.
BIOTECHNOLOGICAL ASPECTS OF RARE SPECIES KEEPING ON THE EXAMPLE OF IRIS SIBIRICA L.
Altai State University, Barnaul
Application of biotechnological methods for keeping of Iris sibirica L. has been discussed. This species is included in regional Red books in the Altai and Stavropol Territories, Omsk, Tver, Tyumen regions as a rare, distributed very rarely, species.
Список литературы Биотехнологические аспекты сохранения редких видов на примере Iris sibirica L
- Алексеева Н.Б. Виды рода Iris во флоре России. Проблемы охраны в природе и интродукции: Автореф. дис. … канд. биол. наук. СПб., 2005. 23 с.
- Калинин Ф.А., Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в физиологии и биохимии растений. Киев, 1980. 488 с.
- Murashige T., Skoog F. A Revised Medium for Rapid Growth and Bioassay with Tobacco Tissue cultures//Physiol. Plant. 1962. V. 15. № 4. Р. 473.
- Барыкина Р.П., Веселова Т.Д., Девятов А.Г. и др. Справочник по ботанической микротехнике. Основы и методы. М.: МГУ, 2004. 312 с.
- Ветчинкина Е.М., Мамаева Н.А. Некоторые аспекты использования культуры семян и зародышей in vitro для изучения и сохранения биоразнообразия рода Iris L.//Биоразнообразие природных и антропогенных экосистем: Сб. статей 3 молод. научн. семинара. Екатеринбург, 2005. С. 21-25.
- Вайновская И.Ф., Фоменко Т.И. Разработка биотехнологических приёмов сохранения и размножения ириса сибирского (Iris sibirica L.) сем. Iridaceae//Мат. междунар. конф., посв. 80-летию ЦБС НАН Беларуси. Т. 2. Минск, 2012. С. 384-388.
- Тихомирова Л.И. Особенности индукции морфогенеза из различных фрагментов цветка ириса в культуре in vitro//Turczaninowia. 2010. № 13 (3). С. 147-151.


