Биотехнологические и молекулярно-генетические методы в селекции овощных культур (к 95-летию ВНИИССОК)
Автор: Шмыкова Н.А., Супрунова Т.П., Пивоваров В.Ф.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы, итоги
Статья в выпуске: 5 т.50, 2015 года.
Бесплатный доступ
Устойчивое наращивание конкурентоспособной сельскохозяйственной продукции при сокращении потребления ресурсов и затрат возможно за счет ускорения селекционного процесса. В связи с этим актуальное значение приобретают новейшие биотехнологические подходы и молекулярно-генетические методы. Клональное микроразмножение, андрогенез, гиногенез, генетическая трансформация широко применяются в сельскохозяйственных программах для расширения спектра формообразования, создания константных линий, ускорения процесса селекции (J.M. Dunwell, 2010). Методы андро- и гиногенеза дают возможность реализовать гаметоклональную изменчивость в индивидуальных растениях, обнаруживать редкие рецессивные аллели, создавать уникальные формы (T. Winkelmann с соавт., 2006). Один из способов получения исходного селекционного материала - межвидовая гибридизация, позволяющая передавать полезные признаки (например, устойчивость к биотическим и абиотическим стрессорам) от диких видов растений к культурным и расширять спектр генетической изменчивости (R. Hajjar с соавт., 2007). Преодоление проблем несовместимости при отдаленной гибридизации возможно за счет биотехнологических приемов. Использование молекулярно-генетических маркеров, выявляющих генетическое разнообразие на уровне ДНК, позволяет контролировать перенос хозяйственно ценных генов от одного организма к другому, проводить генотипирование, картирование и маркирование генов. Благодаря маркер-вспомогательной селекции можно подойти к решению таких практических задач, как поддержание генетических коллекций, подбор родительских форм для скрещивания, составление родословных сортов, их паспортизация и сертификация, защита интеллектуальной собственности селекционеров. Настоящий обзор посвящен 95-летию со дня основания Всероссийского НИИ селекции и семеноводства овощных культур (ВНИИССОК, Московская обл.). Обобщены результаты работы ВНИИССОК в области биотехнологии, молекулярной генетики и их практического использования в селекции овощных культур. С помощью методов отдаленной гибридизации в институте созданы новые сорта лука (Изумрудный, Сигма, Золотые Купола, Цепариус), салата (Изумрудный, Творец, Алекс, Коралл, Малахит), физалиса (Лакомка, Десертный). Ведутся исследования по вовлечению диких видов баклажана в селекцию, а также по межвидовой гибридизации моркови. Разработана технология создания исходного материала перца, устойчивого к вирусным заболеваниям. Активно разрабатываются способы культивирования тканей и клеток in vitro. Предложена технология клонального микроразмножения, позволяющая размножать растения капусты белокочанной с мужской стерильностью в неограниченных количествах. Технология клонального микроразмножения баклажана и перца легла в основу эмбриокультуры по спасению зародышей при межвидовой гибридизации. Оптимизировано культивирование пыльников моркови, благодаря чему созданы удвоенные гаплоидные сортообразцы. Разработана отечественная технология получения удвоенных гаплоидных линий перца через культуру пыльников (микроспор). Оптимизирован базовый протокол культуры микроспор рапса и созданы удвоенные гаплоидные линии капусты китайской, брокколи и капусты белокочанной. Разработаны методы получения удвоенных гаплоидов в культуре неопыленных семяпочек моркови, лука, огурца, кабачка, тыквы, свеклы столовой. Для изучения вариабельности геномов, генотипирования сортов и линий, определения чистоты гибридного потомства у овощных культур используется ISSR-, IRAP-, AFLP- и SSR-маркирование.
Межвидовая гибридизация, клональное микроразмножение, андрогенез, гиногенез, молекулярное маркирование
Короткий адрес: https://sciup.org/142134844
IDR: 142134844 | УДК: 635.1/.7:631.52:[573.6+577.2 | DOI: 10.15389/agrobiology.2015.5.561rus
Текст научной статьи Биотехнологические и молекулярно-генетические методы в селекции овощных культур (к 95-летию ВНИИССОК)
Грибовская овощная селекционная опытная станция, основанная в 1920 году, в 1971 году преобразована во Всероссийский НИИ селекции и семеноводства овощных культур (ВНИИССОК). В течение 95 лет здесь шло последовательное становление селекции овощных культур на научную основу в тесном взаимодействии с развитием биологических наук во всем мире. Еще в начале прошлого века в своих трудах Н.И. Вавилов отмечал,
Часть работ поддержаны грантами ГК ¹ 1282/13, ГК ¹ 566/13 Министерства сельского хозяйства РФ, ГК ¹ 16.М04.11.0004, ГК ¹ 14.М04.12.0013 Министерства образования и науки РФ, грантом РФФИ 08-04-13513-офи_ц.
что селекция как наука представляет собой синтез данных многих дисциплин, она взаимосвязана с генетикой, систематикой, эмбриологией, цитологией, экологией, биохимией, физиологией и технологией (1). На Гри-бовской станции уже через 10 лет после основания появились новые лаборатории теоретического профиля: лаборатория физиологии и биохимии (тогда же начаты исследования устойчивости растений к болезням) — в 1931 году, цитологии — в 1933, защиты растений — в 1943, генетики и цитологии (на базе лаборатория цитологии) — в 1972 году.
Важнейший метод обогащения генофонда растений — отдаленная гибридизация, посредством которой ценные признаки передаются от диких видов культурным. В мировой селекционной практике этому направлению уделяется большое внимание. За последние 20 лет от 60 диких видов в сорта различных сельскохозяйственных культур передано около 100 полезных признаков (2). В результате работ по отдаленной гибридизации, начатых на Грибовской овощной опытной селекционной станции в 1930-е годы, были созданы первые формы межвидовых гибридов лука между Allium cepa , A. fistulosum , A. vavilovii , A. oschaninii , A. schoenoprasum , A. nutans (3-6). На их основе получены сорта Изумрудный, Сигма, Золотые Купола, Цепариус, обладающие высокой устойчивостью к пероноспорозу и стабильно высокой урожайностью (7-9). Использование межвидовой гибридизации представителей рода Lactuca позволило выделить оригинальные формы с новыми морфологическими признаками и устойчивостью к альтернариозу, на основе которых созданы сорта салата Изумрудный, Творец, Алекс, Коралл, Малахит (10). От межвидовой гибридизации физалиса овощного Physalis longifolium (безалкалоидная мелкоплодная форма) и Ph. angulata (крупноплодная низкоалкалоидная форма) во ВНИИССОК получены сорта Лакомка и Десертный, характеризующиеся устойчивостью к абиотическим стрессорам, высоким содержанием сахаров, витамина С, пектина, отсутствием горечи (11-12). В исследованиях по вовлечению диких видов баклажана в селекцию (для передачи устойчивости к абиотическим стрессорам) с помощью метода эмбриокультуры in vitro получены межвидовые гибриды между Solanum melongena L., S . integrifolium L. и S . aethiopicum L., потомство оценено по морфологическим и хозяйственно ценным признакам, отобраны перспективные образцы (13, 14).
С использованием межвидовой гибридизации разработана технология создания исходного материала перца, устойчивого к вирусным заболеваниям. В гибридизацию были вовлечены виды Capsicum annuum L., C. frutescens L. и C. chinense L. При этом применялись как классические методы селекции и оценки полученного материала, так и биотехнологические (культивирование in vitro изолированных зародышей для преодоления несовместимости) и современные молекулярно-генетические подходы (молекулярный контроль на наличие R-генов резистентности у диких видов и межвидовых гибридов с помощью RGA-маркирования). В результате созданы линии перца, толерантные к вирусу бронзовости томата (TSWV): Л-(Здоровье ½ C. frutescens ); Л-(Здоровье ½ C. chinense ); Л-[Чаймс ½ ( C. annuum ½ С. frutescens )]; Л-( C. an-nuum ½ C. chinense ); Л-[ C. annuum ½ C. frutescens ) ½ Здоровье] (15) (работы поддержаны грантом ГК ¹ 1282/13 Министерства сельского хозяйства РФ — МСХ РФ). Исследования по межвидовой гибридизации моркови ведутся во ВНИИССОК последние 20 лет. Среди гибридного потомства от комбинаций скрещиваний Daucus carota ½ D. hispidifolius , D. carota ½ D. gi-ngidium , D. carota ½ D. carota ssp. libanotifolia и др. выделены формы с новым сочетанием высокой устойчивости к альтернариозу, интенсивно-оранжевым корнеплодом и другими признаками культурной моркови (10).
Создание и оценка межвидовых гибридов невозможны без цитоге- нетических исследований, которые проводятся во ВНИИССОК с привлечением высокоэффективных способов диагностики гибридных форм (флуоресцентная геномная in situ гибридизации — genomic in situ hybridization, GISH; fluorescence in situ hybridization — FISH) (16, 17).
В современной селекции одна из важнейших задач — быстрое достижение константности селекционного материала, что особенно актуально при создании гетерозисных гибридов, для которых требуются гомозиготные линии с высокой комбинационной способностью. Обычно такие линии получают при длительном инбридинге (в течение 5-10 поколений), но современные биотехнологические подходы позволяют сократить этот процесс почти вдвое. Из методов клеточных технологий наиболее востребованы клональное микроразмножение, андрогенез, гиногенез, генетическая трансформация, которые применяются в сельскохозяйственных программах для расширения спектра формообразования, создания константных линий с заданными признаками, ускорения селекции (18).
Методы андро- и гиногенеза позволяют реализовать гаметоклональную изменчивость в индивидуальных растениях, обнаруживать редкие рецессивные аллели, создавать уникальные формы. Клональное микроразмножение при условии высоких коэффициентов размножения и сохранении генетической стабильности может быть включено в селекционный процесс и занимает значимое место в мировой практике растениеводства (19). В селекции овощных культур это особенно важно для поддержания растений с мужской стерильностью или самонесовместимостью.
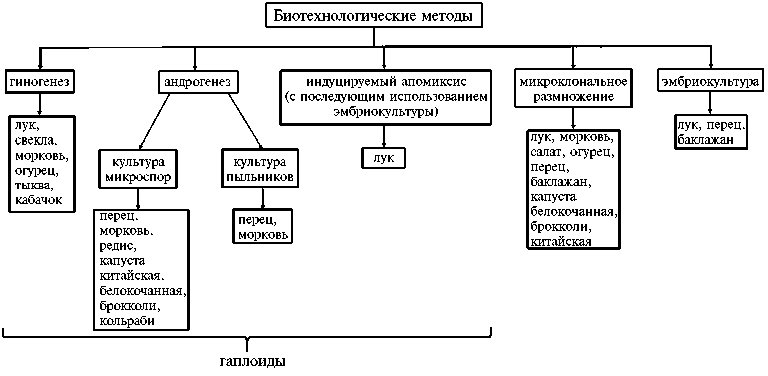
Биотехнологические методы, используемые при создании сортов сельскохозяйственных растений во Всероссийском НИИ селекции и семеноводства овощных культур (Московская обл.)
Во ВНИИССОК с конца 1980-х годов активно развиваются технологии культивирования тканей и клеток in vitro (рис.), начало которым положили работы по получению безвирусного посадочного материала чеснока в меристемной культуре (20). Использование оздоровленного чеснока в качестве посадочного материала способствует увеличению урожайности (максимальный прирост — 70 %) и широко применяется во всем мире (21). Безвирусный посадочный материал стахиса и якона также был получен через меристемную культуру (с термообработкой) и клональное микроразмножение (с использованием антибиотиков) (22, 23).
Число овощных культур, на которых в институте проводятся биотехнологические исследования, со временем увеличивалось. Совершенствовались методы клеточных технологий. Был оптимизирован способ клонального микроразмножения капусты цветной с использованием прифло-563
ральных меристем (24). В мировой практике первые исследования по клональному микроразмножению капустных культур приходятся на начало 1970-х годов, однако достичь высокого коэффициента размножения в пробирке не удавалось. Только в последнее десятилетие были разработаны эффективные методы клонального микроразмножения капусты китайской, брокколи и рапса (25-27). В лаборатории биотехнологии ВНИИССОК предложена технология клонального микроразмножения, позволяющая размножать растения капусты белокочанной с мужской стерильностью в неограниченных количествах (28) (грант ГК ¹ 566/13 МСХ РФ). Клональное микроразмножение может стать основой многих клеточных технологий. Так, у баклажана и перца разработанная нами технология клонального микроразмножения (29, 30) легла в основу эмбриокультуры по спасению зародышей при межвидовой гибридизации (31).
Получение удвоенных гаплоидов (DH-технологии) позволяет быстро создавать гомозиготные линии и ускорить селекционный процесс. К 2010 году в мировой практике с помощью DH-методов получены около 300 сортов (32). Однако на овощных культурах прием оказался менее эффективным, поэтому сейчас они стали объектами экспериментов по индукции гаплоидного эмбриогенеза (18, 33, 34). Первые удвоенные гаплоидные растения моркови и капусты белокочанной в культуре пыльников были получены в лаборатории биотехнологии ВНИИССОК в начале 1990-х годов (35, 36). Цитология эмбриогенеза в культуре пыльников моркови выявила закономерности образования эмбриоидов из микроспор; показано, что изменение плоидности начинается на ранних этапах формирования первичных эмбриоидов (37). Позднее культивирование пыльников моркови оптимизировали, были созданы удвоенные гаплоидные сортооб-разцы различного происхождения — НИИОХ 336, Витаминная, Московская зимняя А-515, Лосиноостровская 13, Леандр, Шантанэ 2461, Напе, Рондо, гибриды F1 Каратан, Калисто и др. Полученные растения-регенеранты обладают гаметоклональной изменчивостью, подтвержденной морфологическим и молекулярно-генетическим анализами (38).
В настоящее время в лаборатории биотехнологии совершенствуются способы получения удвоенных гаплоидов в культуре микроспор для различных овощных культур. Разработана отечественная технология создания удвоенных гаплоидных линий перца через культуру пыльников (микроспор) (39), на основе которой получены удвоенные гаплоиды разных сортов и межвидовых гибридов (40). Эта технология не уступает лучшим зарубежным аналогам для острого перца (41, 42). Работа была поддержана грантом Министерства образования и науки РФ (Минобрнауки РФ) ГК ¹ 16.М04.11.0004 и продолжена при финансировании Минобрнауки РФ (грант ГК ¹ 14.М04.12.0013). Созданы первые гибриды перца сладкого (Натали, Гусар) с участием удвоенных гаплоидных линий.
За рубежом активно развиваются технологии получения удвоенных гаплоидов в культуре микроспор овощных капустных культур (43-48). В лаборатории биотехнологии ВНИИССОК оптимизирован базовый протокол культуры микроспор рапса и созданы удвоенные гаплоидные линии капусты китайской (49), брокколи (линия БР 1-1) и капусты белокочанной, вовлеченные в создание гетерозисных гибридов.
Несмотря на многочисленные попытки получить удвоенные гаплоиды в культуре пыльников моркови (50-54), успехи в разработке технологии культивирования микроспор этой важной овощной культуры были достигнуты только в последние годы (55, 56). В нашем институте разрабатывается технология получения DH-растений в культуре микроспор мор-564
кови и выращены растения-регенеранты.
Для создания гаплоидных растений в селекции используется и женский гаметофит. Культивирование неопыленных завязей и семяпочек in vitro позволяет получать гаплоиды в случаях, когда культура пыльников или микроспор не дает положительных результатов. Иногда это единственный способ выделить DH-линии (например, у растений с цитоплазматической мужской стерильностью) (57). Наиболее разработаны методики культивирования неопыленных семяпочек лука (58-60), огурца (61, 62), свеклы столовой (63), тыквы (64), кабачка (65). Во ВНИИССОК подобные исследования ведутся на протяжении последних 20 лет. Существуют технологии получения удвоенных гаплоидов в культуре неопыленных семяпочек для моркови, лука, огурца, кабачка, тыквы, свеклы столовой (37, 66-69). По эффективности выхода удвоенных гаплоидных растений огурца разработанная в лаборатории методика превосходит зарубежные аналоги в несколько раз (68) (поддержано грантом РФФИ 08-04-13513-офи_ц).
В лаборатории биотехнологии также выполняется генетическая трансформация растений. В сотрудничестве c учеными филиала Института биоорганической химии РАН (г. Пущино) получены трансгенные растения моркови с генами GUS , дефензина Rs и тауматина II, выявлена экспрессия гена тауматина II в листьях и корнеплодах, отобраны семьи трансгенных растений, устойчивые к патогену Fusarium avenaceum (70).
За последние десятилетия благодаря значительному прогрессу в молекулярной генетике исследована физическая и функциональная организация геномов у многих сельскохозяйственных культур. Технологии молекулярного маркирования позволяют контролировать перенос хозяйственно ценных генов от одного организма к другому, способны ускорять и оптимизировать селекционный процесс (71). Системы молекулярного маркирования овощных культур начали разрабатываться во ВНИИССОК в 1990-х годах одновременно с мировым развитием ДНК-технологий. Если на начальном этапе для идентификации внутри- и межвидового полиморфизма использовали только RAPD-маркеры (random amplified polymorphic DNA) на томате, баклажане и луке (72-75), то в настоящее время во ВНИИССОК применяется ISSR- (inter-simple sequence repeat), IRAP- (inter-retrotransposon amplified polymorphisms), AFLP- (amplified fragment length polymorphism) и SSR-маркирование (simple sequence repeat) для изучения вариабельности геномов, генотипирования сортов (линий), определения чистоты гибридного потомства у томата, капусты, лука, петрушки, баклажана, перца и других овощных культур (76-81). Для поддержания и совершенствования коллекции сортов, охраны авторских прав, контроля подлинности сортового материала и сертификации семян составлены молекулярно-генетические паспорта сортов перца на основе мультилокусного маркирования (82). Показана возможность использования данных молекулярно-генетического анализа (AFLP и SSR) при подборе пар для получения гибридов с высоким эффектом гетерозиса, выделены перспективные гетерозисные гибридные комбинации перца сладкого с комплексом основных хозяйственно ценных признаков (83).
Во ВНИИССОК разработка и применение ДНК-маркеров для овощных культур носят в основном прикладной характер и направлены на идентификацию генетических доноров хозяйственно ценных признаков, один из которых — цитоплазматическая мужская стерильность (ЦМС), широко используемая для создания гибридов на стерильной основе. С помощью молекулярных SCAR-маркеров (sequence characterized amplified regions) идентифицированы митохондриальные гены coxII и atp6 , отвечающие за ЦМС, у образцов перца сладкого селекции ВНИИССОК и межвидовых гибридов 565
Capsicum frutescens и C. сhinense , полученных через эмбриокультуру (84).
Скрининг образцов лука репчатого из коллекции ВНИИССОК с помощью ПЦР-маркеров на митохондриальные гены orfА501 и cob позволил идентифицировать образцы со стерильной и фертильной цитоплазмой, а также определить типы стерильной цитоплазмы (S- или T-плазмо-тип), которые фенотипически не различаются (85). Выделенные образцы лука репчатого со стерильным S-плазмотипом рекомендованы для получения гибридов на основе ЦМС, поскольку система мужской стерильности у луков более проста в наследовании и устойчива в различных условиях окружающей среды (86). С использованием мультиплексной ПЦР идентифицирован тип стерильности у капусты белокочанной, брокколи, пекинской, редиса и дайкона, подобрана система праймеров, позволяющая выделять растения с типом цитоплазмы Ogura , Ogu-NWSUAF , nap , pol , cam , rad . Обнаружен новый подтип стерильной цитоплазмы Ogura у капусты белокочанной на основе расшифровки нуклеотидной последовательности orf138 (87).
Косвенный отбор на основе методов молекулярного маркирования делает возможным детектирование желаемых аллелей и гаплотипов уже на ранних стадиях развития растения, что существенно сокращает и упрощает селекционный процесс (88). Примером практического использования этого подхода стали маркеры для гена pun1 , отвечающего за остроту плодов перца ( C. annuum L.) (89). Скрининг расщепляющейся популяции от скрещивания сладкого и острого перцев, выполненный с помощью этого маркера, позволил уже на стадии проростка отобрать генотипы с желаемой комбинацией аллелей Pun1 / Pun1 (90).
Таким образом, результаты теоретических исследований по биотехнологии и молекулярной генетике, наряду с традиционными методами, используются для ускоренного решения селекционных задач, создания качественно новых сортов и гетерозисных гибридов овощных культур, сочетающих высокую продуктивность и качество с комплексной устойчивостью к наиболее опасным болезням, вредителям, абиотическим стрессорам.
Список литературы Биотехнологические и молекулярно-генетические методы в селекции овощных культур (к 95-летию ВНИИССОК)
- Вавилов Н.И. Избранные сочинения. Генетика и селекция. М., 1966.
- Hajjar R., Hodgkin T. The use of wild relatives in crop improvement: A survey of developments over the last 20 years. Euphytica, 2007, 156: 1-13 ( ) DOI: 10.1007/s10681-007-9363-0
- Кривенко А.А. Межвидовые скрещивания луков (Allium L.). Биологический журнал, 1937, 4(3): 289-297.
- Ершов И.И., Абрахина Ю.В. Межвидовая гибридизация репчатого и многолетних луков. Бюллетень Главного ботанического сада, 1966, 61: 16-19.
- Титова И.В., Тимин Н.И., Юрьева Н.А. Межвидовая гибридизация луков с целью получения форм, устойчивых к ложной мучнистой росе. Доклады ВАСХНИЛ, 1983, 8: 190-195.
- Шевченко Г.С., Полумордвинова И.В. Система цитологического контроля при отдаленной гибридизации луков. В сб.: Научные труды по селекции и семеноводству. Т. 1. М., 1995: 104-110.
- Пивоваров В.Ф., Ершов И.И., Агафонов А.Ф. Луковые культуры. М., 2001.
- Тимин Н.И., Агафонов А.Ф., Шмыкова Н.А., Титова И.В., Кан Л.Ю., Логунова В.В., Гуркина Л.К., Романов В.С. Межвидовая гибридизация в роде Allium L. и ее использование в селекции (методические рекомендации). М., 2007.
- Тимин Н.И., Кан Л.Ю., Романов В.С., Агафонов А.Ф., Шмыкова Н.А. Методические особенности создания и оценки форм межвидовых гибридов лука. В сб.: Новые и нетрадиционные растения и перспективы их использования. М., 2007: 269-272.
- Тимин Н.И., Пышная О.Н., Агафонов А.Ф., Мамедов М.И., Титова И.В., Кан Л.Ю., Логунова В.В., Романов В.С., Шмыкова Н.А., Тимина Л.Т., Гуркина Л.К., Супрунова Т.П., Кривошеев С.М., Енгалычева И.А. Межвидовая гибридизация овощных растений (Allium L. -лук, Daucus L. -морковь, Capsicum L. -перец). М., 2013.
- Скворцова Р.В., Кондратьева И.Ю. Сорта томата и овощного физалиса для открытого грунта селекции ВНИИССОК. М., 2000.
- Кондратьева И.Ю., Енгалычев М.Р. Новый сорт физалиса овощного Лакомка. Овощи России, 2013, 3: 64-65.
- Верба В.М., Мамедов М.И., Пышная О.Н., Супрунова Т.П., Шмыкова Н.А. Получение межвидовых гибридов баклажана методом эмбриокультуры. Сельскохозяйственная биология, 2010, 5: 66-71.
- Мамедов М.И., Пышная О.Н., Шмыкова Н.А., Верба В.М., Джос Е.А., Супрунова Т.П. Межвидовая гибридизация в роде Solanum L. и ее использование в селекции. Овощи России, 2012, 2: 10-21.
- Бунин М.С., Мамедов М.И., Пышная О.Н., Шмыкова Н.А., Супрунова Т.П., Енгалычева И.А., Джос Е.А. Межвидовая гибридизация в роде Capsicum L. и ее использование в селекции (методика). М., 2008.
- Хрусталёва Л.И., Кан Л.Ю., Киров И.В., Сальник А.А. Молекулярно-цитогенетический анализ естественных и синтетических гибридов Allium cepa ½ A. fistulosum. Известия ТСХА, 2010, 4: 12-21.
- Будылин М.В., Кан Л.Ю., Романов В.С., Хрусталева Л.И. Хромосомная структура гибридов между Allium cepa и A. fistulosum L., относительно устойчивых к пероноспорозу, по данным геномной in situ гибридизации. Генетика, 2014, 50(4): 443-451.
- Dunwell J.M. Haploids in flowering plants: origins and exploitation. Plant Biotechnol. J., 2010, 8: 377-424 ( ) DOI: 10.1111/j.1467-7652.2009.00498.x
- Winkelmann T., Geier T., Preil W. Commercial in vitro plant production in Germany in 1985-2004. Plant Cell Tiss. Organ Cult., 2006, 86(3): 319-327 ( ) DOI: 10.1007/s11240-006-9125-z
- Тюкавин Г.Б. Получение безвирусных растений чеснока в культуре in vitro. В сб.: Селекция овощных культур. М., 1989, вып. 28: 116-119.
- Nagakubo T., Takaichi M., Oeda K. Micropropagation of Allium sativum L. (garlic). In: Biotechnology in agriculture and forestry. V. 39. High-tech and micropropagation V/Y.P.S. Bajaj (ed.). Berlin-Heidelberg: Springer-Verlag, 1997: 4-19.
- Тюкавин Г.Б., Кононков П.Ф. Клональное микроразмножение якона in vitro. Мат. II Межд. cимп. «Новые и нетрадиционные растения и перспективы их практического использования». Пущино, 1997, т. 4: 502-505.
- Тюкавин Г.Б., Кононков П.Ф. Технология оздоровления и клонального микроразмножения стахиса in vitro. Мат. II Межд. симп. «Новые и нетрадиционные растения и перспективы их практического использования». Пущино, 1997, т. 4: 508-510.
- Ибрагимов И.А. Разработка технологии клонального микроразмножения цветной капусты. Автореф. канд. дис. М., 1991.
- Yang W., Jizhe C., Cuiling L. Strategies in establishing effective regeneration system of Chinese cabbage. Acta Horticulturae Sinica, 2005, 32(4): 701-703.
- Zenkteler M., Zenkteler E., Dostatnia I. Somatic embryogenesis from broccoli stigmas in tissue culture. Acta Biologica Cracovensia Series Botanica, 2006, 48(2): 121-125.
- Guo Y.-D., Niemalo T., Tulisalo U., Pulli S. Maintenance of male sterile germplasm in Brassica rapa by in vitro propagation. Agricultural and Food Science in Finland, 2000, 9: 231-238.
- Бунин М.С., Шмыкова Н.А. Использование биотехнологических методов для получения исходного селекционного материала капусты. М., 2004.
- Верба В.М., Мамедов М.И., Пышная О.Н., Шмыкова Н.А. Клональное микроразмножение баклажана (Solanum melongena) путем органогенеза. Вестник РАСХН, 2010, 6: 57-59.
- Шмыкова Н.А. Разработка системы биотехнологических методов, направленных на ускорение селекционного процесса овощных культур. Автореф. докт. дис. М., 2006.
- Верба В.М. Разработка элементов технологии, направленной на расширение генетического разнообразия баклажана при селекции на качество. Автореф. канд. дис. М., 2011.
- Tuvesson S., Dayteg C., Hagberg P., Manninen O., Tanhuanpaa P., Tenhola-Roininen T., Kiviharju E., Weyen J., Forster J., Schondelmaier J., Lafferty J., Marn M., Fleck A. Molecular markers and doubled haploids in European plant breeding. Euphytica, 2007, 158: 305-312 ( ) DOI: 10.1007/s10681-006-9239-8
- Ferrie A.M.R. Current status of doubled haploids in medicinal plants. In: Advances in haploid production in higher plants/A. Touraev, B.P. Forster, S.M. Jain (eds.). Heidelberg: Springer, 2009.
- Ferrie A.M.R., Caswell K.L. Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production. Plant Cell Tiss. Org. Cult., 2011, 104(3): 301-309 ( ) DOI: 10.1007/s11240-010-9800-y
- Таганов Б.О. Разработка лабораторной технологии получения андрогенных растений моркови in vitro. Автореф. канд. дис. М., 1991.
- Семова Н.Ю. Разработка лабораторной технологии получения андрогенных растений белокочанной капусты с использованием культуры пыльников. Автореф. канд. дис. М., 1992.
- Тюкавин Г.Б., Шмыкова Н.А., Монахова М.А. Цитология эмбриогенеза в культуре пыльников моркови. Физиология растений, 1999, 46(6): 876-883.
- Тюкавин Г.Б., Супрунова Т.П., Шмыкова Н.А., Домблидес А.С., Дорохов Д.Б., Клыгина Т.Э. Изучение гаметоклональной изменчивости у моркови сорта Нантская 4. В сб.: Овощеводство -состояние, проблемы и перспективы: Научные труды (к 70-летию ВНИИО). Т. 1. М., 2001: 157-161.
- Шмыкова Н.А., Пышная О.Н., Шумилина Д.В., Супрунова Т.П., Джос Е.А., Мамедов М.И. Получение удвоенных гаплоидных линий перца (Capsicum annuum L.) через культуру пыльников/микроспор in vitro (Методические рекомендации). М., 2012.
- Шмыкова Н.А., Пышная О.Н., Шумилина Д.В., Джос Е.А. Морфологические характеристики удвоенных гаплоидных растений перца, полученных в культуре микроспор/пыльников in vitro межвидовых гибридов Capsicum annuum L. и C. chinense Jacq. Доклады РАСХН, 2014, 5: 21-24.
- Supena E.D., Suharsono S., Jacobsen E., Custers J.B. Successful development of a shed-microspore culture protocol for doubled haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Reports, 2006, 25: 1-10 ( ) DOI: 10.1007/s00299-005-0028-y
- Kim M.Z., Park E.J., Harn C.H., In D.S., Jung M. Method for plant production from embryos obtained by microspore culture of hot pepper (Capsicum annuum L.). Patent KR 20090070753, 2009.07.01.
- Takahata Y., Keller W.A. High frequency embryogenesis and plant regeneration in isolated microspore culture of Brassica oleracea L. Plant Sci., 1991, 74: 235-242 ( ) DOI: 10.1016/0168-9452(91)90051-9
- Zhang W., Fu Q., Dai X.G., Bao M.Z. The culture of isolated microspores of ornamental kale (Brassica oleracea var. acephala) and the importance of genotype to embryo regeneration. Sci. Horticult., 117(1): 69-72 ( ) DOI: 10.1016/j.scienta.2008.03.023
- Winarto B., Teixeira da Silva J.A. Microspore culture protocol for Indonesian Brassica oleracea. Plant Cell Tiss. Organ Cult., 2011, 107: 305-315 ( ) DOI: 10.1007/s11240-011-9981-z
- Yuan S.X., Su Y.B., Liu Y.V., Fang Z.Y., Yang L.M., Zhuang M., Zhang Y.Y., Sun P.T. Effects of pH, MES, arabinogalactan-proteins on microspore cultures in white cabbage. Plant Cell Tiss. Organ Cult., 2012, 110: 69-76 ( ) DOI: 10.1007/s11240-012-0131-z
- Kim J., Lee S.S. Identification of monogenic dominant male sterility and its suppressor gene from an induced mutation using a broccoli (Brassica oleracea var. italica) microspore culture. Hort. Environ. Biotechnol., 2012, 53(3): 237-241 ( ) DOI: 10.1007/s13580-012-0091-6
- Gu H., Zhao Z., Sheng X., Yu H., Wang J. Efficient doubled haploid production in microspore culture of loose-curd cauliflower (Brassica oleracea var. botrytis). Euphytica, 2014, 195: 467-475 ( ) DOI: 10.1007/s10681-013-1008-x
- Шумилина Д.В., Шмыкова Н.А., Бондарева Л.Л., Супрунова Т.П. Влияние генотипа и компонентов среды на эмбриогенез в культуре микроспор капусты китайской Brassica rapa ssp. сhinensis сорта Ласточка. Известия РАН. Серия биологическая, 2015, 4: 1-8.
- Andersen S.B. Anther culture in carrot. Hereditas Suppl., 1985, 3(12): 132.
- Hu K.L., Matsubara S., Murakami K. Haploid plant production in carrot (Daucus carota L.). J. Japan. Hort. Sci., 1993, 62(3): 561-565.
- Adamus A., Michalik B. Anther culture in carrot (Daucus carota L.). Folia Horticulturae Suppl., 2003, 1: 47-49.
- Nowakowska M., Kozik E.U., Nowak N. Evaluation of phenotypic uniformity of androgenic R1 population of carrot derived by anther culture technique. Folia Horticulturae, 2006, 18(2): 77-86.
- Gorecka K., Cvikrova M., Kowalska U., Eder J., Szafranska K., Gorecki R., Janas K.M. The impact of Cu treatment on phenolic and polyamine levels in plant material regenerated from embryos obtained in anther culture of carrot. Plant Physiol. Biochem., 2007, 45(1): 54-61 ( ) DOI: 10.1016/j.plaphy.2006.12.007
- Gorecka K., Kowalska U., Krzyzanowska D., Kiszczak W. Obtaining carrot (Daucus catota L.) plants in isolated microspore cultures. J. Appl. Genet., 2010, 51: 141-147 ( ) DOI: 10.1007/BF03195722
- Li J.-R., Zhuang F.-Y., Ou C.-G., Hu H., Zhao Z.-W., Mao J.-H. Microspore embryogenesis and production of haploid and doubled haploid plants in carrot (Daucus carota L.). Plant Cell Tiss. Organ Cult., 2013, 112: 275-287 ( ) DOI: 10.1007/s11240-012-0235-5
- Chen J.F., Cui L., Malik A.A., Mbira K.G. In vitro haploid and dihaploid production via unfertilized ovule culture. Plant Cell Tiss. Organ Cult., 2011, 104: 311-319 ( ) DOI: 10.1007/s11240-010-9874-6
- Campion B., Azzimonti M.T., Vicini E., Schiavi M., Falavigna A. Advance in haploid plant induction in onion (Allium cepa L.) through in vitro gynogenesis. Plant Sci., 1992, 86: 97-104 ( ) DOI: 10.1016/0168-9452(92)90183-M
- Bohanec B. Double-haploid onions. In: Allium Crop Science -Recent Advances/H.D. Rabinowich, L. Currah (eds.). London, CABI, 2002.
- Sulistyaningsih E., Aoyagi Y., Tashiro Y. Flower bud culture of shallot (Allium cepa L. aggregatum group) with cytogenetic analysis of resulting gynogenic plants and somaclones. Plant Cell Tiss. Organ Cult., 2006, 86: 249-255 ( ) DOI: 10.1007/s11240-006-9114-2
- Gemes-Juhasz A., Balogh P., Ferenczy A., Kristof Z. Effect of optimal stage of female gametophyte and heat treatment on in vitro gynogenesis induction in cucumber (Cucumis sativus L.). Plant Cell Rep., 2002, 21: 105-111 ( ) DOI: 10.1007/s00299-002-0482-8
- Li J.W., Si S.W., Cheng J.Y., Li J.X., Liu J.Q. Thidiazuron and silver nitrate enhanced gynogenesis of unfertilized ovule cultures of Cucumis sativus. Biologia Plantarum, 2013, 57(1): 164-168 ( ) DOI: 10.1007/s10535-012-0269-x
- Michalik B., Baranski R. In vitro induction of haploid plants from unpollinated ovules of red beet. Proc. XIII Eucarpia Congr. «Reproductive Biology and Plant Breeding». France, 1992: 193-194.
- Mohamed M.F., Refaei E.F.S. Enhanced haploid regeneration in anther culture of summer squash Cucurbita pepo L. Cucurbit Genetics Cooperative Report, 2004, 27: 57-60.
- Shalaby T.A. Factors affecting haploid induction through in vitro gynogenesis in summer squash (Cucurbita pepo L.). Sci. Hort., 2007, 115: 1-5 ( ) DOI: 10.1016/j.scienta.2007.07.008
- Шмыкова Н.А. Культура пыльников, неопыленных завязей и семяпочек лука репчатого. В сб.: Научные труды по селекции и семеноводству. М., 1995: 164-170.
- Шмыкова Н.А., Химич Г.А., Коротцева И.Б., Домблидес Е.А. Перспективы получения удвоенных гаплоидов растений семейства Cucurbitaceae. Овощи России, 2015, 3-4(28-29): 28-31.
- Шмыкова Н.А., Супрунова Т.П. Индукция гиногенеза в культуре in vitro неопыленных семяпочек Cucumis sativus L. Гавриш, 2009, 4: 40-44.
- Шмыкова Н.А., Шумилина Д.В., Кушнерева В.П., Химич Г.А. Индукция гиногенеза в культуре неопыленных семяпочек тыквы. Овощи России, 2011, 1(10): 28-31.
- Тюкавин Г.Б. Основы биотехнологии моркови. М., 2007.
- Супрунова Т.П. Идентификация вариабельности генома томата с помощью маркеров на основе ДНК. Автореф. канд. дис. М., 1997.
- Кочиева Е.З., Супрунова Т.П. Идентификация внутри-и межвидового полиморфизма у томата. Генетика, 1999, 35(10): 1386-1389.
- Кочиева Е.З., Супрунова Т.П., Семенова С.К. RAPD технология для идентификации сортов баклажана Solanum melongena L. Генетика, 1999, 35(8): 1165-1168.
- Дорохов Д.Б., Лаптева М.Н. Быстрая технология RAPD-анализа генотипов луков. Сельскохозяйственная биология, 1997, 5: 22-28.
- Балашова И.Т., Супрунова Т.П., Урсул Н.А., Пивоваров В.Ф., Ведадеваге С.П.К., Гужов В.Л. Последействие низкотемпературного стресса на ранних стадиях развития у исходного материала и гибридов F1 томата. Сельскохозяйственная биология, 2008, 3: 62-71.
- Домблидес Е.А., Домблидес А.С., Бондарева Л.Л., Старцев В.И. Оценка генетического разнообразия и филогенетических связей у образцов А и С геномов капустных культур. Мат. II Межд. науч.-практ. конф. «Современные тенденции в селекции и семеноводстве овощных культур; традиции и перспективы». M., 2010: 214-223.
- Домблидес А.С., Домблидес Е.А., Кан Л.Ю., Романов В.С. Полиморфизм межмикросателлитных повторов у видов лука. Овощи России, 2011, 3: 24-27.
- Домблидес А.С., Домблидес Е.А., Харченко В.А., Потехин Г.А. Изучение генетического полиморфизма образцов петрушки с использованием RAPD и ISSR маркеров. Вестник Московского университета. Серия 16: Биология, 2010, 4: 25-28.
- Mamedov M.I., Pishnaya O.N., Suprunova T.P., Verba V.M., Shmykova N.A. Development and analysis of interspecific hybrids among three species of the genus of Solanum. Proc. XV EUCARPIA Meeting on Genetics and Breeding of Capsicum and Eggplant. Italy, 2013: 525-529.
- Снигирь Е.А., Пышная О.Н., Кочиева Е.З., Рыжова Н.Н. AFLP-анализ сортового полиморфизма Capsicum annuum L. Сельскохозяйственная биология, 2013, 1: 53-60 ( , 10.15389/agrobiology.2013.1.53eng) DOI: 10.15389/agrobiology.2013.1.53rus
- Снигирь Е.А. Использование молекулярных маркеров для анализа полиморфизма генома перца и оптимизации селекционного процесса. Автореф. канд. дис. M., 2013.
- Снигирь Е.А., Кочиева Е.З., Мамедов М.И., Супрунова Т.П., Шмыкова Н.А., Пышная О.Н. Изучение эффекта гетерозиса перца сладкого при подборе родительских пар с использованием данных молекулярного анализа. Овощи России, 2012, 4(17): 25-28.
- Супрунова Т.П., Пышная О.Н., Шмыкова Н.А., Джос Е.А. Получение межвидовых гибридов перца (Capsicum L.) S-плазмотипа с использованием эмбриокультуры in vitro. Сельскохозяйственная биология, 2009, 3: 60-67.
- Супрунова Т.П., Логунов А.Н., Логунова В.В., Агафонов А.Ф. Определение типа цитоплазматической мужской стерильности лука репчатого (Allium cepa L.) селекции ВНИИССОК с помощью молекулярных маркеров. Овощи России, 2011, 4: 20-21.
- Havey M.J. Diversity among male-sterility-inducing and male-fertile cytoplasms of onion. Theor. Appl. Genet., 2000, 101: 778-782 ( ) DOI: 10.1007/s001220051543
- Домблидес Е.А., Домблидес А.С., Заячковская Т.В., Бондарева Л.Л. Идентификация типа цитоплазмы у образцов семейства капустные с использованием ПЦР. Мат. VI Межд. науч.-практ. конф. «Биотехнология как инструмент сохранения разнообразия растительного мира». Ялта, 2014: 164-165.
- Francia E., Tacconi G., Crosatti C., Barabaschi D., Bulgarelli D., Dall’Aglio E., Valè G. Marker assisted selection in crop plants. Plant Cell Tiss. Org. Cult., 2005, 82: 317-342 ( ) DOI: 10.1007/s11240-005-2387-z
- Stewart C.J., Kang B.C., Liu K., Mazourek M., Moore S.L., Yoo E.Y., Kim B.D., Jahn M.M. The Pun1 gene for pungency in pepper encodes a putative acyltransferase. Plant J., 2005, 42: 675-688 ( ) DOI: 10.1111/j.1365-313X.2005.02410.x
- Suprunova T., Pishnaya O., Dzhos E., Mamedov M. Practical use of molecular markers of pungency in breeding program of pepper (Capsicum annuum L.). Proc. European Plant Genetic Resources Conference, EUCARPIA «Pre-breeding -fishing in the gene pool». Sweden, Alnarp, 2013: 67.
- Collard B.C.Y., Mackill D.J. Marker-assisted selection: an approach for precision plant breeding in the twenty-first century. Phil. Trans. R. Soc. B., 2008, 363: 557-572 ( ) DOI: 10.1098/rstb.2007.2170


