Биотехнологические приемы в селекции овощных культур
Автор: Пивоваров В.Ф., Шмыкова Н.А., Супрунова Т.П.
Журнал: Овощи России @vegetables
Рубрика: Теория и практика селекции овощных культур
Статья в выпуске: 3 (12), 2011 года.
Бесплатный доступ
Обзор посвящен биотехнологическим методам и подходам и их использованию в селекции овощных культур. Последние достижения в области клонального микроразмножения, андрогенеза, гиногенеза и генетической трансформации овощных культур представлены в статье. Подчеркивается важность использования технологии культуры клеток in vitro для успешного развития сельского хозяйства.
Клональное микроразмножение, андрогенез, гиногенез, генетическая трансформация, овощные культуры
Короткий адрес: https://sciup.org/14024894
IDR: 14024894 | УДК: 573.6:631.527.8
Текст обзорной статьи Биотехнологические приемы в селекции овощных культур
Биотехнологические методы культивирования растительных клеток in vitro играют важную роль не только в фундаментальных исследованиях по генетике, физиологии, молекулярной биологии, цитологии растений, но имеют также прикладное значение в сельском хозяйстве. Из них наиболее востребованы клональное микроразмножение, андрогенез, гиногенез, генетическая трансформация, которые широко применяются в сельскохозяйственных программах для расширения спектра формообра- зования, создания константных линий, ускорения селекционного процесса. Методы андро- и гиногенеза позволяют реализовать гаметоклональную изменчивость в индивидуальные растения, обнаруживать редкие рецессивные аллели, создавать уникальные формы.
Клональное микроразмножение
Методы культивирования клеток растений к настоящему времени разработаны до такой степени, что любой вид растения при использовании определенных методических подходов может быть регенерирован из каллусных или меристематических тканей. Без регенерации становятся невозможными исследования по трансформации растений, культуре пыльников и микроспор и неопылен-ных семяпочек, межвидовой гибридизации, промышленного клонирования. Клональное микроразмножение – это использование техники in vitro для быстрого получения неполовым способом растений, идентичных исходным.
Р!
Методики клонального микроразмножения занимают значимое место в мировой практике растениеводства. Так, например, в Германии количество посадочного материала, производимого через культуру тканей, в 1985 г. составляло 5 млн. растений, а в 2004 уже 48 млн. растений в год (Winkelmann et al., 2006). В большинстве случаев это касается декоративных, плодовых, ягодных культур, картофеля и в меньшей степени овощных растений. Это объясняется тем, что почти все овощные культуры размножаются семенами и имеют большой коэффициент размножения. Однако в ряде случаев, когда это касается самонесовмести-мых или стерильных линий, необходимых для создания гибридов, а также для получения безвирусного посадочного материала использование клонального микроразмножения может быть актуально, при соответствующих коэффициентах размножения. Так, для лука репчатого была разработана двух ступенчатая технология клонального микроразмножения с использованием в качестве эксплантов бутонов и завязей, которая предназначена для получения растений-регенерантов и может быть использована для генетической трансформации растений (Luthar and Bohance, 1999; Bohance and Luthar, патент, 2000). Технология in vitro способствует оздоровлению и освобождению посадочного материала чеснока от вирусной инфекции, что актуально для данной культуры, которая особенно подвержена вирусным заболеваниям (Ebi et al., 2000; Torres et al., 2000; Zheg et al., 2003). Использование безвирусного посадочного материала чеснока способствует увеличению урожайности до 70 % и широко используется во всем мире (Nagakubo et al., 1997).
Первые исследования по клональному микроразмножению капустных культур приходятся на начало семидесятых годов, однако достичь высокого коэффициента размножения в пробирке не удавалось. Лишь в последнее десятилетие были разработаны эффективные методы клонального микроразмножения капусты и рапса (Yang et al., 2005; Zenkteler et al., 2006; Baojuan et al., 2006).
Технология клонального микроразмножения, разработанная в лаборатории биотехнологии ВНИИССОК, позволяет размножать растения капусты белокочанной с мужской стерильностью в неограниченных количествах. Весь цикл занимает 8-11 недель. Развитие побегов начинается после второго этапа, коэффициент размножения может изменяться от
10-30, в зависимости от экспланта. После третьего этапа коэффициент размножения увеличивается в 2-3 раза, то есть с одного экспланта можно получить за один цикл от 20 до 90 растений-регенерантов. Для увеличения коэффициента размножения третий этап можно повторять несколько раз (Бунин М.С., Шмыкова Н.А., 2004) (рис.1).
Приемы культуры ткани моркови хорошо разработаны, т.к. исследования по регенерации были начаты еще в 1960-х годах (Steward S.M. et al., 1964). Использование этого метода является неотъемлемым этапом работ по созданию трансгенных растений моркови, однако клональное микроразмножение моркови в овощеводстве не распространено, т.к. затраты очень высоки, а появление уродливых корнеплодов может достигать 100% (Rubatzky et. al., 1999).
Известно, что такая овощная культура как баклажан хорошо отзывчива в культуре in vitro . Растения-регенеранты можно получать как через органогенез, так и соматический эмбриогенез (Sharma and Rajam, 1995; Magioli et al., 1998; Franklin et al., 2004; Ribeiro et al., 2009; Xing et al., 2010; Верба и др., 2010).
Перец, в отличие от других представителей семейства Solanaceae, менее отзывчив в культуре in vitro .
Рис. 1. Схема технологии клонального микроразмножения капусты

А
Г
Д
А) Побегообразование на экспланте; Б, В) Растения-регенеранты in vitro; Г) Адаптация растений-регенерантов к условиям in vivo; Д) Растения-регенеранты в полевых условиях.

Однако и для него были разработа-
Однако отдаленная гибридизация annuum x C. chinense, C. baccatum x
ны биотехнологические подходы, делающие возможным регенерацию растений из культуры клеток, тканей и органов через органогенез и эмбриогенез (Ochoa-Alejo and Ramirez-Malagon, 2001; Katoh et al., 2004; Anu et al., 2004).
Эффективная система регенерации растений семейства Cucurbitaceae через соматический эмбриогенез может быть использована для продукции искусственных семян и генетической трансформации растений (Nakagawa et al., 2001). Использование высокоэффективной технологии микрокло-нального размножения огурца может привести к снижению себестоимости производства гибридных семян до 30% (Konstas and Kintzios, 2003).
Межвидовая гибридизация
Важнейшим методом обогащения генофонда культурных растений является отдаленная гибридизация, посредством которой идет передача ценных признаков (например, устойчивость к биотическим и абиоти- связана с многочисленными трудностями на пути ее практического использования. Во-первых, это неспособность многих видов к скрещиванию, а во-вторых, несовместимость тканей эндосперма и зародыша при развитии семени. Решение этих проблем возможно за счет использования биотехнологических приемов – культуры протопластов и эмбриокультуры, с помощью которых можно получать гибридные растения путем слияния протопластов родительских форм либо путем культивирования гибридного зародыша на искусственных питательных средах. Такие методики были разработаны для целого ряда культур, таких как томат (Thomas, Pratt, 1981; Shepard et al., 1983), лук (Umbehara et al., 2006; Тимин и др., 2007), баклажан (Sharma et al., 1980; Rizza et al., 2002; Rotino et al., 2005), перец (Subramanya, 1982; Hossain et al., 2003; Yoon et al., 2006), капустные культуры (Hanse and Earle, 1995; Zhang et al., 2004).
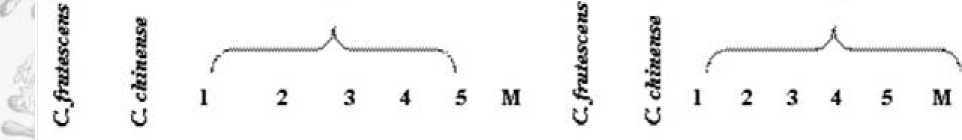
C. annuum, C. frutescens x C. chi-nense, C. frutescens x C. annuum, C. annuum x C. frutescens (рис. 2) (Бунин и др., 2008). Межвидовые гибридные комбинации были оценены на искусственном провокационном инфекционном фоне и выделены устойчивые формы. С помощью ПЦР-маркеров определен S-плазмотип мужской стерильности у гибридного потомства перцев, полученных при межвидовом скрещивании (рис.3) (Супрунова и др., 2009). С помощью молекулярных CAPS маркеров на pvr4 - и pvr1 -локусы, сцепленные с устойчивостью к картофельному вирусу Y, проведена оценка расщепляющегося потомства межвидовых гибридов перца, показавших комплексную устойчивость к фитопатогенам, и выявлены гомо- и гетерозиготные генотипы по данным локусам.
Также во ВНИССОК была разработана методика эмбриокультуры для культивирования незрелых зародышей баклажана и получены ческим стрессорам) от диких видов
Во ВНИИССОК была разработана растения-регенеранты межвидо- к культурным. Она позволяет расширить спектр генетической изменчи- вости, а также дает возможность получения нетрадиционных форм с хозяйственно ценными признаками.
методика культивирования in vitro незрелых зародышей межвидовых гибридов перца, позволившая получить следующие межвидовые гибриды: C. baccatum x C. chinense, C.
вых гибридов S. integrifolium x S melongena, S. aethiopicum x S. mel ongena, S. aethiopicum x S. integri folium, S. melongena x S aethiopicum, S. melongena x S
Рис.2. Культура in vitro незрелых зародышей межвидовых гибридов перца
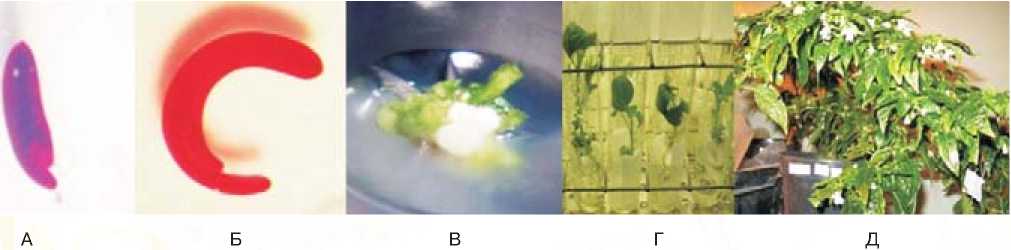
А, Б) Стадии развития зародышей, отзывчивых к эмбриокультуре; В) Побегообразование in vitro; Г) Растения-регенеранты на стадии корнеобразования; Д) Растение F1 (C.frutescens х C.chinense) с признаком ЦМС.

Рис.3. Амплификация SCAR маркеров митохондриальных генов atp6 и coxII, обуславливающих ЦМС перца, у родительских форм (Capsicum frutescens и C. chinense) и стерильных межвидовых гибридов
Fi F,
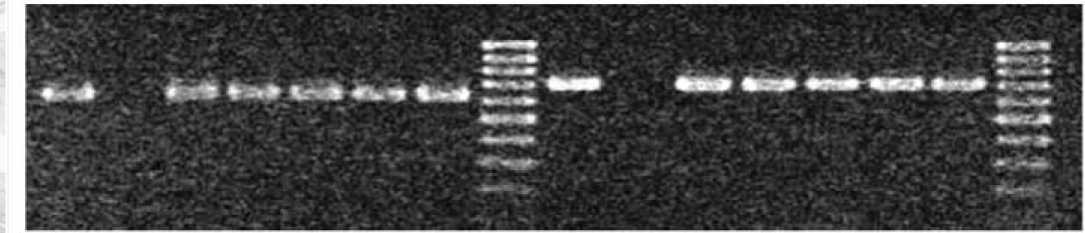
агрб SCAR маркер, coxH St?AR маркер aethiopicum, S. melongena x S. inte-grifolium (Верба и др., 2010).
На протяжении многих лет во ВНИИССОК проводится работа по межвидовой гибридизации в роде Allium. Созданы межвидовые гибриды лука A. cepa x A. oschaninii, A. cepa x A. altaicum, A. cepa x A. vav-ilovii, A. cepa x A. fistulosum, A. cepa x A. nutans , часть из которых была получена через эмбриокультуру. Получены генетические источники ценного исходного материала с высокой устойчивостью к пероноспорозу, на основе которого созданы новые сорта лука Изумрудный, Сигма, Золотые Купола (Тимин и др., 2007).
Гаплоидия (андро-, гиногенез)
В современной селекции одной из важнейших задач является быстрое достижение константности селекционного материала. Наиболее остро эта проблема возникает при создании гетерозисных гибридов, для которых требуются гомозиготные линии с высокой комбинационной способностью. Обычно такие линии получают путем длительного инбридинга в течение 5-10 поколений. Использование биотехнологических подходов (культуры пыльни-ков/микроспор и неопыленных семяпочек in vitro) позволяет сократить временные затраты в несколько раз на получение гомозиготных генетически стабильных линий, что способствует построению рациональных систем создания гибридов, которые отличаются от сортов высокой урожайностью, выравненностью растений по срокам созревания, размером и качеством продуктивных органов. Гомозиготные растения также широко используются генетиками и молекулярными биологами для количественного генетического анализа, изучения взаимодействия генов, генетической изменчивости, определения групп сцепления, картирования популяций и т.д.
Культуры пыльников/микроспор in vitro (андрогенез) занимает ведущее место в селекционных программах по ускорению процесса создания высокопродуктивных гибридов и сортов сельскохозяйственных растений. Изолированные микроспоры при определенных условиях (оптимальная комбинация условий культуры и стрессового воздействия) могут быть переведены с нормального гаметофитного пути развития на спорофитный, при этом продуцируя эмбриоиды, переходящие в гаплоиды (Hs) или в удвоенные гаплоиды (DH-растения). Производство DH-растений – важное звено в селекции растений и в фундаментальных исследованиях. DH-технологии являются быстрым методом создания гомозиготных линий, который может ускорить селекционный процесс. На сегодняшний день существуют коммерческие варианты производства DH-форм таких растений, как пшеница, ячмень, тритикале, рис, разновидности рода Brassica, баклажан, перец, спаржа, табак (Thomas et al., 2003).
Начиная с середины 70-х годов прошлого века, DH-технологии начали активно внедряться в селекционный процесс, благодаря ряду преимуществ по сравнению с традиционными методами получения гомозиготных линий (Forster and Thomas,

et al., 2005; Keller and
2005; Dunwell, 2010). Гаметный эм- 2009; Ferrie и Caswell 2011; Germana, (Kaminski
бриогенез был описан как дополнительный инструмент в «арсенале селекционера» (Forster et al., 2007). ФАО и МАГАТЭ поддержали и сконцентрировали исследования в области разработки DH-технологий и использования их в селекции в развивающихся странах. В последующем была создана программа Евросоюза «Гаметные клетки и молекулярная селекция для улучшения сельскохозяйственных культур», исследования по которой проводились в Европе в течение 2001-2006 года.
Сегодня по всему миру использование DH-технологий становится обычным делом в большинстве селекционных компаний и лабораторий, занимающихся селекцией сельскохозяйственных культур, в результате чего были получены около 300 новых сортов (Tuvesson et al., 2007). В последнее время такие виды, ранее считавшиеся не отзывчивыми к DH-технологии, как кормовые, овощные, бобовые, ароматические, лекарственные и древесные культуры, сейчас яв- ляются объектами успешного изучения и индукции гаплоидного эмбрио- генеза, целью которого являются генетическое улучшение и геномные исследования (Dunwell 2010; Ferrie,
Не существует универсальных протоколов культуры изолированных пыльников/микроспор для всех видов растений, поскольку существуют как межвидовые, так и внутривидовые (генотип-зависимые) различия в отзывчивости на андрогенез. Когда проводится первоначальный скрининг видов на отзывчивость к андрогенезу, в основном используются базовые протоколы, разработанные для растений рода Brassica, ячменя и табака. Основные шаги таких протоколов остаются неизменными. Они включают выращивание растений-доноров, отбор бутонов, выделение микроспор, культивирование микроспор и индуцирование эмбриогенеза, регенерация растений, удвоение хромосом. Тем не менее, в каждом конкретном случае необходима разработка индивидуальных протоколов культуры изолированных пыльников/микроспор для каждой конкретного вида растения, сорта, генотипа.
В настоящее время в ряде стран получены гаплоидные растения и созданы дигаплоидные линии различ- ных видов капусты с использованием культуры микроспор/пыльников. Созданы линии капусты брюссельской
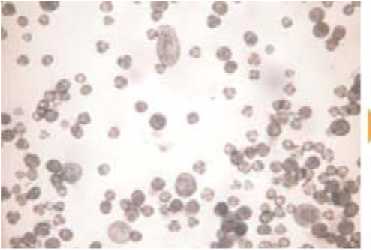
Amstrong, 1983), капусты цветной, брокколи (Takahata et al., 1993; Farnham et al., 1998; Dias, 2001; Gu et al., 2004), капусты белокочанной (Cao et al., 1990; Gorecka 1998; Kuginuki et al., 1993; Hansen, 2000), капусты пекинской (Sato et al., 1989; Zhang and Takahata, 1999), капусты китайской (Kuginuki et al., 1997; Ajisaka et al., 1999; Gu et al., 2003; Zhang et al., 2003). Во ВНИИССОК были получены первые гаплоидные растения капусты белокочанной с помощью метода культуры пыльников (Семова, 1992). В настоящее время разрабатывается метод культивирования изолированных микроспор растений рода Brassica. Получены положительные результаты в культуре изолированных микроспор рапса (рис.4).
В настоящее время в мире активно ведутся работы по культуре in vitro пыльников моркови (Andersen 1985; Hu et al., 1993; Adamus and Michalik 2003; Nowakowska et al., 2006; Gorecka et al., 2007). В лаборатории биотехнологии ВНИИССОК также разработана технология куль тивирования in vitro пыльников мор кови, которая была апробирована на целом ряде сортообразцов моркови европейского происхождения. Сре-
Рис. 4. Индукция эмбриогенеза в культуре микроспор рапса (Brassica napus ssp. Oleifera cv. Тopaz)
А
А) Индукция эмбриогенеза ; Б) Образование эмбриоидов;
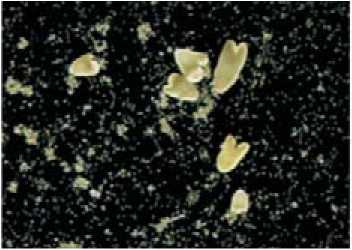
Б
В) Растения-регенеранты



Рис.5. Технология получения удвоенных гаплоидов моркови в культуре пыльников in vitro

А, Б) Пыльники с эмбриоидами ; В) Регенерация растений из каллуса; Г) Растения-регенеранты; Д) Корнеплоды, полученные из одного пыльника.
ди растений-регенерантов прослеживалась гаметоклональная изменчивость, что было подтверждено морфологическим и молекулярным анализами (Тюкавин, 2007) (рис.5).
Разработки технологии регенерации растений рода Capsicum в культуре пыльников in vitro начаты еще в 70-е годы (Wang et al., 1973; Novak, 1974). В настоящее время разработан ряд эффективных DH- технологий для сортов острого перца, часть из которых защищена патентами (Supena et al., 2006; Nowaczyk et al., 2006; Kim et al., 2009; Zhang 2006). Во ВНИИССОК в настоящий момент ведется разработка DH-технологии для отечественных сортов как сладкого, так и острого перца. Получены гаплоидные растения сортов Здоровье, Чудо Подмосковья и др. (рис.6).
Другой культурой из сем Пасленовые, у которой успешно используется in vitro андрогенез, является баклажан (Vaulx and Chambonnet, 1982; Rizza et al., 2002; Rotino et al., 2005; Corral-Martinez et al., 2008; Bal et al., 2009). Менее отзывчивой культурой к индукции гаметного эмбриогенеза является томат, значительные успехи в применении этого метода не достигнуты, имеются лишь единичные положи- тельные результаты (Zagorska et al., 2004; Segui-Samarro, 2007; Bal and Abak, 2007).
Наряду с андрогенезом для получения гаплоидных растений часто используется культура неопыленных семяпочек. Культивирование женского гаметофита менее изучено, по сравнению с культивированием in vitro пыльников и микроспор. В ряде случаев культивирование неопыленных завязей и семяпочек даже предпочтительней. Например, для получения гаплоидов от растений с цитоплазматической мужской стерильностью это единственная уникальная возможность получения гомозиготных форм.
Среди овощных культур наиболее разработанными являются методики культивирования неопыленных семяпочек лука (Campion, 1992; Bohanes et al., 2002; Jakse et al., 2003;
Sulistyaningsih et al., 2006) огурца (Dirk, patent,1996; Gemes Juhans et al., 2002), свеклы (Michalik, Baranski, 1992).
В лаборатории биотехнологии ВНИИССОК также были начаты исследования в этой области, получены растения-регенеранты лука репчатого сорт Штуттгартер ризен и межвидовых гибридов (Шмыкова Н.А. 2006). Создана конкурентоспособ-
Рис.6. Технология получения удвоенных гаплоидов перца (сорт Здоровье) в культуре пыльников/микроспор in vitro

А Б В Г
А) деление микроспоры на две равные клетки; Б) эмбриоиды в глобулярной, сердцевидной и торпедовидной стадиях развития; В) Развившийся in vitro проросток; Г) Растения-регенеранты.
ная отечественная технология по-

(Leptinotarsa decemlineata) (Arpaia et ний различных культур – картофель,
лучения DH-форм огурца в культуре неопыленных семяпочек (Шмыкова и Супрунова, 2009) (Рис.7). Впервые разработана методика получения дигаплоидных растений моркови в культуре неопыленных семяпочек (Тюкавин, 2007).
Генетическая трансформация
Количество новых трансгенных культур с каждым годом неуклонно растет. Хотя ведущими трансгенными культурами в мировом масштабе остаются соя, кукуруза, рапс и хлопчатник (ISAAA, 2004) с каждым годом растет число испытаний овощных культур. Среди основных признаков, переносимых в овощные культуры, полученных посредством генетической инженерии, наиболее популярными являются устойчивость к гербицидам, на- секомым, вирусам, улучшение качества продукции, мужская стерильность.
Так, например, были получены трансгенные растения перца, обладающие комплексной устойчивостью к вирусам (Cai et al., 2003; Shin et al., 2002). С помощью генно-инженерных манипуляций в растения баклажана был перенесен Bt-ген, кодирующий CryIIIB-токсин, обеспечивающий устойчивость к колорадскому жуку al., 1997) и синтетический ген cry1Ab, кодирующий кристаллический белок из Bacillus thuringiensis, обладающий инсектицидным действием против одного из основных вредителей баклажана Leucinodes orbonalis (Kumar et al. 1998). Большой практический интерес представляют растения с мужской стерильностью. В литературе имеются сообщения о получении трансгенных растений капусты китайской c мужской стерильностью с геном CYP86MF (Cao et al., 2006) и томата с промотором PsENDI (Roque et al., 2007).
Одно из интенсивно развивающихся направлений генной инженерии – это биомедицинское использование трансгенных растений в качестве продуцентов «съедобных» вакцин нового поколения. Гены белков, которые сами не являются инфекционными аген- тами, но содержат антигенные детерминанты бактерий или вирусов, переносят в растения. Такие трансгенные растения синтезируют продукты чужеродных генов наряду с собственными и являются перспективными объектами для разработки новых безопасных технологий производства вакцин. К настоящему времени существует ряд разработок по получению вакцин на основе трансгенных расте- томат, кукуруза, салат, морковь, огурец, табак и др. (Richter et al., 2000; Giddings et al., 2000; Nemchinov et al., 2000; Zhang et al., 2002; Tacket et al., 2000; Streatfield and Howard, 2003; Yakushenko et al., 2006).
Таким образом, сочетание методов эмбриокультуры, DH-технологии, соматического эмбриогенеза, сомакло-нальной изменчивости, трансгенеза в сочетании с традиционными методами генетики и селекции способствуют улучшению качества и продуктивности экономически значимых овощных культур. Научные исследования в области биотехнологии растений, как фундаментальные, так и прикладные, могут способствовать успешному развитию селекции сельскохозяйственных растений. Интенсивность таких исследований, в том числе их уровень, зависит в свою очередь от того, какое значение придают люди (через свои правительства) сельскому хозяйству и научным работам в области растениеводства. В периоды финансовых спадов таким исследованиям часто отводится скромное место. Подобная политика близорука, ибо только непрерывные исследования в этой области могут способствовать успеху.
Рис.7. Технология получения удвоенных гаплоидов огурца в культуре неопыленных семяпочек in vitro

А Б В Г
А) Семяпочки огурца; Б) Регенерация побега из семяпочки; В) Растения – регенеранты in vitro; Г) Растения – регенеранты in vivo

Список литературы Биотехнологические приемы в селекции овощных культур
- Бунин М.С., Шмыкова Н.А. Методические рекомендации. М., 2004.-44 с.
- Бунин М.С., Мамедов М.И., Пышная О.Н., и др., Методика. М., 2008.-70 с.
- Верба В.М., Мамедов М.И., Пышная О.Н., и др.//Сельскохозяйственная биология.-2010.-№ 5.-С. 6671.
- Семова Н.Ю. Автореф. дис. канд. биол. наук, М., 1992.-17 с.
- Супрунова Т.П., Пышная О.Н., Шмыкова Н.А., и др.//Сельскохозяйственная биология.-2009.-№ 3.-С. 60-67.
- Тимин Н. И., Агафонов А. Ф., Шмыкова Н.А., и др. Методические рекомендации. М., 2007.-47 с.
- Тюкавин Г.Б. Основы биотехнологии моркови. М., 2007. -480 с.
- Шмыкова Н.А. Автореф. дис. доктора сельскохозяйственных наук. М., 2006.-47 с.
- Шмыкова Н.А., Супрунова Т.П.//Гавриш.-2009.-№ 4.-С. 40-44.
- Adamus A., Michalik B.//Folia Hort. Suppl.-2003.-Vol. 1.-P. 47-49.
- Ajisaka H., Kuginuki Y., Shiratori M., et al.//Breed. Sci. -1999.-Vol. 49.-P. 187-192.
- Andersen S.B.//Hereditas Suppl.-1985.-Vol. 3.-№ 12.-P. 132.
- Anu A., Babu K.N., Peter K.V.//Plant Cell Tissue Organ Cult.-2004.-Vol. 76.-P. 261-267.
- Arpaia, S., Mennella, G., Onofaro, V., et al.//Theor. Appl. Genet.-1997.-Vol. 95.-P. 329-334.
- Bal U., Abak K.//Euphytica.-2007.-Vol. 158.-P. 1-9.
- Bal U., Ellialtioglu S., Abak K.//Sci. Agric.-2009.-Vol. 66.-P. 535-539.
- Baojuan S., Jiashu C., Xun X., et al.//Acta Horticulturae Sinica.-2006.-Vol. 33.-№ 2.-P. 306-310.
- Bohanec B.//In: Rabinowich, H.D., Currah, L. (ed.). Allium Crop Science -Recent Advances.-London: CABI, 2002.-157 p.
- Bohanec B., Luthar Z.//Patent W0/2000/016610, 30.03.2000.
- Cai W.Q., Fang R.X., Shang H.S., et al.//Mol. Breed.-2003.-Vol. 11.-P. 25-35.
- Campion B., Azzimonti M.T., Vicini E., et al.//Plant Sci.-1992.-Vol. 86.-P. 97-104.
- Cao J.S., Yu X.L., Ye W.Z., et al.//Plant Cell Reports.-2006.-Vol. 24.-№ 12.-P. 715-723.
- Cao M.Q., Charlot F., Dore C.//CR Acad. Sci. Paris Serie III.-1990.-Vol. 300.-P. 203-209.
- Corral-Martinez P., Nuez F., Segu?.-Simarro J.M.//In: Prohens J., Badenes M.L. (eds). Modern variety breeding for present and future needs.-Valencia, Spain.: UPV Press, 2008.-P. 104-108.
- Dias J.C.S.//Euphytica.-2001.-Vol. 119.-P. 389394.
- Dirk R.//US Patent № 5492827. 1996.
- Dunwell J.M.//Plant Biotechnol. J.-2010.-Vol. 8.-P. 377-424.
- Ebi M., Kasai N., and Masuda K.//Hort. Science.-2000.-Vol. 35.-№ 4.-P. 735-737.
- Farnham M.W.//J. Amer. Hort. Sci.-1998.-Vol. 123.-P. 73-77.
- Ferrie A.M.R.//In: Touraev A., Forster B.P., Jain S.M. (eds). Advances in haploid production in higher plants.-Heidelberg: Springer, 2009.-P. 209-217.
- Ferrie A.M.R., Caswell K.L.//Plant Cell Tissue Organ Cult.-2011.-Vol. 104.-№ 3.-P. 301-309.
- Forster B.P., Thomas W.T.B.//Plant Breed. Rev.-2005.-Vol. 25.-P. 57-88.
- Forster B.P., Tuvesson S., Weyen J.//Euphytica.-2007.-Vol. 158.-P. 273-274.
- Franklin G., Sheeba C.J., Lakshmi Sita G.//In Vitro Cell. Dev. Biol.-Plant.-2004.-Vol. 40.-P. 188-191.
- Gemes-Juhasz A., Balogh P., Ferenczy A., Kristof Z.//Plant Cell Rep.-2002.-Vol. 21.-P. 105-111.
- Germana M.A.//In: Touraev A., Forster B., Jain M. (eds). Advances in haploid production in higher plants. Heidelberg: Springer, 2009.-P. 241-263
- Giddings G., Allison G., Brooks D. and Carter A.//Nat. Biotechnology.-2000.-Vol. 18.-P. 1151-1155.
- Gorecka K.//Habit. Thesis.-1998.-Vol. 14.-P. 1-71.
- Gorecka K., Cvikrova M., Kowalska U., et al.//Plant Physiology and Biochemistry.-2007.-Vol. 45.-№ 1.-P. 5461.
- Gu H.H., Tang G.X., Zhang G.Q., et al.//J. Zhejiang Univ. (Agric. and Life Sci.).-2004.-Vol. 30.-P. 34-38.
- Gu H.H., Zhou W.J., Hagberg P.//Euphytica.-2003.-Vol. 134.-P. 239-245.
- Hanse L.N., and Earle E.D.//Theor. Appl. Genet.-1995.-Vol. 91.-P. 1293-1300.
- Hansen M.//J. Plant Physiol.-2000.-Vol. 156.-P. 164-167.
- Hossain M.A., Minami M., Nemoto K.//Jpn. J. Trop. Agric.-2003.-Vol. 47.-P. 9-16.
- Hu K.L., Matsubara S., Murakami K.//J. Japan. Hort. Sci.-1993.-Vol. 62.-№ 3.-P. 561-565.
- International Service for the Acquisition of AgriBiotech Application (ISAAA). Information Bulletin.-№1-M.:Centre Bioengineering, 2004.-9 p.
- Jak?e M., Havey M.J., Bohanec B.//Plant Cell Rep.-2003.-Vol. 21.-P. 905-910.
- Kaminski P., Dyki B., Kryzanowska D., et al.//J. Appl. Genet.-2005.-Vol. 46.-№ 1.-P. 25-33.
- Katoh N., Yui M., Sato S., et al.//Sci. Hortic.-2004.-Vol. 100.-P. 1-6.
- Keller W.A., Amstrong K.C.//Euphytica.-1983.-Vol. 32.-P. 151-159.
- Kim M.Z., Park E.J., Harn C.H., et al.//Patent KR 20090070753, 2009.07.01.
- Konstas J. and Kintzios S.//Plant Cell Rep.-2003.-Vol. 21.-P. 538-548.
- Kuginuki Y., Miyajima T., Higashimura H., et al.//J. Japan Soc. Hort. Sci.-1993.-Vol. 62.-№ 2.-P. 236-237.
- Kuginuki Y., Nakamura K., Hida K., et al.//Breeding Science.-1997.-Vol. 47.-P. 341-346.
- Kumar P.A., Mandaokar A., Sreenivasu K., et al.//Mol. Breeding.-1998.-Vol. 4.-P. 33-37.
- Luthar Z., and Bohance B.//Plant Cell Report.-1999.-Vol. 18.-P. 797-802.
- Magioli C., Rocha A.P.M., de Oliveira D.E., et al.//Plant Cell Report.-1998.-Vol. 17.-P. 661-663.
- Michalik B., Baranski R.//Book of abstracts of XIII-th Eucarpia Congress.-France, 1992.-P. 193-194.
- Nagakubo T., Takaichi M and Oeda K.//In Biotechnology in Agriculture and Forestry, Vol.39. HighTech and Micropropagation V (ed. by Y.P.S. Bajaj).-Berlin-Heidelberg: Springer-Verlag, 1997.-P. 4-19.
- Nakagawa H., Saijyo T., Yamauchi N., et al.//Sci. Hort.-2001.-Vol. 90.-P. 85-92.
- Nemchinov L.G., Liang T. J., Rifaat M.M., et al.//Arch. Virol.-2000.-Vol. 145.-№ 12.-P. 2557-2573.
- Novak F.J.//Z. Pflanzenzuchtg.-1974.-Vol.72.-P. 4654.
- Nowaczyk P., Kisia?a A. and Olszewska D.//Acta Physiol. Plant.-2006.-Vol. 28.-№ 1.-P. 35-39.
- Nowakowska M., Kozik E.U., Nowak N.//Folia Horticulturae.-2006.-Vol. 18.-№ 2.-P. 77-86.
- Ochoa-Alejo N., and Ramirez-Malagon R.//In Vitro Cell. Dev. Biol.-Plant.-2001.Vol. 37.-P. 701-729.
- Ribeiro A.P.O., Picoli E.A.T., Lani E.R.G., et al.//In Vitro Cell. Dev. Biol.-Plant.-2009.-Vol. 45.-P. 421-428.
- Richter L.J., Thanavala Y., Arntzen C.J. et al.//Nat. Biotechnology.-2000.-Vol. 18.-P. 1167-1171.
- Rizza F., Mennella G., Collonnier C., et al.//Plant Cell Rep.-2002.-Vol. 20.-P. 1022-1032.
- Roque E., Gomez M.D., Ellul P., et al.//Plant Cell Reports.-2007.-Vol. 26.-№ 3.-P. 313-325.
- Rotino L.G., Sihachakr D., Rizza F., et al.//Acta physiologiae plantarum.-2005.-Vol. 27.-P. 723-733.
- Rubatzky V.E., Quiros C.F., Simon P.W.//CAB Intl., 1999.-304 p.
- Sato T., Nishio T., Hirai M.//Plant Cell Rep.-1989.-Vol. 8.-P. 486-488.
- Segu-Simarro J.M., Nuez F.//J. Exp. Bot.-2007.-Vol. 58.-P.1119-1132.
- Sharma D.K., Chowdhury J.B., Ahuja V., et al.//Z. Pflanzenzuechtg.-1980.-Vol. 85.-P. 248-253.
- Sharma P. and Rajam M.V.//J. Exp. Bot.-1995.-Vol. 46.-P. 135-141.
- Shepard J.F, Bidney D., Barsby T., et al.//Science.-1983.-Vol. 11.-P. 683-688.
- Shin R., Han J.H., Lee G.J., et al.//Transgenic Res.-2002.-Vol. 11.-P. 215-219.
- Steward S.M., Mapes M.O., Kent A.E., et al.//Science.-1964.-Vol.143.-P. 20-27.
- Streatfield S.J., Howard J.A.//International Journal for Parasitology.-2003.-Vol. 33.-№ 5-6.-P. 479-493.
- Subramanya R.//Euphytica.-1982.-Vol. 31.-№ 2.-P. 461-464.
- Sulistyaningsih E., Aoyagi Y., Tashiro Y.//Plant Cell Tiss. Organ. Cult.-2006.-Vol. 86.-P. 249-255.
- Supena E.D., Suharsono S., Jacobsen E., et al.//Plant Cell Rep.-2006.-Vol. 25.-P. 1-10.
- Tacket C.O., Mason H.S., Losonsky G., et al.//J. Infect. Dis.-2000.-Vol. 182.-№ 1.-P. 302-305.
- Takahata Y., Takany Y., and Kaisuma N.//Plant Tiss. Cult. Lett.-1993.-Vol. 10.-P. 49-53.
- Thomas W.T.B., Forster B.P., Gertsson B.//In: Maluszynski M, Szarejko I.(eds). Haploid production in crop plants: a manual.-Dordrecht: Kluwer, 2003.-P.337-349.
- Thomas В., Pratt D.//Theor. Appl. Genet.-1981.-Vol.-№ 4.-P. 215-219.
- Torres A.C., Martins-Fajiaro T.V., Dusi A.N., et al.//Hortic. bras.-2000.-Vol. 18.-№ 3.-P. 192-194.
- Tuvesson S., Dayteg C., Hagberg P., et al.//Euphytica.-2007.-Vol. 158.-P. 305-312.
- Umbehara M., Sucyoshi T., Shimomura K., et al.//Euphytica.-2006.-Vol. 148.-P. 295 -301.
- Vaulx D.R., and Chambonnet D.//Agronomie.-1982.-Vol. 2.-P. 983-988.
- Wang Y.Y., Sun C.S., Wang C.C., et al.//Sci. Sinica.-1973.-Vol. 16.-P. 147-151.
- Winkelmann T, Geier T. and Preil W.//Plant Cell, Tissue and Organ Culture.-2006.-Vol. 86.-№ 3.-P. 319327.
- Xing Y., Yu Y., Luo X., et al.//Biologia Plantarum.-2010.-Vol. 54.-№ 2.-P. 231-236.
- Yakushenko E.V., Lopatnikova J.A., Khrapov E.A., et al.//In: Egorov A.M. and Zaikov G.E. (eds). New Research on Biotechnology and Medicine. M., 2006.-P. 97-107.
- Yang W., Jizhe C., and Cuiling L.//Acta Horticulturae Sinica.-2005.-Vol. 32.-№ 4.-P. 701-703.
- Yoon B.J., Yang C.D., Do J.W., et al.//Breeding Science.-2006.-Vol. 56.-P. 31-38.
- Zagorska N.A., Shtereva L.A., Kruleva M.M., et al.//Plant Cell Rep.-2004.-Vol. 22.-P. 449-456.
- Zenkteler M., Zenkteler E., and Dostatnia I.//Acta Biologica Cracovensia Series Botanica.-2006.-Vol. 48.-№ 2.-P. 121-125.
- Zhang F., Aoki S., Takahata Y.//Euphytica.-2003.-Vol. 131.-P. 207-213.
- Zhang F.L. and Takahata Y.//Breed. Science.-1999.-Vol. 49.-P. 161-166.
- Zhang G. Z.//Patent CN 1836496, 2006.09.27.
- Zhang G., Tang G., Song W., et al.//Euphytica.-2004.-Vol. 140.-P. 181-187.
- Zhang G.G., Rodrigues L., Rovinski B. et al.//Molecular Biotechnology.-2002.-Vol. 20.-№ 2.-P. 131-136.
- Zheg S.J., Henken B., Krens F.A., et al.//In Vitro Cell. Dev. Biol.-Plant.-2003.-Vol. 39.-P. 288-292.


