Биотехнологии в лечении локальных хрящевых и костно-хрящевых дефектов мыщелков бедренной кости
Автор: Лазишвили Гурам Давидович, Кузин Виктор Васильевич, Гордиенко Дмитрий Игоревич, Страхов Максим Алексеевич, Дошлова Дарья Васильевна, Шпак Мария Александровна, Данилов Максим Александрович, Гаев Тимофей Геннадьевич
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Клинические исследования
Статья в выпуске: 1 (17), 2016 года.
Бесплатный доступ
Статья посвящена актуальному направлению современной ортопедии - хирургическому лечению локальных хрящевых и костно-хрящевых дефектов коленного сустава. В последние годы в клинической практике находят все более широкое применение биотехнологии. В статье представлен анализ результатов использования технологии AMIC, основанной на имплантации коллагеновой матрицы у 54 больных с локальными хрящевыми и костнохрящевыми дефектами мыщелков бедренной кости. Наилучшие результаты лечения достигнуты в группе больных с локальными дефектами гиалинового хряща. Изучение исходов одномоментной пластики искусственной костью и имплантации коллагеновой матрицы показало бесперспективность такого метода лечения у больных с обширными костно-хрящевыми дефектами мыщелков бедренной кости.
Коленный сустав, рассекающий остеохондрит, локальные дефекты хряща, костные дефекты, технология amic, коллагеновая матрица, костная пластика, костные трансплантаты
Короткий адрес: https://sciup.org/142211397
IDR: 142211397
Текст научной статьи Биотехнологии в лечении локальных хрящевых и костно-хрящевых дефектов мыщелков бедренной кости
Лечение заболеваний и повреждений суставного гиалинового хряща - актуальная проблема современной ортопедии, а хирургическая коррекция локальных дефектов гиалинового хряща на сегодняшний день одна из сложнейших задач для практикующего врача.
Наше исследование посвящено современным подходам в лечении обширных локальных хрящевых и костно-хрящевых дефектов мыщелков бедренной кости, которые диагностируют в 0,3– 30% случаев травм и заболеваний коленного сустава (КС) [1, 2].
В Европе ежегодно выполняют более 300 тыс. операций по коррекции локальных дефектов суставного хряща [3]. Многие применяемые методы хирургического лечения такой патологии хряща (туннелизация, микрофрактурирование, абразия) уже устарели и, как показывают многочисленные исследования, малоэффективны.
Отдельной нозологической формой хронического локального костно-хрящевого поражения является рассекающий остеохондрит, именуемый в литературе как болезнь Кёнига. Он составляет до 2% всех заболеваний КС и наиболее часто встречается в возрастных группах 11–13 и 20–40 лет [4, 5]. Этиология поражения хряща при этом заболевании до сих пор остается не до конца понятной: травма, ишемия, нарушения процесса оссификации, конституциональные и генетические факторы, болезнь перегрузки и др.
Анализ отдаленных исходов, применяемых до сих пор во многих клиниках способов пластики хрящевых и костнохрящевых дефектов мыщелков бедра, таких как аутогенная или аллогенная костно-хрящевая трансплантация (мозаичная хондропластика) показал, что эти методики далеки от идеала, не позволяют полноценно восстановить дефект и конгруэнтность суставной поверхности пораженного мыщелка. Одна из основных проблем при обширных поражениях мыщелков, с которой можно столкнуться во время операции, это дефицит пластического материала.
В последние годы мы отдаем все большее предпочтение технологии индуцированного на матрице аутохондрогенеза —
AMIC (Autologus Matrix Induced Chondrogenesis). Технология AMIC основана на туннелизации субхондральной кости и репаративной способности мезенхимальных стволовых клеток, поступающих через туннелизационные отверстия. Образующийся в результате этого суперсгусток из цитокинов и стволовых клеток красного костного мозга стабилизируется коллагеновой матрицей Chondro-Gide, имплантируемой на костно-хрящевой дефект, стимулируя репарацию хряща [5, 6].
Преимущества технологии AMIC очевидны: малоинвазивная одноэтапная процедура, не требующая культивирования хондроцитов; возможность восстановления крупных дефектов хряща; простая хирургическая техника; подтвержденная эффективность в отношении купирования болевого синдрома, восстановления функции коленного сустава и удовлетворенности больных исходами лечения.
Используемая нами матрица ChondroGide синтезирована из свиного коллагена I и III типа, который резорбируется естественным путем. На сегодняшний день коллагеновая матрица является ведущим биологическим материалом для восстановления хрящевой ткани, положительно влияющей на дифференцировку стволовых клеток и хондрогенез. Она позволяет стабилизировать и защитить сгусток из стволовых клеток в зоне повреждения хряща. Матрица имеет двухслойную структуру, что препятствует проникновению мезенхимальных стволовых клеток в полость КС. Пористый слой матрицы состоит из рыхлых коллагеновых волокон, способствующих проникновению стволовых клеток в матрицу и их адсорбции. Структура матрицы имеет высокую устойчивость к растяжению, что препятствует ее разрыву. Фиксацию матрицы осуществляли с помощью фибринового клея либо швов.
Операцию считали показанной при полнослойных (стадия 3–4 классификация ICRS) хрящевых и костно-хрящевых дефектах контактных поверхностей мыщелков бедренной кости размером 2–7 см2. Обязательными условиями считали наличие неповрежденного, окружающего дефект гиалинового хряща, жизнеспособной субхондральной кости и нормальной механической оси нижней конечности.
К противопоказаниям к операции отнесли: наличие множественных локальных повреждений хряща, в том числе «целующихся повреждений»; распространенный остеоартроз КС; системные аутоиммунные заболевания; нестабильность КС, обусловленную повреждением связок и менисков; вальгусную или варусную деформацию голени, требующую выполнения корригирующих операций; аллергию на коллаген.
Приводим клинический пример, демонстрирующий основные этапы операции и свидетельствующий о высокой эффективности технологии AMIC.
Клинический пример: Больная А., 24 лет, поступила в клинику с жалобами на боли в левом коленном суставе. Длительность анамнеза заболевания более 2-х лет. При МРТ и МСКТ исследованиях диагностирована болезнь Кенига медиального мыщелка бедренной кости (рис. 1, 2)
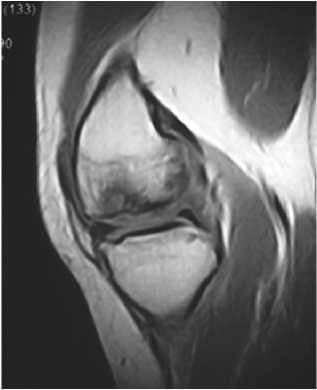
Рис. 1. МРТ картина болезни Кёнига медиального мыщелка бедра у больной А.
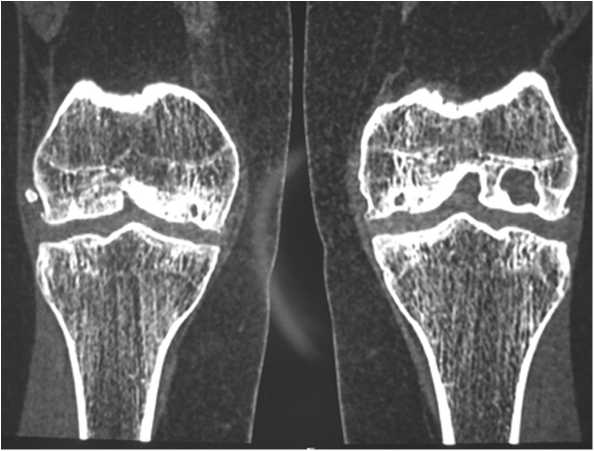
Рис. 2. МСКТ картина болезни Кёнига медиального мыщелка бедра у больной А.
В плановом порядке выполнена операция, во время которой некротизированная хрящевая пластина легко отделилась от своего ложа. После выравнивания краев дефекта и санации его дна образовался дефект хряща округлой формы размером 2×2 см (рис. 3). Сверлом диаметром 2,4 мм произведена туннели-зация субхондральной кости дна дефекта (рис. 4). Алюминиевым шаблоном смоделированы форма и размеры дефекта хряща (рис. 5). Коллагеновая матрица, смоделированная по форме алюминиевого шаблона, фиксирована пористой поверхностью к субхондральной кости фибриновым клеем. (рис. 6). Достигнута прочная фиксация матрицы. Реабилитационная программа по стандартному протоколу.
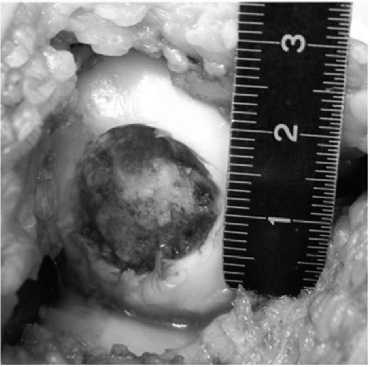
Рис. 3 Форма и размеры дефекта хряща после его санации
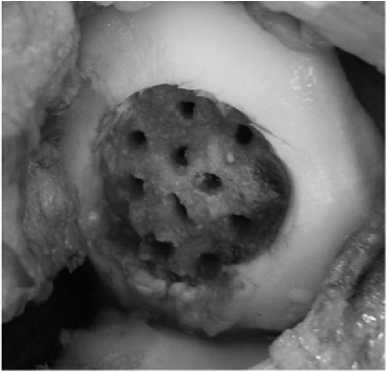
Рис. 4. Субхондральная кость после туннелизации
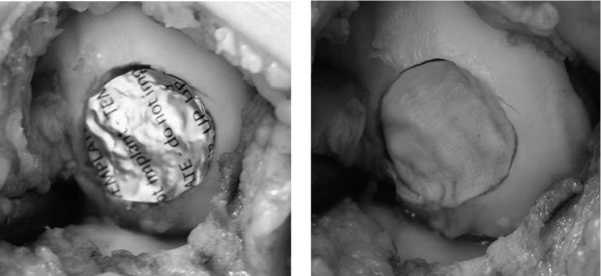
Рис. 5. Моделирование формы и размера дефекта хряща алюминиевым шаблоном
Рис. 6. Имплантация коллагеновой матрицы
Приводим клинический пример, демонстрирующий основные этапы одномоментной костной пластики c имплантацией коллагеновой матрицы и отрицательный исход этой операции.
Клинический пример. Больной М., 27 лет, профессиональный спортсмен, поступил в клинику с жалобами на боли в правом КС. При МРТ-диагностике выявлена болезнь Кенига медиального мыщелка бедренной кости (рис. 8, 9). В плановом порядке выполнена операция, во время которой предоперационный диагноз полностью подтвердился (рис. 10). Некротизированная хрящевая пластина легко отделилась от своего ложа (рис. 11). Выполнено выравнивание краев дефекта и санация его дна. Субхондральная кость удалена до здоровых кровоточащих слоев. Окончательные размеры дефекта составили 2,5 × 2,5 см при глубине поражения 8 мм (рис. 12). Произведены тун-
Через 8 месяцев после операции отмечено полное восстановление функция КС, тонуса и силы четырехглавой мышцы бедра. Больная приступила к занятиям спортом. Через 1,4 года в результате спортивной травмы у больной произошел разрыв заднего рога медиального мениска. Выполнена артроскопическая резекция мениска. Во время операции исследована зона имплантации коллагеновой матрицы, которая полностью была укрыта стабильной хрящевой тканью (рис. 7). Дисконгруэнтности мыщелка в области имплантации матрицы не определено. Отдаленный исход лечения расценен как хороший.
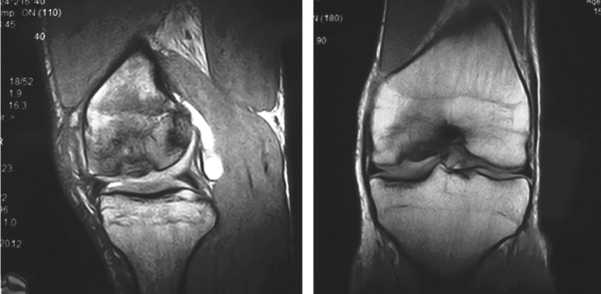
Рис. 8. МРТ картина болезни Кенига медиального мыщелка бедра у больного М.
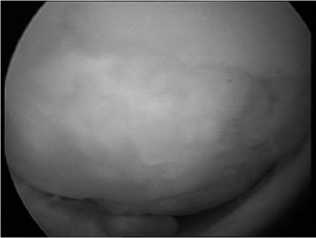
Рис. 7. Артроскопическая картина через 1,4 года – дефект мыщелка полностью закрыт стабильной хрящевой тканью
Особенное внимание сегодня уделяем состоянию субхондральной кости в области дна дефекта мыщелка. Выраженный склероз и некроз субхондральной кости, а также отсутствие «кровяной росы» после туннелизации субхондральной кости свидетельствуют о ее нежизнеспособности. В таких случаях считали показанным выполнение санации (удаление) нежизнеспособной кости до здоровых кровоточащих слоев с последующей пластикой образовавшегося дефекта искусственной костью в виде гранул. Однако, анализ отдаленных исходов этих операций у 5 больных показал ошибочность такой тактики. У всех 5 пациентов по данным МРТ и МСКТ определялось отсутствие перестройки искусственной кости, а ревизионная артроскопия выявила разрушение коллагеновой матрицы в сроки до 2-х лет после её имплантации. Результаты этих операций были расценены как неудовлетворительные, что позволило нам сделать вывод о том, что одномоментная пластика дефекта искусственной костью и имплантация коллагеновой матрицы бесперспективны!
Рис. 9. МРТ картина болезни Кенига медиального мыщелка бедра у больного М.
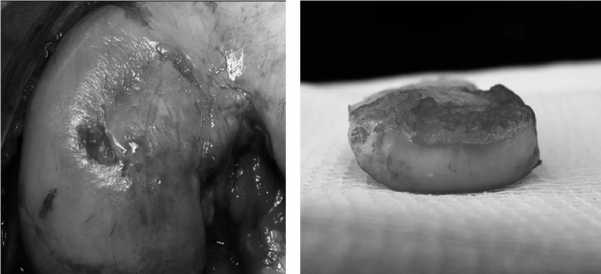
Рис.11. Отделенная некротизированная хрящевая пластина
Рис. 10. Некротизированная хрящевая пластина. В последующем легко отделилась от своего ложа
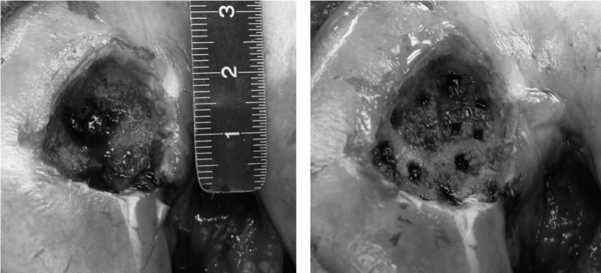
Рис.12. Форма и размеры дефекта мыщелка после его санации
Рис. 13. Дефект мыщелка после туннелизации субхондральной кости
нелизация дна дефекта (рис. 13) и моделирование дефекта алюминиевым шаблоном (рис. 14). Дефект мыщелка заполнен искусственной костью в виде гранул (рис. 15). Конгруэнтность суставной поверхности мыщелка бедра была восстановлена. На искусственную кость нанесен фибриновый клей (рис. 16). Коллагеновая матрица, смоделированная по форме алюминиевого шаблона, уложена пористой поверхностью на клей и плотно фиксирована к искусственной кости (рис. 17). Достигнута прочная фиксация матрицы. Реабилитационная программа по стандартному протоколу.
Через 9 месяцев после операции больной приступил к занятиям спортом (баскетбол). Через 2 года после операции во время контрольного МСКТ обследования выявлено отсутствие перестройки искусственной кости, заполняющей дефект мыщелка и его дисконгруентность (рис.18). Больному выполнена
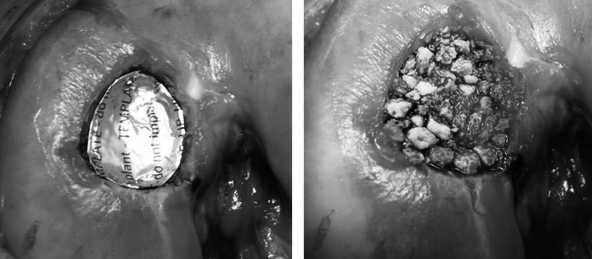
Рис. 15. Заполнение дефекта искусственной костью
Рис. 14. Моделирование формы и размера дефекта алюминиевым шаблоном
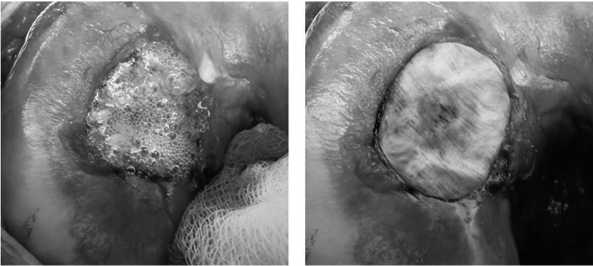
Рис. 17. Закрытие дефекта коллагеновой матрицей
Рис. 16. Нанесение фибринового клея на искусственную кость
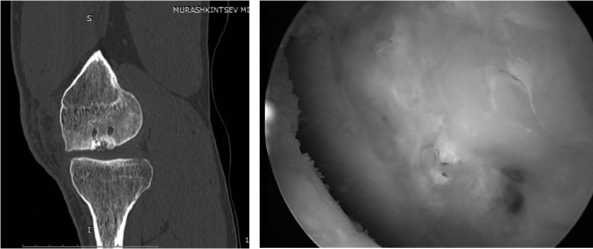
Рис. 18. МСКТ через 2 года после операции. Отсутствуют конгру-ентность суставной поверхности мыщелка и перестройка искусственной кости
Рис. 19. Ревизионная артроскопия через 2 года после операции. Определяется разрушение коллагеновой матрицы
Рис. 22. Заполнение донорского отверстия биокомпозитным материалом
ревизионная артроскопия, во время которой исследована зона имплантации коллагеновой матрицы. Обнаружено разрушение коллагеновой матрицы и отсутствие перестройки искусственной кости, которая так и осталась в виде гранул (рис. 19). Исход лечения расценен как неудовлетворительный.
Понимая бесперспективность одномоментной пластики костного дефекта мыщелка биокомпозитным материалом и имплантации коллагеновой матрицы, в последнее время мы стали заполнять дефект мыщелка измельченной спонгиозной аутокостью. Взятие донорского костного трансплантата производили из бокового отдела противоположного мыщелка бедра циллиндрической полой фрезой диаметром 8–10 мм (рис. 20). Донорский дефект заполнялся биокомпозитным материалом Syntricer на основе b-трикальцийфосфата (рис. 22), форма и размеры которого соответствовали костному трансплантату (рис. 21). Такая операция выполнена у 6 пациентов. Исходы этих операций находятся на стадии анализа.
За период с 2008 по 2016 г. в клинике на лечении находились 52 больных с локальными хрящевыми и костно-хрящевыми дефектами мыщелков бедренной кости. У 39 больных имелось поражение медиального мыщелка бедра, у 13 — латерального мыщелка. У 38 пациентов была диагностирована болезнь Кенига с поражением субхондральной кости. Все пациенты с болезнью Кенига имели длительный (от 6 месяцев до 5 лет) анамнез заболевания.
У 14 больных имелись локальные полнослойные дефекты хряща без поражения субхондральной кости. У 9 пациентов локальные поражения хряща обнаружены артроскопически

Рис. 20. Взятие костного трансплантата Рис. 21. Костный трансплантат и цилиндрической фрезой биокомпозитный материал Syntricer при выполнении операций, связанных с разрывами менисков и связок КС. У всех этих больных образование дефектов хряща мы связываем с травмой.
Костная пластика и имплантация коллагеновой матрицы выполнены 34 больным с болезнью Кенига. В 28 наблюдениях использовалась гранулированная искусственная кость Orthoss, а у 6 пациентов – аутокость.
4 пациентам костную пластику не проводили. Сегодня, считаем такой подход грубейшей ошибкой, так как при поражении субхондральной кости имплантацию коллагеновой матрицы без костной пластики дефекта полагаем бесперспективной.
Отдаленные результаты изучены у 39 пациентов. Максимальный срок наблюдения составил 8 лет. Ближайший срок оценки отдаленных исходов считали 6-7 месяцев со дня операции. Как правило, к этому сроку происходило полное восстановление функции оперированного коленного сустава, тонуса и силы мышц конечности. Большинство пациентов вернулись к прежнему уровню физической активности.
Объективную оценку функционального состояния коленного сустава производили по шкалам IKDC, ICRS и Lysholm. У 34 пациентов исходы лечения расценены как хорошие — все пациенты вернулись к прежнему уровню физической активности при отсутствии (или значительном снижении) болевого синдрома и синовита, полном восстановлении функции коленного сустава.
У 4 пациентов с болезнью Кенига, которым не выполняли костную пластику дефекта, отмечено прогрессирование заболевания, документированное МРТ- и КТ-диагностикой. В одном наблюдении во время ревизионной артроскопии, выполненной в связи с сохраняющимся длительное время выраженным болевым синдромом, обнаружено полное разрушение имплантиро- ванной матрицы. Исходы лечения у этих больных расценены как неудовлетворительные, что потребовало выполнения повторных операций с костной пластикой дефекта мыщелка.
В заключение хотим отметить, что в проблеме лечения локальных дефектов хряща много спорных, требующих разрешения вопросов. Проведенный анализ клинического материала и данных литературы еще раз подтверждает высокую актуальность данного направления хирургии и необходимость дальнейшей разработки многих узловых положений этой проблемы.
Список литературы Биотехнологии в лечении локальных хрящевых и костно-хрящевых дефектов мыщелков бедренной кости
- Маланин Д.А., Писарев В.Б., Новочадов В.В. Восстановление повреждений хряща в коленном суставе. Экспериментальные и клинические аспекты. Волгоград: Волгоградское научное издательство, 2010. 455 с.
- Alford J.W., Cole B.J. Cartilage restoration, part 1: basic science, historical perspective, patient evaluation and treatment options//Am J Sports Med. 2005. V 33. № 2. P.2 95-306.
- Anders S., wiech O., Schaumburger J. et al. Autologus Matrix induced chondrogenesis (AMIC) for focal chondal defects of the knee -first results//J Bone Joint Surg Br. 2009. V. 91. Suppl. 1. P. 83-87.
- Hunziker E.B. Biologic repair of articular cartilage. Defect models in experimental animals and matrix requirements//Clin Orthop Relat Res. 1999. V 367. Suppl. 1. P. 135-146.
- Jacob R.P. AMIC technique for cartilage repair, a single-step surgical intervention as compared to other methods//Eur Cell Mater. 2006. V 12. Suppl. 1. P 26-32.
- Kramer J., Bohrnsen F., Lindner U. et al. In vivo matrix-guided human mesenchymal stem cells//Cell Mol Life Sci. 2006. V.63. №5. P 616-626.


