Биотехнология воспроизводства и использования бурых водорослей-макрофитов
Автор: Шкляревич Галина Андреевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 2 (107), 2010 года.
Бесплатный доступ
Водоросли-макрофиты, акватория белого моря, марикультура, температура, соленость, адаптации, биохимический состав
Короткий адрес: https://sciup.org/14749680
IDR: 14749680
Текст статьи Биотехнология воспроизводства и использования бурых водорослей-макрофитов
К настоящему времени накопилась обширная литература как по вопросам биологии и экологии промысловых видов водорослей-макрофитов (см., например, [9]), так и по вопросам биотехнологии воспроизводства и хозяйственного использования сырьевых запасов морских водорослей. Очень актуально сейчас решение проблем создания технологических экосистем и связанные с этим разработки морских биотехнологий, включая приполярную марикультуру.
Марикультура (морская аквакультура) в широком смысле – активное вмешательство в управление биологическими процессами в морской среде. Эти процессы могут иметь различный характер: от биологической мелиорации (прореживание природных зарослей и пр.) до искусственного выращивания морских гидробионтов и получения новых вариететов организмов с заданными, необходимыми человеку, свойствами.
Эксплуатация природных зарослей водорослей, преимущественно ламинариевых, в северных морях началась довольно давно. В начале XX века появились первые предприятия по переработке ламинарии, специализирующиеся на получении йода и альгината.
В Белом и Баренцевом морях проводится экспериментальное выращивание водорослей для выяснения механизмов репродукции, адаптации и регуляции роста, а также накопления биологически активных веществ в условиях высоких широт. Исследования проводятся с привлечением методов биохимии, физиологии, цитологии; анализируется влияние плантации на гидрохимические характеристики среды; изучается обрастание культивируемых макрофитов эпибионтами. В последние годы исследовалась возможность ведения бикультуры, то есть выращивания на ламинариевых плантациях и других видов гидробионтов, в том числе фукусовых водорослей и двустворчатых моллюсков Mytilus edulis.
Активные промысел и использование фукусовых водорослей начались только в последние годы, после того как было показано, что они, как и ламинариевые, обладают лечебными свойствами и могут широко применяться в медицине и пищевой промышленности. Ранее фукоиды использовались только как сырье для производства йода, пищевая добавка в корм скоту и в качестве удобрений в сельском хозяйстве.
Сотрудниками лаборатории альгологии Мурманского морского биологического института (ММБИ) при участии в исследовательских работах сотрудников других организаций (ПИНРО, ВНИ-РО, ИНБЮМ) была создана биотехнология культивирования ламинарии сахаристой в условиях Баренцева моря (работы проводились под руководством В. Н. Макарова) [6]. Урожай, собранный с первой опытно-промышленной плантации ламинарии в губе Дальнезеленецкая Баренцева моря, показал, что ламинариевые хозяйства в условиях Севера могут быть высокорентабельными. Ниже приводится краткое изложение биотехнологии ведения культуры Laminaria saccharina [6].
БИОТЕХНОЛОГИЯ КУЛЬТИВИРОВАНИЯ
Выращивание ламинарии производится в поверхностных слоях воды от 0,5 до 6–8 м на плантационных установках, представляющих собой систему из синтетических веревок и канатов, закрепленных с помощью якорей из бетонных массивов или каменных глыб и поддерживаемых в толще воды с помощью поплавков (рис. 1).
В качестве субстрата для выращивания ламинарии используются веревки, на которые производится посев зооспор ламинарии. Зооспоры ламинарии получают от зрелых спороносных растений, которые отбирают из естественных зарослей или с плантации. Для получения зооспор осуществляется стимулирование их выхода из спорангиев. Процесс стимулирования заключается в выдерживании спороносной ламинарии при определенном режиме вне воды. После окончания стимулирования ламинарию погружают в емкость с морской водой, где в течение часа происходит интенсивный выход зооспор. Полученную суспензию разбавляют морской водой, доводят до расчетной концентрации и разливают в посевные емкости. Затем в посевную емкость с суспензией зооспор помещают субстраты, которые выдерживают в ней в течение суток. За это время зооспоры успевают осесть и закрепиться на субстратах. После окончания посева субстраты размещаются на плантации. Дальнейшее участие человека в процессе культивирования заключается в регулировании плавучести плантационных установок и поддержании их целостности.
ВЫБОР МЕСТА ДЛЯ ПЛАНТАЦИИ
Установки для выращивания ламинарий следует располагать в полузащищенных бухтах с хорошим водообменом за счет приливно-отливных течений и относительно защищенных от воздействия штормовых волн на глубине от 10–15 до 30 м, с ровным рельефом дна, с преобладанием илисто-песчаного грунта (для удержания якорей). Глубина в местах размещения установок должна быть такой, чтобы исключить касание субстратами грунта, иначе субстраты будут перепутываться, что затруднит уход за плантацией и приведет к потере урожая. Размещение установок на больших глубинах приведет к их удорожанию и затруднит водолазный контроль за техническим состоянием конструкций. В случае отсутствия опасности срыва установок льдом они могут быть размещены на участках с глубиной 10 м; если такая опасность существует, то установки следует размещать на глубине 15 м и более, чтобы имелась возможность притапливать их на зимний период.
ПОДГОТОВКА ЕМКОСТЕЙ ДЛЯ ПОСЕВА
Для посева предлагается использовать любые емкости из нетоксичного материала: ванны из нержавеющих сплавов или пластмассы. Следует защищать субстраты от воздействия прямых солнечных лучей. Для предупреждения интоксикации спор растворимыми веществами, которые могут быть в материале емкости, последние тщательно промывают и вымачивают в течение 1–2 недель с обязательной сменой воды не менее одного раза в сутки. Еще лучше полностью погрузить емкости на этот период в проточную воду или в море.
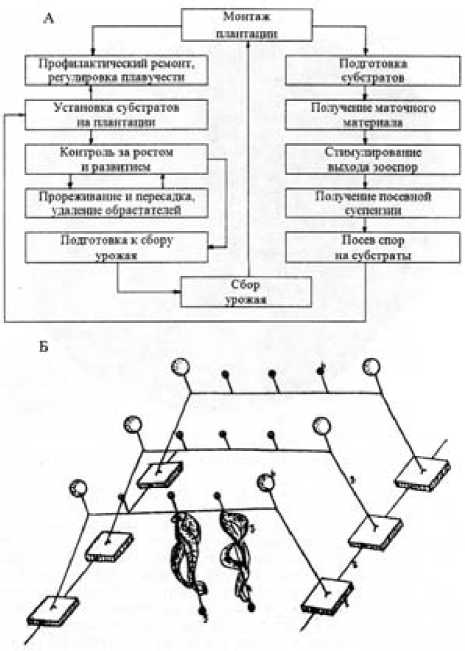
Рис. 1. Схема биотехники культивирования (А) и схема плантации (Б):
1 – бетонные массивы массой 2 т; 2 – трос металлический; 3 – трос капроновый; 4 – субстраты длиной 5 м и диаметром 5 мм; 5 – груз свинцовый массой 0,5 кг; 6 – поплавки; 7 – талломы ламинарии [6]
ПОДГОТОВКА СУБСТРАТОВ
Подготовка субстратов заключается в их вымачивании и стерилизации. В качестве субстратов для выращивания ламинарии используют сеточник из капрона или других синтетических материалов диаметром около 5 мм и длиной 5 м. Вымачивание можно производить в проточной морской или пресной воде, сменяемой не реже одного раза в сутки. Это необходимо для предупреждения интоксикации спор растворимыми веществами, остающимися на капроновом волокне после его производства. Затем субстраты в течение нескольких (3–7) дней стерилизуют для удаления осевших на них микроорганизмов путем подсушивания на солнце или прогрева в воде при температуре 70–80 °С в течение 2 ч или кратковременного погружения в кипящую воду. При значительном количестве бактерий на субстратах элиминация ламинарии на ранних стадиях развития резко возрастает, поэтому стерилизации субстратов следует уделять особое внимание.
ОТБОР МАТОЧНЫХ РАСТЕНИЙ
Отбираются крупные здоровые растения со зрелыми спороносными пятнами. Спороносное пятно в зрелом состоянии имеет темнокоричневую окраску в проходящем и отраженном свете и заметно выступает над поверхностью пластины. Верхняя часть зрелого пятна может иметь более светлый оттенок в связи с начавшимся выходом спор. Маточные растения необходимо предохранять от воздействия прямых солнечных лучей, от атмосферных осадков и обсыхания, под влиянием которых споры могут быстро потерять жизнеспособность.
СТИМУЛИРОВАНИЕ ВЫХОДА ЗООСПОР
Заключается в выдерживании спороносных растений на воздухе. Стимулирование маточных растений проводят на вешалах в прохладном помещении с хорошей вентиляцией, с оптимальной температурой 10 °С, допустимой является температура 5–15 °С. Отобранные маточные растения или их части со спороносными пятнами промывают профильтрованной морской водой и развешивают на вешалах так, чтобы растения не соприкасались друг с другом. Продолжительность стимулирования зависит от температуры, влажности, подвижности воздуха в помещении, и в каждом конкретном случае подбирается определенный режим в результате контроля за динамикой выхода спор. В большинстве случаев хороший выход спор начинается не ранее чем через 12 ч после начала стимулирования. Длительность стимулирования можно в значительной мере увеличить (до 3– 4 сут.), если пластины ламинарии после исчезновения капельной влаги скрутить в трубку, проложив бумагой, и поместить в холодное помещение при температуре, близкой к 0–5 °С.
КОНТРОЛЬ ЗА ВЫХОДОМ СПОР
На спороносное пятно у 3–5 растений пипеткой наносится несколько капель морской воды. Спустя 15 мин капли собирают, переносят на предметное стекло и просматривают под микроскопом. Обычно контроль ведется при увеличении в 120 раз. Выход спор считается нормальным, если в поле зрения в большинстве капель находится более 100 спор.
Перед проведением посева полезно осуществить контрольное стимулирование ламинарии для определения режима стимулирования и расчета необходимого количества маточных растений. Расчет проводится следующим образом. После стимулирования части растений с определенной площадью спороносного пятна помещают в отдельные емкости и заливают морской водой. Через час кусочки вынимают из емкости, а суспензию доводят до определенного объема. С помощью камеры Горяева определяют количество спор в единице объема, и затем подсчитывают среднее количество спор, которое можно получить от одного растения. На основе опыта культивирования известно, что нормальным является посев, когда на 1 мм2 верхней поверхности контрольного стекла насчитывается 50–100 спор (контролем служит предметное стекло, закладываемое вместе с субстратами в посевную емкость). Если предположить, что споры оседают на веревочный субстрат так же, как на стекло, то на полезной площади одного субстрата, равной его диаметру, умноженному на его длину (при длине субстратов 5,5 м и диаметре 5 мм она составит 2,75 · 104 мм), должно находиться 1,4–2,8 млн спор.
Определив, сколько зооспор дает одно растение, можно рассчитать, какое количество растений необходимо для проведения посева на определенное число субстратов. Исследования показывают, что зрелое слоевище ламинарии сахаристой при правильно проведенном стимулировании может давать около 130 тыс. спор с 1 мм2 спороносного пятна. Средняя площадь спороносного пятна составляет 50–60 тыс. мм2. Следовательно, одно растение дает около 65–78 · 108 спор, что является достаточным для засева 2300–2500 субстратов длиной 5,5 м. Однако добиться столь высокого выхода спор не всегда удается. Кроме того, часть спор оседает на дне и стенках емкости, в которой производится посев, часть спор не закрепляется на субстрате, поэтому приходится увеличивать количество маточных растений по отношению к теоретически рассчитанной величине в 10–20 раз.
ПОСЕВ СПОР НА ИСКУССТВЕННЫЕ СУБСТРАТЫ
Сразу после окончания стимулирования производится посев спор на заранее подготовленные веревочные субстраты. В экспериментах в качестве субстрата наилучшими оказались 5метровые отрезки капронового сеточника диа- метром 5 мм. Посев спор можно проводить различными способами. Наиболее простым является способ, когда субстраты и стимулированная ламинария укладываются в емкости для посева слоями и заливаются морской водой. Однако этот способ не позволяет учесть концентрацию осевших спор, что ведет к нестабильности результатов посева. Второй, часто применяемый, способ предусматривает предварительное получение суспензии спор и доведение ее до расчетной концентрации, после чего в суспензию опускаются заранее подготовленные субстраты. Этот способ более экономичен, так как позволяет полно и эффективно использовать маточный материал и регулировать концентрацию осевших спор.
Иногда используется посев на промежуточные субстраты с последующей пересадкой проростков. В качестве субстрата часто применяют резиновые полосы. После того как проростки достигнут не менее 15–20 см длины, их снимают с резиновых полос. Полученная рассада вплетается между прядями капроновой веревки пучками по 3–5 экземпляров через каждые 10 см. Процесс пересадки весьма трудоемок, однако в результате оптимального распределения водорослей на субстрате обеспечиваются высокие урожаи. В качестве промежуточного субстрата можно использовать капроновые нити, которые наматываются в один слой на специальные рамы. После того как ламинария на нитях достигнет в длину 2–5 мм, нити наматываются на основные капроновые веревки, или отрезки нитей длиной 3–5 см вставляются между прядями веревки через каждые 10 см. Ламинария, растущая на нитях, вскоре прочно прикрепится к основным субстратам.
УХОД ЗА ПЛАНТАЦИЕЙ.
ПЕРВЫЙ ГОД ВЫРАЩИВАНИЯ
После размещения субстратов с веревками на морских установках необходимо проводить периодический осмотр и уход за ними. В районах, где образуется ледовый покров, перед ледоставом установки необходимо заглубить, чтобы предупредить их повреждение при подвижке льда. Весной, как только море освободится от льда, необходимо сразу же поднять установки к поверхности моря.
Когда проростки достигнут длины 10–15 см, можно приступать к их прореживанию и пересадке. Одновременно с субстратов удаляется и основная масса организмов-обрастателей. Субстраты, на которых проростки отсутствуют или их очень мало, следует снять с установки и на их место закрепить новые, с вплетенными проростками. Пересадка ламинарии производится пучками по 3–5 экземпляров через каждые 10 см. Для пересадки желательно подбирать растения на одном субстрате приблизительно одинаковых размеров. При прореживании и пересадке необ- ходимо предохранять проростки от прямых солнечных лучей и высыхания.
Наиболее крупные растения с высокими темпами развития следует пересаживать на отдельные субстраты для создания маточного фонда. При снятии рассады с субстратов и пересадке необходимо обращаться с растениями осторожно, чтобы избежать повреждений. В летний период субстраты с проростками периодически очищают от обрастателей. Когда ламинария на субстратах достигнет длины 20 см, обрастатели можно не удалять, так как на рост растений такого размера они уже не оказывают существенного влияния. Техническое обслуживание установок плантации производится согласно инструкции по их эксплуатации.
ВТОРОЙ ГОД ВЫРАЩИВАНИЯ ЛАМИНАРИИ
В тех районах, где образуется ледяной покров, осенью установки заглубляются для предупреждения их повреждения при подвижках льда, а весной, после схода льда, они вновь поднимаются к поверхности. В зимних условиях в районах с образованием ледового покрова никаких работ на плантации не производится. В районах, свободных от льда, установки не заглубляются на зимний период. В течение зимы ведется технический контроль за состоянием установок после сильных штормов. Проводить работы на плантации в зимний период чрезвычайно сложно, поэтому следует ограничиться ремонтными работами при серьезных повреждениях плантации.
Уборку урожая с плантации можно начинать со второй половины июля (второй год выращивания ламинарии). К этому времени ламинария достигает кондиционных размеров и массы, и на ней практически отсутствуют обрастатели. Ламинария в это время представляет собой высококачественное сырье. Для получения более высокого урожая можно проводить сбор ламинарии в начале осени, когда масса растений достигает наибольшей величины, но к этому времени на пластине появляется значительное количество обрастателей, и качество сырья ухудшается. При более позднем сборе ламинарии неизбежны потери урожая.
На третий год остается только небольшая часть плантации, на которой выращиваются маточные растения для получения высококачественного спороносного материала. После снятия урожая субстраты и горизонтальные канаты очищаются. Выборочно проверяется прочность всех элементов конструкции установок, и делается заключение о возможности их повторного использования.
СОВЕРШЕНСТВОВАНИЕ БИОТЕХНОЛОГИИ ВЫРАЩИВАНИЯ ЛАМИНАРИИ
Одним из путей совершенствования биотехнологии выращивания ламинарии является пе- реход на одногодичное выращивание в условиях плантации. Одногодичное культивирование ламинариевых водорослей, применяемое в практике водорослеводческих хозяйств в странах ЮгоВосточной Азии (Японии, Китае, Северной Корее), а также внедряемое в Приморье, основано на выращивании рассады ламинарии в регулируемых условиях наземных бассейнов и последующей пересадке рассады на плантационные субстраты. Данный способ требует значительных капитальных затрат, сложного оборудования и относительно больших энергозатрат на поддержание температурных и световых условий.
В лаборатории альгологии ММБИ определена возможно сть и целесообразность использования проростков ламинарии сахаристой из естественных зарослей, что позволяет сократить сроки плантационного выращивания от 5 месяцев до одного года. Кроме того, был разработан и апробирован метод условно одногодичного культивирования ламинарии сахаристой с использованием компактных субстратов. Предлагаемый нами метод компактных субстратов позволяет сократить время плантационного выращивания ламинарии до одного года и при этом отказаться от использования дорогостоящего, требующего квалифицированного обеспечения энергозатратного оборудования наземных бассейнов. Компактные субстраты, разработанные сотрудниками лаборатории альгологии, были изготовлены кооперативом «Плантация» и испытаны на гидродинамическое воздействие на экспериментальной плантации в губе Дальнезеле-нецкая (Баренцево море) осенью 1990 года. Конструктивно субстрат представляет собой плотно упакованный в форме параллелепипеда полипропиленовый канат, уложенный ровными рядами, зафиксированный с помощью двух деревянных щитов, плотно стянутых с помощью стальных шпилек с резьбой и гайками на концах. В одном компактном субстрате упаковано 750 м полипропиленового каната окружностью 30 мм. Масса сухого субстрата – около 70 кг. Испытания показали, что конструкция субстратов отвечает требованиям прочности, так как она выдержала многократные значительные гидродинамические нагрузки, находясь под влиянием сильных штормов. При этом каких-либо повреждений, грозящих целостности субстратов, не обнаружено. Были отмечены некоторые технические недостатки данной конструкции субстратов, которые будут учтены при дальнейшей их доработке и разработке новых.
Другое направление совершенствования биотехнологии выращивания ламинарии, также успешно развиваемое в лаборатории альгологии ММБИ, заключается в получении культуры гаметофитов, которую можно использовать для посева в любое время года, вне сроков естественного спороношения ламинарии, и получать растения ламинарии с определенными химическими и морфологическими свойствами.
Новые знания, получаемые о биологических особенностях ламинарии сахаристой, в частности о ранних стадиях развития, способствуют совершенствованию биотехнологии культивирования объекта. Ранние стадии развития являются наиболее уязвимыми и наиболее важными, так как в конечном итоге они определяют урожай. В последние годы в лаборатории альгологии были получены сведения о влиянии ультрафиолетовой радиации на развитие спор, проростков. Показано, что природные дозы ультрафиолета могут вызывать гибель ламинарии на ранних стадиях развития. С возрастом растений толерантность к его воздействию увеличивается. Это свидетельствует о том, что оптимальным временем для постановки ламинариевой плантации является август – сентябрь, когда интенсивность ультрафиолетовой радиации снижается.
ОЦЕНКА СОСТОЯНИЯ НАУЧНОЙ ПРОРАБОТКИ ПРОБЛЕМЫ
Решение проблемы рациональной эксплуатации зарослей ламинарии – сложная многофакторная задача. Многие ее аспекты изучены недостаточно. Например, многолетняя динамика основных количественных характеристик остается практически неизученной. Экологические закономерности формирования урожая в пологе ламинарии в условиях плантационного выращивания представлены и обсуждаются на примере плантации Laminaria japonica на Дальнем Востоке и плантации Laminaria saccharina в Баренцевом море [10]. На конкретных примерах показано, что пространственная структура полога ламинарии в связи с движением воды и количеством биогенов является ведущим фактором научно обоснованного управления урожаем в марикультуре водорослей [10], [11]. Эти работы, важные с точки зрения развития методологии аквакультуры в целом, требуют своего продолжения.
Остается неизученной генетическая гетерогенность популяций Laminaria saccharina с точки зрения селекционной ценности особей, составляющих ту или иную популяцию. На начальных стадиях находятся исследования по криоконсервации репродуктивного материала водорослей, механизмам адаптации водорослей к факторам среды, поиску видов, перспективных для культивирования. Мало сведений о биологии субдоминантов сообществ Laminaria saccharina. Требуют продолжения исследования по влиянию ламинариевой плантации на абиотические и биотические комплексы, не проводилось обследования районов, пригодных для размещения водорослевых марихозяйств, без которых можно только ориентировочно, на основе предварительной экспертной оценки, базирующейся на данных о распределении водорослей, судить о пригодности того или иного района для размещения плантаций. Технические разработки конструкций плантаций в нашей стране сделаны только для нужд водорослевых марихозяйств Дальнего Востока (Приморье). В то же время специфика условий северных регионов требует специальных, адаптированных к данным условиям, проектов конструкций плантаций и средств их эксплуатации. Несмотря на то что разработанная и апробированная биотехника культивирования Laminaria saccharina в условиях Баренцева моря дает все основания считать перспективным широкомасштабное развитие культивирования ламинарии на Севере, социально-экономическая проработка этой проблемы до сих пор не проведена.
ВЕЩЕСТВА, ПОЛУЧАЕМЫЕ ИЗ ЛАМИНАРИИ
При любых биотехнологических работах встает вопрос о рентабельности метода технологии получения конечного продукта. Ламинария представляет ценность как продукт питания и как продуцент альгината, маннита, ряда других биологически активных веществ. Поэтому постоянно возникает вопрос о направленности искусственного культивирования ламинарии: на биомассу или на биологически активные вещества. Но даже при культивировании ламинарии на биомассу стоимость продукта зависит не только от качества пластины, но и от содержания в ней альгината, маннита, витаминов, микроэлементов.
Маннит. По содержанию маннита – шестиатомного спирта и его производных – Laminaria saccharina превосходит на несколько процентов дальневосточные виды ламинариевых, чем, собственно, и обусловлено ее название: ламинария сахаристая. При высушивании на поверхности талломов появляются иглы маннита, часто принимаемые за поверхностные плесневые образования. Маннит является одним из первых и, видимо, основных продуктов фотосинтеза. Он выполняет функцию запасного вещества, которое используется в синтезе структурных элементов клеточных стенок макрофитов. Возможно, что при некоторых условиях он может использоваться в процессе обмена, выполняя также осморе-гуляторную роль.
В исследованиях, проведенных на побережье Баренцева моря, нами установлено, что в летние месяцы содержание маннита и его производных у Laminaria saccharina максимально и достигает 30 %, уменьшаясь в зимние месяцы до 2–5 % [8]. Алъгиновая кислота , открытая в 1881 году Е. С. Стенфордом как побочный продукт при извлечении йода и выделенная в очищенном виде А. Крефтингом в 1896 году [2], является наиболее ценной из полисахаридов бурых водорослей. Она находится в клеточных стенках и межклеточных пространствах преимущественно в виде кальциевых, магниевых, железистых солей, а также альгинатов натрия и калия [12].
Альгинат является гетерогенным веществом, состоящим из фракций различных по растворимости и составу уроновых кислот, в основном из блоков маннуроновой (М) и гулуроновой (G), и из изменяющихся цепей этих двух мономеров. Блоки полиманнуроновой кислоты придают вязкость альгинатным растворам, блоки гулуроно-вой кислоты ответственны за силу геля и специфическое связывание двухвалентных ионов металлов. От изменяющихся цепей зависит структура альгинатов. В разных фракциях альгиновой кислоты, получаемых из разных видов водорослей, содержание маннуроновой и гулуроновой кислот различно. Содержание альгины в пластине ламинарии почти в 2 раза превышает таковое в стволиках. В фукусовых водорослях содержание этой кислоты в 1,5–2 раза меньше, чем в ламинариевых (см. таблицу) [6]. Значительных отличий по содержанию альгины между различными видами фукоидов не наблюдается.
Содержание альгиновой кислоты в бурых водорослях (губа Дальнезеленецкая,
|
Баренцево море, июль 1993 года) [6] |
|
|
Виды водорослей |
% сухого веса |
|
Laminaria saccharina пластина |
30–36 |
|
стволики |
19–25 |
|
Laminaria digitata пластина |
24–32 |
|
стволики |
14–19 |
|
Fucus vesiculosus |
16–21 |
|
Ascophyllum nodosum |
14–23 |
В большой степени свойства альгиновой кислоты и ее солей зависят от молекулярной массы этой кислоты. Ранее было отмечено [8], что средние значения молекулярной массы альгината натрия из ламинарии сахаристой с побережья Баренцева моря не подвержены сильным изменениям и лежат в пределах 80 000–130 000 дальтон. Наибольшее количество альгины в зимние месяцы содержится в центре пластины: на 17–20 % выше, чем в краевых частях, а в базальной зоне на 25–30 % ниже, чем в трех других частях пластины. В летние месяцы распределение альгиновой кислоты по пластине более равномерное, тем не менее наибольшее ее содержание обнаружено в центральной и краевой частях листа, что связано с ростом листовой пластины ламинарии. В работе [6] приводятся подробные исследования по местам локализации в талломе маннита и альгиновой кислоты и по сезонным изменениям их количественного содержания. Это очень важно, так как, например, в каталогах на водорослевую продукцию стоимость 1 кг ламинарии в зависимости от содержания полисахаридов может различаться более чем в 10 раз.
К сожалению, для исследованных водорослей отсутствуют сведения о наличии корреляции между изменением молекулярной массы и соотношением G- и М-кислот в онтогенезе и под влиянием факторов внешней среды, а именно, эти соотношения определяют наряду с качеством очистки и свойства альгината. От соотношения G- и М-кислот зависит, в частности, одно из главных свойств альгината – вязкость.
Сезонное содержание маннита подвержено сильным изменениям – от 3 до 30 %, тогда как сезонные изменения в содержании альгиновой кислоты колеблются в меньшей степени – в пределах 12–27 %. На Мурманском побережье Баренцева моря наиболее высокое содержание маннита и альгиновой кислоты наблюдается в летнеосенний период. Содержание маннита и альгината всегда выше у растений в возрасте 1+ и 2+, чем у самых молодых (0+) или самых старых (3+) растений в популяции. Во всех проанализированных пробах содержание маннита в январе не превышало 6 %, а в среднем составляло 2,5 %, тогда как в летних пробах оно достигало 20–24 %. Содержание альгината в январе было низким (10,5– 15,0 %), в летних пробах – 11–23 %.
Если зависимость содержания и качества полисахаридов от факторов внешней среды в какой-то степени уже изучена, то исследование аналогичной зависимости у липидов только начинается. По предварительным данным американских исследователей, водоросли, произрастающие на меководье, превосходят по содержанию липидов водоросли из более высоких мест. А наибольшее содержание липидов наблюдается у ламинарии в период начала спорогенеза. Большая часть липидов – триглицериды ненасыщенных жирных кислот бурых водорослей, относящиеся в основном к типу линолевой и линоленовой кислот. Из липидной фракции ламинарии сахаристой и пищевого энтеросорбента на фирме «Фитолон» (г. Санкт-Петербург) вырабатывается препарат кламин. Действующим началом кламина является комплекс биологически активных веществ: хлорофиллин, полиненасыщенные жирные кислоты типа омега-3, фитостерины, микрокристаллическая целлюлоза и микроэлементы. Показана возможность ингибирования роста опухолей низкими дозами фосфолипидной фракции из Laminaria angustata [13]. Американскими исследователями высказано предположение, что эти кислоты, присутствующие во всех водорослях, образуются в ответ на стресс, как и во всех организмах животных. Если эта гипотеза подтвердится, то таким стрессовым воздействием может быть кратковременное поднятие канатов к поверхности воды для резкого увеличения дозы падающего ультрафиолета.
УВЕЛИЧЕНИЕ ПРОДУКТИВНОСТИ МАРИКУЛЬТУР ЗА СЧЕТ БИКУЛЬТУРЫ
Сотрудниками лаборатории альгологии ММБИ предложена биотехнология комплексного плантационного выращивания ламинариевых и фукусовых водорослей [5], при которой в верхней горизонтальной части плантации выра- щиваются фукусовые водоросли, выполняющие в первую очередь барьерную функцию (рис. 2) [5].
Предлагаемая биотехнология берет начало от апробированной технологии выращивания ламинарии сахаристой. Основное отличие предлагаемой технологии заключается в назначении плантации. Первое назначение – сбор, удержание и утилизация нефтяной пленки с поверхности воды. Второе – использование выращенной биомассы ламинариевых и фукусовых водорослей для получения продукции медицинского и лечебно-профилактического назначения.
Разработаны методы выращивания ламинарии в двухгодичном цикле [3]. Есть данные, что в бикультуре с мидиями (для выращивания которых требуются аналогичные гидролого-химические условия [4]) рост ламинарии сахаристой увеличивается почти в 2 раза [7].
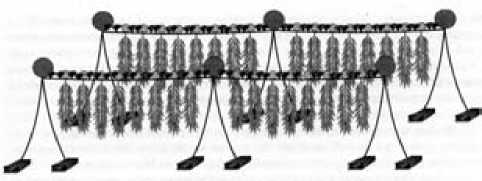
Рис. 2. Схема комплексной бикультурной плантации [5] Верхние горизонтальные ряды – Fucus vesiculosus, вертикальные ряды – Laminaria saсcharina
ЗАКЛЮЧЕНИЕ
До настоящего времени в Белом и Баренцевом морях проводится экспериментальное выращивание водорослей для выяснения механизмов репродукции, адаптации и регуляции роста, а также накопления биологически активных веществ в условиях высоких широт. Исследования проводятся с привлечением методов биохимии, физиологии, цитологии; анализируется влияние плантации на гидрохимические характеристики среды; изучается обрастание культивируемых макрофитов эпибионтами. В последние годы исследовалась возможность ведения бикультуры, то есть выращивания на ламинариевых плантациях и других видов гидробионтов, в том числе фукусовых водорослей и двустворчатых моллюсков Mytilus edulis . Сотрудниками лаборатории альгологии ММБИ при участии в исследовательских работах сотрудников других организаций (ПИНРО, ВНИРО, ИНБЮМ) была создана биотехнология культивирования ламинарии сахаристой в условиях Баренцева моря (работы проводились под руководством В. Н. Макарова) [6]. Урожай, собранный с первой опытно-промышленной плантации ламинарии в губе Дальнезеленецкая Баренцева моря, показал, что ламинариевые хозяйства в условиях Севера могут быть высоко рентабельными.
Серьезной проблемой при рассмотрении вопроса о введении в морскую аквакультуру любого объекта является экологическая безопасность. Виды беломорской альгофлоры, предлагаемые к использованию для культивирования, не являются чужеродными – это массовые виды Белого и Баренцева морей. Как показал биологический мониторинг, большие локальные концентрации ламинарии, например, на плантации не оказывают отрицательного влияния на окружающую часть экосистемы [1].
Развитие водорослевой марикультуры в Белом море позволит сократить объем промысла водорослей, что должно способствовать сохранению естественных зарослей, их стабилизации и улучшению экологической ситуации в море.
По данным FAO, аквакультура в последнее время во всем мире развивается бурными темпами. Водорослевая марикультура становится императивом нашего времени и в карельской акватории Белого моря [14].
Новые и уже накопленные знания о биологических особенностях водорослей, перспективных для введения в марикультуру, способствуют становлению и совершенствованию биотехнологии культивирования этих объектов.
Список литературы Биотехнология воспроизводства и использования бурых водорослей-макрофитов
- Аверинцев В. Г., Байтаз В. А., Байтаз О. Н., Бардан С. И., Кондаков А. В., Кузнецов Л. Л., Москвитина М. И., Песегов В. Г., Сикорский А. В., Фомин О. К., Чиркова З. Н., Широколобов В. Н. Контроль экологической ситуации в районе опытно-промышленной плантации водорослей в губе Дальнезеленецкой (оперативно-информационный материал). Апатиты: Изд-во КНЦ РАН, 1988. 51 с.
- Барашков В. Г. Химия водорослей. М.: Наука, 1963. 143 с.
- Блинова Е. И., Макаров В. Н. Инструкция по биотехнологии культивирования ламинарии сахаристой в двухгодичном цикле в Баренцевом море. М.: Наука, 1987. 34 с.
- Блинова Е. И., Садыхова И. А., Дергалева Ж. Т. Увеличение продуктивности прибрежных экосистем Западного Мурмана за счет бикультуры ламинария-мидия и их рациональное использование//Оптимизация использования морских биоресурсов и комплексное управление прибрежной зоной Баренцева моря: Тез. докладов регион. семинара, посвященного 45-летию Первой научной сессии Мурманской биологической станции (г. Мурманск, 30 ноября 1999 г.). Мурманск: ММБИ КНЦ РАН, 1999. С. 6-7.
- Воскобойников Г. М., Макаров В. Н., Макаров М. В., Шошина Е. В. Биотехнологии в полярной марикультуре и использовании морских биоресурсов Арктики//Современные технологии и прогноз в полярной океанологии и биологии. Апатиты: Изд-во КНЦ РАН, 1999. С. 100-123.
- Воскобойников Г. М., Макаров М. В., Пантелеева Н. Н. Биотехнологии искусственного выращивания морских гидробионтов. Проблемы и перспективы биотехнологии культивирования бурых водорослей в Баренцевом море//Современные информационные и биологические технологии в освоении ресурсов шельфовых морей/ММБИ КНЦ РАН. М.: Наука, 2005. С. 256-272.
- Макаров В. Н. Поведение зооспор и ранние стадии развития Laminaria saccharina (L.) Lamour. Белого и Баренцева морей: Автореф. дис. … канд. биол. наук. Л., 1978. 20 с.
- Макаров В. Н., Джу В. Е., Матишов Г. Г., Хохряков К. Б., Воскобойников Г. М., Денисенко Н. В., Шошина Е. В. Научно-практические аспекты культивирования ламинарии сахаристой в Баренцевом море. Апатиты: Изд-во КНЦ РАН, 1986. 35 с.
- Немова Н. Н., Шкляревич Г. А. Экология водорослей-макрофитов карельской акватории Белого моря как объектов марикультуры//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2009. № 9(103). С. 17-27.
- Силкин В. А., Хайлов К. М. Биоэкологические механизмы управления в аквакультуре. Л.: Наука, 1988. 230 с.
- Хайлов К. М., Празукин А. В., Ковардаков С. А., Рыгалов В. Е. Функциональная морфология морских многоклеточных водорослей. Киев: Наукова думка, 1992. 280 с.
- Haug A., Myklestad S., Larsen B., Smisdrod O. Studieson the sequence of uronic acid residues in alginic acid//Acta Chem. Scand. 1967. Vol. 21. P. 691-704.
- Noda H., Amano H., Arashima K., Nisizawa K. Antitumor activity of marine algae//Hydrobiologia. 1990. № 204/205. P. 577-584.
- The State of World Fisheries and Aquaculture. 2002: [Электронный ресурс]. Режим доступа: http://www.fao.org/documents/show_cdr.asp?url_file=/docrep/005/y7300e/y7300e00.htm


