Биотопические группировки булавоусых чешуекрылых (Lepidoptera, Diuma) в экосистемах северной тайги Карелии
Автор: Резниченко Елена Сергеевна, Горбач Вячеслав Васильевич
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 2 (123), 2012 года.
Бесплатный доступ
Видовой состав и встречаемость дневных бабочек изучали в окрестностях г. Костомукши в течение 4 сезонов (2007-2010 годы). Всего найдены 46 видов. 587 особей 42 видов зарегистрированы в ходе 518 учетов на трансектах в 74 биотопах. Преобладали малинница, крапивница и репейница. Наиболее богатые группировки бабочек формируются на лугах, самые бедные - в сосняках. Отмечена слабая биотопическая дифференциация населения в условиях северной тайги.
Северная тайга карелии, булавоусые чешуекрылые, биотопическое распределение видов, состав и структура группировок
Короткий адрес: https://sciup.org/14750096
IDR: 14750096 | УДК: 574.472:595.789
Текст научной статьи Биотопические группировки булавоусых чешуекрылых (Lepidoptera, Diuma) в экосистемах северной тайги Карелии
Булавоусые, или дневные чешуекрылые, являются одной из хорошо исследованных групп насекомых. Вместе с тем изучение видового состава, распространения и особенностей экологии бабочек на конкретных территориях остается актуальной задачей. Большинство работ о булавоусых в Карелии посвящены южным районам, тогда как по территориям, расположенным к северу от Онежского озера, информации немного: опубликованная в середине прошлого века сводка Пелтонена [27] и по сей день остается основным источником для познания фауны бабочек северной тайги. Немногочисленные работы позднего периода [1], [8], [10], [11], [12], [13], [14], [17], [19] посвящены локальным фаунам Прибеломорья и международного российско-финляндского заповедника «Дружба». Всего из северотаежных провинций Карелии известно 59 видов булавоусых чешуекрылых, и данный список, по-видимому, близок к завершению [3]. Однако имеющиеся сведения о распространении и обилии видов фрагментарны, мало известно о закономерностях формирования биотопических группировок дневных бабочек в условиях северной тайги, их составе и структуре. Настоящая работа призвана восполнить недостаток знаний в этой области.
МАТЕРИАЛ И МЕТОДИКА
Исследования проводили в окрестностях г. Костомукши, в том числе на территории государственного природного заповедника «Костомукшский» (64°35’ с. ш., 30°35’ в. д.). Природно-климатические условия данного района типичны для Западно-Карельской возвышенности. Преобладающий тип рельефа – денудационно-тектонический холмисто-грядовый. Озера занимают 8 % территории, болота – 18 %. Леса представлены сосняками, ельниками и мелколиственными насаждениями, покрывающими 49, 12 и 2 % всех земель соответственно. Около 9 % приходится на долю вырубок, пустырей, дорог и просек. Лугов и полей немного, менее 2 % в структуре ландшафта [2]. Среднегодовая температура воздуха составляет +0,5 °С при среднемесячных показателях от –15 °С в феврале до +14 °С в июле. Количество осадков достигает 550 мм в год [9].
На исследуемой территории выбрали 74 местообитания, представляющих все основные типы биотопов, заселяемых дневными бабочками в условиях северной тайги Карелии. Сфагновые болота включали массивы с доминированием в растительном покрове сосны, олиготрофных кустарничков (карликовой березы, багульника, мирта болотного и др.), осок и пушиц. В лесных биоценозах бабочки встречаются лишь на открытых участках – полянах и просеках. Подобные местообитания в различных типах сосновых лесов не отличались существенным образом по составу растительности, их характерная особенность – бедность разнотравья и присутствие багульника, голубики и других болотных кустарничков. Лиственные леса , сформированные березовыми и осиновыми насаждениями, напротив, имели хорошо развитую, разнообразную травянистую растительность по открытым местам. Исследованные луга представлены комплексами разнотравнозлаковых и влажноразнотравных группировок. Постоянными компонентами растительных ассоциаций выступали низовые злаки (полевица, белоус, душистый колосок, овсяница красная и др.), мелкое и среднее мезофильное разнотравье (манжетки, лютики, горошек мышиный,
чина луговая и др.). Растительность придорожных биотопов сочетала признаки как лесных, так и луговых фитоценозов. Отличительная черта таких местообитаний – обилие сорных и рудеральных растений (погремка, одуванчика, осота, бодяка, крапивы и др.).
Встречаемость бабочек в выбранных местообитаниях исследовали в 2007–2010 годах. Использовали метод учета имаго на трансектах [28]. Длина трансект в зависимости от размера местообитания варьировала от 50 до 150 м при ширине 5 м. Учеты проводили с мая по сентябрь раз в 7–10 дней в солнечную погоду. При необходимости бабочек отлавливали, определяли, а затем отпускали или собирали как эталонные экземпляры. В качестве биотопической группировки мы рассматривали совокупность видов, зарегистрированных в одном местообитании в течение всего периода исследований. Данные по встречаемости бабочек унифицировали посредством пересчета числа особей на единицу площади (экз./га). По полученным выборкам изучали видовой состав, плотность населения, видовое разнообразие и общность группировок, формирующихся в сходных условиях. Видовое разнообразие измеряли с помощью показателей энтропии Шеннона и доминирования Бергера – Паркера, общность – евклидовым расстоянием [5], [7]. Значимость отличий параметров оценивали посредством однофакторного дисперсионного анализа [6]. Видовое богатство группировок, относительную биотопическую приуроченность видов и тренды изменчивости населения бабочек северной тайги исследовали после объединения выборок, полученных в местообитаниях, отнесенных к одному типу биотопов. Видовое богатство описывали кривыми насыщения [16]. Приуроченность оценивали по частоте встреч вида в каждом типе биотопов. Критерий χ2 использовали для сравнения наблюдаемого и равномерного распределений частот. Статистический вывод о значимости различий между распределениями предполагает существование избирательности по отношению к местообитаниям. В таком случае в качестве излюбленного рассматривали местообитание с наиболее высокой встречаемостью особей. Сравнение частоты встреч вида в первом в иерархии местообитании с каждым следующим позволило выявить круг предпочитаемых местообитаний – группу, отличия между членами которой статистически незначимы. Поскольку данный метод нечувствителен к малым величинам, характеризующим встречаемость бабочек в наших выборках (экз./га), сохраняя принцип равенства площадей, мы использовали в расчетах действительные частоты встреч бабочек. Направления изменчивости населения изучали с помощью компонентного анализа [6]. В качестве значимых рассматривали главные компоненты с дисперсией больше единицы.
РЕЗУЛЬТАТЫ
В результате 518 учетов на 74 трансектах были зарегистрированы 587 особей 42 видов булавоусых чешуекрылых (табл. 1). Еще 4 вида – голубянка артаксеркс ( Aricia artaxerxes (Fabricius, 1793)), чернушка болотная ( Erebia embla (Thunberg, 1791)) и новые для карельской фауны червонцы непарный ( Lycaena dispar (Haworth, 1809)) и бурый ( L. tityrus (Poda, 1761)) найдены за пределами исследованных местообитаний. Доля трех наиболее многочисленных видов – малин-ницы, крапивницы и репейницы составила 41 % всех особей.
Биотопические группировки значимо отличались по числу видов (табл. 2: F = 10,91, df = 4,69, η 2 = 0,39, p < 0,001). Хорошей иллюстрацией изменчивости видового богатства населения служат кривые насыщения (рис. 1). Распадаясь на два кластера, они демонстрируют явное преимущество луговых и придорожных группировок чешуекрылых над лесными и болотными. Средняя плотность населения варьировала от 5,4 экз./га в сосняках до 27,2 экз./га на лугах ( F = 11,47, df = 4,69, η 2 = 0,40, p < 0,001). Сравнение структуры группировок чешуекрылых, формирующихся в биотопах одного типа, с помощью евклидовой меры показало высокую степень однородности населения сосняков и значительную изменчивость луговых группировок. Отличия между выборками по данному параметру значимы ( F = 138,37, df = 4,522, η 2 = 0,51, p < 0,001). Видовое разнообразие группировок, согласно индексу Шеннона, возрастало в направлении от сосняков и болот к лиственным лесам, придорожным биотопам и лугам ( F = 11,61, df = 4,69, η 2 = 0,40, p < 0,001). Самым многочисленным видом в болотных, лесных и придорожных местообитаниях является малинница, на лугах отмечено доминирование репейницы. Заметное участие в формировании луговых группировок, кроме того, принимали зорька, брюквенница, малин-ница и дневной павлиний глаз, а в придорожных биотопах чаще других встречались крапивница и репейница. Оценка видового разнообразия по индексу доминирования Бергера – Паркера показала, что наименее выравненная структура населения бабочек свойственна сосновым лесам, где около 40 % особей приходится на долю малинницы. В других местообитаниях происходит расширение круга видов с относительно высокой встречаемостью и значения показателя значимо уменьшаются, достигая минимума в луговых группировках чешуекрылых ( F = 9,26, df = 4,69, η 2 = 0,35, p < 0,001).
Относительная приуроченность к одному и более типам биотопов выявлена у 20 видов, их число варьирует от 1 в сосняках до 16 на лугах (табл. 1). Распространение многих видов по исследуемой территории сильно ограничено. Наиболее высокая локализация популяций отмечена для толстоголовки палаемон, червонца огненного, голубянки лесной, ленточника тополевого и углокрыльницы с-белое. Только на сфагновых болотах встречались перламутровки северная и эвномия, сенница болотная и сатир болотный, а голубянка эвмедон найдена лишь на лугах.
Метод главных компонент выявил одну значимую компоненту, учитывающую 75 % изменчивости исходной выборки (табл. 3). Все биотопические группировки имеют здесь примерно равные факторные нагрузки и составляют единственную плеяду.
Таблица 1
|
Вид |
Сфагновые болота, n = 11 |
Сосняки, n = 19 |
Лиственные леса, n = 15 |
Луга, n = 15 |
Придорожные биотопы, n = 14 |
||||||||||
|
M |
S |
Ps |
M |
S |
Ps |
M |
S |
Ps |
M |
S |
Ps |
M |
S |
Ps |
|
|
Pyrgus malvae (Linnaeus, 1758) – Толстоголовка мальвовая |
– |
– |
– |
– |
– |
– |
0,2 |
0,7 |
13 |
0,5 |
1,3 |
13 |
– |
– |
– |
|
Carterocephalus silvicola (Meigen, 1829) – Т. лесная желтая* |
0,4 |
1,2 |
10 |
– |
– |
– |
0,2 |
0,7 |
13 |
– |
– |
– |
– |
– |
– |
|
C. palaemon (Pallas, 1771) – Т. палемон* |
– |
– |
– |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
– |
– |
– |
|
Thimelicus lineola (Ochenheimer, [1808]) – Т.-тире |
– |
– |
– |
0,2 |
0,6 |
11 |
– |
– |
– |
0,8 |
1,4 |
27 |
– |
– |
– |
|
Papilio machaon Linnaeus, 1758 – Махаон* |
– |
– |
– |
– |
– |
– |
– |
– |
– |
0,2 |
0,7 |
13 |
0,1 |
0,5 |
7 |
|
Leptidea sinapis (Linnaeus, 1758) – Беляночка горошковая |
– |
– |
– |
– |
– |
– |
0,2 |
0,9 |
7 |
0,8 |
1,2 |
33 |
0,3 |
0,7 |
14 |
|
Anthocharis cardamines – Зорька |
– |
– |
– |
– |
– |
– |
0,6 |
1,2 |
27 |
2,4 |
2,7 |
53 |
1,8 |
2,6 |
36 |
|
Aporia crataegi (Linnaeus, 1758) – Боярышница* |
– |
– |
– |
– |
– |
– |
0,2 |
0,7 |
13 |
1,0 |
1,7 |
33 |
0,5 |
1,2 |
21 |
|
Pieris brassicae (Linnaeus, 1758) – Капустница* |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
0,1 |
0,5 |
7 |
0,3 |
0,7 |
14 |
|
P. rapae (Linnaeus, 1758) – Репница* |
– |
– |
– |
– |
– |
– |
– |
– |
– |
0,2 |
1,0 |
7 |
0,1 |
0,5 |
7 |
|
P. napi (Linnaeus, 1758) – Брюквенница |
– |
– |
– |
– |
– |
– |
0,6 |
1,2 |
27 |
1,8 |
3,3 |
33 |
1,1 |
1,9 |
29 |
|
Colias palaeno (Linnaeus, 1761) – Желтушка торфяниковая* |
0,4 |
0,8 |
20 |
0,5 |
1,1 |
21 |
0,5 |
1,1 |
20 |
0,2 |
1,0 |
7 |
– |
– |
– |
|
Gonepteryx rhamni (Linnaeus, 1758) – Крушинница |
– |
– |
– |
– |
– |
– |
1,0 |
1,4 |
40 |
1,0 |
2,1 |
27 |
0,7 |
1,6 |
21 |
|
Callophrys rubi (Linnaeus, 1758) – Малинница |
1,9 |
1,7 |
70 |
2,2 |
2,0 |
68 |
3,4 |
3,3 |
80 |
3,0 |
3,2 |
67 |
4,2 |
3,0 |
86 |
|
Lycaena virgaurea (Linnaeus, 1758) – Червонец огненный* |
– |
– |
– |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
– |
– |
– |
|
Celastrina argyolus (Linnaeus, 1758) – Голубянка весенняя |
0,5 |
1,2 |
20 |
0,1 |
0,4 |
5 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
Plebejus argus – Г. аргус* |
0,5 |
1,2 |
20 |
0,3 |
0,7 |
16 |
0,1 |
0,5 |
7 |
0,5 |
1,1 |
20 |
0,1 |
0,5 |
7 |
|
P. idas (Linnaeus, 1761) – Г. идас* |
0,2 |
0,6 |
10 |
0,1 |
0,4 |
5 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
P. optilete (Knoch, 1781) – Г. торфянико-вая* |
0,4 |
1,2 |
10 |
0,4 |
1,0 |
16 |
– |
– |
– |
– |
– |
– |
0,3 |
0,7 |
14 |
|
Aricia eumedon (Esper, [1780]) – Г. эвме-дон |
– |
– |
– |
– |
– |
– |
– |
– |
– |
0,4 |
1,1 |
13 |
– |
– |
– |
|
Polyommatus icarus (Rottemburg, 1775) – Г. икар* |
0.4 |
0.8 |
20 |
– |
– |
– |
– |
– |
– |
0,2 |
0,7 |
13 |
– |
– |
– |
|
P. semiargus (Rottemburg, 1775) – Г. лесная* |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
– |
– |
– |
– |
– |
– |
|
Limenitis populi (Linnaeus, 1758) – Ленточник тополёвый* |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
– |
– |
– |
– |
– |
– |
|
Nymphalis antiopa (Linnaeus, 1758) – Траурница* |
– |
– |
– |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
0,1 |
0,5 |
7 |
|
N. io (Linnaeus, 1758) – Дневной павлиний глаз |
– |
– |
– |
– |
– |
– |
0,9 |
2,5 |
20 |
2,0 |
3,0 |
40 |
1,2 |
2,2 |
36 |
Видовой состав и плотность населения (экз./га) булавоусых чешуекрылых в местообитаниях северной тайги Кар елии
Примечание. n – число исследованных местообитаний, M – средняя арифметическая, S – стандартное отклонение, Ps – доля местообитаний, где был отмечен вид (встречаемость, %), жирным шрифтом указана относительная биотопическая приуроченность вида, * – вид не обнаружил значимой приуроченности ни к одному из биотопов.
Продолжение табл. 1
|
Виды |
Сфагновые болота, n = 11 |
Сосняки, n = 19 |
Лиственные леса, n = 15 |
Луга, n = 15 |
Придорожные биотопы, n = 14 |
||||||||||
|
M |
S |
Ps |
M |
S |
Ps |
M |
S |
Ps |
M |
S |
Ps |
M |
S |
Ps |
|
|
N. urticae (Linnaeus, 1758) – Крапивница |
– |
– |
– |
0,4 |
1,0 |
16 |
1,1 |
2,6 |
27 |
1,5 |
2,8 |
33 |
2,4 |
3,6 |
43 |
|
Polygonia c-album (Linnaeus, 1758) – Углокрыльница с-белое* |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
|
Vanessa atalanta (Linnaeus, 1758) – Адмирал |
– |
– |
– |
0,1 |
0,4 |
5 |
0,6 |
2,0 |
13 |
1,4 |
3,0 |
20 |
0,7 |
1,8 |
14 |
|
V. cardui (Linnaeus, 1758) – Репейница |
1,0 |
1,3 |
50 |
0,2 |
0,6 |
11 |
1,8 |
2,0 |
60 |
4,4 |
2,8 |
87 |
3.5 |
2,5 |
86 |
|
Arashnia levana (Linnaeus, 1758) – Пестрокрыльница |
– |
– |
– |
– |
– |
– |
0,5 |
1,1 |
20 |
0,5 |
1,1 |
20 |
– |
– |
– |
|
Brenthis ino (Rottemburg, 1775) – Перламутровка-таволжанка* |
– |
– |
– |
0,3 |
1,0 |
11 |
0,6 |
1,4 |
20 |
0,5 |
1,3 |
13 |
0,4 |
1,1 |
14 |
|
Boloria aquilonaris (Stichel, 1908) – П. северная |
0,9 |
1,3 |
40 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
Clossiana eunomia (Esper, [1799]) – П. эв-номия |
0,5 |
0,9 |
30 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
C. euphrosyne (Linnaeus, 1758) – П. эфро-сина |
0,2 |
0,6 |
10 |
0,2 |
0,6 |
11 |
– |
– |
– |
0,9 |
1,3 |
27 |
0,3 |
1,0 |
7 |
|
C. selene ([Dennis & Schiffermüller], 1775) – П. селена* |
0,2 |
0,6 |
10 |
0,1 |
0,4 |
5 |
0,1 |
0,5 |
7 |
0,4 |
1,1 |
13 |
0,5 |
1,2 |
21 |
|
Pararge maera (Linnaeus, 1758) – Бархатка большая* |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
– |
– |
– |
0,3 |
1,0 |
7 |
|
P. petropolitana (Fabricius, 1787) – Б. петербургская* |
– |
– |
– |
0,1 |
0,4 |
5 |
– |
– |
– |
– |
– |
– |
0,3 |
0,7 |
14 |
|
Coenonympha tullia – Сенница болотная |
0,5 |
0,9 |
30 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
C. pamphilus (Linnaeus, 1758) – С. обыкновенная* |
0,5 |
1,2 |
20 |
– |
– |
– |
0,1 |
0,5 |
7 |
0,4 |
0,8 |
20 |
0,4 |
1,1 |
14 |
|
Aphantopus hyperantus (Linnaeus, 1758) – Глазок цветочный |
– |
– |
– |
– |
– |
– |
0,1 |
0,5 |
7 |
0,6 |
1,6 |
20 |
0,1 |
0,5 |
7 |
|
Erebia ligea (Linnaeus, 1758) – Чернушка кофейная |
0,2 |
0,6 |
10 |
0,2 |
0,6 |
11 |
1,0 |
1,7 |
33 |
0,6 |
1,6 |
20 |
1,1 |
3,0 |
21 |
|
Oeneis jutta (Hübner, [1806]) – Сатир болотный* |
0,2 |
0,6 |
10 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
Таблица 2
Характеристики биотопических группировок чешуекрылых
|
Показатель |
Сфагновые болота, n = 11, *n = 55 |
Сосняки, n = 19, *n = 171 |
Лиственные леса, n = 15, *n = 105 |
Луга, n = 15, *n = 105 |
Придорожные биотопы, n = 14, *n = 91 |
|
|
Число видов |
M S |
3,5 |
2,2 |
4,8 |
7,1 |
5,6 |
|
2,4 |
1,4 |
2,4 |
2,5 |
2,8 |
||
|
Плотность населения, |
M |
8,7 |
5,4 |
14,7 |
27,2 |
21,1 |
|
экз./га |
S |
6,6 |
4,1 |
10,4 |
14,5 |
13,1 |
|
Общность группировок, |
M |
0,137 |
0,104 |
0,209 |
0,313 |
0,262 |
|
евклидово расстояние |
S |
0,040 |
0,043 |
0,103 |
0,093 |
0,100 |
|
Видовое разнообразие, |
M |
0,55 |
0,37 |
0,71 |
0,89 |
0,77 |
|
индекс Шеннона |
S |
0,32 |
0,26 |
0,24 |
0,16 |
0,22 |
|
Видовое разнообразие, |
M |
0,53 |
0,72 |
0,40 |
0,27 |
0,37 |
|
индекс Бергера – Паркера |
S |
0.33 |
0,31 |
0,20 |
0,07 |
0,17 |
Примечание. n – число группировок, *n – число сравниваемых пар для оценки общности группировок, M – средняя арифметическая, S – стандартное отклонение.
Ординация объектов показывает, что виды расположились вдоль оси рассматриваемой компоненты согласно частоте их встречаемости (рис. 2). Наименьшие значения получили редкие виды, такие как толстоголовка палаемон и махаон, а наибольшие значения остались за доминантами – малинницей, репейницей и крапивницей. Информативность второй компоненты оценена в 16 %. И хотя формально она незначима (дисперсия меньше 1), без учета содержащейся в ней информации анализ нельзя признать полным. Именно здесь проявилась тенденция к противопоставлению группировок бабочек, формирующихся на болотах и в сосняках, луговым группировкам. Таким образом, первая ось описывает встречаемость видов в условиях северной тайги, общую структуру фауны, а вторая намечает направления биотопической дифференциации населения.
Таблица 3
Факторные нагрузки и дисперсии главных компонент
|
Биотопические группировки |
ГК-1 |
ГК-2 |
|
Сфагновые болота |
0,389 |
-0,587 |
|
Сосняки |
0,430 |
-0,480 |
|
Лиственные леса |
0,495 |
0,096 |
|
Луга |
0,426 |
0,575 |
|
Придорожные биотопы |
0,488 |
0,292 |
|
Дисперсия |
3,75 |
0,81 |
|
Дисперсия, % |
75,0 |
16,2 |
Примечание. ГК – главная компонента.
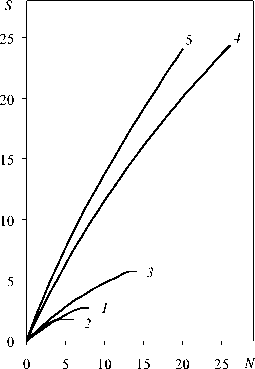
Рис. 1. Насыщенность видами биотопических группировок чешуекрылых:
1 – сфагновые болота, 2 – сосняки, 3 – лиственные леса, 4 – луга, 5 – придорожные биотопы. N – число особей, S – число видов
-
1 .0
0.5
0.0
-0.5
-1.0
-1.5
crat
napi
atal
♦ rham
io
carm card
urt
hvn/ sina hype malv leva
♦ bras ♦ maer ♦ pet silv
line
lige
idas
icar ♦ jut
♦ euph sele
pamp
ino
tul I euno
♦ argy
opt
argu
♦ pala
aqui
rub
-
-1.5 -1.0 -0.5 0.0 0.5 1.0 _ - 1
Рис. 2. Ординация чешуекрылых в осях главных компонент: виды обозначены первыми литерами их латинского названия, для обозначения V. cardui принято сокращение card, для A. cardamines – carm. У видов, помещенных на границы диаграммы, уменьшены значения соответствующих главных компонент. Эллипсом выделена группа видов, включающая C. palaemon , P. machaon , P. rapae , H. virgaurea , A. eumedon , C. semiargus , L. populi , N. antiopa и P. c-album
ОБСУЖДЕНИЕ
46 видов булавоусых чешуекрылых, найденных в окрестностях г. Костомукши, составляют 77 % всех видов, известных из северной тайги Карелии [3]. Лишь 14 видов не отмечены нами на исследуемой территории. Прежде всего это толстоголовка северная ( Pyrgus centaureae (Ram-bur, 1839)), червонец голубоватый ( Lycaena helle ([Dennis&Schiffermüller], 1775)), голубянка ни-кия ( Aricia nicias (Meigen, 1830)), перламутровки фрея ( Clossiana freija (Becklin in Thunberg, 1791)) и фригга ( C. frigga (Becklin in Thunberg, 1791)), типичные виды для местных условий, но имеющие локальное распространение [13]. Остальные виды северотаежной фауны – толстоголовка-запятая ( Hesperia comma (Linnaeus, 1758)), зефир березовый ( Thecla betulae (Linnaeus, 1758)), червонцы пятнистый ( Lycaena phlaeas (Linnaeus, 1761)) и щавелевый ( L. hippothoe (Linnaeus, 1758)), перламутровки аглая ( Argynnis aglaja (Linnaeus, 1758)) и полевая ( Issoria lathonia (Linnaeus, 1758)), шашечница аталия ( Melitaea athalia (Rottemburg, 1775)), сенница луговая ( Coenonympha glycerion (Borkhausen, 1788)) и чернушка диса ( Erebia disa (Becklin in Thunberg, 1791)) отмечены для сопредельных районов по немногим находкам [27]. Впервые на исследуемой территории зарегистрирован 31 вид. Почти все эти бабочки известны для запада северной тайги по опубликованным данным. Находку непарного и бурого червонцев мы склонны рассматривать как результат случайного заноса, поскольку северные границы их ареалов проходят на 300–500 км южнее [22]. Тем не менее нельзя полностью исключать и возможность естественного проникновения этих видов на север в результате экспансии, которую в последние годы наблюдали у многих чешуекрылых [26], [30]. В целом же результаты исследования свидетельствуют о бедности северотаежной фауны дневных бабочек. С одной стороны, это связано с тем, что распространение ряда обычных для Карелии видов в северном направлении ограничено 62–63° с. ш. Те из них, что проникают в северную тайгу, попадаются крайне редко. С другой стороны, нет здесь и арктических бабочек, которые не встречались бы в среднетаежных провинциях. Исключение составляют лишь чернушка диса, известная из района Калевалы, и северная форма толстоголовки-запятой (f. geogr. catena ), указанная для Соловецкого архипелага [27].
Количественные оценки населения булавоусых чешуекрылых исследуемой территории оказались существенно ниже, чем в среднетаежных ландшафтах: например, средняя частота встреч имаго в местообитаниях Прионежья составляла 57 экз./га [15] против 15 экз./га в рассматриваемом случае. Низкое обилие дневных бабочек обусловлено, по-видимому, не только природно-климатическими особенностями рассматриваемого района, но и крайне неблагопри- ятными для развития большинства видов погодными условиями в летние месяцы 2007–2008 годов [4]. Преобладание малинницы и крапивницы характерно и для южных провинций Карелии, другие доминантные виды среднетаежных ландшафтов – брюквенница, крушинница, перламутровка-таволжанка, глазок цветочный и чернушка кофейная – на исследуемой территории попадались гораздо реже. Высокая численность репейницы – явление в наших широтах редкое, обусловленное интенсивной миграцией особей на север в годы с теплым летом. В такие сезоны в таежных местообитаниях чаще встречаются и другие мигранты (адмирал, дневной павлиний глаз и т. д.).
Бабочки очень неравномерно размещены по исследуемой территории, так же как и в средней тайге, населяя лишь более или менее открытые местообитания – болота, луга, поляны, просеки, вырубки и обочины дорог. Однако северотаежные группировки булавоусых чешуекрылых заметно беднее. Число видов, зарегистрированных в местообитании, здесь не превышает 11, тогда как в Северо-Западном Прионежье этот показатель достигает 21 вида [15], в Северном Прила-дожье – 38 [21], [25], а на юге Финляндии – 46 [18]. Наблюдаемое обеднение биотопических группировок происходит вследствие уменьшения встречаемости, а затем и полного выпадения видов из состава локальных фаун. Еще более заметно в северном направлении меняется плотность населения бабочек. В основных типах среднетаежных местообитаний среднее число зарегистрированных на трансектах особей составляло 45–101 [23], [29] и 35–88 экз./га [15], тогда как в северотаежных местообитаниях значение этого показателя не превышало 28 экз./га. Анализ структуры населения показал, что в северотаежных группировках чешуекрылых относительно высокую встречаемость имеют немногие виды, прежде всего те, что указаны в качестве доминирующих для исследуемой фауны. Использованные меры видового разнообразия вполне адекватно регистрируют выявленные градиенты. Значения энтропии Шеннона по сравнению с Прионежьем [15] снижаются с 1,6–2,27 до 0,37–0,88, а значения индекса доминирования Бергера – Паркера возрастают с 0,22–0,42 до 0,27–0,72. Вместе с тем иерархия биотопических группировок бабочек по числу видов, плотности населения и видовому разнообразию остается постоянной независимо от географического положения упомянутых районов: наиболее бедные группировки в условиях таежной зоны формируются в лесных и болотных местообитаниях, а наиболее богатые – на лугах. Лучшей иллюстрацией общей тенденции служат показанные на рис. 1 кривые насыщения группировок видами.
Биотопические предпочтения видов формируются под влиянием многих факторов, важнейшими из которых являются наличие в достаточном количестве пищевых ресурсов и благоприятные мезо- и микроклиматические условия. Соответствие условий среды экологической специфике каждого вида обусловливает свойственное только ему биотопическое распределение. Одни виды на исследуемой территории сохраняют строгую приуроченность к очень узкому набору местообитаний. Примером могут служить сенница болотная, перламутровки северная и эвномия, которые в условиях лесной зоны облигатно связаны с болотными биоценозами [20]. Другие виды демонстрируют более равномерное биотопическое распределение, чем в среднетаежных ландшафтах. Некоторые из них, такие как желтушка торфянниковая, голубянка аргус, сенница обыкновенная, перламутровки таволжанка и селена, не обнаруживают значимой приуроченности ни к одному из рассматриваемых типов местообитаний, у малин-ницы биотопические предпочтения смещаются от болот к придорожным биотопам. Приуроченность многих бабочек к лугам и обочинам дорог объясняется прежде всего богатством растительности, в которой в достаточном количестве присутствуют кормовые растения гусениц и нектароносные растения для питания имаго. Болота и сосновые леса вследствие специфичности среды наименее благоприятны для развития дневных бабочек, поэтому к этим местообитаниям тяготеют немногие виды.
Обобщающий анализ размещения чешуекрылых не выявил значимых трендов изменчивости населения исследуемой территории, деления их на лесные, болотные и луговые, как ранее было показано для среднетаежных ландшафтов [15], [24]. Метод главных компонент зафиксировал лишь тенденцию пространственной дифференциации населения. При этом многочисленные виды обнаружили тяготение к тем же типам биотопов, что и в средней тайге. Даже малин-ница, анализ размещения которой показал приуроченность к придорожным биотопам, здесь попала в категорию лесных и болотных видов, каким по сути и является. Это связано с тем, что взаиморасположение видов в осях главных компонент, отражая корреляционные связи между биотопическими группировками, определяется не столько абсолютными значениями плотности, сколько участием вида в формировании структуры населения местообитаний. Причины отсутствия явных трендов кроются в особенностях природно-климатических условий района исследований. Во-первых, здесь относительно мало лугов и луговые виды бабочек вынуждены использовать все более или менее подходящие для существования открытые местообитания, в том числе и лесные. Во-вторых, отсутствует четкое разграничение между растительным покровом болотных и лесных местообитаний;
под пологом леса, на полянах и просеках присутствует целый ряд типичных болотных растений – обычное явление для северной тайги. Как следствие жесткость связи тирфобионтов и тир-фофилов с болотами ослабевает. В-третьих, поскольку в северной тайге в силу климатических условий численность дневных бабочек редко бывает высокой даже в наиболее благоприятных для развития местообитаниях, то и пространственное размещение большинства видов отличается большей выравненностью, чем их размещение на юге Карелии.
Список литературы Биотопические группировки булавоусых чешуекрылых (Lepidoptera, Diuma) в экосистемах северной тайги Карелии
- Болотов И. Н., Шутова Е. В. Закономерности формирования островных фаун булавоусых чешуекрылых (Lepidoptera, Diuma) на северном пределе распространения лесов в области плейстоценовых материковых оледенений (на примере островов Белого моря)//Известия РАН. Сер. биологическая. 2006. Вып. 3. С. 327-336.
- Волков А. Д., Громцев А. Н., Еруков Г. В. и др. Экосистемы ландшафтов запада северной тайги (структура, динамика). Петрозаводск, 1995. 194 с.
- Горбач В. В., Резниченко Е. С. Видовой состав и распространение дневных бабочек (Lepidoptera, Diurna) в ЮгоВосточной Фенноскандии//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2009. № 7 (101). С. 31-39.
- Горбач В. В., Сааринен К., Резниченко Е. С. К экологии тополевого ленточника Limenitispopuli (Lepidoptera, Nymphalidae) Восточной Фенноскандии//Зоологический журнал. 2010. Т. 89. № 11. С. 1340-1349.
- Коросов А. В. Специальные методы биометрии. Петрозаводск: Изд-во ПетрГУ, 2007. 364 с.
- Коросов А. В., Горбач В. В. Компьютерная обработка биологических данных. Петрозаводск: Изд-во ПетрГУ, 2010. 84 с.
- Мэгарран Э. Экологическое разнообразие и его измерение. М.: Мир, 1992. 181 с.
- Полевой А. В., Хумала А. Э. Насекомые//Материалы инвентаризации природных комплексов и научное обоснование ландшафтного заказника «Сыроватка». Петрозаводск: Карельский научный центр РАН, 2003. С. 67-72.
- Романов А. А. О климате Карелии. Петрозаводск: Госиздат КАССР, 1961. 140 с.
- Свиридов А. В. Чешуекрылые (Lepidoptera, Macrolepidoptera) окрестностей Беломорской биологической станции Московского государственного университета и их стациальное распределение//Энтомологическое обозрение. 1970. Т. 49. Вып. 3. С. 365-372.
- Хумала А. Э. Изучение энтомофауны островных экосистем Онежской губы Белого моря//Природное и культурное наследие Северной Фенноскандии. Петрозаводск: Карельский научный центр РАН, 2003. С. 83-89.
- Хумала А. Э., Полевой А. В. К фауне насекомых Карельского побережья и островов Белого моря//Инвентаризация и изучение биологического разнообразия на Карельском побережье Белого моря. Петрозаводск, 1999. С. 106-113.
- Шутова Е. В., Антонова Е. М., Свиридов А. В., Кутенкова Н. Н. Чешуекрылые Кандалакшского заповедника//Флора и фауна заповедников СССР. Вып. 80. М., 1999. 48 с.
- Яковлев Е. Б., Хумала А. Э., Полевой А. В. Насекомые//Инвентаризация и изучение биологического разнообразия на территории центральной Карелии. Петрозаводск: Карельский научный центр РАН, 2001. С. 149-158.
- Gorbach V. V., Saarinen K. The butterfly assemblages of Onega Lake Area in Karelia, middle taiga of NW Russia (Hes-perioidea, Papilionoidea)//Nota lepid. 2003. Vol. 25. P. 267-279.
- Gotelli N., Colwell R. Quantifying biodiversity: procedures and pitfalls in measurement and comparison of species richness//Ecology Letters. 2001. Vol. 4. P. 379-391.
- Heikkilä R., Lindholm T. Biodiversity and conservation of boreal nature. Kainuu, 2003. P. 187-192.
- Kuussaari M., Heliölä J., Salminen J., Niininen I. Maatalousympäristön päiväperhosseurannan vuoden 2000 tulokset//Baptria. 2001. Vol. 26. P. 69-80.
- Leinonen R., Itamies J., Kutenkova N. Lepidoptera of the Nature Reserve Friendship//Ecosystems, fauna and flora of the Finnish-Russian Nature Reserve Friendship. Helsinki: The Finnish Environment, 1997. P. 235-256.
- Mikkola K., Spitzer K. Lepidoptera associated with peatlands in central and northern Europe: a synthesis//Nota lepid. 1983. Vol. 6. P. 216-229.
- Saarinen K. A comparison of butterfly communities along field margins under traditional and intensive management in SE Finland//Agriculture, Ecosystems and Environment. 2002. Vol. 90. P. 59-65.
- Saarinen K., Gorbach V. V. Erikoisia kultasiipiä itärajan tuntumassa//Baptria. 2007. Vol. 32. P. 15.
- Saarinen K., Jantunen J. A comparison of butterfly fauna of agricultural habitats under different management history in Finnish and Russian Karelia//Ann. Zool. Fenn. 2002. Vol. 39. P 173-181.
- Saarinen K., Marttila O., Jantunen J. Species richness and distribution of butterflies (Lepidoptera: Hesperioidea, Papilionoidea) in agricultural environment in SE Finland//Entomol. Fenn. 1998. Vol. 9. P. 9-18.
- Saarinen K., Valtonen A., Jantunen J., Saarnio S. Butterflies and diurnal moths along road verges: Does road type affect diversity and abundance?//Biol. Conserv. 2005. Vol. 123. P 403-412.
- Parmesan C., Ryrholm N., Stefanescu C. et al. Poleward shifts in geographical ranges of butterfly species associated with regional warming//Nature. 1999. Vol. 399. P. 579-583.
- Peltonen O. Vienan perhosfaunasta//Ann. Entomol. Fenn. 1947. Vol. 13. S. 131-144.
- Pollard E., Yates T. J. Monitoring butterflies for ecology and conservation. The British butterfly monitoring scheme. London: Chapman & Hall, 1993. 274 p.
- Väisänen R. Distribution and abundance of diurnal Lepidoptera on a raised bog in southern Finland//Ann. Zool. Fenn. 1992. Vol. 29. P. 75-92.
- Warren M. S., Hill J. K., Thomas J. A. et al. Rapid responses of British butterflies to opposing forces of climate and habitat change//Nature. 2001. Vol. 414. P. 65-69.


