Биотрансформация арилалкильных сульфидов целыми клетками Rhodococcus rhodochrous ИЭГМ 66
Автор: Елькин А.А., Кылосова Т.И., Гришко В.В., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
В модельных экспериментах подобраны условия окислительной биотрансформации прохирального фенилметилового сульфида (тиоанизола) в соответствующий (S)-сульфоксид (ее 82%) с использованием целых клеток Rhodococcus rhodochrous ИЭГМ 66. Установлено, что наиболее высокая окислительная активность характерна для клеток родококков, включенных в матрицу поливинилового спирта. Благодаря использованию приема иммобилизации оказалось возможным использовать сульфидные субстраты в концентрациях (1.0-1.5 г/л), токсичных для свободных клеток родококков. Окислительная активность закрепленных бактериальных клеток проявляется в способности их к образованию (S)-энантиомерно обогащенных фенилметил-, пара-толилметил-, фенилэтилсульфоксидов и их последующему активному окислению в соответствующие сульфоны.
Актинобактерии, целые клетки, биотрансформация, тиоани- зол, сульфоксид, иммобилизация, поливиниловый спирт
Короткий адрес: https://sciup.org/147204876
IDR: 147204876 | УДК: 544.473+577.15+57.088.6+547.27
Текст научной статьи Биотрансформация арилалкильных сульфидов целыми клетками Rhodococcus rhodochrous ИЭГМ 66
Интерес к оптически активным сульфоксидам обусловлен высокой реакционной способностью и возможностью последующего удаления медиаторов, включающих фрагмент RS→O, в реакциях циклоприсоединения, альдольной конденсации, присоединения по Михаэлю и др. (Альфонсов и др., 1998). Данный подход позволяет осуществлять на основе хемо-, регио- и стереоселективных превращений сульфинильных интермедиатов синтез молекул практически любого класса органических соединений. Кроме того, некоторые сульфоксиды проявляют биологическую активность, определяющую полезные свойства таких растений как лук, чеснок, горчица и др. (Fernandez et al, 2003). Среди современных противоязвенных средств к наиболее эффективным блокаторам протонной помпы относится ( S )-сульфоксид омепразола – эзомепразол (Cotton et al, 2000; Andersson et al, 2001).
Наряду с металлокомплексным катализом для направленного окисления прохиральных органических сульфидов в оптически активные сульфоксиды используют метод биокаталитической трансформации. При этом в качестве катализаторов процесса сульфоксидирования применяются как индивидуальные ферменты, так и целые микробные клетки. Описаны единичные работы (Holland et al, 1992; Porto et al, 2002), в которых для повышения эффективности процесса окисления прохиральных сульфидов применяется широко используемый в биотехнологии прием иммобилизации целых клеток мицелиальных грибов. Основные проблемы, возникающие в процессе разработки таких биокатализаторов – сохранение жизнеспособности и функциональной активности иммобилизованных клеток микроорганизмов. С этой точки зрения, наиболее эффективным представляется использование криогелей, обеспечивающих проведение иммобилизации бактериальных клеток при физиологических значениях pH, температуры без применения токсичных химических веществ (Лозинский, 1998).
Многие микроорганизмы в природе склонны к образованию агрегированных форм в виде хлопьев и биопленок. Так, среди бактерий выраженной способностью к кооперации отличаются представители рода Rhodococcus , самоиммобилизация которых в условиях индуцированного алканотроф-ного типа метаболизма способствует адаптации микробных клеток к экстремальным условиям обитания. Подобные адаптивные механизмы позволяют эффективно использовать родококки в биотехнологических целях, в том числе в процессах биотрансформации органических соединений (Ившина и др., 2007).
Цель настоящей работы – оценка способности иммобилизованных клеток родококков к окислительной биоконверсии арилалкилсульфидов.
В работе использовали штамм R. rhodochrous ИЭГМ 66 из Региональной профилированной коллекции алканотрофных микроорганизмов ИЭГМ (акроним коллекции ИЭГМ; Каталог штаммов.., 1994; .
Биотрансформацию арилалкилсульфидов (0.5– 1.5 г/л) свободными и иммобилизованными клетками родококков проводили в минеральной среде следующего состава, г/л: KNO3 – 1.0; K2HPO4 – 1.0; KH2PO4 – 1.0; NaCl – 1.0; MgSO4x7H2O – 0.2; CaCl2x2H2O – 0.02; FeCl3 – 0.001; дрожжевой экстракт – 0.1%; раствор микроэлементов по Постгейту – 1.0 мл/л; 0.1, 0.5 или 1.0 об.% н -гексадекана в качестве источника углерода и энергии. В качестве посевного материала использовали 1 мл 2 сут биомассы родококков (5.0±0.4×106 кл/мл), выращенных на мясопептонном агаре и отобранных в экспоненциальной фазе роста, или 200 гранул иммобилизованных клеток (5.0±0.6×106 клеток) на 100 мл среды.
В качестве носителя использовали макропористый гетерофазный криогель на основе поливинилового спирта (ПВС). В работе применяли ПВС марки 40/2 (ГОСТ 10779-78) производства ПО «Азот» (Невинномысск, Россия). Иммобилизацию родококков осуществляли путём внесения клеточной суспензии в раствор ПВС согласно методике, описанной в работе (Kuyukina et al , 2006). Перед использованием полученный биокатализатор регидратировали в 0.5% р-ре NaCl в течение 24
ч.
Бактериальные клетки выращивали в условиях периодического культивирования в колбах Эрлен-мейера с объемом питательной среды 100 мл на орбитальном шейкере Certomat/S (160 об/мин) при 28°С.
Коммерчески доступные фенилметиловый ( Iа ), фенилэтиловый ( Iб ) и пара -толилметиловый ( Iв ) сульфиды в виде раствора в изопропаноле (1:10) добавляли одновременно или через 2 сут культивирования бактериальных клеток. При этом продолжительность процесса биотрансформации ро-дококками составляла 1–12 сут.
Продукты биотрансформации тиоанизола экстрагировали этилацетатом. Объединенные этилаце- татные вытяжки сушили над сульфатом натрия. Растворитель удаляли в вакууме роторного испарителя «Heidolph» (Германия). Качественный состав продуктов биотрансформации контролировали методом тонкослойной хроматографии на пластинах с флуоресцентной добавкой фирмы «Sigma-Aldrich» (США), фиксируя образование продуктов окисления в УФ (254 нм) при сравнении с эталонными сульфидами и соответствующими сульфоксидами, полученными методом химического окисления.
Анализ продуктов биотрансформации осуществляли методом хромато-масс-спектрометрии с помощью газового хроматографа Agilent 6890N с кварцевой колонкой HP-5MS SN US 15189741-1 и квадрупольным масс-спектрометром Agilent MSD 5973N в качестве детектора. Оптическое вращение растворов образцов арилалкилсульфоксидов измеряли на поляриметре фирмы «Perkin-Elmer» (США) модель 341 при длине волны 589 нм. Колоночную хроматографию проводили на силикагеле фирмы «Merck» (США) (0.06–0.20 мм), соотношение вещества и сорбента ≈ 1 : 12, в качестве элюента использовали смесь гексана с возрастающим от 5 до 40% содержанием этилацетата.
Эксперименты проводили в трехкратной повторности. Статистическую обработку полученных результатов осуществляли с помощью компьютерных программ Exel 2000 и Statistica (версия 6.0 для Windows).
Прием индукции оксигеназных ферментных систем родококков углеводородными субстратами широко используется в процессе биотрансформации органических соединений различных классов, в том числе органических прохиральных сульфидов (Ohta et al, 1984, 1985; Гришко и др. 2000, 2009). Ранее нами было показано (Гришко и др., 2004), что в присутствии 1 об.% н -гексадекана свободные клетки R. rhodochrous ИЭГМ 66 трансформируют фенилметиловый сульфид ( Iа ) (тиоанизол) в оптически активный ( S )-сульфоксид ( IIа ) (содержание в сумме продуктов реакции 55%) за 7 сут при условии добавления сульфида через 2-е сут инкубации родококков (рис. 1, 2).

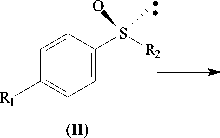
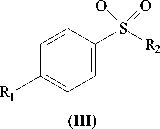
а R 1 =H, R 2 =CH 3
б R 1 =H, R 2 =C 2 H 5
в R1=R2=CH3
Рис. 1 . Биотрансформация арилалкилсульфидов R. rhodochrous ИЭГМ 66
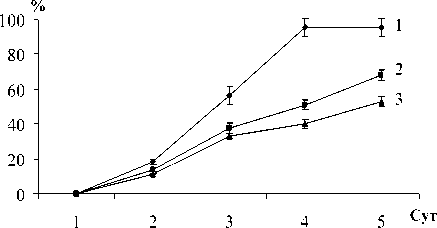
Рис. 2 . Биотрансформация тиоанизола ( Ia ) (0.5 г/л) свободными клетками родококков в присутствии н -гексадекана в концентрации, об. %:
1 – 0.1; 2 – 0.5; 3 – 1.0
Установлено, что существенное влияние на каталитическую активность оксигеназных ферментов R. rhodochrous ИЭГМ 66 в отношении тиоанизола оказывает концентрация н-гексадекана в ростовой среде. Как видно из рис. 2, снижение содержания н-гексадекана до 0.5 об. % приводит к увеличению сульфидокисляющей активности родо-кокков и, как следствие, повышению содержания сульфоксида (IIа) до 68% в сумме продуктов биотрансформации. Полная конверсия тиоанизола (Iа) в соответствующий сульфоксид (IIа) достигается в присутствии 0.1 об. % н-гексадекана, что позволяет сократить продолжительность трансформации тиоанизола до 6-ти сут при условии добавления сульфида через 2-е сут инкубации родококков.
В то же время при повышении концентрации тиоанизола биокаталитическая активность родо-кокков заметно ингибируется. Так, при внесении 1.0 или 1.5 г/л тиоанизола уровень биоконверсии сульфида ( Iа ) составляет не более 25%, при увеличении продолжительности инкубации до 12 сут – не превышает 50%.
Для оптимизации процесса биоконверсии тиоанизола ( Iа ) использовали прием иммобилизации клеток родококков в криогель на основе ПВС. По данным хромато-масс-спектрометрии, полная биоконверсия тиоанизола (0.5 г/л) в целевой сульфоксид достигается при использовании иммобилизованных бактериальных клеток, предварительно выращенных в присутствии н -гексадекана. Установлено, что при использовании гранул биокатализатора, содержащих 0.1 об.% н -гексадекана, уже через 1 сут регистрируется образование в среде целевого сульфоксида ( IIа ) и сульфона ( IIIа ) тиоанизола в соотношении 3:1 (табл. 1).
Таблица 1
Биотрансформация тиоанизола (Iа) иммобилизованными клетками родококков
|
Соединение |
Содержание в сумме продуктов реакции (%)* |
||||||||
|
А |
Б |
В |
|||||||
|
1 сут |
2 сут |
3 сут |
1 сут |
2 сут |
3 сут |
1 сут |
2 сут |
3 сут |
|
|
Тиоанизол ( Ia ) |
- |
- |
- |
73.6 |
- |
- |
94.1 |
18.0 |
- |
|
Сульфоксид ( IIa ) |
74.7 |
34.3 |
13.3 |
26.4 |
55.9 |
28.3 |
5.9 |
78.3 |
41.2 |
|
Сульфон ( IIIa ) |
25.3 |
65.7 |
86.7 |
- |
44.1 |
71.7 |
- |
3.7 |
58.8 |
* При концентрации тиоанизола ( Iа ) в среде: А – 0.5, Б – 1.0, В – 1.5 г/л.
Достигнутая благодаря использованию иммобилизованных клеток интенсификация окислительного процесса позволила использовать более высокие концентрации сульфидного субстрата. По данным хромато-масс-спектрометрии, иммобилизованные клетки R. rhodochrous ИЭГМ 66 при добавлении тиоанизола ( Iа ) в концентрации 1.0 и 1.5 г/л катализируют активное окисление образующегося сульфоксида ( IIа ) в сульфон ( IIIа ) уже в течение первых суток. Как следствие, на момент полного исчезновения тиоанизола через 2-3-е сут концентрация побочного сульфона ( IIIа ) составляет 44.1 и 58.8 % соответственно ( см . табл. 1).
На следующем этапе исследовали ферментативную активность иммобилизованных клеток R. rhodochrous ИЭГМ 66 в отношении арилалкильных гомологов тиоанизола – фенилэтилового (Iб) и пара-толилметилового (Iв) сульфидов. Установлено, что родококки при добавлении сульфидов (Iб, Iв) в концентрации 1.5 г/л, как и в модельных экспериментах с тиоанизолом (Iа), катализируют образование соответствующих (S)- сульфоксидов (IIб, IIв). Однако, показатель оптической чистоты арилалкилсульфоксидов (IIб, IIв) уступает таковому сульфоксида тиоанизола (IIа). Энантиомерный избыток (ее) (S)-сульфоксидов (IIб, IIв) составляет 54.7 и 48.0 %, соответственно. Как видно из табл. 2, при окислении арилалкил-сульфидов (Iа, Iб, Iв) параллельно с процессом образования сульфоксидов (IIа, IIб, IIв) регистрируется накопление побочных продуктов окисления – сульфонов (IIIа, IIIб, IIIв), сопровождающееся снижением эффективности процесса направленного синтеза целевых сульфоксидов (IIа, IIб, IIв), химический выход которых не превышает 30%. На наш взгляд, решение проблемы ингибирования сульфоноокисляющей активности родококков позволит сместить направление процесса окислительной биотрансформации в сторону направленного образования целевого продукта и повышения его оптической чистоты.
Таблица 2
Биотрансформация арилалкилсульфидов (Iа, Iб, Iв) иммобилизованными клетками родококков
|
Сульфид |
Содержание (%) продуктов биотрансформации |
Химический выход (%), ее (%) и [α]D ( S )-сульфоксида ( II ) |
||
|
( I ) |
( II ) |
( III ) |
||
|
Тиоанизол ( Iа ) |
0.0 |
41.2 |
58.8 |
27.5; 82.1; -134 ( c 0.4; CHCl3) |
|
Фенилэтилсульфид ( Iб ) |
0.0 |
43.6 |
56.4 |
28.4; 54.7; -116 ( c 0.3; EtOH) |
|
пара -Толилметилсульфид ( Iв ) |
9.8 |
40.3 |
49.9 |
29.6; 48.0; -86 ( c 0.4; CHCl3) |
Таким образом, полученные в результате проведенных исследований данные свидетельствуют о значительном повышении сульфидокислительной активности целых клеток R. rhodochrous ИЭГМ 66 при включении их суспензии в ПВС-криогель. Установлено, что использование иммобилизованной формы биокатализатора позволяет осуществить конверсию арилалкилсульфидов в концентрациях (>0.5 г/л), токсичных для свободных клеток родо-кокков, и сократить продолжительность процесса биотрансформации до 3 сут. О высоком окислительном потенциале родококков свидетельствует активность полученного биокатализатора в отношении образующихся в процессе биотрансформации арилалкилсульфоксидов, ингибирование процесса окисления которых в соответствующие сульфоны может способствовать повышению продуктивности процесса образования целевых сульфоксидов.
Работа поддержана грантами Президента РФ «Ведущие научные школы» НШ-64403.2010.4 и Программы фундаментальных исследований Президиума РАН «Биологическое разнообразие».
Список литературы Биотрансформация арилалкильных сульфидов целыми клетками Rhodococcus rhodochrous ИЭГМ 66
- Гришко, В.В. Биотрансформация изопимаровой и дегидроабиетиновой кислот с использованием бактерий рода Rhodococcus/В.В. Гришко, А.В. Воробьев, Э.Н. Шмидт//Химия в инт. устойч. развития. 2000. № 8. С. 693-698.
- Гришко, В.В. Биотрансформация тиоанизола актинобактериями Rhodococcus sensu stricto/В.В. Гришко, И.Б. Ившина, А.Г. Толстиков//Биотехнология. 2004. № 5. С. 49-56.
- Гришко, В.В. Биокаталитическое получение физиологически активных соединений на основе растительного -ситостерола/В.В. Гришко, Е.М. Ноговицина, И.Б. Ившина//Кат. в промышл. 2009. № 1. С. 67-74.
- Ившина, И.Б. Адаптационные механизмы выживания алканотрофных родококков, реализованные в неблагоприятных условиях среды/И.Б. Ившина, Т.Н. Каменских, Б.А. Анохин//Вестн. Перм. ун-та. Сер. Биология. 2007. № 5 (10). С. 107-112.
- Каталог штаммов Региональной профилированной коллекции алканотрофных микроорганизмов/под ред. И.Б. Ившиной. М.: Наука, 1994. 163 с.
- Лозинский, В.И. Криотропное гелеобразование растворов поливинилового спирта//Успехи химии. 1998. Т. 67, № 7. С. 641-652.
- Получение и свойства органических соединений серы/В.А. Альфонсов [и др.]; под ред. Л.И. Беленького. М.: Химия. 1998. 560 с.
- Andersson, T. Pharmacokinetic studies with esomeprazole, the (S)-isomer of omeprazole/T. Andersson, M. Hassan-Alin, G. Hasselgren [et al.]//Clin. Pharmacokinet. 2001. Vol. 40. № 6. P. 411-426.
- Cotton, H. Asymmetric synthesis of esomeprazole/H. Cotton, T. Elebring, M. Larsson [et al.]//Tetrahedron: Asymmetry. 2000. Vol. 11. № 18. P. 3819-3825.
- Fernandez, I. Recent developments in the synthesis and utilization of chiral sulfoxides/I. Fernandez, N. Khiar.//Chem. Rev. 2003. Vol. 103. P. 3651-3705.
- Holland, H.L. Effect of cell immobilization and organic solvents on sulfoxidation and steroid hydroxylation by Mortierella isabellina/H.L. Holland, S. Poddar, B. Tripet//J. Ind. Microbiol. 1992. Vol. 10. P. 195-197.
- Kuyukina, M.S. Immobilization of hydrocarbonoxidizing bacteria in poly(vinyl alchohol) cryogels hydrophobized using a biosurfactant/M.S. Kuyukina, I.B. Ivshina, A.Y. Gavrin [et al.]//J. Microbiol. Methods. 2006. Vol. 65. P. 596-603.
- Ohta, H. Asymmetric synthesis of chiral sulfoxides via microbial oxidation of sulfides/H. Ohta, Y. Okamoto, G. Tsuchihashi//Chem. Lett. 1984. P. 205-208.
- Ohta, H. Microbial oxidation of allylic sulfides to the corresponding optically active sulfoxides/H. Ohta, Y. Okamoto, G. Tsuchihashi//Agric. Biol. Chem. 1985. Vol. 49, № 3. P. 671-676.
- Porto, A.L.M. Aspergillus terreus CCT 3320 immobilized on chrysotile or cellulose/TiO2 for sulfide oxidation/A.L.M. Porto, F. Cassiola, S.L.P. Dias [et al.]//J. Mol. Cat. B: Enzymatic. 2002. Vol. 19-20. P. 327-334.


