Биотрансформация бетулина с использованием актинобактерий рода Rhodococcus
Автор: Тарасова Е.В., Гришко В.В., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
Впервые показана способность актинобактерий рода Rhodococcus к биотрансформации растительного пентациклического тритерпеноида лупанового ряда бетулина с образованием бетулона. Бетулон представляет собой продукт региоселективного окисления 3р-гидроксильной группы бетулина и является перспективным интермедиатом для получения новых биологически активных соединений. Из 104 исследованных штаммов родококков разных видов из Региональной профилированной коллекции алканотрофных микроорганизмов отобран наиболее активный штамм-биотрансформатор R. rhodochrous ИЭГМ 66. Установлено, что в присутствии 0.5 г/л бетулина растущие клетки родококков катализируют образование до 72.2% бетулона в течение 240 ч. Использование нерастущих клеток родококков позволяет существенно сократить продолжительность процесса биотрансформации бетулина, при этом уровень биоконверсии бетулина (0.5-3.0 г/л) в бетулон через 96 ч. составляет 60-75 %
Бетулин, бетулон, биотрансформация, региоселективное окисление
Короткий адрес: https://sciup.org/147204705
IDR: 147204705 | УДК: 579.66+615.322
Текст научной статьи Биотрансформация бетулина с использованием актинобактерий рода Rhodococcus
Полициклические тритерпеноиды растительного происхождения представляют интерес в качестве исходных соединений в синтезе новых фармакологически активных веществ. Бетулин (луп-20(29)-ен-3,28-диол, C30H50O2, CAS: 473-98-3) – пентациклический тритерпеноид лупанового ряда, содержание которого во внешнем слое коры березы достигает 20-35%, активно используется для получения противовоспали- тельных, гепапротекторных, противоопухолевых, противовирусных, антималярийных, антибактериальных соединений [Betulin …, 2005; Pharmacological ..., 2006; Novel semisynthetic …, 2009].
Помимо химических модификаций предпринимаются попытки биологической трансформации бетулина с помощью микроорганизмов, так как биокатализ открывает возможность получать целевые продукты с высокой степенью регио- и стереоселективности в одну технологическую стадию при
обычных температурах и давлении, в неагрессивной реакции среды и экологически безопасных условиях. Примеры биотрансформации бетулина пока немногочисленны [Microbial …, 2009; Biotransformation of triterpenes, 2011] и связаны преимущественно с использованием эукариотов, в частности представителей грибов Armillaria , Aspergillus , Chaetomium , Dothideomycetes , Rhodotorula. Описаны процессы окислительного расщепления бетулина до 4,28-дигидрокси-3,4-секолуп-20(29)-ен-3-овой кислоты при участии Chaetomium longirostre IFO 9873 [Microbial …, 2002] и окисления бетулина до бетулиновой кислоты с участием Armillaria luteo-virens Sacc QH, Aspergillus foetidus Zu-G1, Aspergillus oryzae Sacc QH [The betulinic acid ..., 2009; Liu, Fu, Chen, 2010]. Недавно появились сведения о региоселективном окислении бетулина до бетулона с использованием Rhodotorula muci-laginosa F10 [Novel biotransformation …, 2012] и Dothideomycete sp. HQ 316564 [Highly …, 2013].
В качестве одного из перспективных интермедиатов в синтезе биологически активных соединений особый интерес представляет 3-оксопроизводное бетулина – бетулон [Synthesis and cytotoxicity of 2-cyano …, 2009; Synthesis and cytotoxicity of 28-carboxymethoxy …, 2009; Synthesis, proapoptotic …, 2010; Trofimov ..., 2011]. Описаны процессы химического синтеза цитотоксичных циано- и азапроизводных бетулина на основе бетулона [Synthesis and cytotoxicity of 2-cyano …, 2009; Synthesis and cytotoxicity of 28-carboxymethoxy …, 2009; Synthesis, proapoptotic …, 2010]. В отличие от трехстадийного химического синтеза бетулона использование микроорганизмов позволяет осуществлять одностадийное окисление вторичной гидроксильной группы бетулина в оксогруппу при сохранении нативной С(28) гидроксильной группы. Однако описанные процессы биотрансформации бетулина до бетулона с использованием условнопатогенных дрожжей R . mucilaginosa F10 [Novel biotransformation …, 2012] и грибов Dothideomycete sp. HQ 316564 [Highly …, 2013] имеют значительные недостатки, поскольку осуществляются в условиях использования сложных питательных сред, характеризуются высокой продолжительностью, невысоким уровнем биоконверсии субстрата при внесении низких концентраций исходного соединения. Кроме того, использование грибов в качестве биокатализаторов потенциально опасно вследствие характера их посевного материала (споры) и способности к синтезу микотоксинов, обладающих мутагенным и канцерогенным действием. В связи с этим актуальным является поиск непатогенных микроорганизмов, способных эффективно катализировать окислительные трансформации бетулина.
Одной из активно используемых групп микроорганизмов в промышленной биотехнологии являются непатогенные актинобактерии рода Rhodococcus. Не мицелиальный характер роста, политрофность и лабильность метаболических систем, синтез биосурфактантов, способность расти на минимальных средах, высокая каталитическая активность и отсутствие выраженных патогенных свойств [Ившина, Пшеничнов, Оборин, 1987; Oil desorption …, 1998; Larkin, Kulakov, Allen, 2006; Biodegradation …, 2009; Kuyukina, Ivshina, 2010] обусловливают перспективность реализации уникальных метаболических систем родококков для окислительной биотрансформации бетулина.
Цель настоящего исследования – оценка бетулинтрансформирующей активности коллекционных культур актинобактерий рода Rhodococcus и подбор оптимальных условий процесса биотрансформации.
Материалы и методы
В работе использовали 104 штамма родокок-ков, принадлежащих к видам R. erythropolis (33), ‘R. longus’ (10), R. opacus (14), R. rhodochrous (17), R. ruber (30) и поддерживаемых в Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, номер 768 во Всемирной федерации коллекций культур, .
Условия культивирования . Бактерии выращивали в колбах Эрленмейера объемом 250 мл, в которые вносили 100 мл питательной среды. Культивирование проводили на орбитальной качалке Certomat IS (Sartorius, Германия) при 160 об/мин. и 28 ° С. В опытах по биотрансформации бетулина использовали минеральную среду следующего состава (г/л): K 2 HPO 4 – 1.0; KH 2 PO 4 – 1.0; KNO 3 – 1.0; NaCl – 1.0; MgSO 4 ∙7H 2 O – 0.2; CaCl 2 ∙2H 2 O – 0.02; FeCl 3 – 0.001 [Каталог штаммов…, 1994]. В среду добавляли 0.1% дрожжевого экстракта (Микроген, Россия) и раствор микроэлементов по Постгейту [Романенко, Кузнецов, 1974]. Исходное значение рН реакционной среды составляло 6.8-7.0 до инокуляции. В качестве субстратов роста использовали глюкозу (1.0%), глицерин (1.0%) или н -гексадекан (0.1; 1.0; 3.0 об. %). В отдельных экспериментах для культивирования родококков использовали мясопептонный бульон (МПБ) производства ГНЦ ПМБ, Оболенск, Россия следующего состава (г/л): панкреатический гидролизат рыбной муки – 8.0; пептон ферментативный – 8.0; NaCl – 4.0; рН 7.0–7.4. Бактерии, выращенные на мясопептонном агаре (МПА) в течение 48 ч., вносили в среду культивирования до конечной концентрации 6.5 x 10 6 клеток/мл. Бетулин (0.5 г/л) в культуральную среду добавляли в виде раствора в диметилсульфоксиде (1:10 мг/мкл) через 48 ч с начала культивирования родококков. В данных условиях динамику образования бетулона отслеживали с интервалом 24 ч. в течение 240 ч.
Условия иммобилизации . В качестве носителя использовали макропористый гетерофазный криогель на основе поливинилового спирта (ПВС) производства ПО «Азот», Невинномысск, Россия. Иммобилизацию клеток R. rhodochrous ИЭГМ 66, предварительно выращенных в минеральной среде с добавлением 3.0 об. % н -гексадекана, осуществляли путём внесения клеточной суспензии в раствор ПВС по методике, описанной в работе [Immobilization …, 2006]. Клеточную суспензию и раствор ПВС смешивали в соотношении 1:2 v/v. Последующие этапы гранулирования, замораживания и оттаивания осуществляли согласно указанной выше методике. Перед использованием полученный биокатализатор регидратировали в 0.5%-ном растворе NaCl в течение 24 ч. и добавляли в минеральную среду из расчета 200 гранул (5.0±0.6 х 10 6 клеток/мл) на 100 мл среды.
Подготовка суспензий нерастущих клеток . Под термином «нерастущие клетки» (resting cells) понимаем трижды отмытые от питательной среды жизнеспособные клетки стационарной фазы роста, прекратившие свое деление в силу исчерпания источников питания или в силу каких-либо иных причин [Эль-Регистан, 2005] и перенесенные из питательной среды в буферный раствор. Клетки R. rhodochrous ИЭГМ 66 предварительно выращивали в МПБ и минеральной среде в присутствии глюкозы (1.0%), глицерина (1.0%) или н -гексадекана (1.0 об. %) в течение 48-72 ч. Родо-кокки в стационарной фазе роста осаждали центрифугированием при 3000 об/мин. в течение 10 мин. и трижды промывали эквивалентным объемом фосфатного буфера (рН 7.0) с последующим центрифугированием. Для получения фосфатного буферного раствора со значением рН 6.0; 7.0; 8.0; 9.0 к 500 мл 0.1 М KH 2 PO 4 (13.6 г/л) добавляли 56, 291, 461 и 481 мл 0.1 М NaOH (4 г/л) соответственно и доводили дистиллированной водой до 1000 мл [Справочник …, 1991]. Отмытые клетки ресуспендировали в 100 мл фосфатного буфера (рН 6.0; 7.0; 8.0 или 9.0) и доводили оптическую плотность клеточных суспензий до значений OП 600 1.4; 1.6; 1.8; 2.0; 2.2; 2.4; 2.6; 2.8 с последующим пересчетом на сухой вес клеточной биомассы. Бетулин вносили в подготовленную клеточную суспензию в концентрации 0.5; 1.0; 2.0 или 3.0 г/л. Продолжительность экспериментов по биотрансформации бетулина нерастущими клетками составляла 96 ч., при оценке динамики накопления бетулона пробы отбирали каждые 24 ч. В сравнительных исследованиях бетулинтрансформирующей активности нерастущих клеток использовали подготовленные аналогичным образом клеточные суспензии родококков разных видов.
Получение клеточных фракций . Суспензию клеток R. rhodochrous ИЭГМ 66 в 100 мл фосфатном буфере (pH 7.0; OП 600 2.0) обрабатывали с помощью ультразвукового дезинтегратора Soniprep 150 (MSE, Великобритания) при амплитуде 10 мкм в течение 60 мин. Полученный гомогенат центрифугировали при охлаждении 6000 об/мин. в течение 10 мин. Для выделения мембраносвязанных ферментов осадок ресуспендировали в 100 мл 1%-ного раствора Тритона X-100 в фосфатном буфере (рН 7.0), перемешивали на орбитальном шейкере в течение 30 мин. и затем центрифунировали при 6000 об/мин. в течение 10 мин. Полученный осадок, содержащий неэкстрагируемые ферменты, ре-суспендировали в 100 мл фосфатном буфере (рН 7.0). Подготовленные клеточные фракции: (1) супернатант с внутриклеточными ферментами; (2) супернатант с мембранносвязанными ферментами, (3) ресуспендированные соникаты с ферментами, не экстрагируемыми детергентами, использовали в сравнительных исследованиях по биотрансформации бетулина (0.5 г/л) и наиболее изученных структурных аналогов бетулина - β-ситостерола (0.5 г/л) и холестерола (0.5 г/л). В качестве контроля использовали суспензию клеток R. rhodo-chrous ИЭГМ 66 (OП 600 2.0) в 100 мл фосфатном буферном растворе (pH 7.0).
Определение дыхательной активности родо-кокков проводили с помощью высокоэффективного 6-канального респирометра Micro-OxymaxR (Columbus Instruments, США) в стеклянных флаконах Micro-Oxymax вместимостью 300 мл, содержащих 100 мл бактериальной суспензии (OП 600 2.6) в фосфатном буфере и бетулин в концентрации 0.5; 1.0; 2.0 и 3.0 г/л. Постоянное перемешивание (300 об/мин.) осуществляли с помощью многоместной магнитной мешалки RT 10 (Power IKAMAG, Германия) в течение 96 ч при температуре 28±2°С. Оценивали скорость дыхания (мкл/мин-1) и количество потребляемого кислорода (мкл). В качестве контроля использовали бактериальную суспензию в фосфатном буфере (OП 600 2.6) без добавления бетулина.
Исследование продуктов биотрансформации. Для выделения продуктов биотрансформации бетулина постферментационную среду подкисляли 10%-ным водным раствором HCl до рН 3.0–4.0 и трижды экстрагировали эквивалентным объемом этилацетата. Объединенные экстракты последовательно промывали 1%-ным водным раствором Na2CO3 и дистиллированной водой (до рН 7.0). Полученный этилацетатный экстракт обезвоживали над Na2SO4. Растворитель удаляли с помощью роторного испарителя (Heidolph, Германия). Качественный состав метаболитов предварительно контролировали методом тонкослойной хроматогра- фии (ТСХ) на высокоэффективных пластинах с силикагелем ПТСХ-П-В (Sorbfil, Россия). Наличие продуктов окисления бетулина фиксировали при обработке пластин в системе растворителей этилацетат : гексан (1:4) и опрыскивании пластинок 5% H2SO4 с последующим прогреванием в течение 2-3 мин при 95–100ºС. Количественный анализ продуктов биотрансформации бетулина осуществляли методом газовой хромато-масс-спектрометрии (ГХ-МС) с использованием хроматографа Agilent 6890N/5975B (Agilent Technologies, США), оборудованного капиллярной колонкой HP-5ms (30 м х 0.25 мм, 0.25 мкм) и работавшего в режиме ионизации электронным ударом (70 эВ). В качестве газа-носителя использовали гелий (1 мл/мин.). Вводили 0.2 мкл этилацетатного экстракта с делением потока (от 1:1 до 11:1). Температура колонки программировалась от 100 до 300°С с повышением температуры со скоростью 50°С/мин. Масс-спектры регистрировали в диапазоне m/z от 40 до 460 а.е.м. В экстрактах, содержащих остаточный н-гексадекан, время начала детектирования продуктов биотрансформации выбирали через 5 мин. после выхода н-гексадекана. Полученные масс-спектры сравнивали с масс-спектрами библиотеки NIST08 MS Library. Масс-спектры считали идентифицированными при совпадении масс-спектров исследуемого вещества с библиотечным коэффициентом подобия, превышающим 90%.
Эксперименты по препаративному получению бетулона проводили в колбах Эрленмейера объемом 250 мл, содержащих 100 мл клеточной суспензии (OП 600 2.6) R. rhodochrous ИЭГМ 66 в фосфатном буфере (рН 8.0) и 0.3 г бетулина, растворенного в 3 мл ДМСО, при постоянном перемешивании (160 об/мин) и температуре 28 ° С. Через 24 ч. продукты биотрансформации трижды экстрагировали эквивалентным объемом этилацетата. Полученные продукты биотрансформации (0.28 г) разделяли с помощью колоночной хроматографии на силикагеле 60–200 μm (Merck, Германия), соотношение вещества и сорбента « 1 : 50, элюент -гексан:этилацетат (9:1). Пороговое значение температуры в точке плавления определяли на приборе OptiMelt MPA100 (Stanford Research Systems Inc., США).
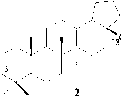
Бетулон (2, луп-20(29)-ен-28-ол-3-он) - белый порошок. Т пл 120.5°C ( н -гексан–этилацетат, 5:1) (лит.: Т пл 94-96°C ( н -гексан) [Hata, Hori, Takahashi, 2002], 175-176°C [Lupane ..., 1992]. MS, m/z (отн. интенсивность): 440.4 (9.51, M+).
Статистическая обработка результатов. Математическую обработку полученных результатов осуществляли с использованием компьютерных программ Excel 2003 (Microsoft Inc., 2003), Statistica, версия 6.0 (StatSoft Inc., 2001), рассчитывая среднее арифметическое и стандартную ошибку. Достоверность различий между средними ку. Достоверность различий между средними величинами оценивали с помощью t-критерия Стьюдента [Лакин, 1990].
Результаты и их обсуждение
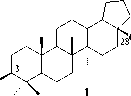
Бетулинтрансформирующая активность коллекционных культур родококков . По нашим данным, в присутствии глюкозы, глицерина или н -гексадекана, а также в условиях использования МПБ родококки катализируют региоселективное окисление вторичной гидроксильной группы бетулина (рис. 1, 1) с образованием бетулона (рис. 1, 2).
HO
CH 2 O H
O
CH 2 OH
Рис. 1. Окислительная биотрансформация бетулина родококками
Как видно из табл. 1, наиболее высокий (44.9%) уровень образования бетулона достигается в присутствии 1.0 об. % н- гексадекана.
Таблица 1
Биотрансформация бетулина клетками R. rhodochrous ИЭГМ 66
|
Условия |
Содержание в сумме продуктов реакции, % |
|
|
Бетулин |
Бетулон |
|
|
Абиотический контроль |
100 |
|
|
Богатая питательная среда (МПБ) |
64.5±2.1 |
35.5±3.0 |
|
Минеральная среда с добавлением глюкозы (1.0%) |
92.5±4.2 |
7.5±0.5 |
|
Минеральная среда с добавлением глицерина (1.0%) |
74.6±3.8 |
25.4±3.2 |
|
Минеральная среда с добавлением н- гексадекана (1.0 об. %) |
48.0±4.1 |
44.9±4.7 |
При исследовании влияния концентрации н -гексадекана на интенсивность процесса биотрансформации бетулина показана прямая зависимость между уровнем образования бетулона и содержанием н- алкана в среде культивирования. Максимальный (72.2%) выход бетулона регистрируется в присутствии 3.0 об. % н- гексадекана через 240 ч. (рис. 2).
В результате сравнительного анализа бетулинтрансформирующей активности родококков разных видов в присутствии 3.0 об. % н- гексадекана выявлена гетерогенность зависимости между уровнем образования целевого продукта и видовой принадлежностью культур.
Как видно из табл. 2, высокая степень биоконверсии бетулина характерна для отдельных представителей видов R. erythropolis, ‘R. longus’, R. rhodochrous, R. ruber, при этом максимальный вы- ход бетулона достигается при использовании R. rhodochrous ИЭГМ 66. Высокая степень биоконверсии бетулина в присутствии н-гексадекана обусловлена, по-видимому, повышением уровня гидрофобности клеточной стенки родококков и синтезом биосурфактантов при росте родококков в данных условиях, что способствует взаимодействию бактериальных клеток с гидрофобным тритерпеновым субстратом. Однако, несмотря на относительно высокий (72.2%) выход целевого продукта, длительность (240 ч.) процесса биоконверсии и наличие остаточного (до 0.9 об. %) углеводорода в смеси продуктов биотрансформации (в полученных экстрактах, при проведении ГХ-МС анализа, при выделении бетулона в чистом виде) ограничивают возможность использования расту-й б
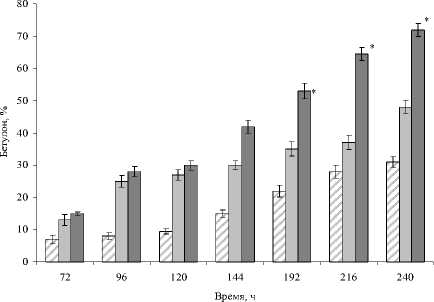
Рис. 2 . Биотрансформация бетулина (0.5 г/л) клетками R. rhodochrous ИЭГМ 66 при различном содержании н- гексадекана (об. %) в среде инкубации:
1 – 0.1; 2 – 1.0; 3 – 3.0. Бетулин вносили через 48 ч. *Данные достоверно отличаются от остальных вариантов опыта, p <0.05
Таблица 2
Биотрансформация бетулина родококками в присутствии н- гексадекана
|
Вид, штамм |
Бетулон, % |
|
Абиотический контроль |
0,0 |
|
R. erythropolis |
|
|
ИЭГМ 199 |
39.9±3.6 |
|
ИЭГМ 200 |
45.3±3.6 |
|
ИЭГМ 203 |
53.5±4.2 |
|
R. erythropolis |
|
|
ИЭГМ 199 |
10.9±3.1 |
|
ИЭГМ 200 |
34.2±2.1 |
|
ИЭГМ 203 |
38.5±3.4 |
|
‘R. longus’ |
|
|
ИЭГМ 30 |
9.8±2.0 |
|
ИЭГМ 31 |
|
|
ИЭГМ 32 |
72.2±4.8 |
|
R. opacus |
6.6±0.8 |
|
ИЭГМ 223 |
37.6±2.1 |
|
R. rhodochrous |
|
|
ИЭГМ 66 |
42.9±2.3 |
|
ИЭГМ 73 |
2.9±0.2 |
|
ИЭГМ 608 |
42.9±2.3 |
В сравнительных исследованиях каталитической активности нерастущих и иммобилизованных родококков в отношении бетулина установлено, что после иммобилизации клетки теряют бетулинтрансформирующую способность, что, очевидно, связано со снижением степени доступности тритерпенового субстрата для клеток, заключенных в матрицу ПВС.
В то время как нерастущие клетки сохраняют способность к региоселективному окислению бетулина в бетулон (рис. 3).
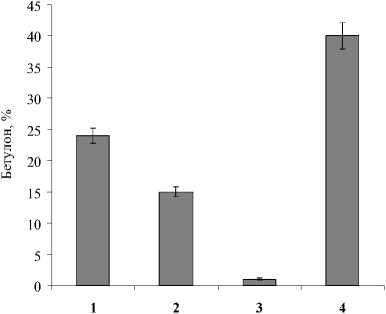
Рис. 3 . Биотрансформация бетулина (0.5 г/л) нерастущими клетками R. rhodochrous ИЭГМ 66, предварительно выращенными в минеральной среде с добавлением н -гексадекана, 1.0 об. % (1), глюкозы, 1.0 % (2), глицерина, 1.0 % (3) или в МПБ (4).
Условия процесса: OП 600 2.0; фосфатный буфер (рН 7.0), продолжительность 48 ч. *Данные достоверно отличаются от остальных вариантов опыта, p <0.05
При этом уровень образования целевого продукта определяется условиями их предварительного культивирования. Как видно из рис. 3, наибольший (24 и 40%) выход бетулона достигается при использовании клеток, предварительно выращенных в присутствии н -гексадекана или МПБ. Применение нерастущих клеток существенно сокращает продолжительность биотрансформации бетулина, а использование буферного раствора позволяет значительно упростить выделение бетуло-на из смеси продуктов биотрансформации.
Биотрансформация бетулина с использованием полученных клеточных фракций из родо-кокков . По данным отдельных авторов в реакциях микробного окисления вторичной гидроксильной группы тритерпеновых спиртов и кислот (с использованием мицелиальных грибов, бацилл или нокардий) принимают участие холестеролоксидаза [Biotransformation of betulinic …, 2007] или 3β-гидроксистероид дегидрогеназа [Biosynthesis …, 2010]. Оба фермента локализуются преимущественно в цитоплазме или связаны с клеточной мембраной и катализируют реакцию окисления 3β-гидроксильной группы стеролов (холестерола,
β-ситостерола) и стероидов с образованием соответствующих кетонов. Как видно из табл. 3, полученный супернатант с мембранносвязанными ферментами родококков катализирует реакцию окисления 3β-гидроксигруппы холестерола и β-сито-стерола с образованием 4-ен-3-оновых производных, в то время как в отношении бетулина данный супернатант не активен.
Таблица 3
Окислительная биотрансформация бетулина, холестерола и β-ситостерола с использованием клеточных фракций из R. rhodochrous ИЭГМ 66
|
Клеточная фракция |
Бетулон |
Холестенон |
Стигмаст-4-ен-3-он |
|
Целые клетки |
+++ |
+++ |
++* |
|
(1)** |
+ |
+ |
+ |
|
(2) |
+++ |
++ |
|
|
(3) |
+++ |
+ |
+ |
Незначительный (10.6%) уровень конверсии бетулина в бетулон наблюдается при использовании супернатанта с внутриклеточными ферментами родококков. Увеличение (до 22.4%) выхода бету-лона регистрируется в процессе биотрансформации бетулина ресуспендированными соникатами родо-кокков, содержащими компоненты клеточных стенок и, возможно, элементы бактериальных мембран с интегральными белками, имеющими гидрофобный якорь и связанными с мембраной за счет более прочных гидрофобных взаимодействий. Все это свидетельствует о прочной связи катализирующего окисление бетулина фермента с клеточной мембраной родококков. При этом следует особо отметить, что суммарная (33%) активность внутриклеточных ферментов и ферментов, прочно связанных с клеточной мембраной родококков, практически сопоставима с бетулинтрансформирующей активностью (40%) целых клеток.
Интенсификация процесса биотрансформации . Известно, что значительное влияние на активность ферментов оказывает уровень водородного показателя (рН среды), который определяет степень ионизации функциональных групп и конформацию каталитического центра фермента. При исследовании влияния рН буферного раствора на процесс биотрансформации бетулина (0.5 г/л) выявлено, что наиболее высокая степень образования бетулона достигается в условиях слабощелочной реакции среды. При рН 8.0 и 9.0 выход целевого продукта составляет 45%. Полученные результаты согласуются с данными X. Yang с соавт. [Rv1106c …, 2007] о максимальной активности 3β-гидроксистероид дегидрогеназы актинобактерий рода Mycobacterium при рН 8.5-9.5, в то время как холестеролоксидаза актинобактерий рода Rhodococcus проявляет наибольшую активность при рН 7.0-7.5 [Purification …, 2008; Extracellular
…, 2010], что может свидетельствовать об участии дегидрогеназы в окислении бетулина.
Нами установлена зависимость между количеством биомассы нерастущих клеток и выходом целевого продукта. Как видно из рис. 4, максимальный (65%) выход бетулона регистрируется при использовании 10 г/л (ОП 600 2.6) клеточной биомассы. Дальнейшее повышение (до 25 г/л) количества биомассы приводит к резкому снижению степени биоконверсии бетулина. Наблюдаемый эффект, по-видимому, обусловлен ограничениями процессов массопереноса при увеличении (более 10 г/л) клеточной биомассы.
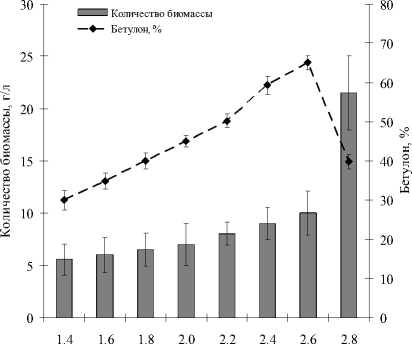
Оптическая плотность клеточной суспензии, ОП 600
Рис. 4 . Влияние количества биомассы R. rhodochrous ИЭГМ 66 на процесс биотрансформации бетулина (0.5 г/л).
Условия процесса: фосфатный буфер (рН 8.0), продолжительность 48 ч.
Серия дальнейших экспериментов посвящена изучению возможности биотрансформации бетулина в условиях повышенных (в 2–6 раз) концентраций нерастущими клетками R. rhodochrous ИЭГМ 66. В процессе исследования респираторной активности родококков установлено, что бетулин в концентрации от 0.5 до 3.0 г/л не оказывает ингибирующего влияния на дыхание бактериальных клеток. При этом скорость потребления О 2 практически не зависит от концентрации вносимого бетулина и достигает максимальных значений в течение первых 24 ч. эксперимента, что совпадает с периодом наибольшей каталитической активности родококков в отношении 0.5, 1.0, 2.0, 3.0 г/л бетулина с образованием 60, 56.8, 51.7 и 40% бетулона соответственно. На рис. 5 представлена характерная зависимость уровня образования бетулона от скорости потребления О 2 .
Сравнительно высокий уровень метаболической активности нерастущих родококков на начальном этапе процесса биотрансформации бетулина, по-видимому, может быть связан с запуском адаптационных механизмов при переносе жизне- способных клеток в среду без источников питания [Эль-Регистан, 2005; Мулюкин, 2010]. В последующие часы наблюдается постепенное снижение и стабилизация интенсивности дыхания и каталитической активности родококков. Как видно из рис. 6, повышение концентрации вносимого бетулина приводит к незначительному снижению каталитической активности родококков, при этом выход целевого продукта через 96 ч. составляет 60-75%
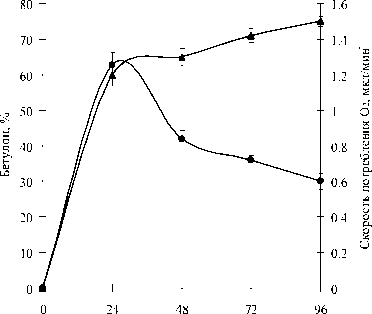
Время, ч
Рис. 5 . Динамика образования бетулона (1) и респираторная активность (2) нерастущих клеток R. rhodoсhrous ИЭГМ 66 в процессе биотрансформации бетулина (0.5 г/л).
Условия процесса: фосфатный буфер (рН 8.0), OП 600 2.6
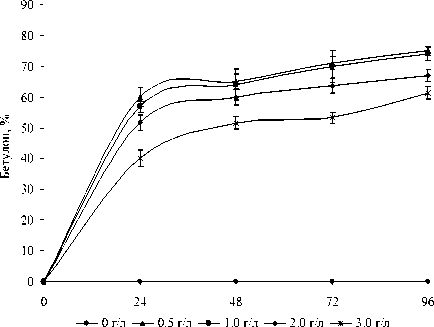
Рис. 6 . Динамика образования бетулона в процессе биотрансформации бетулина (0.5-3.0 г/л) клетками R. rhodochrous ИЭГМ 66.
Условия процесса: фосфатный буфер (рН 8.0); OП 600 2.6, продолжительность 24 ч.
Следует отметить, что в процессах биотрансформации бетулина в бетулон с применением растущих клеток грибов Dothideomycete [Highly …, 2013] и дрожжей Rhodotorula [Novel biotransformation …, 2012] биоконверсия бетулина не превышала 43.4 и 52.6% соответственно при использовании значительно меньших концентраций субстрата.
Заключение
В результате проведенных исследований проведена оценка возможности биотрансформации растительного пентациклического тритерпеноида бетулина с использованием актинобактерий рода Rhodococcus. При сравнении бетулинтрансформирующей активности 104 коллекционных культур родококков разных видов отобран штамм R. rhodochrous ИЭГМ 66, эффективно катализирующий образование бетулона - ключевого интермедиата в синтезе биологически активных соединений. Максимальный (свыше 70%) уровень биоконверсии бетулина (0.5 г/л) регистрируется в присутствии 3.0 об. % н -гексадекана в течение 240 ч. Существенное сокращение (до 24 ч) длительности процесса биотрансформации бетулина достигается при использовании нерастущих клеток. Оптимальными условиями трансформации бетулина нерастущими клетками являются предварительное выращивание родококков в богатой питательной среде (МПБ), слабощелочная реакция среды (рН 8.0-9.0) и использование клеточной биомассы в количестве 10 г/л. В экспериментах с использованием различных клеточных фракций родококков подтверждена прочная связь ферментов, катализирующих региоселективное окисление бетулина, с клеточной мембраной родококков. Использование бетулона в качестве ключевого интермедиата в химическом синтезе функционализированных производных (А-секопроизводных и гетероциклических, в частности) бетулина позволит расширить спектр новых тритерпеновых соединений с ценной биологической активностью.
Исследования выполнены в рамках Государственного задания 6.1194.2014/K Минобрнауки России и поддержаны грантом №14-04-96017-р_урал_а РФФИ и Министерства образования и науки Пермского края.
Список литературы Биотрансформация бетулина с использованием актинобактерий рода Rhodococcus
- Ившина И.Б., Пшеничнов Р.А., Оборин А. А. Пропанокисляющие родококки. Свердловск, 1987. 128 с
- Каталог штаммов Региональной профилированной коллекции алканотрофных микроорганизмов/под ред. И.Б. Ившиной. М.: Наука, 1994. 163 с
- Лакин Г.Ф. Биометрия: учеб. пособие для вузов. М.: Высшая школа, 1990. 352 c
- Романенко В.И., Кузнецов С.И. Экология микроорганизмов пресных вод. Лабораторное руководство. М.: Наука, 1974. 194 с
- Справочник биохимика: пер. с англ./Р. Досон, Д. Эллиот, У. Эллиот, К. Джонс. М.: Мир, 1991. 544 с
- Эль-Регистан Г.И. Покой как форма адаптации микроорганизмов//Механизмы выживания бактерий/отв. ред. В.И. Покровский. М.: Медицина, 2005. С. 11-129.
- Betulin and its derivatives. Chemistry and biological activity/G.A. Tolstikov et al.//Chemistry for Sustainable Development. 2005. Vol. 13. P. 1-29
- Biodegradation potential of the genus Rhodococcus/L. Martinkova et al.//Environment International. 2009. Vol. 35, № 5. P. 162-177
- Biosynthesis of ursolic acid derivatives by microbial metabolism of ursolic acid with Nocardia sp. strains -Proposal of new biosynthetic pathways/D. Leipold et al.//Process Biochemistry. 2010. Vol. 45, № 7. P. 1043-1051
- Biotransformation of betulinic and betulonic acids by fungi/D. Bastos et al.//Phytochemistry. 2007. Vol. 68, № 6. P. 834-839
- Biotransformation of triterpenes/K. Muffler et al.//Process Biochemistry. 2011. Vol. 46, № 7. P. 1-15
- Extracellular cholesterol oxidase from Rhodococcus sp.: isolation and molecular characterization/H. Lashkarian et al.//Iranian Biomedical Journal. 2010. Vol. 14, № 1-2. P. 49-57
- Hata K., Hori K., Takahashi S. Differentiation-and apoptosis-inducing activities by pentacyclic triter-penes on a mouse melanoma cell line//Journal of Natural Products. 2002. Vol. 65, № 5. P. 645-648
- Highly regioselective synthesis of betulone from betulin by growing cultures of marine fungus Do-thideomycete sp. HQ 316564/H. Liu et al.//Journal of Molecular Catalysis B: Enzymatic 2013. Vol. 88. P. 32-35
- Immobilization of hydrocarbon-oxidizing bacteria in poly(vinyl alcohol) cryogels hydrophobized using a biosurfactant/M.S. Kuyukina et al.//Journal of Microbiological Methods. 2006. Vol. 65, № 3. P. 596-603
- Kuyukina M.S., Ivshina I.B. Rhodococcus biosurfac-tants: biosynthesis, properties and potential applications//Biology of Rhodococcus. Microbiology Monography/Alvarez HM (editor). Berlin: Springer; 2010. Vol. 16. P. 291-313
- Larkin M.J., Kulakov LA., Allen C.R. Biodegradation by members of the genus Rhodococcus: biochemistry, physiology and genetic adaptation//Advances in Applied Microbiology. 2006. Vol. 59. P. 1-29
- Liu J., Fu M.L., Chen Q.H. Biotransformation optimization of betulin into betulinic acid production catalysed by cultured Armilaria luteo-virens Sacc ZJUQH100-6 cells//Journal of Applied Microbiology. 2010. Vol. 110. P. 1-8
- Lupane triterpenoids of Salacia cordata/W.F. Tinto et al.//Journal of Natural Products. 1992. Vol. 55, № 3. P. 395-398
- Microbial transformation of triterpenoids/A. Parra et al.//Mini-Reviews in Organic Chemistry. 2009. Vol. 6, № 4. P. 307-320
- Microbial transformations of two lupane-type triter-penes and anti-tumor-promoting effects of the transformation products/T. Akihisa et al.//Journal of Natural Products. 2002. Vol. 65, № 3. P. 278-282.
- Novel biotransformation of betulin to produce betu-lone by Rhodotorula mucilaginosa/D-B. Mao et al.//Journal of the Taiwan Institute of Chemical Engineers. 2012. Vol. 43, № 6. P. 825-829
- Novel semisynthetic derivatives of betulin and betulinic acid with cytotoxic activity/R.C. Santos et al.//Bioorganic & Medicinal Chemistry. 2009. Vol. 17, № 17. P. 6241-6250
- Oil desorption from mineral and organic materials using biosurfactant complexes produced by Rhodococcus species/I.B. Ivshina et al.//World Journal of Microbiology and Biotechnology. 1998. Vol. 14, № 5. P. 711-717
- Pharmacological properties of the ubiquitous natural product betulin/S. Alakurtti et al.//European Journal of Pharmaceutical Sciences. 2006. Vol. 29, № 1. P. 1-13
- Purification and characterization of extra-cellular cholesterol oxidase from Rhodococcus sp. PTCC 1633/M.T. Yazdi et al.//Biotechnology. 2008. Vol. 7, № 4. P. 751-756
- Rv1106c from Mycobacterium tuberculosis is a 3beta-hydroxysteroid dehydrogenase/X. Yang et al.//Biochemistry. 2007. Vol. 46, № 31. P. 9058-9067
- Synthesis and cytotoxicity of 28-carboxymethoxy lu-pane triterpenoids. Preference of 28-O-acylation over 28-O-alkylation of betulin by ethyl bromoace-tate/A.A. Mar et al.//Chinese Chemical Letters. 2009. Vol. 20, № 10. P. 1141-1144
- Synthesis and cytotoxicity of 2-cyano-28-hydroxy-lup-1-en-3-ones/A. Koohang et al.//Bioorganic & Medicinal Chemistry Letters. 2009. Vol. 19, № 8. P. 2168-2171
- Synthesis, proapoptotic screening, and structure-activity relationships of novel aza-lupane triterpe-noids/A.A. Mar et al.//Bioorganic & Medicinal Chemistry Letters. 2010. Vol. 20, № 18. P. 5389-5393
- The betulinic acid production from betulin through biotransformation by fungi/Q-H. Chen et al.//Enzyme and Microbial Technology. 2009. Vol. 45, № 3. P. 175-80
- Trofimov synthesis of betulin derivatives with 2,3-annelated pyrrole/A.V. Orlov et al.//Chemistry of Natural Compounds. 2011. Vol. 46, № 6. P. 906-909
- Мулюкин А.Л. Покоящиеся формы неспорообразующих бактерий: дис.. д-ра биол. наук: 03.02.03. М., 2010. 349 с


