Бис(бромдифторацетат) три-пара-толилвисмута. Синтез и особенности строения
Автор: Сенчурин Владислав Станиславович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 4 т.12, 2020 года.
Бесплатный доступ
Взаимодействием три( пара -толил)висмута с бромдифторуксусной кислотой в присутствии трет -бутилгидропероксида в эфире получен бис (бромдифторацетат) три( пара -толил)висмута. По данным рентгеноструктурного анализа, проведенном при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо К α-излучение, λ = 0,71073 Å, графитовый монохроматор) кристалла [C25H21O4F4Br2Bi, M 830,22; сингония триклинная, группа симметрии P -1; параметры ячейки: a = 10,292(8), b = 11,752(9), c = 12,693(9) Å; α = 89,42(2) град., β = 78,04(3) град., γ = 78,04(3) град.; V = 1424,8(18) Å3; размер кристалла 0,73×0,57×0,41 мм; интервалы индексов отражений -13 ≤ h ≤ 13, -15 ≤ k ≤ 15, -16 ≤ l ≤ 16; всего отражений 45443; независимых отражений 7096; Rint 0,1030; GOOF 1,049; R 1 = 0,0739, wR 2 = 0,1834; остаточная электронная плотность 2,11/-2,78 e/Å3] атом висмута имеет искаженную тригонально-бипирамидальную координацию. Аксиальный угол OBiO равен 172,2(3)°, сумма углов CBiC в экваториальной плоскости составляет 360,6°. Длины аксиальных связей Bi-O равны 2,275(8) Å и 2,295(8) Å; интервал изменения длин экваториальных связей Bi-C составляет 2,187(10)-2,212(13) Å. В структуре бис (бромдифторацетата) три( пара -толил)висмута присутствуют внутримолекулярные контакты между атомами висмута и кислорода карбоксилатных лигандов. Расстояния Bi···O=С составляют 3,127(10) и 3,159(10) Å, что меньше суммы ван-дер-ваальсовых радиусов висмута и кислорода (3,59 Å). В кристалле отсутствуют межмолекулярные контакты H∙∙∙Hal. Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 1923097; deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Три(пара-толил)висмут, бромдифторуксусная кислота, бис(бромдифторацетат) три(пара-толил)висмута, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147234241
IDR: 147234241 | УДК: 546.87+547.29+548.312.5 | DOI: 10.14529/chem200404
Текст научной статьи Бис(бромдифторацетат) три-пара-толилвисмута. Синтез и особенности строения
Взаимодействием три(пара-толил)висмута с бромдифторуксусной кислотой в присутствии трет-бутилгидропероксида в эфире получен бис(бромдифторацетат) три(пара-толил)висмута. По данным рентгеноструктурного анализа, проведенном при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD – детектор, МоКα-излучение, λ = 0,71073 Å, графитовый монохроматор) кристалла [C25H21O4F4Br2Bi, M 830,22; сингония триклинная, группа симметрии P–1; параметры ячейки: a = 10,292(8), b = 11,752(9), c = 12,693(9) Å; α = 89,42(2) град., β = 78,04(3) град., γ = 78,04(3) град.; V = 1424,8(18) Å3; размер кристалла 0,73×0,57×0,41 мм; интервалы индексов отражений –13 ≤ h ≤ 13, –15 ≤ k ≤ 15, –16 ≤ l ≤ 16; всего отражений 45443; независимых отражений 7096; Rint 0,1030; GOOF 1,049; R1 = 0,0739, wR2 = 0,1834; остаточная электронная плотность 2,11/–2,78 e/Å3] атом висмута имеет искаженную тригонально-бипирамидальную координацию. Аксиальный угол OBiO равен 172,2(3)°, сумма углов CBiC в экваториальной плоскости составляет 360,6°. Длины аксиальных связей Bi-O равны 2,275(8) Å и 2,295(8) Å; интервал изменения длин экваториальных связей Bi–C составляет 2,187(10)–2,212(13) Å. В структуре бис(бромдифторацетата) три(пара-толил)висмута присутствуют внутримолекулярные контакты между атомами висмута и кислорода карбоксилатных лигандов. Расстояния Bi···O=С составляют 3,127(10) и 3,159(10) Å, что меньше суммы ван-дер-ваальсовых радиусов висмута и кислорода (3,59 Å). В кристалле отсутствуют межмолекулярные контакты H∙∙∙Hal. Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 1923097; ; .
В последние годы активно изучается биологическая активность дикарбоксилатов триарилвисмута [1–6]. Однако, если число структурно охарактеризованных дикарбоксилатов трифенилвисмута достигает 25 соединений по данным Кембриджского банка структурных данных [7], то для дикарбоксилатов тритолилвисмута этот показатель ограничивается тремя соединениями с мета -толильными заместителями [8], одним с орто -толильными – аддукт бис (хлорацетата) три( орто -толил)висмута с хлоруксусной кислотой [9] и двумя с пара -толильными – бис (пентафторбензоат) и бис (хлорацетат) три( пара -толил)висмута [10, 11].
В настоящей работе рассматриваются синтез и особенности строения бис(бромдифторацетата) три(пара-толил)висмута, полученного окислением три(пара-толил)висмута трет бутилгидропероксидом в присутствии бромдифторуксусной кислоты (1:1:2 мольн.).
Экспериментальная часть
Синтез бис (бромдифторацетата) три( пара -толил)висмута. Смесь 0,300 г (0,62 ммоль) три ( пара -толил)висмута, 0,218 г (1,24 ммоль) бромдифторуксусной кислоты и 0,086 г (0,62 ммоль) 65%-ного водного раствора трет бутилгидропероксида в 20 мл диэтилового эфира выдерживали при комнатной температуре 24 ч. После испарения растворителя остаток перекристаллизовывали из смеси бензол-гептан (5:1 объемн.). Получили 0,449 г (87 %) светло-желтых кристаллов бис (бромдифторацетата) три( пара -толил)висмута с т. разл. 161 ° С. ИК-спектр, ( v , см - 1): 3090, 2954, 2868, 1689, 1560, 1541, 1487, 1356, 1190, 1143, 1051, 997, 795, 418.
ИК-спектр записывали на ИК-Фурье спектрометре Shimadzu IRAffinity- 1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ ( РСА ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K „ -излучение, X = 0,71073 А, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [12]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [14] и OLEX2 [13]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1 Кристаллографические данные, параметры эксперимента и уточнения структуры
|
Параметр |
Значение |
|
Формула |
C25H21O4F4Br2Bi |
|
М |
830,22 |
|
Т , К |
293,15 |
|
Сингония |
Триклинная |
|
Пр. группа |
P –1 |
|
a , Å |
10,292(8) |
|
b, Å |
11,752(9) |
|
c, Å |
12,693(9) |
|
α, град |
89,42(2) |
|
β, град |
78,04(3) |
|
γ, град |
71,86(5) |
|
V , Å3 |
1424,8(18) |
|
Z |
2 |
|
р (выч.), г/см3 |
1,935 |
|
р , мм-1 |
9,045 |
|
F (000) |
784,0 |
|
Форма кристалла (размер, мм) |
обломок (0,73×0,57×0,41) |
|
Область сбора данных по 9 , град |
5,92–56,98 |
|
Интервалы индексов отражений |
–13 ≤ h ≤ 13, –15 ≤ k ≤ 15, –16 ≤ l ≤ 16 |
|
Измерено отражений |
45443 |
|
Независимых отражений |
7096 |
|
R int |
0,1030 |
|
Переменных уточнения |
328 |
|
GOOF |
1,049 |
|
R -факторы по F 2 > 2 a (F 2 ) |
R 1 = 0,0739, wR 2 = 0,1834 |
|
R -факторы по всем отражениям |
R 1 = 0,0999, wR 2 = 0,2008 |
|
Остаточная электронная плотность (min/max), e/A3 |
2,11/–2,78 |
Таблица 2
Длины связей и валентные углы
|
Связь d , Å |
Угол го , ° |
||
|
Bi(1)–O(1) |
2,275(8) |
O(1)Bi(1)O(3) |
172,2(3) |
|
Bi(1)–O(3) |
2,295(8) |
C(1)Bi(1)C(11) |
110,2(4) |
|
Bi(1)∙∙∙O(2) |
3,127(10) |
C(11) Bi (1)C(21) |
136,7(4) |
|
Bi(1)∙∙∙O(4) |
3,159(10) |
C(1) Bi (1)C(21) |
113,1(5) |
|
Bi(1)–C(1) |
2,187(10) |
C(1)Bi(1)O(1) |
86,9(4) |
|
Bi(1)–C(11) |
2,190(12) |
C(11)Bi(1)O(1) |
91,0(4) |
|
Bi(1)–C(21) |
2,212(13) |
C(21)Bi(1)O(1) |
91,0(4) |
Окончание табл. 2
|
Связь d , Å |
Угол го , ° |
||
|
O(1)–C(8) |
1,287(15) |
C(1)Bi(1)O(3) |
86,0(3) |
|
O(2)–C(8) |
1,227(16) |
C(11)Bi(1)O(3) |
94,7(4) |
|
O(3)–C(18) |
1,268(14) |
C(21)Bi(1)O(3) |
88,5(4) |
|
O(4)–C(18) |
1,215(16) |
||
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1923097; ; .
Обсуждение результатов
В данной работе было изучено взаимодействие три( пара -толил)висмута с бромдифторуксусной кислотой (2:1 мольн.) в присутствии трет -бутилгидропероксида, а также структурно охарактеризован продукт реакции: бис (бромдифторацетат) три( пара -толил)висмута.
Одним из методов синтеза дикарбоксилатов триарилвисмута является реакция окислительного присоединения с участием триарилвисмута, карбоновой кислоты и пероксидного окислителя. Данный метод хорошо изучен для трифенилвисмута и различных карбоновых кислот [11, 15– 24], но практически не исследован для толильных производных. Установлено, что реакция три( пара -толил)висмута с бромдифторуксусной кислотой в присутствии трет бутилгидропероксида протекала по обычной схеме:
p -Tol 3 Bi + 2 НOOCCBrF 2 + t -BuОOH → p -Tol 3 Bi[OC(O)CBrF 2 ] 2 + t -BuOH + Н 2 О
По данным РСА, атом висмута в соединении имеет искаженную тригонально-бипирамидальную координацию с аксиально расположенными карбоксильными группами (см. рисунок). Аксиальный угол OBiO равен 172,2(3) ° , сумма углов CBiC в экваториальной плоскости составляет 360,6 ° . Длины аксиальных связей Bi-O равны 2,275(8) А и 2,295(8) А, длины связей Bi–C изменяются в интервале 2,187(10)–2,212(13) Å.
Внутримолекулярные расстояния Bi⋅⋅⋅O=С в молекуле соединения незначительно отличаются друг от друга (3,127(10) и 3,159(10) Å) и меньше суммы ван-дер-ваальсовых радиусов атомов висмута и кислорода (3,59 Å) [25]. Необходимо отметить, что в кристалле бис (бромдифторацетата) три( пара -толил)висмута отсутствуют межмолекулярные контакты H∙∙∙Hal. Наиболее короткие расстояния H∙∙∙Br (3,22 Å) и H∙∙∙F (3,31 Å) превышают суммы ван-дер-ваальсовых радиусов атомов водорода и брома (2,93 Å) и водорода и фтора (2,57 Å) [25].
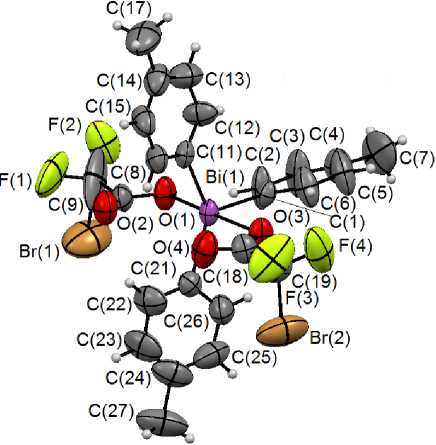
Общий вид молекулы бис (бромдифторацетата) три( пара -толил)висмута
Выводы
Установлено, что взаимодействие три( пара -толил)висмута с бромдифторуксусной кислотой в присутствии трет -бутилгидропероксида приводит к образованию бис (бромдифорацетата) три( пара -толил)висмута. Бромдифторацетатные лиганды, имеющие в составе карбоксильных групп атомы кислорода с неподеленными электронными парами, обусловливают дополнительную координацию с центральным атомом висмута, что приводит к увеличению его координационного числа до 7.
Выражаю благодарность проф. В.В. Шарутина за рентгеноструктурный анализ кристалла соединения.
Список литературы Бис(бромдифторацетат) три-пара-толилвисмута. Синтез и особенности строения
- Stability and Toxicity of Tris-tolyl Bismuth(V) Dicarboxylates and Their Biological Activity Towards / Y.C. Ong, V.L. Blair, L. Kedzierski et al. // Leishmania Major. Dalton Trans. - 2015. -V. 44. - P. 18215-18226. DOI: 10.1039/c5dt03335g.
- Tiekink, E.R.T. Antimony and Bismuth Compounds in Oncology / E.R.T. Tiekink // Crit. Rev. Oncol. / Hematol. - 2002. - V. 42, № 3. - P. 217-224. DOI: org/10.1016/S1040-8428(01)00217-7.
- Synthesis, Characterization and In Vitro Cytotoxicity Screening of Some Triarylbismuth(V) Di(N-salicylidene)amino Carboxylates and the Crystal Structure of (2-HOC6H4CH=NCH2CO2)2Bi(C6H5)3 / G.-C. Wang, J. Xiao, Y.-N. Lu et al. // Appl. Organomet. Chem. - 2005. - V. 19, № 1. - P. 113-117. DOI: 10.1002/aoc.749.
- Synthesis, Crystal Structures, DNA Interaction and Anticancer Activity of Organobismuth(V) Complexes / L. Cui, C. Bi, Y. Fan et al. // Inorgan. Chim. Acta. - 2015. - V. 437, № 1. - P. 41-46. DOI: 10.1016/j.ica.2015.07.008.
- Synthesis, Characterization and Cytotoxicity of Some Triarylbismuth(V) Di(N-p-toluenesulfonyl) Aminoacetates and the Crystal Structure of (4-CH3C6H4SO2NHCH2CO2)2Bi(C6H4Cl-4)3 / L.Yu, Y.-Q. Ma, G.-C. Wang et al. // Appl. Organomet. Chem. - 2004. - V. 18, № 4. - P. 187-190. DOI: 10.1002/aoc.609.
- Comparative Stability, Toxicity and Anti-leishmanial Activity of Triphenyl Antimony(V) and Bismuth(V) a-Hydroxy Carboxylato Complexes / R.N. Duffin, V.L. Blair, L. Kedzierski et al. // Dalton Trans. - 2018. - V. 47. - P. 971-980. DOI: 10.1039/C7DT04171C.
- Cambridge Crystallographic Data Center. 2019. (deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
- Шарутин, В.В. Синтез и строение дикарбоксилатов три-мета-толилвисмута / В.В. Шару-тин, О.К. Шарутина, В.С. Сенчурин // Журн. неорган. химии. - 2014. - Т. 59, № 1. - С. 42-46. DOI: 10.7868/S0044457X14010164.
- Андреев, П.В. Строение аддукта бис(хлорацетата) три(о-толил)висмута с хлоруксусной кислотой / П.В. Андреев // Вестник ЮУрГУ. Серия «Химия». - 2019. - Т. 11, № 3. - С. 59-65. DOI: 10.14529/chem190307.
- Особенности строения дикарбоксилатов триарилвисмута Ar3Bi[OC(O)R]2 / В.В. Шарутин, И.В. Егорова, О.К. Шарутина и др. // Химия и компьютерное моделирование. Бутлеровские сообщения. - 2002. - Т. 2, № 9. - С. 59-64.
- Шарутин, В.В. Дикарбоксилаты триарилвисмута Ar3Bi[OC(O)R]2, Ar = p-Tol, R = CH2Cl; Ar = Ph, R = C6H4OMe-2, CH=CHPh / В.В. Шарутин, О.К. Шарутина, АН. Ефремов // Журн. неорган. химии. - 2019. - Т. 64, № 2. - С. 159-164. DOI: 10.1134/S0044457X19020181.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726.
- Додонов, В.А. Синтез и некоторые реакции диацилатов трифенилвисмута / В.А. Додонов, А.В. Гущин, Т.Г. Брилкина // Журн. общ. химии. - 1985. - Т. 55, № 1. - С. 73-80.
- Додонов, В.А. Синтез диацилатов трифенилвисмута / В.А. Додонов, А.В. Гущин, А.В. Ежова // Журн. общ. химии. - 1988. - Т. 58, № 9. - С. 2170-2171.
- Особенности строения дикарбоксилатов трифенилвисмута / И.В. Егорова, В.В. Шарутин, Т.К. Иваненко и др. // Коорд. химия. - 2006. - Т. 32, № 9. - С. 672-679.
- Bis(but-2-enoato-KO)triphenylbismuth(V) / P.V. Andreev, N.V. Somov, O.S. Kalistratova et al. // Acta Cryst. - 2013. - V. E69, № 6. - m 333. DOI: 10.1107/S1600536813013317.
- Synthesis and Structural Study of TriphenylbismuthBis(Salicylate) / K. Feham, A. Benkadari, A. Chouaih et al. // Crystal Structure Theory and Applications. - 2013. - V. 2, no. 1. - P. 28-33. DOI: 10.4236/csta.2013.21004.
- Шарутин, В.В. Синтез и строение бис(пентахлорбензоата)трифенилвисмута / В.В. Шарутин, О К. Шарутина // Журн. неорган. химии. - 2014. - Т. 59, № 6. - С. 734-737. DOI: 10.7868/S0044457X14060208.
- Facile One-Pot Synthesis of Triphenylbismuth(V) Bis(carboxylate) Complexes / I. Kumar, P. Bhattacharya, K.H. Whitmire et al. // Organometallics. - 2014. - V. 33, № 11. - P. 2906-2909. DOI: 10.1021/om500337z.
- Kumar, I. Structural Diversity in Phenyl Bismuth(III) Bis(carboxylate) Complexes / I. Kumar, P. Bhattacharya, K.H. Whitmire // J. Organomet. Chem. - 2015. - V. 794. - P. 153- 167. DOI: 10.1016/j.jorganchem.2015.06.023.
- Synthesis of Triphenylbismuth Bis(2-methylpropenoate) / VA. Verkhovykh, O.S. Kalistratova, A.I. Grishina et al. // Вестник ЮУрГУ. Серия «Химия». - 2015. - Т. 7, № 3. - С. 61-65.
- Synthesis and Structures of Triphenylbismuth Bis [3-(2-Furyl)Acrylate] Ph3Bi[O2CCH=CH(C4H3O)]2 and Triphenylbismuth Di-meta-nitrocinnamate Ph3Bi(O2CCH=CH-С6H4)2 / A.A. Gusakovskaya, O.S. Kalistratova, P.V. Andreev et al. // Cryst. Rep. - 2018. - V. 63, № 2. -P. 186-190. DOI: 10.1134/S1063774518020062.
- Consistent Van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. - 2009. - V. 113, iss. 19. - P. 5806-5812. DOI: 10.1021/jp8111556.


