Ближайшие клинические результаты хирургического лечения пациентов с повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава
Автор: Толкачев Владимир Сергеевич, Бажанов Сергей Петрович, Коршунова Галина Александровна, Капралов Сергей Владимирович, Ульянов Владимир Юрьевич, Островский Владимир Владимирович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.28, 2022 года.
Бесплатный доступ
Проблема повреждений седалищного нерва после тотального эндопротезирования тазобедренного сустава является актуальной вследствие высокого распространения подобных осложнений, при этом в литературе нет единства мнений по поводу механизма повреждения, способов хирургического лечения, показаний и сроков выполнения операций, что обусловливает необходимость проведения подобных исследований. Цель. Провести сравнительный анализ динамики клинико-неврологических и электрофизиологических показателей у пациентов с повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава при выполнении различных методов хирургического лечения. Материалы и методы. Обследован 61 пациент, находившийся на стационарном лечении с 2005 по 2021 г. Пациенты распределены на две группы, однородные по полу, возрасту, степени выраженности неврологического дефицита. В I группе (n = 32) выполняли микрохирургический невролиз ствола седалищного нерва, во II (n = 29) - применяли метод прямой электростимуляции седалищного нерва на уровне повреждения в сочетании с микрохирургическим невролизом. Оценивали клинико-неврологический статус пациентов и показатели электронейромиографии до операции и через 6 месяцев после операции. Результаты. У всех пациентов отмечали снижение болевого синдрома по ВАШ с 6 (5,5; 8) до 4 (2; 6) в I группе и до 3 (1; 5) баллов во II группе (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Седалищный нерв, тотальное эндопротезирование тазобедренного сустава, нейропатия
Короткий адрес: https://sciup.org/142236803
IDR: 142236803 | УДК: 616.8-089:611.835.8:617.581 | DOI: 10.18019/1028-4427-2022-28-6-774-777
Текст научной статьи Ближайшие клинические результаты хирургического лечения пациентов с повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава
По данным литературы, повреждения седалищного нерва (ПСН) в основном являются последствиями тотального эндопротезирования тазобедренного сустава (ТЭП ТБС), составляя 0,16-8 % всех осложнений такого вмешательства [1-3]. Так, в своей работе
2005 г. C.M. Farrell с соавт. проанализировали исходы 27 004 ТЭП ТБС, при этом повреждение СН отмечали в 0,17 % случаев [4]. Причины ПСН могут быть различны: тракция, механическая травма хирургическим ретрактором, послеоперационная гематома [4, 5]. Сре-
ди факторов риска повреждения СН ряд авторов выделяет дисплазию ТБС, задний доступ при выполнении ТЭП, ревизионные хирургические вмешательства, необходимость удлинения конечности в ходе операции, женский пол, молодой возраст пациентов [6-8].
При ПСН после ТЭП ТБС отмечают высокий уровень травмы нерва с возникновением грубого неврологического дефицита и быстро формирующимся комплексным регионарным болевым синдромом (КРБС) в нижних конечностях [9]. Наиболее распространенными методами хирургического лечения ПСН являются микрохирургический невролиз (МН) и невротизация, однако полное восстановление полезной функции нижней конечности после травмы СН отмечается достаточно редко, несмотря на применение микрохирургических методов реконструкции. Причиной этого является прогрессирующая мышечная атрофия, которая развивается при длительной денервации конечности [10-12].
Использование не только стандартных хирургических методик, но и электростимуляции (ЭС), в том числе прямой стимуляции периферического нерва и сегментарного аппарата спинного мозга, а также их со- четанное применение, является перспективным методом лечения. Они особенно актуальны для пациентов с КРБС, так как их действие направлено на уменьшение выраженности болевого синдрома [11].
Тем не менее, в литературе нет единого мнения по поводу показаний и сроков применения ЭС. Недостаточно исследований по оценке регенерации нервномышечного аппарата на фоне применения ЭС, а большинство подобных работ проводились на анимальных моделях [13]. На текущем этапе сроки и показания для применения ЭС у стационарных пациентов определяются, в основном, эмпирически и по личной преференции лечащего врача [14]. Отсутствие единых рекомендаций по применению различных методик лечения ПСН обусловливает актуальность исследований, направленных на их сравнение и выявление наиболее эффективной в каждом конкретном случае.
Цель исследования – провести сравнительный анализ динамики клинико-неврологических и электрофизиологических показателей у пациентов после применения различных методик хирургического лечения ПСН.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование моноцентровое, продольное, открытое, ретро- и проспективное, проведено с соблюдением Женевской конвенции и одобрено локальным этическим комитетом ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России (протокол заседания комитета по этике ФГБОУ СГМУ им. В.И. Разумовского Минздрава России № 7 от 02.02.2021 г.).
Критериями включения пациентов в исследование явились возраст (от 18 до 65 лет для мужчин и от 18 до 60 лет для женщин), изолированный характер травмы СН, степень повреждения, соответствующая II-IV степени (по классификации Sunderland), предшествующее консервативное лечение согласно стандартам оказания медицинской помощи, проведённое в срок не менее 3-х месяцев с момента получения травмы, подписанное добровольное информированное согласие пациента на участие в исследовании.
Объект исследования составил 61 пациент с ПСН, находившийся на стационарном лечении в нейрохирургическом отделении НИИТОН СГМУ с 2005 по 2021 г. Исследование проведено в двух группах, однородных по полу, возрасту и степени выраженности неврологического дефицита. Численность I группы составила 32 пациента (ретроспективное исследование), численность II группы – 29 пациентов (проспективное исследование).
У пациентов I группы выполняли МН СН: под спинномозговой анестезией в положении больного на животе СН выделяли из проекционного доступа по задней срединной линии бедра. Рассекали кожу, подкожную клетчатку, фасцию бедра. В верхней трети бедра длинную головку двухглавой мышцы отводили медиально и частично надсекали большую ягодичную мышцу. По- сле разведения мышц рассекали фасциальный футляр, в котором находили СН, и выполняли его МН.
Пациентам II группы после проведенного МН выполняли имплантацию восьмиканальных электродов на ствол СН на уровне подгрушевидного отверстия. Электроды выводили из раны через контрапертуру и фиксировали к коже узловыми швами. Рану ушивали послойно.
Для каждого пациента параметры стимуляции подбирали индивидуально, при этом использовали минимальные показатели, при которых регистрировали вызванный ответ с мышц нижней конечности по данным электронейромиографии (ЭНМГ). Сеансы стимуляции проводили 3 раза в день по 10-15 минут в течение 14 суток.
У всех пациентов в послеоперационном периоде применяли консервативные методы лечения, включая комплексное физиотерапевтическое и медикаментозное.
Динамику клинико-неврологического статуса и электрофизиологических показателей оценивали через 6 месяцев после операции. Использовали визуальноаналоговую шкалу (ВАШ), шкалу Oswestry Disability Index (ODI), пятибалльные шкалы мышечной силы и чувствительности. При сравнении показателей ЭНМГ использовали характеристики М-ответа – амплитуду, латентность, скорость проведения импульса (СПИ).
Статистический анализ полученных данных осуществляли с применением программ Microsoft Office Excel 2019, IBM SPSS Statistics v23. Оценку данных выполняли с помощью описательных и непараметрических методов статистики. Использовали U-критерий Манна-Уитни, критерий Вилкоксона. Для оценки достоверности различия исследуемого параметра применяли U-критерий Манна-Уитни. Различия между группами считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
На дооперационном этапе у всех пациентов был отмечен КРБС высокой интенсивности, при этом разницы между исследуемыми группами отмечено не было (p = 0,953), по ВАШ его Ме (Q1; Q3) составила 6 (5,5; 8) баллов. В послеоперационном периоде у всех пациен- тов было отмечено снижение интенсивности болевого синдрома, при этом полного его регресса не было отмечено ни в одном случае. Медианные показатели и интерквартильный интервал ВАШ составили 4 (2; 6) балла в I группе, 3 (1; 5) балла во II группе (p < 0,001) (рис. 1).
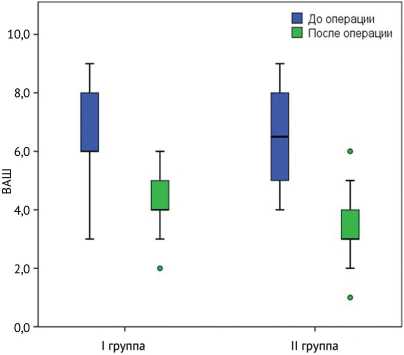
Рис. 1. Динамика болевого синдрома в I и II группах
При оценке функциональной недостаточности нижней конечности в дооперационном периоде у большинства пациентов был отмечен умеренный и высокий дефицит по данным шкалы ODI. Его показатели для I группы составляли 31 (24,5; 40,5) балл, для II группы – 27 (21; 36) баллов (p = 0,476). В послеоперационном периоде у всех пациентов была зафиксирована положительная динамика в виде улучшения функции нижней конечности. За счет снижения нейропатического болевого синдрома у многих пациентов отмечали восстановление возможности ходить с опорой на пораженную конечность, однако в I группе снижение функциональной недостаточности нижней конечности было менее выражено. Послеоперационные показатели шкалы ODI в I группе составили 28 (20; 34,5) баллов, во II группе – 16,5 (8,5; 21,75) баллов (p < 0,0001).
По данным ЭНМГ в дооперационном периоде у пациентов с ПСН наиболее часто отмечали повреждение обеих порций нерва, при этом изолированное поражение большеберцовой порции встречалось достаточно редко и было отмечено только в двух случаях. Дооперационные показатели М-ответа ветвей СН представлены в таблице.
Таблица
Показатели М-ответа нервов нижних конечностей на дооперационном этапе, Me (Q1; Q3)
|
Точка стимуляции |
М-ответ, mV |
Латентность, ms |
СПИ, м/с |
|
Малоберцовый нерв |
|||
|
M1 |
1,22 (0,61; 2,0) |
3,70 (3,13; 5,075) |
42,2 (38,5; 44,5) |
|
M2 |
1,6 (0,9; 2,20) |
15,0 (13,3; 16,3) |
|
|
Большеберцовый нерв |
|||
|
M1 |
1,9 (1,2; 3,67) |
4,77 (4,0; 5,657) |
43,4 (40,29; 46,6) |
|
M2 |
2,6 (1,8; 3,6) |
13,5 (11,23; 14,7) |
|
Примечание: M1 – голеностопный сустав; M2 – коленный сустав
Представленные в таблице данные свидетельствуют о превалировании в исследовании тяжелых аксональных поражений СН, что характеризовалось снижением амплитуд М-ответа и увеличением их латентности, а также снижением скорости проведения импульса по нервам.
В послеоперационном периоде у всех пациентов отмечали увеличение амплитуд и снижение латентности М-ответа по малоберцовому и большеберцовому нервам по данным стимуляционной ЭНМГ, при этом медианные показатели амплитуды М-ответа малоберцового нерва составили для I группы 1,2 (0,275; 2,90), для II группы 1,6 (1,164; 2,23), p = 0,257. Латентный период малоберцового нерва у пациентов I группы составил 3,7 (3,125; 5,15), у пациентов II группы 3,35 (3,00; 5,125), p = 0,176. Для большеберцового нерва амплитуда М-ответа в I группе составила 3,2 (1,3; 5,2), во II группе 2,16 (1,393; 2,6), p = 0,217, при этом латентный период составлял в I группе 4,6 (3,75; 5,5), во II группе 4,6 (3,96; 5,61), p = 0,394.
В случаях тяжелого и крайне тяжелого поражения СН отмечали появление низкоамплитудных М-ответов с точек стимуляции, в которых М-ответ ранее не регистрировался. У всех пациентов положительная динамика электрофизиологических показателей коррелировала с клиническими данными и была выражена лучше у пациентов с более легкими повреждениями.
При сравнении исследуемых групп было выявлено, что положительная динамика показателей М-ответа была достоверно лучше во II группе (p < 0,05) (рис. 2).
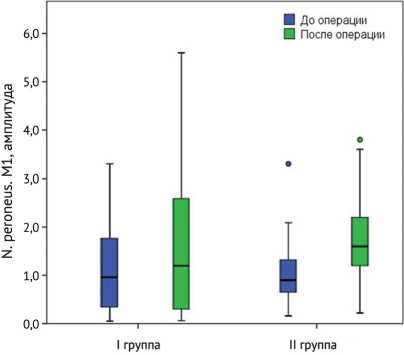
Рис. 2. Динамика показателей М-ответа (на уровне голеностопного сустава)
Таким образом, по данным анализа динамики клинико-неврологических и электрофизиологических показателей продемонстрирована высокая эффективность метода МН в сочетании ЭС и его преимущество по сравнению с выполнением только МН, что проявилось более интенсивным регрессом болевого синдрома и функциональной недостаточности нижней конечности, а также более выраженной динамикой показателей М-ответа поврежденных нервов.
ОБСУЖДЕНИЕ
По данным ряда авторов [15-17], продемонстрировано выраженное снижение болевого синдрома при применении ЭС у пациентов с поражением периферических нервов, при этом, в отличие от нашей работы, изучение состояния периферического сенсомоторного аппарата по данным ЭНМГ не производилось.
В литературе встречаются сообщения об усилении регенерации СН на фоне проведения ЭС. Так, Мещеряги-на И.А. и соавт. [10] в своей работе демонстрируют успешный случай лечения пациентки с нейропатией СН после ТЭП ТБС. При этом применялся пункционный метод установки электрода на ствол СН, а ЭС носила хронический характер, что определяет отличия от нашей работы.
В данной работе на основании проведенного анализа применения различных методик хирургического лечения у пациентов с ПСН продемонстрирована достоверная эффективность МН в сочетании с одноуровневой ЭС (II группа) по сравнению с применением только МН (I группа), при этом по данным ЭМНГ наиболее быстрое восстановление было отмечено в проксимальных точках стимуляции. У пациентов I группы было отмечено сохранение болевого синдрома в послеоперационном периоде, что не позволяло проводить полноценный комплекс реабилитационно-восстановительных мероприятий.
В настоящее время происходит значительное развитие функциональной нейрохирургии, появляются новые методики лечения, расширяются показания для их применения, вводятся в эксплуатацию новые устройства для ЭС [18], однако на текущий момент не собрано достаточного количества научных и клинических данных, свидетельствующих об однозначном преимуществе ЭС перед другими методиками комплексного лечения, а также не определены четкие показания для ее применения в различных клинических ситуациях. Эти факты обусловливают необходимость проведения дальнейших исследований и поиска оптимального алгоритма, позволяющего выбрать адекватный метод лечения пациентов с ПСН после ТЭП ТБС.
ЗАКЛЮЧЕНИЕ
Несмотря на то, что наиболее распространенной можно назвать достаточно перспективным, что подтактикой лечения ПСН является применение МН в тверждается высокими темпами регресса болевого качестве единственного метода хирургического вме- синдрома и степени функциональной недостаточности шательства, метод прямой ЭС СН в сочетании с МН нижней конечности.
Список литературы Ближайшие клинические результаты хирургического лечения пациентов с повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава
- Nerve trauma of the lower extremity: evaluation of 60,422 leg injured patients from the TraumaRegister DGU® between 2002 and 2015 / T. Huckhagel, J. Nüchtern, J. Regelsberger, M. Gelderblom, R. Lefering; TraumaRegister DGU® // Scand. J. Trauma Resusc. Emerg. Med. 2018. Vol. 26, No 1. P. 40. DOI: 10.1186/s13049-018-0502-5.
- Реакция нервов на растяжение и их структурная адаптация к удлинению конечности / М.М. Щудло, Н.А. Щудло, Т.Н. Варсегова, И.В. Борисова // Гений ортопедии. 2009. № 4. C. 48-55.
- Попович М.И. Тракционная травма элементов сосудисто-нервного пучка // Оренбургский медицинский вестник. 2014. Т. 3, № 7. С. 19-23.
- Motor nerve palsy following primary total hip arthroplasty / C.M. Farrell, B.D. Springer, G.J. Haidukewych, B.F. Morrey // J. Bone Joint Surg. Am. 2005. Vol. 87, No 12. P. 2619-2625. DOI: 10.2106/JBJS.C.01564.
- Su E.P. Post-operative neuropathy after total hip arthroplasty // Bone Joint J. 2017. Vol. 99-B, No 1 Suppl. P. 46-49. DOI: 10.1302/0301-620X.99B1. BJJ-2016-0430.R1.
- Nerve injuries associated with total hip arthroplasty / R. Hasija, J.J. Kelly, N.V. Shah, J.M. Newman, J.J. Chan, J. Robinson, A.V. Maheshwari // J. Clin. Orthop. Trauma. 2018. Vol. 9, No 1. P. 81-86. DOI: 10.1016/j.jcot.2017.10.011.
- DeHart M.M., Riley L.H. Jr. Nerve injuries in total hip arthroplasty// J. Am. Acad. Orthop. Surg. 1999. Vol. 7, No 2. P. 101-111. DOI: 10.5435/00124635199903000-00003.
- Risk of sciatic nerve traction injury during hip arthroscopy - is it the amount or duration? An intraoperative nerve monitoring study / J.J. Telleria, M.R. Safran, A.H. Harris, J.N. Gardi, J.M. Glick // J. Bone Joint Surg. Am. 2012. Vol. 94, No 22. P. 2025-2032. DOI: 10.2106/JBJS.K.01597.
- Шостак Н.А., Правдюк Н.Г., Клименко А.А. Комплексный региональный болевой синдром - клиника, диагностика, лечение // Клиницист. 2013. Т. 7, № 1. С. 41-47. DOI: 10.17650/1818-8338-2013-1-41-47.
- Нейропатия седалищного нерва у пациентки после эндопротезирования по поводу врожденного вывиха головки бедра (клинический случай из практики) / И.А. Мещерягина, С.В. Мухтяев, О.С. Россик, К.А. Григорович, М.В. Хомченков, Ю.Л. Митина // Гений ортопедии. 2014. № 3. С. 82-88.
- Малоинвазивные методы лечения повреждений периферических нервов / А.Т. Худяев, И.И. Мартель, В.В. Самылов, И.А. Мещерягина, О.С. Россик // Гений ортопедии. 2012. № 1. С. 85-88.
- Мещерягина И.А., Скрипников А.А. Применение комбинированной электростимуляции при изолированных и сочетанных повреждениях периферических нервов верхних и нижних конечностей // Российский медицинский журнал. 2015. Т. 21, № 3. С. 14-19.
- Gordon T. Peripheral Nerve Regeneration and Muscle Reinnervation // Int. J. Mol. Sci. 2020. Vol. 21, No 22. Р. 8652. DOI: 10.3390/ijms21228652.
- Electrical stimulation combined with exercise increase axonal regeneration after peripheral nerve injury / E. Asensio-Pinilla, E. Udina, J. Jaramillo, X. Navarro // Exp. Neurol. 2009. Vol. 219, No 1. P. 258-265. DOI: 10.1016/j.expneurol.2009.05.034.
- Detection and prevalence of variant sciatic nerve anatomy in relation to the piriformis muscle on MRI / V. Varenika, A.M. Lutz, C.F. Beaulieu, M.D. Bucknor // Skeletal Radiol. 2017. Vol. 46, No 6. P. 751-757. DOI: 10.1007/s00256-017-2597-6.
- Landers M., Altenburger P. Peripheral nerve injury // Advances in Physiotherapy. 2003. Vol. 5, No 2. P. 67-82. DOI: 10.1080/14038190310012656.
- Peripheral nerve stimulation for occipital neuralgia / V. Salmasi, O.O. Olatoye, A.S. Terkawi, J.M. Hah, E. Ottestad, M. Pingree // Pain Med. 2020. Vol. 21, No Suppl. 1. P. S13-S17. DOI: 10.1093/pm/pnaa083.
- The future of peripheral nerve stimulation / M. Stanton-Hicks, I.G. Panourias, D.E. Sakas, K.V. Slavin // Prog. Neurol. Surg. 2011. Vol. 24. P. 210217. DOI: 10.1159/000324298.


