Болезнь Шмалленберга: молекулярно-биологические особенности вируса и клиническая картина (обзор)
Автор: Спрыгин А.В., Кононов А.В., Бабин Ю.Ю., Мищенко В.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Проблемы, обзоры
Статья в выпуске: 6 т.47, 2012 года.
Бесплатный доступ
Вирус болезни Шмалленберга по генетической характеристике предварительно принадлежит к семейству Bunyaviridae, роду Orthobunyavirus, серогруппе Симбу. Вирусный геном представлен тремя сегментами: S (короткий), M (средний) и L (длинный), а передача вируса происходит через укусы насекомых, главным образом мокрецов Culicoides spp. Заболевание характеризуется желудочно-кишечными расстройствами, повышением температуры тела и снижениюем удоев у взрослых животных (коровы, овцы, козы), рождением молодняка с пороками развития, мертворождениями в результате заражения матерей в период беременности. Обсуждается происхождение вируса, генетические свойства, патогенез, методы диагностики болезни Шмалленберга, затронуты вопросы профилактики и эпизоотологической ситуации в странах ЕС
Вирус шмалленберга, крупный рогатый скот(крс), буньявирусы, артрогрипоз, пцр
Короткий адрес: https://sciup.org/142133356
IDR: 142133356 | УДК: 619:578
Текст обзорной статьи Болезнь Шмалленберга: молекулярно-биологические особенности вируса и клиническая картина (обзор)
История вопроса. В августе 2011 года было зарегистрировано массовое заболевание дойных коров в Северной Рейн-Вестфалии (Германия) и на северо-западе Нидерландов. Заболевание проявлялось угнетенным состоянием, отказом от корма, диареей, гипертермией (температура тела 40 ° С и выше), снижением молочной продуктивности более чем на 50 % и абортами (1). В пораженных стадах в течение нескольких недель заболевало 20-70 % поголовья. Клинические признаки исчезали через несколько суток после начала заболевания.
0.1
100 Schmallenberg virus
69 Shamonda virus
Yaba-7 virus
Tinaroo virus
Sathuperi virus Douglas virus Sabo virus
Akabane virus
Simbu virus

Shuni virus
Kaikalur virus
Sango virus
Peaton virus
Aino virus
100 Oropouche virus Jatobal virus
Faceys Paddock virus Ingwavuma virus
Buttonwillow virus
Batai virus
Серогруппа Симбу
Bunyamwera virus
California encephalitis virus
La Crosse virus
Серогруппа Буньямвера Серогруппа Калифорния
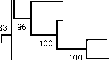
Рис. 1. Филогенетическое родство выявленного вируса и ортобуньявирусов из серогрупп Симбу, Буньям-вера и Калифорния. Дендрограмма построена с помощью алгоритма neighbor-joining (1000 повторов, 702 п.н.) (1).
Случаи массовой диареи и значительная потеря молочной продуктивности стали основанием для подозрения на заболевание взрослого крупного рогатого скота (КРС) коронавирусной зимней дизентерией или вирусной
диареей. Однако ре
зультаты исследований проб фекалий на указанные инфекции оказались отрицательными. Дополнительно проводились исследования по выявлению в крови животных герпесвируса-1, вирусов блютанга, ящура, эпизоотической геморрагической лихорадки, лихорадки долины Рифт, эфемерной лихорадки. На ферме около местечка Шмалленберг у скота были отобраны
пробы крови и выполнен метагеномный анализ. Полученные результаты свидетельствовали о присутствии трех РНК-последовательностей: малой (S; 830 п.н.), средней (M; 4,415 п.н.) и большой (L; 6,865 п.н.), которые впоследствии были депонированы в международной базе GenBank (HE649912-HE649914). Дендрограмма, построенная при сравнительном анализе этих последовательностей (рис. 1), указывала, что по предварительной оценке выявленный вирус принадлежит к роду Orthobunyaviridae . По S-сегменту он был наиболее гомологичен вирусу Шамонда (97 % идентичности), по М-сегменту — вирусу Сатупери (82 % идентичности) и по L-сегменту — также вирусу Шамонда (92 % идентичности) (1). Вирус выделяли в культуре клеток насекомых Culicoides variipennis larvae cells (KC-клетки) с последующим пересевом на культуру клеток ВНК-21.
Представители сем. Bunyaviridae широко распространены в Азии, Африке и Океании (2). Передача происходит в основном через укусы насекомых, главным образом Culicoides spp. и москитов. К наиболее значимым патогенам жвачных относятся вирусы из серогруппы Симбу — Ака-бане, Айно и Шамонда. Важно отметить, что вирусы указанной серогруппы никогда не встречались в Европе (3). Поскольку вирус изолировали впервые, то его назвали в честь местечка, рядом с которым он был выделен (1). Вирусы Акабане, Айно и Шамонда переносятся москитами, а инфицирование неиммунных животных проявляется в мягкой транзиентной форме (4). Все вирусы способны проникать через плацентарный барьер, реплицироваться в тканях плода, вызывать аборты и врожденные уродства у потомства (5-8).
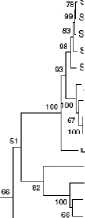
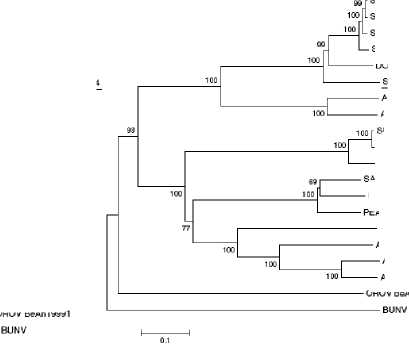
С т р о е н и е и г е н е т и ч е с к и е о с о б е н н о с т и в ир у с а Ш м а л л е н б е р г а. Вирус Шмалленберга имеет сферическую форму и диаметр 100 нм (9); геном представлен РНК с отрицательной полярностью, состоящей, как уже отмечалось, из трех сегментов: L — большого, кодирующего РНК-полимеразу (транскриптазу); S — малого, кодирующего нуклеокапсидный белок (N) и неструктурный протеин (NSm), и M — среднего, кодирующего поверхностные гликопротеины (G 1 и G2). Поверхностные белки участвуют в прикреплении, слиянии клеток и гемагглютинации, следовательно, содержат важные детерминанты вирулентности. Нейтрализующие антитела направлены против эпитопов поверхностных гликопротеинов G 1 и G2, при этом защитными свойствами обладают антитела к гликопротеину G2. Состав вирионных липидов соответствует составу мембран клеток, используемых для культивирования вируса. При сравнении нуклеотидной последовательности в трех геномных РНК-сегментах вирусов Сатупери, Шамонда, Дуглас и Шмалленберга и их филогенетическом анализе (рис. 2) было сделано предположение, что вирус Шмалленберга — реассортант вирусов Сатупери (по М-сегменту, 82 %) и Шамонда (по S- и L-сегменту, соответственно 97 и 92 %) (10).
Вирусы Шамонда и Сатупери принадлежат к серогруппе Симбу (род Orthobunyavirus) вместе с вирусами Дуглас, Тинару и Пеатон, которые способны вызывать врожденные уродства у жвачных в Азии, Африке и Океании (2). Вирус Шамонда впервые был выделен от КРС в Нигерии (11) и относительно недавно зарегистрирован в Японии (12). Интересно, что у вируса Шамонда, несмотря на то, что прошло около 40 лет между случаями его выявления, практически не проявляется генетический дрейф (3 % на уровне РНК). Поскольку генетическая дистанция между нигерийскими и японскими изолятами вируса Шамонда примерно сопоставима с таковой между японским изолятом вируса Шамонда и вирусом болезни Шмалленберга (около 3 %), то наиболее вероятно, что вирус болезни Шмалленберга может быть вариантом вируса Шамонда (1, 13). Однако для подтверждения такого предположения нужны дополнительные исследования.
А
SATV ON-1 №/06
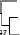
Б
SATVKSB-2/C/O8
SATVON-1/P/06
SATV OI-3/P/07
SATVOI№/07
SATV OY-1 /Р/99
SATVI-11155
Schmallenberg BH80/11 -4
SHAVAn5550
SHAV KSB-6/C/02
iw'SHAVON-S/P/O?
--D0UVCSIR0150
AKAV MP496
AKAV B8935
AKAV OBE-1
TINV CSIRO153
PEAV NS-3/P/99
SANV An5077
AIN0VB7974
PEAVCSIR011O
OROV BeAn19991
---AINOV JANAi28
SATV KSB-2/C/06
SATV OY-1/P/99
DOUVCSIRO150
Schmallenberg BH80/11 -4
AINOVJaNAr28
Al NOV B7974
SHAV ON-3/P/07
SHAV KSB-6/C/02
SHAV An5550
SANVAn5077
PEAV CSIRO110
PEAV NS-3O99
•TINVCSIRO153
AKAV MP496
AKAVBS935
AKAV OBE-1
Рис. 2. Дендрограммы, отражающие филогенетическое родство вируса Шмалленберга (реассортант): по М-сегменту РНК — с вирусом Сатупери (Б) , по S- и L-сегменту — с вирусом Шамонда (А, В) (10).
OROV BoAn19991

Круг хозяев и пути передачи. Геном вируса болезни Шмалленберга с помощью ОТ-ПЦР (ПЦР с обратной транскрипцией) обнаружен в материале от коров, овец, коз и бизонов (9). Антитела к вирусам серогруппы Симбу выявляются не только у домашних животных, но и у экзотических: буйволов (Syncerus caffer), зебры (Equus burchelli), винторогой антилопы (Tragelaphus strepsiceros), импалы (Aepyceros melampus), го лубой гну (Connochaetes taurinus), слона (Loxodonta africana), бородавочника (Phacochoerus aethiopeticus), носорога (Diceros bicornis, Ceratotherium simum), благородного оленя (Cervus elaphus) и кабана (Sus scrofa) (14, 15). Однако до настоящего времени клинические признаки были зарегистрированы только у КРС.
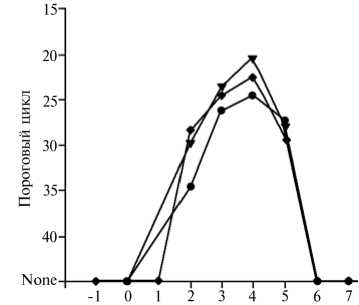
Патогенез и клинические признаки. Наиболее чувствительные периоды для заражения у КРС — 4-8-я нед стельности, у овец — 8-14-я нед суягности. При экспериментальном заражении трех телят в возрасте 9 мес ПЦР-позитивной кровью от четырех больных коров все зараженные животные заболели и были ПЦР-позитивны на 2-5-е сут после инокуляции. В среднем пик вирусемии приходился на 4-е сут после заражения (рис. 3). При этом наблюдали следующие клинические признаки: температура 40,5 ° С у первого животного и диарея в течение нескольких суток — у второго (1, 16).
Клинические признаки при болезни Шмалленберга отличаются от субклинических при естественном и экспериментальном заражении виру-
Время, сут
Рис. 3. Динамика вирусемии у трех телят при экспериментальном заражении кровью коров, ПЦР-позитивной по вирусу Шмалленберга (1).
сами Акабане или Айно (2, 17). Наиболее тяжелые проявления при заражении вирусом Акабане — энцефалит у взрослых особей КРС (18, 19), однако при болезни Шмалленберга такие случаи не зарегистрированы.
С помощью ПЦР геном вируса болезни Шмалленберга обнаруживали у новорожденных животных с врожденными уродствами, мертворожденных или абортированных плодов (9, 20, 21). Также отмечались случаи рождения внешне здоровых особей, но с такими нарушениями, как глухота слепота, гипервозбудимость, неспособность стоять, атаксия, нарушение сосательного рефлекса, повышенное слю ноотделение (20, 21).
Дополнительно в Институте Фридриха Леффлера (Friedrich-Loeffler-Institut, Federal Research Institute for Animal Health — FLI, остров Римс, Графсвальд, Германия) изучали эффект при различных способах заражения КРС пробами вируса Шмалленберга (внутривенное, подкожное и алиментарное, по 2 гол. в каждом варианте). Виремию отмечали на 2-6-е сут после подкожной и внутривенной инокуляции вируса. Вирус был выявлен в фекалиях и в пробах из ротовой полости. Все это позволяет предположить существование и других путей заражения. При алиментарном заражении виремию не регистрировали. В экспериментах, проведенных в научно-исследовательских учреждениях стран — членов ЕС, вирус Шмалленберга диагностирован в пробах тканей головного мозга 6-месячного абортированного плода КРС из Бельгии; в пробах тканей головного мозга нежизнеспособного новорожденного ягненка; в перитонеальной жидкости мертворожденного теленка, родившегося за 10 сут до физиологического срока; в фекалиях от больных диареей коров; в крови больных животных; в меконии новорожденных жвачных; в материале из ротовой полости ко ров и от кровососущих насекомых.
Специалистами из Германии и Нидерландов установлены существенные различия в накоплении вируса Шмалленберга в головном мозге у разных видов животных. Геном вируса Шмалленберга детектировали только в 5 % проб от нежизнеспособных и абортированных телят и телят с уродствами, характерными для этой болезни. В то же время в патологическом материале от овец и коз разработанный метод ПЦР позволяет выявить РНК вируса в значительно большем числе проб. Вероятно, этим можно объяснить низкую частоту индикации возбудителя в пробах от КРС.
У взрослых животных в сезон активности переносчика часто наблюдается неявное, но достаточно острое течение заболевания: гипертермия (температура тела 40 °С и выше), ослабленное общее состояние, анорексия, диарея, снижение удоев с последующим восстановлением молочной продуктивности (до минимального уровня, наблюдаемого у животных в стаде, — за несколько суток, до соответствующего среднему по стаду — через 2-3 нед). Для молодняка с врожденными дефектами и мертворожденных животных (телята, ягнята, козлята) характерны следующие клинические признаки и патолого-анатомические изменения: артрогрипоз, врожденное недоразвитие нижней челюсти (брахигнатия), анкилоз, искривле- ние шеи (тортиколез), сколиоз, гипоплазия отделов головного и спинного мозга (дополнительно см. .
Вирус Акабане. В настоящее время о вирусе болезни Шмалленберга известно очень мало и все эпизоотологические прогнозы делаются на основе соответствующего профиля вируса Акабане.
Вирус Акабане наряду с вирусами Айно, Дуглас, Тинару принадлежит к серогруппе Симбу (род Orthobunyavirus ). Вирус Акабане был зарегистрирован в Австралии, Японии, Израиле и Корее. В Австралии вспышки заболевания происходят раз в 10-15 лет вследствие неблагоприятных погодных условий, в результате которых снижается численность переносчиков и животные становятся неиммунными перед началом репродуктивного периода. Единственным переносчиком вируса служит мокрец Culicoides brevitarsis Kieffer. Данные серомониторинга свидетельствуют о широком распространении вируса на территории Австралии с преимущественной локализацией в северной части материка. При этом необходимо отметить, что вирусы Шамонда и Сатупери никогда в Австралии выявлены не были (P.D. Kirkland, персональное сообщение).
Продолжительность виремии составляет от 1 до 9 сут (в основном 4-5 сут). Географическое распространение антител у КРС и появление клинических признаков коррелируют с ареалом переносчика. Однако случаи сероконверсии были зарегистрированы за пределами зоны распространения переносчика. Сероконверсию у сумчатых никогда не регистрировали (2). На севере Австралии циркуляция вируса происходит в течение всего года, тогда как на юге носит сезонный характер и прекращается, как правило, с наступлением неблагоприятных погодных условий. На севере Австралии разводят коров мясной породы. С учетом ранней инфекции все нетели перед осеменением становятся иммунными, что защищает поголовье от потерь. На юге, где отмечается сезонность л ё та переносчиков, разводят коров молочной породы и для получения молока в течение всего года осеменение планируется с учетом л ё та мокрецов, чтобы избежать инфицирования во время беременности (2).
Семя зараженных быков не представляет опасности для воспроизводства поголовья. В экспериментах с инокуляцией вируса в семя и осеменением коров инфицированным генетическим материалом не происходит заражения плода (2).
Основные особенности патогенеза вируса зависят от срока беременности на момент заражения. Весенняя случка сопровождается максимальными потерями, при заражении на ранних сроках у плода развивается слабый паралич и отмечается наибольшее число абортов, на 5-6-м мес — артрогрипоз, на 3-4-м мес — гидроцефалия. У овец и коз наблюдается артрогрипоз и гидроцефалия. Если у КРС заражение происходит на поздних сроках и телята рождаются вовремя, то поражается главным образом ЦНС — головной и спинной мозг. В биологическом материале от таких телят выявляют вирусную РНК (на пределе чувствительности ПЦР). У телят, не получавших молозива, накапливаются высокие титры IgG. Вирус можно также выделить из абортированного плода.
Антитела против вируса Акабане создают частичный перекрестный иммунитет к другим вирусам из рода Orthobunyavirus — Айно, Дуглас, Питан и Тинару. Были случаи смешанных инфекций, вызванных несколькими ортобуньявирусами, но не более чем двумя (2).
В Австралии между вектором, вирусом и хозяином существует экологическое равновесие. Однако каждые 10-15 лет регистрируются вспышки инфекции из-за его нарушения, вызванного экстремальными погодными условиями, при котором численность популяции векторов снижается и животные становятся иммунными к повторному заражению. Для снижения вероятности вспышки ввезенных в активный период вектора животных не объединяют с другими стадами. Вакцинацию в Австралии не проводят из-за нерентабельности вакцин, при этом вакцины используются только в случае прогнозируемой вспышки, а вспышки главным образом зависят от экстремальных погодных условий (22).
Израильские ученые исследовали пробы мозга и крови от клинически здоровых взрослых коров и установили, что такие животные могут быть ПЦР-позитивны по вирусу Акабане и, следовательно, не исключено наличие его резервуара в природе.
Диагностика. Согласно техническому листу МЭБ, вирус болезни Шмалленберга можно выявлять с помощью ОТ-ПЦР (23) (доступны коммерческие наборы), выделения на культуре клеток насекомых (KC), хомячка (BHK), зеленой мартышки (VERO), а также с помощью ИФА (имеются коммерческие наборы), непрямой иммунофлуоресценции и реакции нейтрализации.
Для диагностики используют патологический материал, который следует перевозить в охлажденном или замороженном виде: при выявлении вируса от животных в острой стадии болезни — кровь с EDTA и сыворотку крови (2 мл), от телят, ягнят, козлят с врожденными уродствами — образцы ткани мозга (головной мозг и ствол головного мозга), от новорожденных животных — околоплодную жидкость и плаценту, меконий; при выявлении антител — перикардиальную жидкость, кровь (предпочтительно преколостральную). Проводятся гистологические исследования ЦНС, включая срезы спинного мозга.
Пути передачи и риск для человека. Доказано, что переносчиками буньявирусов служат кровососущие насекомые мокрецы Cu-licoides spp. и москиты родов Anopheles , Culex и Ochlerotatus (24, 25). Вирус Айно переносится москитами Culex spp. и мокрецами C . midges (26, 27). Вирус болезни Шмалленберга выявлен в слюнных железах мокрецов C . obsoletus и C . dewulfi в Бельгии (28-31). РНК вируса также выявлена у мокрецов комплекса C . obsoletus , собранных в октябре 2011 года в Дании (32). Отсутствие мРНК р -актина жвачных и высокие титры РНК вируса в этих пробах свидетельствуют о репликации вирус в организме насекомых, то есть мокрецы, включая виды C. punctatus , — биологические переносчики вируса болезни Шмалленберга. Это положение в значительной степени актуально для России, так как на территории страны относительно широко распространены виды потенциальных переносчиков вируса — мокрецы C . dewulfi , C . obsoletus , C. pulicaris , C . punctatus и C . chiopterus (33). Их ареал доходит до 72 ° с.ш., места выплода некоторых — перегнивающие субстраты, в том числе навоз, что позволяет им сохранять активность и в холодное время года.
Некоторые представители серогруппы Симбу (например, вирус Оро-пуше) вызывают зоонозные инфекции. Поскольку вирус болезни Шмалленберга генетически близок к вирусу Шамонда, который поражает только жвачных, то риск заражения человека вирусом болезни Шмалленберга оценивается, как очень низкий (29). Опубликованы первые результаты исследования проб крови от людей из группы высокого риска (фермеры и ветеринарные специалисты неблагополучных ферм), свидетельствующие об отсутствии антител в крови (34). В то же время данных о неспособности вируса размножаться в клетках человека нет, поэтому одной из вероятных причин отсутствия антител у человека может быть высокая степень зоо- фильности компетентных векторов.
Эпизоотологическая ситуация по болезни Шмалленберга на территории ЕС (на сентябрь 2012 года). В настоящее время болезнь зарегистрирована в Германии, Голландии, Бельгии, Англии, Франции, Люксембурге, Италии, Дании, Швейцарии (рис. 4, табл.). По данным на осень 2012 года, антитела к вирусу болезни Шмалленберга обнаружены уже в Австрии и Польше (соответственно у коров и коз). В Польше также зарегистрированы положительные случаи ПЦР (см. дополнительно .
Рис. 4. Распространение вируса Шмалленберга в странах ЕС (отмечено стрелкой) .
Необходимо отметить высокий уровень превалентности заболевания в стадах и низкий — у животных. Так, первые подобные исследования провели в Голландии. Всего с ноября 2011 по январь 2012 года исследовали 1123 пробы сыворотки крови КРС в реакции нейтрализации. Общая серопревалентность по Нидерландам составила 72,5 %. По результатам голландских исследователей, в центрально -восточной части страны серопревалентность оказалась выше, чем в северной и южной частях (р < 0,001). Более того, высокую внутристадовую превалентность (70-100 %) отмечали на двух неблагополучных по болезни Шмалленберга молочных фермах и на двух овцеводческих фермах. Также было показано, что нет зависимости наличия или отсут ствии антител от возраста животного. Это косвенно свидетельствует, что вирус Шмалленберга — новый для Европы.
Число случаев ПЦР-регистрации вируса болезни Шмалленберга в странах ЕС (на сентябрь 2012 года, по данным Института зоопрофилактики Терамо, Италия)
|
Страна |
| Крупный рогатый скот | |
Овцы |
| Козы | |
Всего |
|
Нидерланды |
237 |
107 |
6 |
350 |
|
Германия |
899 |
867 |
48 |
1814 |
|
Бельгия |
408 |
167 |
2 |
577 |
|
Англия |
53 |
220 |
0 |
273 |
|
Франция |
1505 |
1128 |
17 |
2650 |
|
Люксембург |
11 |
6 |
0 |
17 |
|
Италия |
3 |
0 |
5 |
8 |
|
Испания |
0 |
5 |
0 |
5 |
|
Швейцария |
90 |
0 |
0 |
90 |
|
Дания |
3 |
0 |
0 |
3 |
Во Франции исследования проводили в северной, центральной и южной частях страны. На севере из 30 случайно выбранных коров из неблагополучного хозяйства серопозитивными оказались все животные, а из 56 овец — 86 %. На юге серопревалентность внутри стада у овец составила 21 %, в центральной части — только 7 %.
В Бельгии весной 2012 года протестировали пробы сыворотки крови от 519 коров (телят). В радиусе 250 км от того места, где вирус был обнаружен ранее, среди коров доля серопозитивных составила около 91 % (риск заражения для телят — 28 %) (30). Дополнительно провели ПЦР- мониторинг проб от коров. Всего за срок наблюдения у 114 из 343 стельных коров (размер выборки) зарегистрировали аборты. В патологическом материале от абортированных телят вирус Шмалленберга выявили только в 30,5 % случаев.
За период исследования потери среди овец в странах ЕС составили 30 %, по КРС данные пока не опубликованы.
К настоящему времени о влиянии вируса Шмалленберга на опло-дотворяемость ничего не известно. Нет также сведений о том, передается ли вирус с мясом и молоком. Принимается презумпция неинфекционно-сти по аналогии с вирусом Акабане. Однако для подтверждения этого факта требуются дальнейшие исследования.
Профилактика болезни Шмалленберга и контроль за распространением инфекции. Как и в случае с вирусом Акабане, страны ЕС не вводят и, возможно, не будут вводить обязательную вакцинацию против вируса Шмалленберга. Однако при заражении вирусом Акабане стельные коровы, родившие нежизнеспособных телят, считаются иммунными к повторному заражению. Иммунитет сохраняется в течение нескольких лет (2). Поскольку полагают, что потери и риски от вируса Шмалленберга незначительны по сравнению с таковыми от вируса блютанга, вакцинация будет добровольной и проводиться по усмотрению и за счет фермеров.
В странах ЕС нет ограничений на продажу молока и мяса жвачных животных с подозрением на инфицированность вирусом Шмалленберга. Ветеринарные специалисты доказали, что вирус в крови присутствует в течение 5-6 сут, данных о выделении вируса с молоком нет. В случае заражения молока пастеризация должна привести к инактивации возбудителя. В связи с коротким периодом виремии считается маловероятным, что вирус может быть обнаружен в мясе клинически здоровых животных.
При болезни Шмалленберга трупы мертворожденных, вынужденно убитых новорожденных жвачных животных и последы утилизируют согласно существующим правилам.
Наиболее действенными мерами по снижению экономических потерь от рождения нежизнеспособного потомства может быть планирование осеменения и стельности в период, свободный от активного л ё та насекомых, а также ночное содержание животных в защищенных от насекомых помещениях.
Артрогрипоз и гидроцефалия — характерные особенности заболеваний, вызываемых тератогенными вирусами из группы Симбу. Европейские ученые, однако, установили, что между разными вспышками заболеваний, вызванными вирусами группы Симбу в Азии, Австралии и Европе, существуют различия (35, 36). В 1969-1970 годах в Израиле при инфицировании вирусом Акабане у крупного и мелкого рогатого скота регистрировали артрогрипоз и гидроцефалию, однако в 2002-2003 годах деформации отмечали исключительно у животных с гидроцефалией, при этом патологию диагностировали не как артрогрипоз и гидроцефалию, а как слепоту телят. У взрослых особей клинические признаки не регистрировали. Недавно в Израиле зафиксированы ранее не описанные проявления заражения вирусом из серогруппы Симбу. При этом у взрослых особей КРС ставили диагноз энцефалит (J. Brenner, Y. Stram, D. Rotenberg et al., неопубликованные данные), что сопровождалось повышенной смертностью стельных коров незадолго до отела и ростом числа абортированных плодов, а также телят, рожденных с уродствами. Другим возможным проявлением (наряду с уменьшением продуктивности, абортами и рассасыванием плода) было снижение эффективности осеменения. Более того, идентифицированы внешне клинические здоровые коровы, которые оказались ПЦР-позитивными по вирусу Акабане в пробах крови и тканей головного мозга, что указывает на наличие природного резервуара патогена (J. Brenner, Y. Stram, D. Rotenberg et al., неопубликованные данные).
Опыт, накопленный при изучении арбовирусов в Израиле (9 серотипов вируса блютанга, 7 серотипов вируса эпизоотической геморрагической болезни, вирус Акабане и Айно, вирус энцефалита лошадей и вирус эфемерной лихорадки КРС) (37-39), может быть полезен для понимания того, что способствовало появлению вируса Шмалленберга в Европе, и изучения нового для всего мира заболевания, вызываемого вирусом Шмалленберга.
Таким образом, несмотря на имеющуюся информацию, эпизоотологическая ситуация по возбудителю болезни Шмалленберга остается в большой степени неизученной. Вирус хотя и похож на буньявирусы (такие как Акабане, Шамонда и т.п.), но официального таксономического положения в семействе пока не имеет. До сих пор неясно, каково происхождение вируса Шмалленберга и как он проник в Северную Европу. Полностью неизученным остается вопрос о том, что служит резервуаром вируса в период отсутствия активных векторов. Не менее важен и экономический аспект: как защитить фермеров от убытков, понесенных в результате ввоза коров, которые были инфицированы в период стельности? В целом представленные данные свидетельствуют о необходимости скрининговых исследований проб сывороток крови и патологического материала для дифференциальной диагностики болезни Шмалленберга в животноводческих хозяйствах.


