Брахитерапия интраэпителиального рака влагалища (клинический случай)
Автор: Кулиева Г.З., Сидорин А.В., Вербинская Н.И., Рыкова Е.В., Мозеров С.А., Крикунова Л.И.
Рубрика: Научные статьи
Статья в выпуске: 4 т.28, 2019 года.
Бесплатный доступ
Приведён клинический случай брахитерапии интраэпителиального рака влагалища на аппарате «Гаммамед» источником 192Ir. Для лечения преинвазивного рака влагалища существует достаточно широкий спектр терапевтических воздействий, в настоящее время используют такие методы лечения как брахитерапия, химиотерапия, криодеструкция или фотодинамическая терапия. С учётом первичной множественности злокачественных новообразований, возраста пациентки, анамнеза, наличия вируса папилломы человека высокого канцерогенного риска на междисциплинарном консилиуме решено провести эндовагинальную брахитерапию. Проведено планирование параметров облучения на гамма-терапевтическом аппарате «ГаммаМед Plus» высокой мощности дозы (HDR), с использованием источника 192Ir. План лечения анализировался по интегральной гистограмме доза-объём согласно рекомендациям European Gynecological GEC-ESTRO Working Group. В результате анализа отмечен адекватный охват мишени, рекомендованные дозы не превышены. Возможность объёмного планирования брахитерапии позволяет персонифицировать программы лечения онкогинекологических больных, повысить эффективность лечения с сохранением качества жизни. Пациентка находится под динамическим наблюдением, признаки прогрессирования и рецидива заболевания в настоящее время отсутствуют.
Рак влагалища, рак шейки матки, лучевая терапия, брахитерапия, изодозный контур, планирование, оптимизация, вирус папилломы человека, дисплазия шейки матки, органы риска, оконтуривание
Короткий адрес: https://sciup.org/170171508
IDR: 170171508 | УДК: 618.15-006.6-085.849.1 | DOI: 10.21870/0131-3878-2019-28-4-65-72
Текст научной статьи Брахитерапия интраэпителиального рака влагалища (клинический случай)
Описание клинического случая
Пациентка Н., 64 года, поступила в отделение лучевых и комбинированных методов лечения гинекологических заболеваний МРНЦ им. А.Ф. Цыба с диагнозом: «Первично-множественный метахронный рак: 1. Рак шейки матки in situ pTisN0M0. Хирургическое лечение 10.11.2011 г. (экстирпация матки с придатками). 2. Рак влагалища in situ сTisN0M0».
Из анамнеза известно, что в ноябре 2011 г. по месту жительства проведено хирургическое лечение рака шейки матки in situ в объёме: экстирпация матки с придатками. После проведённого лечения наблюдалась нерегулярно. В июне 2017 г. самостоятельно обратилась в МРНЦ с жалобами на дискомфорт во влагалище. Наследственную предрасположенность к злокачественным новообразованиям отрицает. Постменопауза 11 лет, беременностей – 3, роды – 2, аборт – 1.
При гинекологическом осмотре в куполе влагалища выявлен участок гиперемии диаметром 0,5 см с неровной поверхностью без признаков инфильтрации подлежащих тканей. Культя влагалища небольшая, инфильтратов в малом тазу нет. Была выполнена биопсия стенки влагалища. Из гистологического заключения № 6230 от 09.07.2017 г.: фрагмент многослойного плоского неороговевающего эпителия без подлежащей стромы с признаками тяжёлой дисплазии (VaIN III, HSIL) (рис. 1).
Кулиева Г.З.* – м.н.с.; Сидорин А.В. – врач; Вербинская Н.И. – врач-радиотерапевт; Рыкова Е.В. – врач-радиотерапевт; Мозеров С.А. – с.н.с.; Крикунова Л.И. – зав. отдел., д.м.н., проф. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
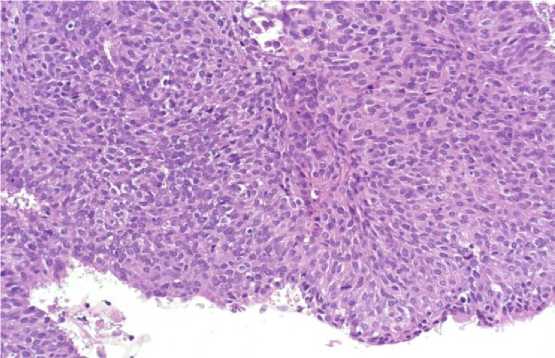
Рис. 1. Микроскопическая картина вагинальной интраэпителиальной неоплазии тяжёлой степени (VaIN III, HSIL). Окраска: гематоксилин-эозином, х 200.
Данные магнитно-резонансной томографии органов малого таза: состояние после хирургического лечения по поводу рака шейки матки in situ ; культя влагалища с низким МР-сигналом, толщина 5 мм. Данных, подтверждающих прогрессирование заболевания, не получено. Лимфоузлы в области исследования не увеличены.
При молекулярно-генетическом исследовании с помощью метода полимеразной цепной реакции выявлен вирус папилломы человека (ВПЧ) высокого канцерогенного риска – 16-й тип.
С учётом первичной множественности злокачественных новообразований, возраста пациентки, анамнеза, наличия вируса папилломы человека высокого канцерогенного риска на междисциплинарном консилиуме решено провести эндовагинальную брахитерапию.
Предопределяющим фактором для планирования параметров лечения при раке влагалища является анатомическое расположение влагалищной трубки, лежащей между мочевым пузырём и уретрой спереди и прямой кишкой сзади. В данном случае толщина культи влагалища в куполе 5 мм, везиковагинальной перегородки 2 мм, а ректовагинальной перегородки 4 мм.
В связи с локализацией патологического процесса в куполе влагалища перед нами была поставлена задача обеспечить равномерный охват культи влагалища с подведением радикальной дозы к мишени без переоблучения начальных отделов влагалищной трубки со снижением дозы на критические органы (мочевой пузырь, уретра, прямая кишка).
В рамках решения поставленной задачи выполнено ультразвуковое исследование (УЗИ) органов малого таза с измерением линейных размеров культи влагалища, визуализацией границ с мочевым пузырём, прямой кишки для выбора объёма последующего планирования. Сделана спиральная компьютерная томография (СКТ) органов малого таза с введённым эндовагинальным эндостатом.
Проведено планирование параметров облучения на гамма-терапевтическом аппарате «ГаммаМед Plus» высокой мощности дозы (HDR), с использованием источника 192Ir. Аппарат оснащён планирующей системой «Brachivision», которая позволяет создать объёмное изображение органов малого таза, оценить анатомо-топографические особенности расположения эндостата относительно мишени и органов риска, чётко определить планируемый объём лечения и с учётом анализа гистограммы «доза-объём» провести оптимизацию условий облучения (рис. 2). При создании плана лечения был оконтурен визуализируемый анатомический объём мочевого пузыря и прямой кишки по СКТ-сканам.
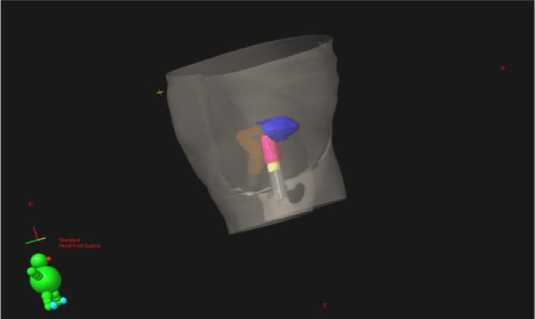
Рис. 2. Оптимизированный план облучения в трёхмерном изображении.
Для проведения сеанса лечения используется одноканальный аппликатор, его особенностью является наличие одной излучающей цепочки центрального расположения, что позволяет равномерно облучать всю влагалищную трубку. Расположение патологического очага требует изменения параметров облучения с подведением радикальной дозы к мишени без увеличения нагрузки на начальный отдел влагалищной трубки и органы риска. Для решения данной задачи была проведена графическая оптимизация стандартного плана облучения и сформирован терапевтический изодозный контур в форме «булавы», за счёт увеличения времени стояния источника 192Ir в верхних позициях эндостата (рис. 3). Брахитерапия выполнялась в разовой оча- говой дозе (РОД) 5 Гр, суммарная очаговая доза (СОД) 30 Гр.
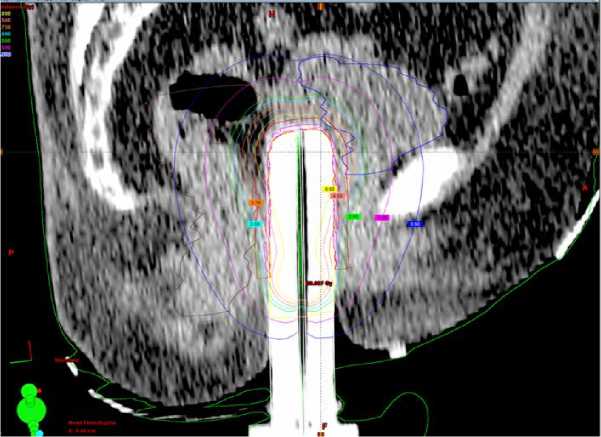
Рис. 3. Изодозное распределение в трёхмерном изображении в форме булавы.
План лечения анализировали по интегральной гистограмме «доза-объём», согласно рекомендациям European Gynecological GEC-ESTRO Working Group по следующим величинам: D1cc (1 см3), D2cc (2 см3), СОД на слизистую оболочку влагалищной трубки (рис. 4).
-
• D1cc (1 см3) – величина, показывающая дозу в 1 см3 критического органа, получающего максимальную дозную нагрузку.
-
• D2cc (2 см3) – величина, показывающая дозу в 2 см3 критического органа, получающего максимальную дозную нагрузку.
В результате анализа отмечен адекватный охват мишени. СОД на слизистую в куполе влагалища составила 58,8 Гр, на слизистую верхней трети влагалищной трубки 39,6 Гр, на слизистую нижней трети 33,0 Гр. Нагрузки на мочевой пузырь в точках D1cc (1 см3), D2cc (2 см3) составляет 44% и 54%, а для прямой кишки соответственно 37% и 47%.
Следует отметить, что полученные данные не превышают предписанных доз согласно рекомендациям. В настоящее время пациентка без признаков прогрессирования и рецидива заболевания находится под динамическим наблюдением, она социально адаптирована. Непосредственно в процессе лечения и через 24 месяца после окончания лечения лучевых реакций не отмечено.
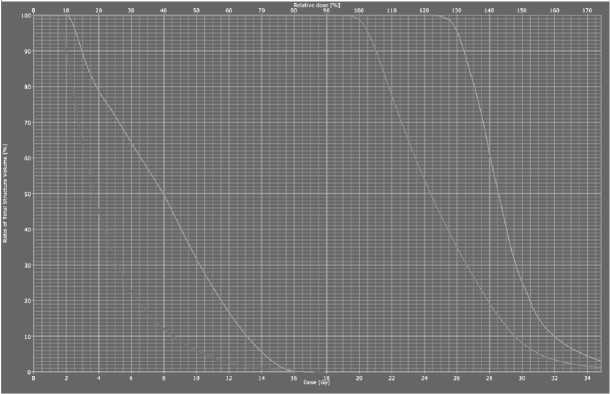
Рис. 4. Интегральная гистограмма доза-объём.
Обсуждение
Первичный рак влагалища является редким заболеванием. Его частота составляет 1-2% по отношению ко всем злокачественным опухолям женских половых органов. В Европе диагностируется 1 случай на 28000 человек, в США – 0,7 случаев на 100000, в России – 0,3 случая на 100000 населения. Статистических данных по поводу встречаемости рака влагалища in situ в России нет, в США – 0,18 на 100000, что составляет менее 1% [1-3]. Первичный рак влагалища диагностируется редко, чаще выявляют метастатическое поражение влагалища. Метастазы во влагалище возникают при первичной локализации рака в области шейки матки, тела матки. Реже источниками метастазирования являются злокачественные новообразования прямой кишки, яичников, хориокарцинома и гипернефрома [4].
Рак влагалища, возникающий через 5 и более лет после лечения рака шейки матки, считается первичным раком влагалища [4].
Международным обществом по изучению патологии вульвы и влагалища (ISSVD) и Международным обществом по гинекологической патологии (ISGP) дисплазия влагалища обозначается как вагинальная интраэпителиальная неоплазия (VaIN). VaIN подразделяется на три гистологических типа по аналогии с цервикальной интраэпителиальной неоплазией (CIN) [5]. Согласно пересмотру классификации, принятой ВОЗ в 2014 г., VaIN III соответствует тяжёлой степени дисплазии и раку влагалища in situ.
В 2005 г. Feng Q. et al. отметили, что у женщин, прооперированных по поводу тяжёлой дисплазии, преинвазивного и инвазивного рака шейки матки в сочетании с папилломавирусной инфекцией, возрастает риск возникновения опухолей влагалища [6, 7].
Schockaert S. в 2008 г. представил результаты сравнения пяти ретроспективных исследований, проведённых в различные периоды [8]. Согласно результатам анализа частота возникновения вагинальной внутриэпителиальной неоплазии (VaIN) после хирургического лечения рака шейки матки in situ варьирует от 0,9 до 7,4% [9-12].
Лечение рака влагалища, прежде всего, зависит от степени распространённости опухолевого процесса. Для лечения преинвазивного рака влагалища существует достаточно широкий спектр терапевтических воздействий. В настоящее время используют такие методы лечения как: брахитерапия, химиотерапия, криодеструкция или фотодинамическая терапия. Выбор метода лечения во многом зависит от стадии заболевания с учётом гистологической формы опухоли, возраста пациентки и соматического статуса. Согласно современным стандартам при лечении рака влагалища предпочтение отдаётся лучевой терапии: дистанционной и брахитерапии [4]. До середины ХХ века основным методом лечения рака влагалища in situ являлось также внутри-полостное облучение. На слизистую оболочку влагалища подводилась доза 60-70 Гр. Такое лечение является весьма эффективным, однако связано с достаточно высоким риском осложнений со стороны критических органов [13].
Мощность дозы брахитерапии в пределах 0,4-2 Гр/ч определяется (low dose rate – LDR) как низкая, в пределах 2-12 Гр/ч называется (middle dose rate – MDR) средней, выше 12 Гр/ч – (high dose rate – HDR) высокой. Методики брахитерапии опухолей влагалища отличаются большой вариабельностью. Выделяют такие методики, как внутриполостная, внутритканевая и аппликационная. В основном, применяется внутриполостная лучевая терапия с использованием эндостата цилиндрической формы [4, 7, 10].
В работе Zolciak-Siwinska A. et al. [14], опубликованной в 2015 г., показаны результаты брахитерапии рака влагалища in situ . В исследование было включено 20 пациенток. Возраст больных варьировал в диапазоне от 28 до 80 лет, медиана возраста составляла 57 лет. Медиана наблюдения – 39 месяцев (14-115 месяцев). 3-летняя выживаемость составила 90%. Частота токсических реакций составляла 16,7% в группе пациентов, получивших СОД 47,3-63 Гр и 71,4% при СОД ≥70 Гр. На основании полученных результатов, авторами сделан вывод о целесообразности и эффективности использования брахитерапии при раке влагалища in situ , однако эскалация дозы не должна быть более 70 Гр [14].
Заключение
Важным компонентом терапии рака влагалища в настоящее время остаётся лучевая терапия. Полученные результаты позволяют заключить, что оптимизация методических подходов при лечении онкогинекологических заболеваний с комплексным учётом клинико-морфологических и этиологических факторов прогноза и разработка стратегии лечения на основе новых медицинских технологий приводит к повышению эффективности терапии при снижении лучевых осложнений с сохранением качества жизни.
Все авторы сообщают об отсутствии конфликта интересов.
Список литературы Брахитерапия интраэпителиального рака влагалища (клинический случай)
- Злокачественные новообразования в России в 2016 году (заболеваемость и смертность) /Под ред. А.Д. Каприна, В.В. Cтаринского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
- Siegel R., Ma J., Zou Z., Jemal A. Cancer statistics, 2014 //CA Cancer J. Clin. 2014. V. 64, N 5. P. 364.
- Гранов А.М., Винокуров В.Л. Лучевая терапия в онкогинекологии и онкоурологии. СПб.: ООО «Издательство ФОЛИАНТ», 2002. 352 с.
- Каприн А.Д., Галкин В.Н., Иванов С.А., Солодкий В.А., Титова В.А. Брахитерапия в лечении рака влагалища //Biomedical Photonics. 2016. Т. 5, № 1. С. 22-26.
- WHO Classification of Tumors of the Female Reproductive Organs. Vol. 6. WHO Classification of Tumors, 4th edition. Eds.: R.J. Kurman, M.L. Carcangiu, C.S. Harrington, R.H. Young. Geneva, Switzerland: WHO Press, 2014. 307 p.
- Feng Q., Kiviat N.B. New and surprising insights into pathogenesis of multicentric squamous cancers in the female lower genital tract //J. Nat. Cancer. Inst. 2005. V. 97, N 24. P. 1798-1799.
- Филатова Е.И. Первичный рак влагалища. Диагностика и лечебная тактика //Практическая онколо-гия. 2006. Т. 7, № 4. С. 228-235.
- Schockaert S., Poppe W., Arbyn M., Verguts T., Verguts J. Incidence of vaginal intraepithelial neoplasia after hysterectomy for cervical intraepithelial neoplasia: a retrospective study //Am. J. Obstet. Gynecol. 2008. V. 199, N 113. P. 111-115.
- Gemmel J., Holmes D.M., Duncan I.D. How frequently need vaginal smears be taken after hysterectomy for cervical intraepithelial neoplasia? //Br. J. Obstet. Gynaecol. 1990. V. 97, N 1. P. 58-61.
- Wiener J.J., Sweetnam P.M., Jones J.M. Long term follow-up of women after hysterectomy with a history of preinvasive cancer of the cervix //Br. J. Obstet. Gynaecol. 1992. V. 99, N 11. P. 907-910.
- Kalogirou D., Antoniou G., Karakitsos P., Botsis D., Papadimitriou A., Giannikos L. Vaginal intraepithelial neoplasia in patients treated for carcinoma in situ of the cervix //Eur. J. Gynaecol. Oncol. 1997. V. 18, N 3. P. 188-191.
- Babarinsa I., Mathew J., Wilson C., Oladipo A. Outcome of vaginal intraepithelial neoplasia following hys-terectomy for cervical intraepithelial neoplasia //J. Obstet. Gynaecol. 2006. V. 26, N 2. P. 157-158.
- Туркевич В.Г. Лучевое лечение первичного и метастатического рака влагалища //Практическая онкология. 2006. Т. 7, № 4. С. 236-245.
- Zolciak-Siwinska A., Gruszczynska E., Jonska-Gmyrek J., Kulik A., Michalski W. Brachytherapy for vaginal intraepithelial neoplasia //Eur. J. Obstet. Gynecol. Reprod. Biol. 2015. V. 194, N 22. P. 73-77.


