Брахитерапия ретинобластомы: результаты 13 лет применения
Автор: Яровой Андрей А., Яровая Вера А., Котова Елена С., Ушакова Татьяна Л., Голанов Андрей В., Чочаева Амина М., Володин Денис П., Поляков Владимир Г.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.11, 2021 года.
Бесплатный доступ
Цель работы. Представить собственный опыт БТ ретинобластомы с рутениевыми и стронциевыми офтальмоаппликаторами. Материалы и методы. В период с 2007 по 2020 годы БТ в качестве локального метода лечения РБ проведена 120 пациентам (137 глаз - 194 очага РБ). Возраст пациентов на момент лечения варьировал от 4 до 109 месяцев (в среднем - 26 мес.). Монофокальное поражение наблюдалось в 32% случаев (44 глаза), мультифокальное - в 68% случаев (93 глаза). БТ проводилась на единственном глазу в 36 случаях (30%). С использованием рутениевых офтальмоаппликаторов (ОА) пролечено 79 пациентов (87 глаз), стронциевых ОА - 25 пациентов (26 глаз), 16 пациентов (24 глаза) пролечено с использованием как рутениевых, так и стронциевых ОА. Результаты. Клинически полная регрессия опухоли была достигнута в 62% случаев (120 очагов), частичная регрессия опухоли наблюдалась в 31% случаев (60 очагов). В 6 % случаев (12 очагов) наблюдался продолженный рост опухоли, в 1% случаев (2 очага) наблюдался рецидив опухоли в сроки от 4-6 месяцев после БТ. Локальный контроль над опухолью был достигнут в 93% случаев. Единственные глаза были сохранены в 92% случаев. Осложнения различной степени выраженности после БТ наблюдались в 38% случаев (46 пациентов - 49 глаз) при среднем сроке наблюдения 55 месяцев (от 3 до 157 мес.). В 92% случаев (42 пациента - 45 глаз) осложнения были ассоциированы с использованием рутениевых ОА и лишь в 8% случаев (4 пациента - 4 глаза) со стронциевыми. Были определены факторы риска развития радиоиндуцированных осложнений: размеры очага (высота более 2,5 мм (Р = 0,0005), протяженность более 7,3 мм (Р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Ретинобластома, брахитерапия, рутений-106, стронций-90
Короткий адрес: https://sciup.org/140290744
IDR: 140290744 | DOI: 10.18027/2224-5057-2021-11-2-5-12
Текст научной статьи Брахитерапия ретинобластомы: результаты 13 лет применения
Ретинобластома (РБ) — злокачественная опухоль сетчатки, является наиболее распространённой внутриглазной злокачественной опухолью у детей и составляет около 3% всех педиатрических злокачественных новообразований [1]. Несмотря на высокие показатели выживаемости пациентов с РБ в развитых странах, достигнувшие за последние
50 лет почти 100%, сохранение глаза по-прежнему остается трудной задачей и требует применения комбинации химиотерапевтических и локальных методов лечения, втом числе дистанционной лучевой терапии (ДЛТ) [2].
В настоящее время одну из ключевых ролей в схеме комбинированного органосохраняющего лечения РБ играет брахитерапия (БТ) — метод контактного облучения опухоли [3].
Идея контактного облучения была впервые предложена Moore P. и Stallard H. в 1929 году [4]. БТ стала применяться как альтернатива ДЛТ, которая на протяжении практически полувека являлась основным методом органосохраняющего лечения РБ. Причиной отказа от широкого применения ДЛТ стало увеличение риска развития вторичных радиоиндуцированных опухолей в зоне облучения, а также постлучевой деформации орбиты [5,6].
За всю историю применения БТ в лечении РБ использовались офтальмоаппликаторы (ОА) с изотопами Co60, Ir192, Pd103, I125, Ru106 и Sr90. По данным литературы, в настоящее время изотопы I125 и Pd103 используются в офтальмоонко-логических центрах США и Канады, I125 и Ru106 — в странах Европы, исключительно Ru106 — в Японии, Ru106 и Sr90 — на территории России [7].
Несмотря на более, чем полувековую историю применения БТ в офтальмоонкологии, представленные вли-тературе исследования, посвященные БТ с Ru106 при РБ немногочисленны, а БТ со Sr90 не найдены вовсе. При этом в публикуемых исследованиях существует значительный разброс данных, касающихся эффективности метода, оптимальных параметров доз облучения, факторов риска, влияющих на развитие поздних лучевых осложнений.
Цель работы: представить собственный опыт брахитерапии ретинобластомы с рутениевыми и стронциевыми офтальмоаппликаторами.
Материал и методы: в период с 2007 по 2020 гг. в ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» 120 пациентам (137 глаз — 194 очага РБ) проведена БТ в качестве локального метода лечения РБ. Из них— 56 больных — девочки (47%), 64 — мальчики (53%). Возраст пациентов на момент лечения составил от 4до 109 месяцев (в среднем 26 мес.). Монокулярная РБ наблюдалась у 30 пациентов, бинокулярная у90 пациентов, из них метахронное поражение парного глаза было отмечено у 5 больных. Монофокальное поражение наблюдалось в 32% случаев (44 глаза), мультифокальное — в 68% случаев (93 глаза). БТ проводилась на единственном глазу в 36 случаях (30%).
Распределение по стадиям и группам согласно классификации TNM [8] и АВС-классификации РБ [9] было следующим: T1a стадия (группа А) — 24 глаза (18%); T1b (группа В)— 47 (34%); T2a (группа С)— 26 (19%); T2b (группа D)— 40 (29%).
В 83% случаев (у 100 пациентов) БТ предшествовало комбинированное системное и локальное лечение— селективная интраартериальная и интравитреальная химиотерапия. Исключительно локальная ХТ предшествовала проведению БТ в 9,5% случаев (11 пациентов) и лишь в 7,5% случаях (9 пациентов) БТ использовалась в качестве самостоятельного метода лечения. Дистанционная лучевая терапия (ДЛТ) была проведена до БТ в 6% случаев (7 пациентов — 7 глаз).
Необходимость в проведении БТ была вызвана наличием остаточных опухолевых очагов после завершения химиотерапевтического лечения в 42% случаев (80 очагов), продолженным ростом опухоли после неэффективности других локальных методов лечения — транспупиллярной термотерапии (ТТТ) и криодеструкции (КД) в 30% случаев (59 очагов), рецидивом опухоли в ранее интактной зоне сетчатки в 23% случаев (45 очага), рецидивом опухоли на рубцах в 5% случаях (10 очагов).
Операция подшивания ОА пациентам проводилась под общей анестезией. Для точного определения положения ОА относительно опухоли был разработан способ, заключающийся в определении центра проекции очага под контролем обратной офтальмоскопии изогнутым по форме глазного яблока световодом путем транссклеральной диа-фаноскопии. Торцом световода проводилась склероком-прессия в области найденного ранее центра проекции очага в течение 15 секунд до появления точки склерального вдавления. Не позднее 60 секунд проводилась маркировка красителем точки склерального вдавления. После чего ОА фиксировался к склере в зоне маркировки (патент РФ№ 2 734 137 от 13.10.2020). Удаление ОА осуществлялось по истечении рассчитанного заранее времени экспозиции.
С использованием рутениевых ОА пролечено 79 пациентов (87 глаз), стронциевых ОА — 25 пациентов (26 глаз), 16 пациентов (24 глаза) пролечено с использованием как рутениевых, так и стронциевых ОА. У 42 пациентов (48 глаз) с мультифокальной формой РБ использовались различные варианты проведения БТ (рис. 1). Облучение с нескольких полей проводилось 36 пациентам (40 глаз): с двух полей — 31 глаз, с трех полей — 7 глаз, с четырех полей — 1 глаз, с пяти полей — 1 глаз. БТ с одновременной фиксацией двух ОА в разных отделах была проведена 6 пациентам (6 глаз), БТ с последовательным перемещением ОА в смежную или контралатеральную зону — 12 больным (12
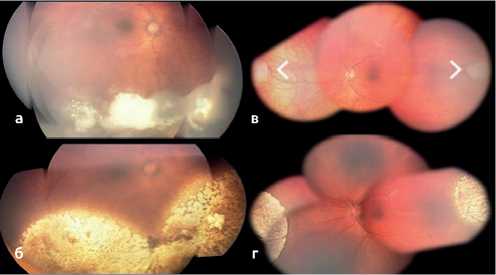
Рисунок 1. а — панорама глазного дна до проведения
БТ; б — полная регрессия опухолевых очагов после БТ с перемещением рутениевого ОА; в — расположение опухолевых очагов до БТ; г — полная регрессия опухоли после БТ с одновременным подшиванием стронциевых ОА.
глаз); БТ с одномоментным облучением нескольких крупных очагов проведена 14 пациентам (15 глаз), БТ с одномоментным облучением множественных очагов малого размера в количестве от 5 до 10–3 пациентам (3 глаза). Параметры очагов, средние апикальные и склеральные дозы представлены в табл. 1. Локализация и распределение очагов по квадрантам глазного дна представлены в табл. 2.
РЕЗУЛЬТАТЫ
Эффект после БТ оценивался согласно общепринятой классификации типов регрессии РБ [10]. Клинически полная регрессия опухоли была достигнута в 62% случаев (120 очагов), что соответствует I типу (17 очагов) и IV типу (103 очага) регрессии. Средний срок наступления регрессии составил 5 месяцев (от 1 до 19 мес.).
Частичная регрессия опухоли наблюдалась в 31% случаев (60 очагов), из них в 18% (35 очагов) потребовалось повторное проведение БТ (7 очагов), проведение ТТТ (25 очагов) и КД (3 очага). В результате удалось достичь клинически полной регрессии в 11% случаев (I тип — 4 очага, IV тип— 18 очагов) и стабилизации опухоли в 7% случаев (II тип — 3 очага, III тип — 10 очагов).
Продолженный рост опухоли был зарегистрирован в 6% случаев (12 очагов), что потребовало повторного проведения БТ (5 очагов), проведения БТ совместно сТТТ и КД (2 очага), удаления глазного яблока в связи с прогрессией опухоли (4 глаза — 5 очагов).
В 1% случаев (2 очага) наблюдался рецидив опухоли в сроки от 4 до 6 месяцев после БТ, что потребовало проведения дополнительного сеанса ТТТ в одном случае и стереотаксической радиохирургии на установке «Гамма-нож» во втором случае.
Таким образом, локальный контроль над опухолью после проведения БТ был достигнут в 93% случаев. Единственные глаза были сохранены в 92% случаев (33 из 36 пациентов). Сохранить глаза в случае многопольного облучения удалось в 81%, 9 из 40 глаз были удалены по причине прогрессии опухоли (5 глаз) и развития осложнений с невозможностью визуального контроля глазного дна (4 глаза). Средний срок наблюдения составил 55 месяцев (от 3 до 157 мес).
Радиоиндуцированные осложнения различной степени выраженности наблюдались в 38% случаев (46 пациентов— 49 глаз), среди них: непролиферативная ретинопатия— в14% (19 глаз); пролиферативная ретинопатия — в 3% (4 глаза); оптическая нейропатия (папиллопатия) — в25% (34 глаза); экссудативная отслойка сетчатки — в 7% (10 глаз); частичный гемофтальм — в 17% (23 глаза) и тотальный гемофтальм — в 2% (3 глаза), лучевая катаракта — в 8% (11 глаз), вторичная глаукома — в 1% (1 глаз). Средний срок возникновения радиоиндуцированных осложнений после окончания лечения составил 5 месяцев (от 3 до 15 мес). Осложнения, связанные с технологией подшивания ОА, не зарегистрированы.
Таблица 1
|
Вид ОА |
Высота очага, мм |
Протяжен-ность, мм |
Ср. апикальная доза, Гр |
Склеральная доза, Гр |
|
Ru106+Rh106 |
2,9 (0,8–7,5) |
6,5 (2,0–12,3) |
89 (44–137) |
330 (114–1000) |
|
Sr90+Y90 |
1,9 (0,7–3,0) |
4,8 (2,5–8,9) |
172 (126–236) |
680 (288–1123) |
Таблица 2
|
Локализация очагов |
Количество очагов |
Распределение по отделам |
Количество очагов |
|
Центральный отдел |
72 (37%) |
Верхний |
60 (31%) |
|
Средняя периферия |
53 (27%) |
Наружный |
45 (23%) |
|
Крайняя периферия |
69 (36%) |
Внутренний |
12 (6%) |
|
Всего |
194 (100%) |
Нижний |
77 (40 %) |
В большинстве случаев осложнения были купированы посредством консервативной терапии (24 глаза) и ретробульбарной инфузионной терапии (12 глаз), описанной ранее [11]. В 2 случаях ввиду развития тотального гем-офтальма, в 1 на единственном глазу, была проведена витрэктомия с одновременной ирригацией мелфалана по описанной методике [12,13]. У 2 пациентов в исходе развития осложнений сформировалась субатрофия глазного яблока, в связи с чем была проведена энуклеация.
Энуклеация глаза по поводу геморрагических осложнений и невозможности визуального контроля глазного дна была проведена у 3 пациентов. У 6 пациентов поводом для энуклеации стала прогрессия опухоли на фоне неполного ответа на проводимое лечение и развития осложнений после БТ. В общей сложности энуклеация была проведена в 11% случаев (15 глаз).
В 92% случаев (42 пациента — 45 глаз) осложнения были ассоциированы с использованием рутениевых ОА и лишь в 8% случаев (4 пациента — 4 глаза) со стронциевыми. Для выявления факторов риска, играющих ведущую роль в развитии осложнений при БТ с Ru106, была проведена статистическая обработка данных, включающая ROC-анализ, анализ методом Каплана–Мейера и метод пропорциональной регрессии рисков Кокса, с использованием программы MedCalc.
При проведении многофакторного анализа были проанализированы следующие признаки: пол и возраст пациентов, форма РБ (мультифокальная/монофокальная), параметры очага (высота, протяженность, наличие витреальных опухолевых отсевов, центральная локализация — вблизи макулярной зоны и диска зрительного нерва), параметры облучения (апикальная, склеральная доза), а также предшествующая ДЛТ.
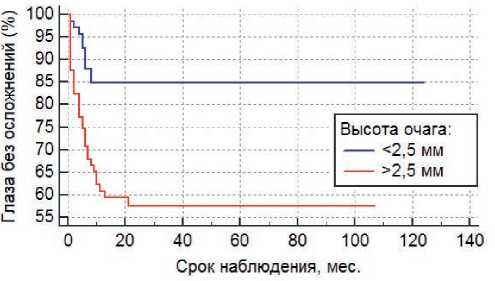
Рисунок 2. Связь высоты очага с риском развития постлучевых осложнений (Р =0,0005).
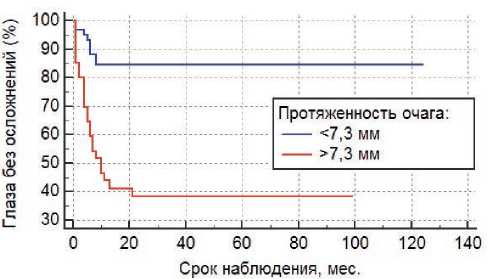
Рисунок 3. Связь протяженности очага с риском развития постлучевых осложнений (Р <0,0001).
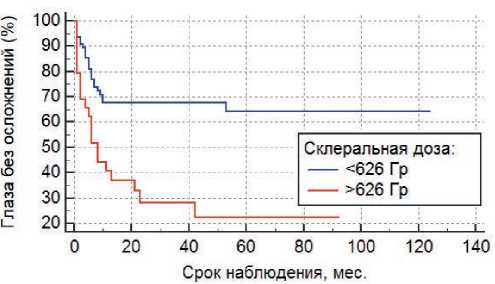
Рисунок 4. Связь склеральной дозы с риском развития постлучевых осложнений (Р =0,0002).
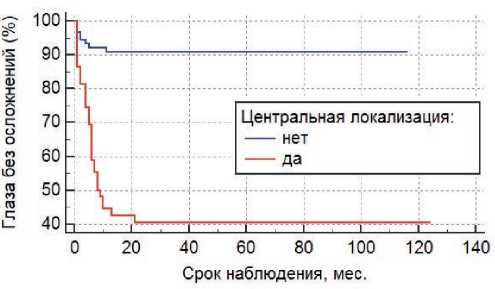
Рисунок 5. Связь центральной локализации очага с риском развития постлучевых осложнений (Р <0,0001).
С использованием ROC-анализа были найдены ключевые параметры для следующих признаков: высота >2,5 мм (AUC =0,648; Р =0,004), протяженность очага >7,3 мм (AUC =0,697; Р < 0,001) и склеральная доза >626 Гр (AUC =0,683; Р =0,001).
При анализе факторов риска методом Каплана–Мейера было показано, что высота очага более 2,5 мм (Р =0,0005), протяженность более 7,3 мм (Р <0,0001), склеральная доза более 626 Гр (Р =0,0002), а также центральная локализация опухоли (Р <0,0001) с высокой степенью достоверности влияют на развитие радиоиндуцированных осложнений (рис. 2, 3, 4, 5), вто время как пол (Р =0,3), возраст (Р =0,5), форма РБ (Р =0,5), витреальные опухолевые отсевы (Р =0,5), апикальная доза облучения (Р =0,3) и предшествующая ДЛТ (Р =0,9) не играют существенной роли в их возникновении. Методом пропорциональной регрессии рисков Кокса среди всех вышеперечисленных факторов риска развития радиоиндуцированных осложнений были выделены наиболее значимые: склеральная доза более 626 Гр (Р =0,0081) и центральная локализация опухолевого очага (Р =0,0028) (табл. 3).
ОБСУЖДЕНИЕ
В настоящее время БТ используется в качестве дополнительного метода лечения РБ— после предшествующей ХТ с целью консолидации опухоли [14,15], либо при рецидиве или неполной регрессии опухоли при неэффективности локальных методов лечения данной патологии (например, КД или ТТТ) [16]. Однако в случае монофокального поражения БТ может успешно применяться в качестве первичного метода лечения РБ. В исследовании C. Shields с соавторами БТ в качестве первичного метода лечения РБ применялась у 31 пациента (30%), а при неэффективности предыдущих методов лечения —у72 пациентов (70%), при этом полной клинической регрессии опухоли удалось достичь в 84% и 89% случаев, соответственно [17]. В нашем исследовании БТ в качестве первичного метода лечения использовалась лишь у 9 пациентов (7,5%), в качестве дополнительного метода лечения у111 пациентов (92,5%), при этом локальный контроль над опухолью был достигнут в 93% случаев.
Количество исследований в литературе, посвященных проблеме БТ РБ с изотопом рутения (Ru106) невелико, а с изотопом стронция (Sr90) отсутствуют, что, возможно обусловлено активным применением ОА с изотопом йода (I125) на территории других государств [7]. Тем не менее, рутений и стронций как источники бета-излучения обладают рядом преимуществ перед изотопом йода: более быстрое падение поглощенной дозы облучения в тканях приводит к меньшему повреждению окружающих структур глаза и в результате уменьшает частоту возникновения радиоиндуцированных осложнений, а более длительный период полураспада (для рутения — около 1 года, для стронция — около 28 лет) объясняет экономическую выгоду [18–20].
Таблица 3. Многофакторный регрессионный анализ рисков развития постлучевых осложнений
|
b |
Стд. ошибка |
Вальд |
P |
Exp (b) |
95% дов. интервал для Exp (b) |
|
|
Высота> 2,5 мм |
0,5461 |
0,4252 |
1,6494 |
0,1990 |
1,7266 |
0,7503 до 3,9733 |
|
Протяженность> 7,3 мм |
0,2908 |
0,4350 |
0,4469 |
0,5038 |
1,3375 |
0,5702 до 3,1373 |
|
Склеральная доза>626 Гр |
1,2831 |
0,4846 |
7,0099 |
0,0081 |
3,6076 |
1,3955 до 9,3267 |
|
Центральная локализация |
1,2390 |
0,4150 |
8,9126 |
0,0028 |
3,4521 |
1,5304 до 7,7866 |
Примечание: Рмодели< 0,0001
Список литературы Брахитерапия ретинобластомы: результаты 13 лет применения
- Rao R., Honavar S. G. Retinoblastoma// Indian J. Pediatr. 2017. Vol. 84, №12. P. 937-944.
- Fabian I. D, Abdallah E., Abdullahi S. U., Abdulqader R. A., Boubacar S. A., Ademola-Popoola D. S. et al. Global Retinoblastoma Presentation and Analysis by National Income Level// JAMA Oncol. 2020. Vol. 6, №5. P. 685.
- Яровой А. А., Кривовяз О. С., Горовцова О. В., Ушакова Т. Л., Поляков В. Г. Роль локальных методов в системе органосохраняющего лечения интраокулярной ретинобластомы// Вестник РОНЦ им. Н. Н. Блохина РАМН. 2015. Т. 26, №2. С. 15-22. [Yarovoy A. A., Krivovyaz O. S., Gorovtsova O. V., Ushakova T. L., Polyakov V. G. The role of local methods in the organ-preserving treatment of intraocular retinoblastoma// Vestnik RONC im. N. N. Blokhina RAMN. 2015. T. 26, №2. S. 15-22. (In Russ.)].
- Moore R. F., Stallard H. B., Milner J. G. Retinal gliomata treated by radon seeds. // Br. J. Ophthalmol. 1931. Vol. 15, №12. P. 673-696.
- Kleinerman R. A., Tucker M. A., Tarone R. E., Abramson D. H., Seddon J. M., Stovall M. et al. Risk of New Cancers After Radiotherapy in Long-Term Survivors of Retinoblastoma: An Extended Follow-Up// J. Clin. Oncol. 2005. Vol. 23, №10. P. 2272-2279.
- Kim J.-Y., Park Y. Treatment of Retinoblastoma: The Role of External Beam Radiotherapy// Yonsei Med. J. 2015. Vol. 56, №6. P. 1478.
- Simpson E. R., Gallie B., Laperrierre N., Beiki-Ardakani A., Kivela Т., Raivio V. et al. The American Brachytherapy Society consensus guidelines for plaque brachytherapy of uveal melanoma and retinoblastoma// Brachytherapy. 2014. Vol. 13, № 1. P. 1-14.
- TNM8: The updated TNM classification for retinoblastoma. // Community eye Heal. 2018. Vol. 31, № 101. P. 34.
- Linn Murphree A. Intraocular Retinoblastoma: the Case for a New Group Classification// Ophthalmol. Clin. North Am. 2005. Vol. 18, №1. P. 41-53.
- Dunphy E. B. The story of retinoblastoma. // Trans. Am. Acad. Ophthalmol. Otolaryngol. 1964. Vol. 68. P. 249-264.
- Яровой А. А., Клеянкина C. C., Зубарева С. А., Ушакова Т. А., Яровая В. А., Котельникова А. В., Котова Е. С. Ретробульбарная инфузионная терапия интраокулярных осложнений локального лечения ретинобластомы. Российская детская офтальмология. 2020. № 2. С. 26-30. [Yarovoy A. A., Kleyankina S. S., Zubareva S. A., Ushakova Т. L., Yarovaya V. A., Kotelnikova A. V., Kotova E. S.. Retrobulbar Infusion Therapy of Intraocular Complications of Local Treatment of Retinoblastoma// Russ. Ophthalmol. Child. 2020. №2. P. 26-30. (In Russ.)].
- Yarovoy A. A., Ushakova T. L., Gorshkov I. M., Polyakov V. G., Golubeva O. V., Gorovtsova O. V. et al. Intraocular Surgery with Melphalan Irrigation for Vitreous Hemorrhage in an Only Eye with Retinoblastoma// Eur. J. Ophthalmol. 2016. Vol. 26, №1. P. 17-19.
- Яровой А. А., Горшков И. M., Ушакова Т. А., Яровая В. А., Котова Е. С., Котельникова А. В. Хирургическое лечение гемофтальма с одновременной ирригацией мелфалана у пациентов с ретинобластомой. Российская детская офтальмология. 2020. №2. С. 20-25. [Yarovoy A. A., Gorshkov I. M., Ushakova Т. L., Yarovaya V. A., Kotova E. S., Kotelnikova A. V. Surgical Treatment with Simultaneous Melphalan Irrigation for Vitreous Haemorrhage in Patients with Retinoblastoma// Russ. Ophthalmol. Child. 2020. №2. P. 20-25. (In Russ.)].
- Chantada G. L., Fandiño A. C., Raslawski E. C., Manzitti J., de Dávila M. Т., Casak S. J. et al. Experience with chemoreduction and focal therapy for intraocular retinoblastoma in a developing country// Pediatr. Blood Cancer. 2005. Vol. 44, №5. P. 455-460.
- Sohajda Z., Damjanovich J., Bárdi E., Szegedi I., Berta A., Kiss C. Combined Local Treatment and Chemotherapy in the Management of Bilateral Retinoblastomas in Hungary// J. Pediatr. Hematol. Oncol. 2006. Vol. 28, № 6. P. 399-401.
- Shields J. A., Shields C. L., De Potter P., Hernandez J. C., Brady L. W. Plaque Radiotherapy for Residual or Recurrent Retinoblastoma in 91 Cases// J Pediatr Ophthalmol Strabismus. 1994. Vol. 31 (4). P. 242-5.
- Shields C. L., Shields J. A., De Potter P., Minelli S., Hernandez C., Brady L. W. et al. Plaque Radiotherapy in the Management of Retinoblastoma. Use as aprimary and secondary treatment// Ophthalmology. 1993. Vol. 100, №2. P. 216-224.
- Nag S., Quivey J. M., Earle J. D., Followill D., Fontanesi J., Finger P. T. The American Brachytherapy Society recommendations for brachytherapy of uveal melanomas// Int. J. Radiat. Oncol. 2003. Vol. 56, №2. P. 544-555.
- Schefler A. C., Kim R. S. Recent advancements in the management of retinoblastoma and uveal melanoma// F1000Research. 2018. Vol. 7. P. 476.
- Abouzeid H., Moeckli R., Gaillard M. C., Beck- Popovic M., Pica A., Zografos L. et al. 106Ruthenium Brachytherapy for Retinoblastoma// Int. J. Radiat. Oncol. 2008. Vol. 71, №3. P. 821-828.
- Schueler A. O., Flühs D., Anastassiou G., Jurklies C., Sauerwein W., Bornfeld N. Beta-Ray Brachytherapy of Retinoblastoma: Feasibility of a New Small-Sized Ruthenium-106 Plaque// Ophthalmic Res. 2006. Vol. 38, №1. P. 8-12.
- Schueler A. O., Flühs D., Anastassiou G., Jurklies C., Neuhauser M., Schilling H. et al. P-Ray brachytherapy with 106Ru plaques for retinoblastoma// Int. J. Radiat. Oncol. 2006. Vol. 65, №4. P. 1212-1221.
- Murakami N., Suzuki S., Ito Y., Yoshimura R., Inaba K., Kuroda Y. et al. 106Ruthenium Plaque Therapy (RPT) for Retinoblastoma// Int. J. Radiat. Oncol. 2012. Vol. 84, №1. P. 59-65.
- Яровой А. А., Булгакова E. С., Кривовяз О. С., Ушакова Т. А., Поляков В. Г. Эффективность брахитерапии при ретинобластоме. Офтальмохирургия. 2016; (1):52-58. [Yarovoy A. A., Bulgakova E. S., Krivovyaz O. S., Ushakova T. L., Polyakov V. G. The efficiency of plaque radiotherapy in the management of retinoblastoma. Fyodorov Journal of Ophthalmic Surgery. 2016; (1):52-58. (In Russ.)].
- Саакян С. В., Вальский В. В. Эффективность брахитерапии в комплексном лечении ретинобластомы. Альманах клинической медицины. 2018;46 (2):132-136. [Saakyan S. V., Valskiy V. V. Effectiveness of brachytherapy in the combination treatment of retinoblastoma. Almanac of Clinical Medicine. 2018;46 (2):132-136. (In Russ.)].
- Котова E. С., Яровой А. А., Володин Д. П., Котельникова А. В. Брахитерапия ретинобластомы (обзор литературы). Российский журнал детской гематологии и онкологии. 2021. Т. 8. №1. С. 50-56. [Kotova E. S., Yarovoy A. A., Volodin D. P., Kotelnikova A. V. Retinoblastoma brachytherapy (literature review) // Russ. J. Pediatr. Hematol. Oncol. 2021. Vol. 8. №1. P. 50-56. (In Russ.)].


