Браншированный гибридный протез: экспериментальное исследование in vivo
Автор: Шаданов А.А., Чернявский А.М., Сирота Д.А., Ляшенко М.М., Владимиров С.В., Тимченко Т.П., Докучаева А.А., Бородин В.П., Сабетов А.К., Хомушку Д.В., Муртазалиев М.Н., Русакова Я.Л., Кузнецова Е.В., Журавлева И.Ю.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 2 т.28, 2024 года.
Бесплатный доступ
Актуальность. Разработка гибридных протезов нового поколения призвана улучшить результаты хирургического лечения комбинированных поражений дуги и нисходящего отдела аорты. Цель. Оценка биосовместимости нового браншированного гибридного стент-графта. Методы. Разработанный гибридный стент-графт состоит из двух частей: сосудистой части и стент-графтовой части с дополнительной стентированной браншей для реконструкции левой подключичной артерии. Для оценки биологической совместимости имплантировали стент-графт 25 крупным свиньям в позицию нисходящего грудного отдела аорты. Оценивали операционную смертность, послеоперационные осложнения, результаты селективной ангиографии аорты и гистологического исследования через 6 мес. Результаты. Имплантация гибридного стент-графта во всех случаях прошла успешно, без осложнений. В раннем периоде погибли 3 животных, причинами смерти стали дыхательная недостаточность из-за баротравмы легкого, интраоперационное кровотечение и внезапная сердечная смерть. Остальные свиньи дожили до окончания срока наблюдения (6 мес.) без осложнений, после чего были выведены из эксперимента. Длительность перфузии посредством сонно-бедренного шунтирования составила 55 [50; 60] мин. Объем пропотевания крови через сосудистую часть протеза — 2,28 ± 0,23 мл/см2/мин. Объем кровопотери за первый час по дренажам — порядка 70,2 ± 8,9 мл. По данным ангиографии аорты через 6 мес. после операции, основное тело и ветви гибридного стент-графта полностью проходимы. Миграции, деформации или эндоликов не наблюдалось. Результаты анализа гистологических срезов показали наличие конфлюэнтного слоя неоинтимы, непрерывно и равномерно распространенного по всей луминальной поверхности кондуитов, включая боковые бранши и анастомозы. Неоинтима представлена слоями однонаправленных клеток фибробластного ряда, гиперплазирована, ее луминальная поверхность покрыта слоем эндотелиоцитов. Заключение. Продемонстрированы техническая возможность и безопасность применения нового гибридного стент-графта с дополнительной стентированной браншей.
In vivo, браншированный гибридный протез, замороженный хобот слона, ландрас, сосудистый протез, тканый дакроновый протез, эксперимент на свиньях
Короткий адрес: https://sciup.org/142241023
IDR: 142241023 | DOI: 10.21688/1681-3472-2024-2-73-84
Текст научной статьи Браншированный гибридный протез: экспериментальное исследование in vivo
А.А. Шаданов, А.М. Чернявский, Д.А. Сирота, М.М. Ляшенко, С.В. Владимиров, Т.П. Тимченко, А.А. Докучаева, В.П. Бородин, А.К. Сабетов, Д.В. Хомушку, М.Н. Муртазалиев, https://orcid.
How to cite: Shadanov A.A., Chernyavskiy A.M., Sirota D.A., Lyashenko M.M., Vladimirov S.V., Timchenko T.P., Dokuchaeva A.A., Borodin V.P., Sabetov A.K., Khomushku D.V., Murtazaliev M.N., Rusakova Ya.L., Kuznetsova E.V., Zhuravleva I.Yu. Branched hybrid prosthesis: in vivo experimental study. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2024;28(2):73-84. (In Russ.)
A.A. Shadanov,
A.M. Chernyavskiy,
D.A. Sirota,
M.M. Lyashenko,
S.V. Vladimirov,
T.P. Timchenko,
A.A. Dokuchaeva,
V.P. Borodin,
A.K. Sabetov,
D.V. Khomushku,
M.N. Murtazaliev,
Ya.L. Rusakova,
E.V. Kuznetsova,
I.Yu. Zhuravleva,
Лечение комбинированных поражений грудного отдела аорты остается одной из сложнейших проблем кардиохирургии. Открытая реконструкция грудного отдела сопровождается высокой летальностью в раннем и отдаленном послеоперационных периодах [1]. Если внутригоспитальные результаты удалось значительно улучшить, то в отдаленном периоде сохраняется проблема проходимости ложного канала.
Общепризнано, что хирургическое вмешательство на восходящем отделе аорты при ее расслоении обязательно должно включать резекцию первичного дефекта интимы и протезирование восходящего отдела аорты. Однако определение уровня формирования дистального анастомоза при хирургическом лечении проксимальных расслоений зависит от многих факторов: распространения патологического процесса; наличия разрывов, фенестраций, тромбоза в дуге аорты; вовлечения в расслоение брахиоцефальных сосудов [2]. Формирование дистального анастомоза и протезирование брахиоцефальных сосудов — наиболее сложный и ответственный этап реконструкции грудного отдела аорты. Ограниченное пространство для выполнения хирургического приема и трудности визуализации значительно увеличивают время циркуляторного ареста, что повышает риск неврологического дефицита и уровень летальности [3]. Этим объяс- няется тенденция проксимализации дистального анастомоза с выполнением сонно-подключичного переключения [4]. В то же время этот способ несет высокий риск сохранения функционирующего ложного канала аневризмы, который является предиктором неблагоприятных событий в послеоперационном периоде [5].
Стремление избежать данной проблемы стимулировало развитие новых хирургических технологий, одной из которых стала операция «замороженный хобот слона» (англ. frozen elephant trunk). Основное преимущество метода — возможность одномоментной реконструкции дуги и нисходящего отдела аорты за счет наличия дистальной стентированной части протеза. Опубликованы данные о более чем 90% вероятности тромбоза ложного просвета после выполнения этого вида вмешательства в остром периоде расслоения аорты [6; 7].
Гибридные протезы c дополнительными стентированными браншами позволяют уменьшить длительность основного этапа операции за счет проксимализации дистального анастомоза и одномоментного стент-графтинга левой подключичной артерии (ЛПкА) [8; 9].
Мы разработали модель гибридного протеза, позволяющую выполнять открытое стентирование нисходящей грудной аорты и ЛПкА. Цель данной работы — испытание нового гибридного протеза с одной дополнительной стентированной браншей в эксперименте на животных.
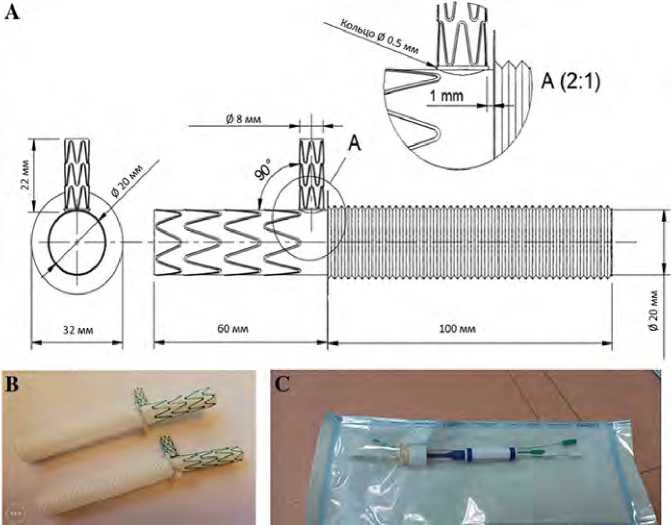
Рис. 1. Гибридный протез для имплантации в грудной отдел аорты: чертеж-схема (А); общий вид в раскрытом состоянии (В); общий вид протеза, собранного на системе доставки и стерилизованного этиленоксидом (С)
Методы
Конструкция гибридного протезаи система доставки
Гибридный протез состоит из стентированного (негофрированного) фрагмента диаметром 20 мм, соединенного швом с гофрированной частью диаметром 20 мм. Обе сосудистые заготовки выполнены из полиэтилентерефталатных (ПЭТФ, лавсан) волокон (БНТУ «Политехник», Минск, Республика Беларусь). Стентированная часть состоит из Z-образных саморасширяющихся нитиноловых стентов, фиксированных к сосудистому протезу снаружи. В стентированной части протеза расположена дополнительная стентированная бранша ЛПкА диаметром 8 мм и длиной 20 мм. Длина гофрированной и негофрированной частей протеза — 100 и 60 мм соответственно. Общий вид гибридного протеза представлен на рис. 1А, В.
Физико-технические свойства протеза мы подробно охарактеризовали ранее [10; 11]. На заключительной стадии изготовления кондуит подвергали герметизирующей желатиновой пропитке с антибактериальным эффектом (бычий желатин типа В + ванкомицин) [12; 13], после чего собирали на системе доставки. Последняя включает рукоятку со стержнем, вытягивающуюся проволочную петлю и лигатуру 2/0, которая удерживает протез в свернутом состоянии (рис. 1С).
Экспериментальная модель
В качестве модели для проведения серии экспериментов использовали 25 крупных свиней породы ландрас. Все процедуры с животными выполняли в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18.03.1986 г.).
Анестезиологическое пособие
В день эксперимента всем животным натощак выполняли премедикацию (Золетил 100). Дозу подбирали индивидуально согласно весоростовым параметрам. После наступления сна подготавливали операционное поле и область катетеризации сосудов шеи. Животное транспортировали на операционный стол и закрепляли в положении на спине для последующей интубации трахеи, установки центрального артериального и венозного катетеров. Эксперимент выполняли в условиях эндотрахеаль-ного наркоза севофлураном и миорелаксации (ро-курония бромид). Искусственную вентиляцию легких проводили с помощью наркозно-дыхательного аппарата Fabius Plus (Draeger, Любек, ФРГ) с положительным давлением на вдохе (20–30 см вод. ст.) и на выдохе (5–8 см вод. ст.) с дыхательным объемом 8 мл/кг и частотой 12–14 дыханий в минуту. Параметры жизнедеятельности фиксировали с помощью монитора IntelliVue MP70 (Philips, Амстердам, Нидерланды). Перед началом оператив-
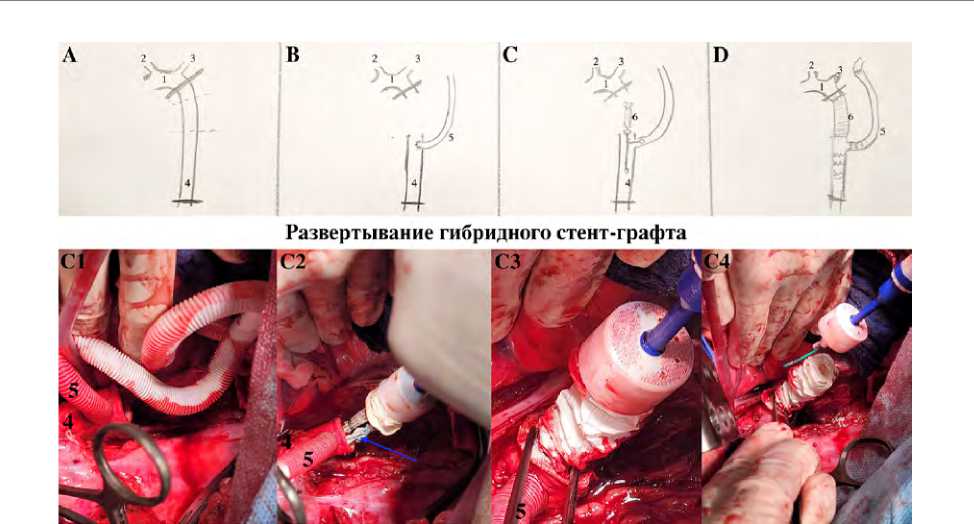
Рис. 2. Основной этап оперативного вмешательства: наложение зажимов на уровне перешейка аорты и дистальной 1/3 нисходящей грудной аорты, пунктирной линией указана зона резекции аорты (А); формирование анастомоза между сосудистым протезом диаметром 8 мм и нисходящей грудной аортой для имитации левой подключичной артерии (В); позиционирование и раскрытие гибридного протеза (С); общий вид раны после пришивания к нисходящей аорте сосудистого протеза (имитация левой подключичной артерии) (С1); позиционирование стент-графта (С2); удаление проволочных фиксаторов и раскрытие стент-графта (C3); удаление системы доставки (С4); формирование анастомозов с гибридным протезом (D)
Примечание. 1 — дуга аорты, 2 — бычий ствол, 3 — левая подключичная артерия, 4 — нисходящая грудная аорта, 5 — протез диаметром 8 мм для имитации левой подключичной артерии, 6 — гибридный протез.
ного вмешательства пунктировали по Сельдинге-ру бедренную вену и устанавливали центральный венозный катетер (Certofix Duo HF V920; B.Braun, Мельзунген, Германия; 9F (13G)) для мониторинга центрального венозного давления и внутривенной инфузии. Для мониторинга инвазивного артериального давления секционно/пункционно по Сельдин-геру устанавливали артериальную линию (Arteriofix Art.-Kath.-Set; B.Braun; 18G/160 мм) в подкожную артерию внутренней поверхности бедра. Антибактериальная профилактика включала внутривенное введение 2 г цефазолина (1 г за 30 мин до кожного разреза и 1 г через 4 ч после начала операции).
Техника имплантации гибридного протеза
Для достижения цели исследования мы отказались от классического протезирования дуги аорты из-за анатомических особенностей грудного отдела аорты (малая протяженность восходящего отдела и дуги аорты; глубокое, крайне неудобное расположение в ране), необходимости искусственного кровообращения и гипотермического циркуляторного ареста. В связи с этим решили выполнять опе- ративное вмешательство на нисходящем отделе аорты из-за ее достаточной длины и наличия рабочего пространства с имитацией ЛПкА. Технические подробности выполнения вмешательства описаны ниже.
После фиксации животного на операционном столе в положении на правом боку выполняли левостороннюю торакотомию в III межреберном промежутке с резекцией IV ребра. Оттеснив левое легкое, мобилизовали участок нисходящего отдела грудной аорты. С целью перфузии внутренних органов и задних конечностей после системной гепаринизации (300 Ед/кг) выполняли канюляцию артериальных доступов по схеме сонная артерия – бедренная артерия. При малом диаметре внутренней сонной артерии проводили канюляцию дуги аорты.
Шунтирование крови на этапе пережатия аорты проводили путем перфузии в условиях пассивного шунта под контролем инвазивного артериального давления по вышеописанной схеме, использовали периферические артериальные канюли 14 Fr и 16 Fr. Аорту пережимали между перешейком нисходящей аорты и 9-й межреберной артерией. Резецировали
Рис. 3. Хирургические детали операции: схема формирования соннобедренного временного пассивного шунтирования, красными стрелками показано направление потока крови (А); боковой торакотомный доступ в III–IV межреберье (В); общий вид после основного этапа, гибридный протез в позиции нисходящей грудной аорты (С)
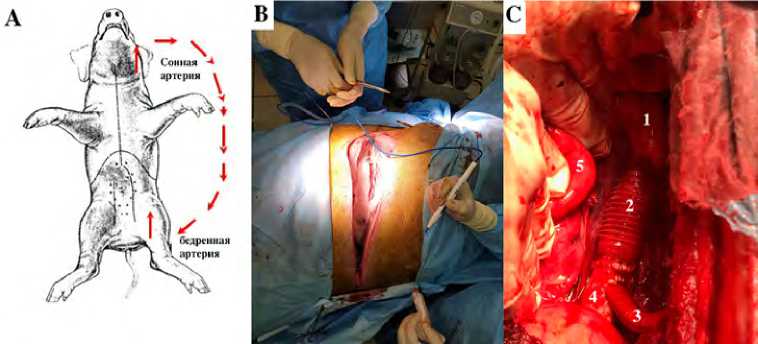
Примечание. 1 — перешеек нисходящей грудной аорты, 2 — сосудистая часть гибридного протеза, 3 — дополнительная отводящая бранша диаметром 8 мм (имитация левой подключичной артерии), 4 — дистальная часть нисходящей грудной аорты с имплантированной стентированной частью гибридного протеза, 5 — левое легкое.
участок грудной аорты длиной 4 см (рис. 2А). Формировали анастомоз между сосудистым протезом диаметром 8 мм и нисходящей грудной аортой с целью имитации устья ЛПкА (рис. 2В). Выполняли позиционирование и раскрытие основной бранши гибридного протеза в просвете аорты, дополнительную браншу позиционировали в предварительно имплантированную браншу протеза диаметром 8 мм (рис. 2С, С1, С2, С3, С4). Последовательно формировали дистальный анастомоз между аортой и манжетой гибридного протеза, после чего полипропиленовой нитью 4/0 выполняли проксимальный анастомоз между сосудистой (гофрированной) частью протеза и перешейком грудной аорты. В дальнейшем ЛПкА отсекали от устья и формировали анастомоз со свободным концом протеза диаметром 8 мм (рис. 2D). После профилактики воздушной эмболии восстанавливали естественный антеградный кровоток.
После восстановления кровотока по аорте для оценки объема кровопотери через сосудистую часть протеза производили окутывание марлевыми салфетками сосудистой части протеза на 5 мин под контролем активированного времени свертывания крови и системного артериального давления на уровне последнего 110–120 мм рт. ст. Далее взвешивали марлевые салфетки и вычитали их массу с перерасчетом показателей в миллилитрах из расчета плотности крови 1,06 г = 1 мл. Измеряли длину сосудистой части протеза и рассчитывали площадь поверхности имплантированной сосудистой части протеза по формуле площади боковой поверхности цилиндра: S = 2 × π × R × h. Полученные резуль- таты использовали для расчета показателя кровопотери (мл/см2/мин).
Производили деканюляцию и нейтрализацию гепарина. Завершали оперативное вмешательство дренированием левой плевральной полости двумя ПВХ-трубками. На этапе окончания операции после наложения кожных швов прекращали подачу севофлурана в дыхательную смесь. На фоне восстановления самостоятельного дыхания, стабильной гемодинамики, при отсутствии признаков сердечной недостаточности и удовлетворительной оксигенации (оценивали по показателям газового состава артериальной крови: сатурация не менее 90 %, парциальное давление кислорода не менее 70 мм рт. ст., парциальное давление углекислого газа 33–45 мм рт. ст.) животное экстубировали. Затем проводили мониторинг гемодинамики (инвазивное артериальное давление, центральное венозное давление), электролитного и газового состава крови, электрокардиографический мониторинг в течение 60 мин и транспортировали животное в виварий.
Послеоперационный период и наблюдение
В послеоперационном периоде всем животным проводили обезболивание нестероидными противовоспалительными препаратами (кетопрофен 1,4 мг/кг внутримышечно с интервалом 12 ч). Первые 3 сут. после операции животным вводили фракси-парин в дозировке 0,3 мл 2 раза в день, затем переходили на комбинацию пероральных антиагрегантных препаратов (клопидогрел 75 мг 1 раз в день и ацетилсалициловая кислота 75 мг 1 раз в день) в течение всего периода наблюдения. Для профилактики инфекционных осложнений в послеоперационном периоде использовали антибиотикотерапию (цефазо-лин 2 г внутримышечно 1 раз в день в течение 7 дней).
Оценка проходимости гибридного протеза
Проходимость протезов оценивали с помощью селективной аортографии во время операции и через 6 мес. перед выведением из эксперимента. В качестве контрастного препарата применяли Ультра-вист (Ultravist, Bayer, Леверкузен, Германия). Для введения контрастного вещества использовали инъекционную систему (инжектор) MEDRAD Mark V ProVis (Bayer, Леверкузен, Германия). Ангиоскопию проводили с помощью передвижного рентгеновского аппарата OEC 9900 ELITE (GE HealthCare, Чикаго, США).
Выведение животного из эксперимента
По истечении срока наблюдения (6 мес.) животных выводили из эксперимента внутривенным введением 100 мл 4% раствора хлорида калия в условиях общей комбинированной анестезии (пропофол 4–7 мг/кг, фентанил 0,006–0,008 мг/кг и ингаляции севофлурана 2–4 об.%). Имплантат выделяли с окружающими тканями реципиента на 5 см дистальнее и проксимальнее границ имплантата.
Гистологическое исследование
Для гистологического исследования изготавливали парафиновые срезы толщиной 6 мкм из зон внутренней выстилки гибридного протеза; зоны анастомоза проксимального края сосудистого протеза и нативной аорты, области контакта балок стентовых элементов и стенки нативной аорты. Из указанных зон забирали по 5 фрагментов размером 5 × 7 мм. Срезы окрашивали гематоксилином и эозином по стандартной методике. Анализ препаратов выполняли на микроскопе Axioskop 40 (Zeiss, Оберкохен, Германия). На каждом препарате измеряли толщину неоинтимы. Поскольку в сосудистой части базальная поверхность неоинтимы имела «волнообразную» форму, повторяя рельеф впадин и выступов гофрированного протеза, измеряли толщину по двум алгоритмам: от луминальной поверхности до «впадины» (максимальная толщина) и от луми-нальной поверхности до «выступа» (минимальная толщина).
Статистический анализ
Результаты измерений анализировали в программе Stata версии 14.0 (Stata Corporation, Колледж-Стейшен, США). Нормальность распределения непрерывных данных оценивали с использованием
Пред- и интраоперационные данные
|
Показатель |
Значение, n = 25 |
|
Пол экспериментальных животных, мужской, n (%) |
10 (40) |
|
Вес на момент операции, кг |
138 [130; 145] |
|
Возраст на момент операции, мес. |
13,4 ±1,75 |
|
Интраоперационные результаты |
|
|
Диаметр сонной артерии, мм |
6 [5; 6] |
|
Диаметр бедренной артерии, мм |
5 [5; 5] |
|
Диаметр аорты в зоне проксимального анастомоза, мм |
19 [18; 20] |
|
Длительность сонно-бедренного шунтирования, мин |
55 [50; 60] |
|
Длительность искусственной вентиляции легких, мин |
315 [290; 365] |
|
Инотропная поддержка, n (%): |
|
|
не требовалась |
23 (92) |
|
требовалась |
2 (8) |
|
Длина имплантированной сосудистой части протеза, мм |
55,6 ± 3,4 |
|
Объем пропотевания крови из сосудистой части протеза, мл/см2/мин |
2,28 ± 0,23 |
|
Активированное время свертывания крови, с |
438 [415; 459] |
|
Объем кровопотери в течение 1 ч после операции, мл |
70,2 ± 8,9 |
теста Шапиро – Уилка. При нормальном распределении непрерывные данные указывали как среднее ± стандартное отклонение (M ± σ); если распределение отличалось от нормального, непрерывные данные рассчитывали как медиану и межквартильный размах (Me [25 %; 75 %]). Категориальные данные представлены частотой распределения и процентным соотношением.
Результаты
Ранние послеоперационные результаты
Всего выполнили 25 успешных имплантаций новой модели гибридного протеза с боковой бран-шей. Диаметр протезов был постоянным и составил 20/20/8 мм. Хирургические детали операции и общий вид раны представлены на рис. 3. Доопе-рационная масса тела животных варьировала от 89 до 200 кг. Осложненная интубация с конверсией на открытую трахеостомию составила 2 (8 %) случая. В 1 (4 %) случае отметили малый диаметр общих сонных артерий — менее 5 мм. Произвели конверсию канюляции в дугу аорты стандартным способом. В остальных случаях протокол канюляции не меняли. Длительность основного этапа соответствовала длительности сонно-бедренного шунтирования, пред- и интраоперационные данные представлены в таблице.
После позиционирования гибридного протеза в просвете грудной аорты проводили раскрытие стентированной части протеза, проволочные фиксаторы удаляли без затруднений, все стент-графты легко развернули. Длительность позиционирования и развертывания гибридного протеза не превышала 2 мин.
Удаление системы доставки проводили плавно без признаков деструкции или дислокации гибридного протеза. При выполнении шовной фиксации манжеты протеза не выявили случаев прорезыва-ния/разрывов ткани или кровотечения после восстановления кровотока по протезу. Интраоперационная проницаемость для крови сосудистой части протеза составила 2,28 ± 0,23 мл/см2/мин, а объем кровопотери по дренажам за первый час после операции — 70,2 ± 8,9 мл. Всех животных экстубировали в течение 1 ч после операции. Только в двух случаях потребовалась инфузия допамина (5 мкг/кг/мин) во время восполнения объема кровопотери и деканюляции. Остальным животным не проводили кардиотоническую поддержку. Интраоперационно в 3 (12 %) случаях зарегистрировали пневмоторакс на фоне баротравмы легких, осу-
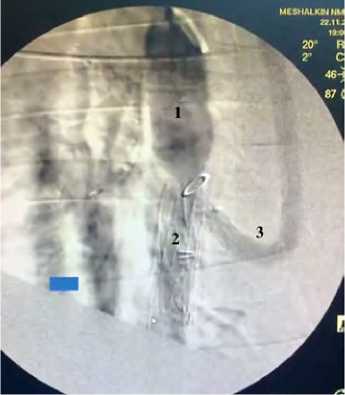
Рис. 4. Результаты селективной ангиографии
Примечание. 1 — сосудистая часть протеза, 2 — стент-графтовая часть протеза, 3 — дополнительная стентированная бранша.
ществляли дренирование плевральной полости по Бюлау.
В течение первых 24 ч после имплантации погибли 3 животных. Основными причинами гибели были интраоперационное кровотечение, не связанное с имплантацией гибридного протеза (n = 1; 4 %), разрыв легкого (n = 1; 4 %) и остановка сердечной деятельности на фоне гипертрофии миокарда (n = 1; 4 %). На протяжении всего периода наблюдения не зарегистрировали спинальных ишемических осложнений.
В первом случае интраоперационное кровотечение было обусловлено канюляцией в дугу аорты. После деканюляции наблюдали прорезывание кисетного шва с последующим разрывом аорты и неконтролируемым кровотечением. Во втором случае во время операции отметили множественные разрывы левого легкого. Интраоперационно показатели оксигенации были крайне низкими, несмотря на активное дренирование плевральной полости. В связи с отсутствием возможности экстубации и перевода в виварий животное вывели из эксперимента. В третьем случае свинью планово экстубировали и транспортировали в виварий в стабильном состоянии. Спустя 15 ч животное нашли без признаков жизнедеятельности. При патологоанатомическом вскрытии протез был полностью проходим, зоны анастомозов состоятельные, отмечалась концентрическая гипертрофия миокарда левого желудочка, толщина миокарда левого желудочка и межжелудочковой перегородки составила более 10 мм.
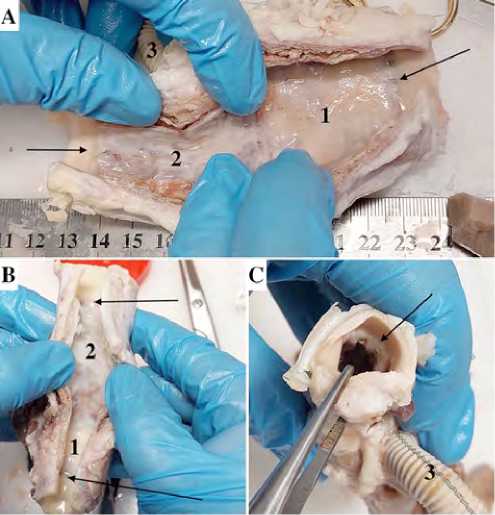
Рис. 5. Макроскопический вид эксплантиро-ванных протезов: продольное рассечение (стрелками указаны зона проксимального анастомоза и граница стентированной части протеза и грудной аорты) (А, В); поперечный вид (стрелкой указана переходная зона гибридного протеза) (C)
Ни один летальный случай не был напрямую связан с дисфункцией гибридного протеза.
Отдаленные результаты
Запланированный период наблюдения (6 мес.) пережили 22 свиньи. В отдаленном периоде не зарегистрировали летальных случаев. В целом естественный прирост массы тела к концу наблюдения составил 260 [250; 270] кг, максимальный вес — 350 кг — зарегистрировали у одной свиньи. По данным ангиографии через 6 мес. после имплантации, во всех случаях протезы проходимы (рис. 4).
При макроскопическом исследовании все гибридные протезы проходимы. Луминальную поверхность покрывает гладкий конфлюэнтный слой неоинтимы с очагами гиперплазии (рис. 5), тромботические массы в стент-графтовом сегменте отсутствуют. Адвентициальная поверхность интегрирована в прилежащие ткани, без признаков деформации. Области анастомозов во всех образцах — без признаков кровоизлияний, разрывов и несостоятельности швов, покрыты толстым гладким слоем неоинтимы. Материал боковых бран-шей интегрирован в прилежащие ткани с адвентициальной стороны и проходим и эндотелизирован со стороны просвета сосуда. Гистологический анализ подтвердил наличие конфлюэнтного слоя неоинтимы, непрерывно и равномерно распространенного по всей луминальной поверхности кондуитов, включая боковые бранши и анастомозы (рис. 6). Структура и клеточный состав
Примечание. 1 — гофрированная часть протеза, 2 — стентированная часть протеза, 3 — бранша, имитирующая левую подключичную артерию.
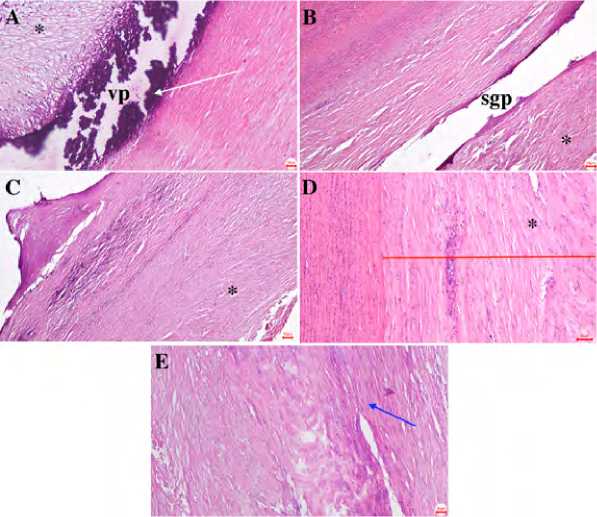
Примечание. * — зона луминальной поверхности неоинтимы; vp — область с минерализацией сосудистой части протеза, тканый материал вылущен при обработке; sgp — зона расположения стент-графтовой части протеза; белая стрелка — очаги кальцификации; синяя стрелка направлена на фибробласты, доказывающие интеграцию протеза в прилежащие ткани; красная линия показывает толщину неоинтимы. Окраска гематоксилином и эозином. Шкала 50 мкм.
Рис. 6. Микрофотографии сосудистой части (А, C), стент-графтовой части (В, D), фиброзной капсулы в сосудистой части (Е) гибридного протеза через 6 мес. после имплантации также универсальны для всех сегментов протеза: неоинтима, представленная слоями однонаправленных клеток фибробластного ряда, гиперплазирована, ее луминальная поверхность покрыта слоем эндотелиоцитов (рис. 6D). В субинтимальной области визуализируются крупные очаги кальцификации с последующей частичной отслойкой неоинтимы, признаки минерализации также присутствуют интраинтимально в областях с выраженной гиперплазией, где толщина неоинтимы превышает 500 мкм (рис. 6А, С). Максимальная толщина неоинтимы сосудистой части протеза составляет 1,8 [1,4; 2,0] мм, минимальная 1,2 [1,1; 1,4] мм. Толщина неоинтимы стент-графтовой части — 0,6 [0,4; 1,0] мм.
С адвентициальной стороны клеточное окружение протезов представлено соединительной тканью без признаков отторжения, инкапсуляции протеза или деформирующего фиброза (рис. 6Е). В стент-графтовой части (рис. 6В) на срезах четко визуализируются ходы, образованные металлическими балками стентовых элементов, при этом в прилежащих тканях не обнаружено признаков воспаления или реакции инородного тела.
Обсуждение
Несмотря на развитие хирургической техники и анестезиологического пособия, уровень госпитальной летальности при реконструктивных вмешательствах на грудной аорте остается высоким. По данным Международного регистра острых расслоений аорты (англ. International Registry of Acute Aortic Dissection, IRAD), летальность при хирургическом лечении острого расслоения типа А составляет 22 % [14]. Развитие гибридных методов хирургического лечения привело к улучшению исходов, что подтверждается результатами японского регистра острого расслоения аорты, согласно которому ежегодно имплантируется более 1 000 гибридных протезов при остром расслоении типа А с уровнем вну-тригоспитальной летальности 11 % [15].
На российском рынке ранее были представлены два типа гибридных протезов: E-vita open plus (Jotec GmBH, Хехинген, Германия) и Thoraflex Hybrid (Vascutek, Инчиннан, Великобритания). Значительный общий недостаток этих устройств — высокая стоимость, что ограничивает применение данного метода лечения у широкого круга пациентов и стимулирует разработки отечественных гибридных протезов, адекватных по цене и не уступающих по техническим характеристикам зарубежным аналогам. В последние годы появились гибридные протезы отечественного производителя ЗАО НПП «МедИнж»
(Пенза, Россия) удовлетворительного качества и цены, поэтому количество имплантируемых устройств неуклонно растет и достигло в 2022 г. 107 случаев, что говорит о высокой потребности в протезах такого типа в сердечно-сосудистой хирургии [16]. При этом данных об имплантации гибридных протезов нового поколения с боковой стентированной браншей на сегодняшний день нет.
В данной работе представлены результаты доклинической апробации новой модели отечественного гибридного протеза с дополнительной стентированной браншей. Бесшовная имплантация устройства в нисходящую грудную аорту и ЛПкА позволяет формировать анастомоз в наиболее анатомически выгодной позиции во 2-й зоне дуги аорты и освобождает хирурга от формирования анастомоза с ЛПкА. Конструкцию гибридного протеза формировали на основании анализа анатомической вариабельности ветвей дуги аорты пациентов. Мы установили, что диаметр ЛПкА статистически значимо не различается у пациентов с расслоениями и аневризмами аорты, а при расслоении аорты ЛПкА реже вовлекается в процесс, который чаще ограничивается первым сегментом [17]. В связи с этим наличие в гибридном протезе одной дополнительной бранши, унифицированной по габаритам, представляется целесообразным.
Выбор свиньи как экспериментальной модели был обусловлен как анатомической схожестью с сердечно-сосудистой системой человека, так и доступностью этих животных для экспериментальной работы. В эксперименте использовали свиней, диаметр аорты которых в зоне имплантации составлял не менее 20 мм, что определяли до операции методом эхокардиографии. Предпочтительными оказались животные породы ландрас. В целом мы отметили быстрый рост животных и двукратное увеличение массы тела за 6 мес. наблюдения, что доставляет значительные неудобства при выполнении контрольной ангиографии и аутопсии. Баротравму легочной ткани на фоне искусственной вентиляции легких в виде разрывов легких отметили в 3 случаях (в одном из них с летальным исходом), несмотря на применение щадящих режимов искусственной вентиляции. Данные особенности свиньи описаны в руководстве по экспериментальной работе на свиньях М.M. Swindle и A.C. Smith [18]. Авторы указывают, что чем моложе свинья, тем больше хрупкость тканей. Это согласуется с нашими данными: возраст свиней с кровотечением из дуги аорты и с множественными разрывами легкого был наименьшим в группе и составил 8 и 10 мес. соответственно. Полученные нами неблагоприятные результаты подтверждают важность правильного выбора породы и возраста свиньи с учетом ее быстрого роста и набора массы тела, что определяет технические особенности проведения эксперимента.
В нашей экспериментальной модели использованный протез из полиэтилентерефталатного волокна с герметизирующей пропиткой продемонстрировал минимальную проницаемость для крови при системной гепаринизации (300 Ед/кг). Эти данные согласуются с результатами, полученными K. Tsagakis и соавт. для гибридного протеза E-vita open plus: минимальная проницаемость в их исследовании составила 2,4 ± 0,3 мл/см2/мин [19].
В серии хронических экспериментов нами доказана техническая возможность имплантации и надежность разработанной модели гибридного протеза с системой доставки оригинальной конструкции. Ни в одном эксперименте не наблюдалось миграции, деформации или транспротезной утечки. Еще один важный критерий безопасности имплантатов — их биоинертность по отношению к крови и окружающим тканям. Макро- и микроскопическая оценка гибридного протеза показала, что его внутренняя поверхность была покрыта умеренно выраженным, равномерным слоем неоинтимы, более выраженным в гофрированной части. Можно предполагать, что это обусловлено видовыми особенностями, так как пролиферация неоинтимы у свиней происходит более активно, чем у человека, и неоэндотелиаль-ный слой формируется главным образом путем краевого «наползания» эндотелиоцитов с поверхности нативной части аорты [20].
Ограничения
К ограничениям исследования относятся выполнение экспериментов на здоровой свиной аорте, различия анатомического строения грудной аорты свиньи и человека, а также сравнение результатов с данными литературы.
Заключение
В эксперименте продемонстрирована возможность эффективной и безопасной реконструкции грудного отдела аорты с использованием разработанного гибридного протеза с дополнительной стентированной браншей. Конструкция протеза позволяет быстро и эффективно формировать анастомоз, минимизировать риски и технические трудности, связанные с традиционными открытыми вмешательствами у пациентов с комбинированными поражениями грудной аорты.
Список литературы Браншированный гибридный протез: экспериментальное исследование in vivo
- Sharaf O.M., Kohtz P.D., Arnaoutakis G.J. Aortic arch repair using open and hybrid techniques: a systematic review. Innovations (Phila). 2022;17(4):273-282. PMID: 35934948. https://doi.org/10.1177/15569845221115355
- Czerny M., Grabenwöger M., Berger T., Aboyans V., Della Corte A., Chen E.P., Desai N.D., Dumfarth J., Elefteriades J.A., Etz C.D., Kim K.M., Kreibich M., Lescan M., Di Marco L., Martens A., Mestres C.A., Milojevic M., Nienaber C.A., Piffaretti G., Preventza O., Quintana E., Rylski B., Schlett C.L., Schoenhoff F., Trimarchi S., Tsagakis K.; EACTS/STS Scientific Document Group. EACTS/STS Guidelines for diagnosing and treating acute and chronic syndromes of the aortic organ. Eur J Cardiothorac Surg. 2024;65(2):ezad426. Erratum in: Eur J Cardiothorac Surg. 2024;65(6):ezae235. PMID: 38408364. https://doi.org/10.1093/ejcts/ezad426
- Редкобородый А.В., Селяев В.С., Рубцов Н.В., Коков Л.С., Муслимов Р.Ш., Попова И.Е., Торшхоев К.М., Хуцишвили Л.Г. Выбор тактики хирургического лечения «острейшего» расслоения аорты I типа по De Bakey в условиях многопрофильного хирургического стационара. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2023;12(1):14-22. https://doi.org/10.23934/2223-9022-2023-12-1-14-22 Redkoborody A.V., Selyaev V.S., Rubtsov N.V., Kokov L.S., Muslimov R.Sh., Popova I.E., Torshkhoyev K.M., Khutsishvili L.G. The choice of tactics for surgical treatment of acute De Bakey type I aortic dissection in a multidisciplinary surgical hospital. Russian Sklifosovsky Journal “Emergency Medical Care”. 2023;12(1):14-22. (In Russ.) https://doi.org/10.23934/2223-9022-2023-12-1-14-22
- Geragotellis A., Jubouri M., Hussain K., Alzaanin W., Tan S.Z.C.P., Patel R., Mohammed I., Bashir M. Head-to-head: Zone 2 vs. Zone 3 frozen elephant trunk. Vessel Plus. 2023;7:6. https://doi.org/10.20517/2574-1209.2022.41
- Charchyan E., Breshenkov D., Belov Y. Follow-up outcomes after the frozen elephant trunk technique in chronic type B dissection. Eur J Cardiothorac Surg. 2020;57(5):904-911. PMID: 31899477. https://doi.org/10.1093/ejcts/ezz348
- Kayali F., Chikhal R., Agbobu T., Jubouri M., Patel R., Chen E.P., Mohammed I., Bashir M. Evidence-based frozen elephant trunk practice: a narrative review. Cardiovasc Diagn Ther. 2023;13(6):1104-1117. PMID: 38162110; PMCID: PMC10753235. https://doi.org/10.21037/cdt-23-300
- Kozlov B.N., Panfilov D.S. False lumen thrombosis after frozen elephant trunk procedure in acute and chronic aortic dissection. J Cardiovasc Surg (Torino). 2022;63(2):195-201. PMID: 34792310. https://doi.org/10.23736/S0021-9509.21.11800-2
- Шаданов А.А., Сирота Д.А., Ляшенко М.М., Хван Д.С., Чернявский А.М. Гибридные протезы для реконструкции дуги аорты: эволюция и современное состояние. Ангиология и сосудистая хирургия. 2021;27(2):41-49. https://doi.org/10.33529/ANGIO2021126 Shadanov A.A., Sirota D.A., Liashenko M.M., Khvan D.S., Cherniavskiy A.M. Hybrid grafts for aortic arch reconstruction: evolution and state of the art. Angiologiia i sosudistaia khirurgiia = Angiology and Vascular Surgery. 2021;27(2):41-49. PMID: 34166343. (In Russ.) https://doi.org/10.33529/ANGIO2021126
- Shimamura K., Kuratani T., Matsumiya G., Shirakawa Y., Takeuchi M., Takano H., Sawa Y. Hybrid endovascular aortic arch repair using branched endoprosthesis: the second-generation "branched" open stent-grafting technique. J Thorac Cardiovasc Surg. 2009;138(1):46-52. PMID: 19577055. https://doi.org/10.1016/j.jtcvs.2009.03.025
- Шаданов А.А., Тимченко Т.П., Владимиров С.В., Лущик П.Е., Заблоцкий А.В., Киселев С.О., Журавлева И.Ю., Сирота Д.А., Чернявский А.М. Влияние ткацких технологий на интегральные характеристики синтетических сосудистых протезов. Современные технологии в медицине. 2022;14(6):5-14. https://doi.org/10.17691/stm2022.14.6.01 Shadanov А.А., Timchenko Т.P., Vladimirov S.V., Lushchyk P.E., Zablotsky А.V., Kiselyov S.О., Zhuravleva I.Yu., Sirota D.А., Chernyavskiy А.M. The influence of weaving technologies on the integral characteristics of synthetic vascular prostheses. Sovremennye tehnologii v medicine = Modern Technologies in Medicine. 2022;14(6):5-13. PMID: 37181288; PMCID: PMC10171052. (In Russ.) https://doi.org/10.17691/stm2022.14.6.01
- Журавлева И.Ю., Тимченко Т.П., Владимиров С.В., Ляшенко М.М., Кузнецова Е.В., Чернявский А.М. Ab ovo: факторы, влияющие на радиальную жесткость стент-графтов грудного отдела аорты. Современные технологии в медицине. 2021;13(1):17-26. https://doi.org/10.17691/stm2021.13.1.02 Zhuravleva I.Yu., Timchenko T.P., Vladimirov S.V., Lyashenko M.M., Kuznetsova E.V., Chernyavskiy A.M. Ab ovo: factors affecting the radial stiffness of thoracic aorta stent-grafts. Sovremennye tehnologii v medicine = Modern Technologies in Medicine. 2021;13(1):17-25. PMID: 34513062; PMCID: PMC8353689. (In Russ.) https://doi.org/10.17691/stm2021.13.1.02
- Zhuravleva I.Yu., Shadanov A.A., Surovtseva M.A., Vaver A.A., Samoylova L.M., Vladimirov S.V., Timchenko T.P., Kim I.I., Poveshchenko O.V. Which gelatin and antibiotic should be chosen to seal a woven vascular graft? Int J Mol Sci. 2024;25(2):965. PMID: 38256039; PMCID: PMC10816219. https://doi.org/10.3390/ijms25020965
- Шаданов А.А., Журавлева И.Ю., Самойлова Л.М., Тимченко Т.П., Владимиров С.В., Карпова Е.В., Лучников Н.Е., Сирота Д.А., Едемский А.Г., Богачев-Прокофьев А.В., Чернявский А.М. Оценка оригинального герметизирующего покрытия с антибактериальным эффектом для синтетических сосудистых протезов. Патология крово¬обращения и кардиохирургия. 2023;27(1):38-46. https://doi.org/10.21688/1681-3472-2023-1-38-46 Shadanov A.A., Zhuravleva I.Yu., Samoylova L.M., Timchenko Т.P., Vladimirov S.V., Karpova E.V., Luchnicov N.E., Sirota D.A., Edemskiy A.G., Bogachev-Prokofiev A.V., Chernyavskiy A.M. Evaluation of the original sealant with antibacterial effect for synthetic vascular grafts. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2023;27(1):38-46. (In Russ.) https://doi.org/10.21688/1681-3472-2023-1-38-46
- Evangelista A., Isselbacher E.M., Bossone E., Gleason T.G., Di Eusanio M., Sechtem U., Ehrlich M.P., Trimarchi S., Braverman A.C., Myrmel T., Harris K.M., Hutchinson S., O’Gara P., Suzuki T., Nienaber C.A., Eagle K.A. IRAD Investigators. Insights from the international registry of acute aortic dissection: a 20-year experience of collaborative clinical research. Circulation. 2018;137(17):1846-1860. PMID: 29685932. https://doi.org/10.1161/CIRCULATIONAHA.117.031264
- Okita Y. Frozen elephant trunk usage in acute aortic dissection. Asian Cardiovasc Thorac Ann. 2021;29(7):612-618. PMID: 34470526. https://doi.org/10.1177/0218492320951304
- Бокерия Л.А., Милиевская Е.Б., Прянишников В.В., Юрлов И.А. Сердечно-сосудистая хирургия – 2022. Болезни и врожденные аномалии системы кровообращения. М.: НМИЦ ССХ им. А.Н. Бакулева Минздрава России, 2023. 344 с. Bokeriya L.A., Milievskaya E.B., Pryanishnikov V.V., Yurlov I.A. Cardiovascular surgery – 2022. Diseases and congenital anomalies of the circulatory system. Moscow: Bakulev National Medical Research Center for Cardiovascular Surgery Publ.; 2023. 344 p. (In Russ.)
- Шаданов А.А., Сирота Д.А., Берген Т.А., Ляшенко М.М., Чернявский А.М. Анатомическая вариабельность строения дуги и грудного отдела аорты и ее влияние на патологические состояния аорты. Патология кровообращения и кардиохирургия. 2020;24(4):72-82. https://doi.org/10.21688/1681-3472-2020-4-72-82 Shadanov A.A., Sirota D.A., Bergen T.A., Lyashenko M.M., Chernyavskiy A.M. Anatomical variability of the structure of the arch and thoracic aorta and its effect on pathological conditions of the aorta. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2020;24(4):72-82. (In Russ.) https://doi.org/10.21688/1681-3472-2020-4-72-82
- Swindle M.M., Smith A.C. Swine in the laboratory: surgery, anesthesia, imaging, and experimental techniques. 3th ed. Boca Raton: CRC press; 2015. 607 p.
- Tsagakis K., Pizanis N., Baba H.A., Wendt D., Wisbrun N., Altenbernd J., Eggebrecht H., Kamler M., Jakob H. Impermeability to blood of the E-vita open plus hybrid stent-graft: experimental and clinical evaluation. J Endovasc Ther. 2010;17(3):340-348. PMID: 20557173. https://doi.org/10.1583/09-2758MR.1
- Houbballah R., Robaldo A., Albadawi H., Titus J., LaMuraglia G.M. A novel model of accelerated intimal hyperplasia in the pig iliac artery. Int J Exp Pathol. 2011;92(6):422-427. PMID: 22050434; PMCID: PMC3248078. https://doi.org/10.1111/j.1365-2613.2011.00790.x


