Brca-ассоциированный рак яичников в российской популяции пациенток. Анализ неинтервенционного исследования OVATAR
Автор: Тихомирова Т.Е., Тюляндина А.С., Румянцев А.А., Исраелян Э.Р., Кекеева Т.В., Ведрова О.В., Филипенко М.Л., Любченко Л.Н., Демидова И.А., Имянитов Е.Н., Андреев С.Ю., Хохлова С.В., Саевец В.В., Стаценко Г.Б., Коломиец Л.А., Ткаченко С.А., Королева И.А., Лисянская А.С., Бакашвили О.А., Крикунова Л.И., Соловьева Е.П., Пономаренко Д.М., Владимирова Л.Ю., Красильников С.Э., Ширинкин В.Б., Сакаева Д.Д., Румянцева Е.А., Емельянов С.А., Строяковский Д.Л., Новикова Е.Г., Ронина Е.А., Владимиров В.И., Новикова О.Ю., Загуменнова Л.С., Горобцова В.В., Черепанова Е.В., Пашкова Е.Н., Моисеенко В.М., Иванова Ф.Г., Удовица Д.П., Карасева В.В., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 4 т.13, 2023 года.
Бесплатный доступ
Цель исследования: Определение доли мутаций в генах BRCA1/2 у пациенток с серозным и эндометриоидным раком яичников (РЯ), брюшины и маточных труб в России, определение процентного соотношения герминальных и соматических мутаций, выявления спектра мутаций в генах BRCA1/2, определение клинико-морфологических особенностей течения BRCA-ассоциированного РЯ. Материалы и методы: Включались пациентки с впервые выявленным серозным и эндометриоидным РЯ, брюшины и фаллопиевых труб в возрасте от 18 лет. Проведён сбор биологического материала (кровь, опухолевая ткань) с последующим проведением молекулярно-генетического анализа. Методами диагностики мутации в крови являлись аллель специфическая ПЦР, высокоразрешающее плавление (HRM), метод секвенирования по Сэнгеру. При расширенном генетическом тестировании использовались секвенирование нового поколения (NGS) и мультиплексная амплификация лигированных зондов (MLPA). Проведён сбор клинических данных, семейного анамнеза, клинико-морфологических характеристик опухоли. Результаты исследования: в исследование включено 500 пациенток, определение мутаций в генах BRCA1/2 было проведено 496 пациенткам (99,2%). Частота мутаций в генах BRCA1/2 в российской популяции пациенток составила 28,4% (n = 141/496). Частота встречаемости герминальных мутаций составила 23,5% (n = 117/141), соматических — 4,8% (n = 24/141). Частые мутации в российской популяции были определены в 50%. При анализе этнической принадлежности пациенток в РФ BRCA-ассоциированный РЯ наиболее часто встречался у русских (83,6%, n = 118/141), украинских (4,2%, n = 6/141) и татарских (3,5%, n = 5/141) женщин. Отягощённый онкологический семейный анамнез был выявлен у 44% пациенток (n = 62/141) с мутациями в генах BRCA1/2. Заключение: В связи с высокой частотой герминальных и соматических мутаций в генах BRCA1/2 при РЯ в российской популяции пациенток рекомендовано проведение расширенных методов тестирования не только в крови, но и в опухолевой ткани.
Рак яичников, мутации в генах BRCA1/2, молекулярно-генетическое тестирование
Короткий адрес: https://sciup.org/140304592
IDR: 140304592 | DOI: 10.18027/2224-5057-2023-13-4-46-59
Текст научной статьи Brca-ассоциированный рак яичников в российской популяции пациенток. Анализ неинтервенционного исследования OVATAR
Рак яичников (РЯ) является одним из наиболее часто выявляемых онкологических заболеваний у женщин и занимает 18-е место среди всех злокачественных заболеваний по всему миру [1]. Несмотря на современные подходы к лечению, за последние 25 лет 5-летняя общая выживаемость для пациенток с впервые диагностированным РЯ увеличилась лишь до 49% [2]. Высокая летальность при данном заболевании в основном связана с поздней диагностикой и асимптоматичным течением [2].
РЯ характеризуется высокой частотой наличия мутаций в генах BRCA1/2, которые выявляются в 25% случаев [3]. Наследственный РЯ, обусловленный наличием герминальных мутаций в генах BRCA1/2, выявляется в 15–18% случаев. Дополнительно 5–7% случаев РЯ связаны с соматическими мутациями в тех же генах [4,5]. Стоит отметить, что риск возникновения РЯ на протяжении жизни при наличии мутации в гене BRCA1 составляет 40–50%, а при наличии мутации BRCA2–20–30% [6].
Наиболее значимым фактором риска возникновения наследственного РЯ является отягощённый онкологический семейный анамнез. При наличии родственников первой и второй линии родства, имеющих в анамнезе РЯ, риск развития заболевания увеличивается в 3,6 и 2,9 раза соответственно [7]. Несмотря на то, что наследственный РЯ является давно изученной проблемой, и генетическое тестирование рекомендуется проходить всем женщинам с отягощённым семейным анамнезом, только 30% женщин в странах Европы и Соединённых Штатах Америки (США)
обращаются к генетикам [3]. В Российской Федерации (РФ) статистика по обращению к врачам-генетикам отсутствует, что может свидетельствовать о низкой частоте данного показателя.
Частота носительства BRCA1/2 мутаций в общей популяции составляет 1 случай на 300–800 человек, при этом распространённость различается в зависимости от популяции [8]. Исходя из этого, в практику врачей по всему миру широко вошёл термин «мутации основателя», под которым подразумеваются наиболее часто встречаемые мутации, которые характерны для определённой популяции в различных странах и регионах. В РФ по результатам многочисленных исследований была разработана диагностическая панель для выявления наследственной этиологии заболевания. На сегодняшний день методом ПЦР определяются 8 «горячих точек» — то есть наиболее часто встречаемые мутации в генах BRCA1/2 в российской популяции пациенток. В данную панель входят 7 мутаций в гене BRCA1 (c. 5266dup, c. 4035del, c. 1961del, c. 181T > G, c. 68_69del, c. 3756_3760del, c. 3700_3704del) и 1 мутация в гене BRCA2 (c. 5946del) [9]. С течением времени под воздействием различных факторов «мутации основателя» могут меняться в разных этнических группах, что в свою очередь требует пересмотра панели диагностируемых в популяции генов.
Несмотря на высокую эффективность ПЦР метода, около 50% мутаций не удаётся выявить при первичной диагностике, что связано с выявлением только наиболее часто встречаемых мутаций при помощи данного метода. При отрицательном результате ПЦР исследования следую-
Рисунок 1. Регионы РФ, в лечебных центрах которых проводилось исследование OVATAR.
щим методом молекулярно-генетического тестирования является секвенирование нового поколения (NGS), которое позволяет выявить все мутации в заданном списке генов. Описанный двухступенчатый подход к диагностике BRCA-ассоциированного РЯ до недавнего времени считался «золотым стандартом». Однако по мере уменьшения стоимости расширенных методов тестирования возрастает популярность метода NGS, что в свою очередь требует пересмотра алгоритма тестирования.
По результатам различных исследований BRCA-ассоциированный РЯ не обладает специфическими клиническими особенностями и чаще представлен низкодифференцированной аденокарциномой [8]. У женщин с наличием патогенных мутаций в генах BRCA1 или BRCA2 заболевание чаще диагностируется на распространённых стадиях. По мнению некоторых авторов результаты лекарственного лечения у данной категории пациенток оказались выше, а продолжительность жизни дольше по сравнению со спорадическими случаями заболевания [10–12].
Целью нашего исследования является определение доли BRCAm + пациенток с серозным и эндометриоидной раком яичников, брюшины и маточных труб в России. Также задачей нашего исследования является определение процентного соотношения герминальных и соматических мутаций, выявления спектра мутаций в генах BRCA1/2 в российской популяции пациенток, определение клинико-морфологических особенностей течения BRCA-ассоциирована РЯ и составление алгоритма молекулярногенетической диагностики на основе различных методов тестирования.
МАТЕРИАЛЫ И МЕТОДЫ
Наблюдательное неинтервеционное исследование OVATAR проводилось в период с 2014 по 2018 гг. и было направлено на оценку подходов к диагностике и лечению рака яичников в России. В исследование было включено 500 пациенток из 29 лечебных центров (рис. 1) с впервые выявленным серозным и эндометриоидным раком яичников, брюшины и фаллопиевых труб в возрасте от 18 лет. Определение мутаций в генах BRCA1/2 было проведено 496 пациенткам (99,2%). Методами диагностики мутации в крови в различных центрах являлись: аллель специфическая ПЦР, высокоразрешающее плавление (HRM), метод секвенирования по Сэнгеру. При расширенном генетическом тестировании использовались секвенирование нового поколения (NGS) и мультиплексная амплификация лигированных зондов (MLPA).
РЕЗУЛЬТАТЫ
По результатам исследования частота мутаций в генах BRCA1/2 в российской популяции пациенток оказалась высокой и составила 28,4% (n = 141/496) (схема 1). При этом частота встречаемости герминальных мутаций составила 23,5% (n =117/141), а соматических — 4,8% (n =24/141). Наиболее частыми методами определения распространённых мутаций были анализ кривых плавления с высоким разрешением (HRM-анализ, High Resolution Melting), аллель-специфическая ПЦР и секвенирование по Сэнгеру.
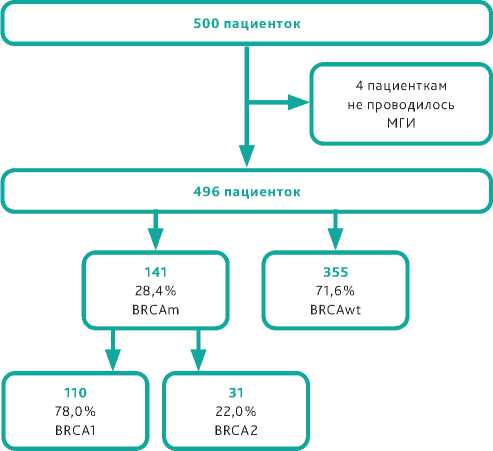
Схема 1. Частота мутаций в генах BRCA 1/2 в российской популяции пациенток.
Среди методов расширенного тестирования преобладал метод секвенирования нового поколения (NGS).
Мутации в гене BRCA1 выявлены в 78,0% (n = 110/141) случаев, в гене BRCA2-в 22,0% (n = 31/141) случаев.
Количество мутаций в гене BRCA1 при тестировании крови составило 84,5% (n = 93 / 110), при оценке опухолевой ткани — 77,3 % (n = 85/ 110), при этом в 61,1% слу- чаев (n = 68/110) мутации были выявлены как в крови, так и в ткани. Из 110 (100%) выявленных мутаций в гене BRCA1, 17 мутаций (15,5%) оказались соматическими.
Количество мутаций в гене BRCA2 при тестировании крови составило 48,4% (n = 15/31), при оценке опухолевой ткани — 90,3% (n = 28/31), при этом в 67,7% случаев (n = 21/31) мутации были выявлены как в крови, так и в ткани. Из 31 (100%) выявленных мутаций в гене BRCA2 семь мутаций (22,6%) оказались соматическими.
При анализе образцов крови и опухолевой ткани мутации в генах BRCA1/2 были обнаружены в 83% (n = 117 / 141) и в 80,1 % (n = 113 / 141) соответственно, частота мутаций как в крови, так и в ткани составила 63,1 % (n = 89/141).
Наиболее частыми мутациями в гене BRCA1 являлись c. 5266dup (n = 40 / 110), c. 4035del (n = 7 / 110), c. 1961del (n = 6 /110), c. 181T > G (n = 6 /110), c. 68_69del (n = 4 /110), c. 3756_3760del (n = 3/110). В гене BRCA2 самой частой мутацией оказалась c. 5286T > G (n = 4 / 31). Стоит отметить, что мутация c. 5946del (ген BRCA2), входящая в панель 8 «горячих точек», была определена только у одной пациентки. Таким образом, частые мутации в российской популяции были определены в 50% (диаграмма 1).
Медиана возраста пациенток с наличием мутаций в генах BRCA1 / 2 (n = 141) равнялась 53 годам (23–76). При анализе этнической принадлежности пациенток в РФ оказалось, что BRCA-ассоциированный РЯ наиболее часто встречался у русских (83,6%, n = 118/141), украинских (4,2%, n = 6/141) и татарских (3,5%, n = 5/141) женщин. Частота выявления BRCA-ассоциированного РЯ в зависи- c.5266dup 28 % c.4035del 6 % c.1961del 4 % c.181T>G 4 % c.68_69del 3 %
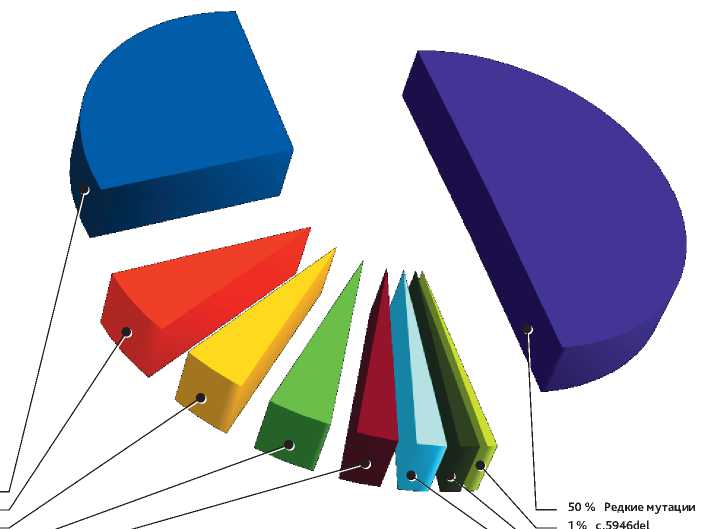
50 % Редкие мутации
Диаграмма 1. Частые и редкие мутации в генах BRCA 1/2 в российской популяции пациенток.

■ Тувинцы (n=2)
■ Осетины (n=2)
■ Казахи (n=1)
■ Татары (n=5)
■ Евреи (n=2)
■ Армяне (n=2)
■ Белорусы (n=1)
■ Украинцы (n=6) z Русские (n=118)
Диаграмма 2. Частота выявления BRCA-ассоциированного РЯ в России в зависимости от этнической принадлежности.
мости от этнической принадлежности представлена в диаграмме 2. Преобладание русских женщин в данном анализе может быть связано с географической локализацией лечебных центров, принявших участие в исследовании.
Отягощённый онкологический семейный анамнез был выявлен у 44% пациенток (n = 62/141) с мутациями в генах BRCA1/2 (диаграмма 3), при этом в популяции пациенток с диким типом мутации (n = 355) данный показатель составил 18,9% (n = 67/355) (р = 0,0001). Рак яичников был диагностирован у родственников 12 пациенток (19,4%, n = 12 / 62), из них большая часть (n = 9 / 12) имела родственников 1-й степени родства. Рак молочной железы (РМЖ) наблюдался в анамнезе у родственников 62,9% пациенток (n = 39 / 62): 1-я степень родства отмечалась у 21 пациентки, 2-я степень родства —у 13, 3-я степень родства —у 3. Стоит отметить, что РМЖ был диагностирован у 10 пациенток (26%, n = 10/39) и являлся частью их личного онкологического анамнеза. У 1 пациентки в роду был
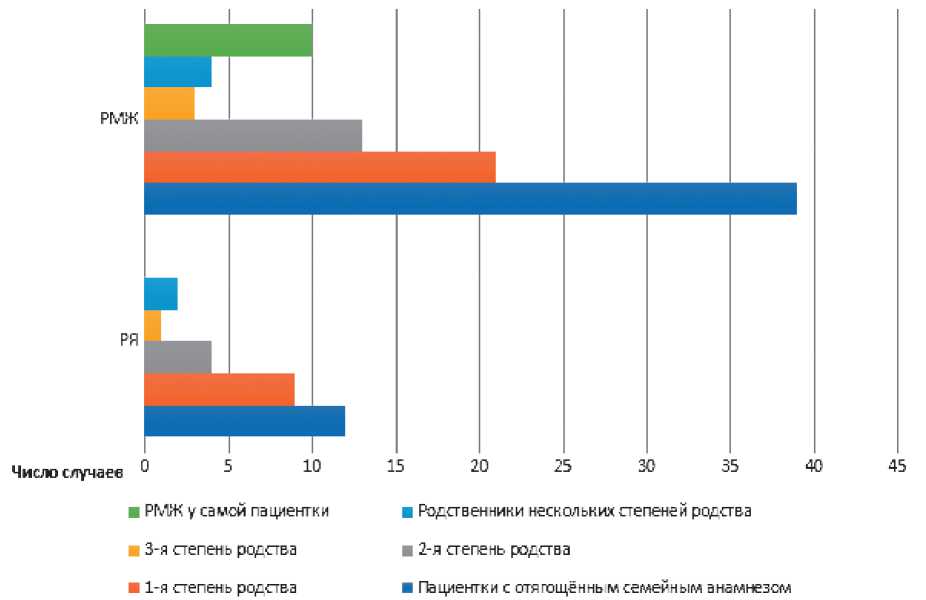
Диаграмма 3. Отягощённый онкологический семейный анамнез у пациенток с BRCA-ассоциированным РЯ.
Таблица 1. Распределение уровня CA125 в зависимости от стадии заболевания при BRCA-ассоциированном РЯ.
Больше половины случаев BRCA-ассоциированного рака яичников выявлено на поздних стадиях: стадия IIIC —
53,3% (n = 78 /141), стадия IV — 10,6% (n = 15/ 141). В 93,6% случаев (n = 132/141) опухоль локализировалась в яичниках, в 6,4% (n = 9/141) в маточных трубах. Гистологический тип опухоли был представлен серозной аденокарциномой в 94,3 % (n = 133 /141), эндометриоидной аденокарциномой — в 4,3% (n = 6/141), смешанной формой в 0,7% (n = 1/141), а также недифференцированным типом в 0,7% (n = 1/141). Высокая степень злокачественности в опухолевой ткани была обнаружена в 76,6% случаев (n = 108/141). Уровень маркера CA125 был определён у 114 пациентки (80,8%) и до начала лечения был повышен в 92,1 % случаев (n = 105 / 114), медиана составила 467,8 Ед / мл (7–19674) (табл. 1). Сравнительная характеристика пациенток в зависимости от наличия или отсутствия мутаций в генах BRCA1/2 представлена в таблице 2.
ОБСУЖДЕНИЕ
Частота встречаемости мутаций в генах BRCA1/2 при РЯ в российской популяции пациенток составила 28,4%, что несколько выше, чем средний показатель в международных исследованиях. Стоит отметить, что около 5% мутаций оказались соматическими. Данный показатель свидетельствует в пользу важности проведения расширенных методов тестирования не только в крови, но и в опухолевой ткани.
Бóльшая часть мутаций выявлена в гене BRCA1 (78%), что сопоставимо с данными современной литературы. Значительная часть мутаций в гене BRCA1 была выявлена при исследовании образцов крови, что может быть свя-
Таблица 2. Сравнительная характеристика пациенток в зависимости от наличия или отсутствия мутаций в генах BRCA1/2.
При изучении спектра мутаций в половине случаев мутации оказались частыми и входили в панель исследуемых генов методом ПЦР. Интересным представляется тот факт, что мутация c. 5946del в гене BRCA2, входящая в панель 8 «горячих точек», была выявлена только у 1 пациентки, что составило 0,71 % от всех мутаций в генах BRCA1/2. В свою очередь, мутация c. 5286T > G в гене BRCA2 была выявлена у 4 пациенток (2,8% от всех выявленных мутаций). Исходя из полученных данных, можно сделать вывод, что с течением времени спектр наиболее часто встречаемых в популяции мутаций может меняться. Следствием может стать пересмотр и коррекция диагностических панелей на основании современных данных по распространению мутаций среди населения. Альтернативным решением представляется переход на расширенные методы диагностики, минуя первичное звено диагностики методом ПЦР.
Также важной особенностью данного исследования является высокая частота пациенток, относящих себя к этнической принадлежности «русские». Описанное в анализе этническое распределение более вероятно связано с географической локализацией участвующих в исследовании лечебных центров, а также с неравным количеством пациенток в этих центрах. Данные характеристики в особенности влияют на панель выявленных мутаций. Другими словами, описанные мутации в бóльшей степени характерны для русских женщин, у которых панель ПЦР эффективна в 50% случаев.
В исследовании OVATAR большое внимание было уделено сбору семейного анамнеза. Оказалось, что отягощённый онкологический семейный анамнез был выявлен у 44% пациенток с мутациями в генах BRCA1/2, по сравнению с 18% пациенток с диким типом мутаций. Данный показатель оказался статистически значимым (р = 0,0001).
Из полученных данных можно сделать вывод, что отягощённый семейный онкологический анамнез является фактором риска развития РЯ. Кроме того, обращает на себя внимание высокий процент пациенток с отягощённым семейным анамнезом, но с отсутствием мутаций в генах BRCA1 / 2. Представленные данные могут свидетельствовать в пользу других генетических нарушений, которые могут увеличивать риск развития РЯ, например, нарушение в системе гомологичной рекомбинации.
Несмотря на высокий процент осведомлённости пациенток, а также здоровых носителей мутаций о наличии злокачественных новообразований у членов их семьи, женщины в РФ крайне редко обращаются к врачам-генетикам. Отсутствие популяризации важности генетического тестирования приводит к увеличению случаев заболевания. В связи с трудностями ранней диагностики и отсутствием скрининговых программ знание мутационного статуса может повысить уровень профилактики заболевания и снизить частоту выявления РЯ.
ЗАКЛЮЧЕНИЕ
Неинтервенционное исследование OVATAR позволило на большой выборке пациенток изучить актуальное количество и распределение мутаций в генах BRCA1 /2 в российской популяции пациенток при РЯ. Получены современные данные о распространённости как герминальных, так и соматических мутаций. Информация о спектре мутаций подтверждает важность применения используемых диагностических моделей, а также направляет практикующих врачей на создание новых алгоритмов диагностики заболевания. Доказанный наследственный фактор риска развития РЯ подтверждает большое значение своевременного генетического тестирования здоровых носителей с целью дальнейшей профилактики заболевания.
В связи с особенностями течения и появлением новых терапевтических методов BRCA-ассоциированный РЯ в настоящее время может быть условно выделен в отдельную подгруппу заболеваний.
ИНФОРМАЦИЯ ОБ АВТОРАХ
BRCA-ASSOCIATED OVARIAN CANCER IN THE RUSSIAN PATIENTPOPULATION. ANALYSIS OF THE NON-INTERVENTIONALSTUDY OVATAR
-
T . E. Tikhomirova¹, A. S. Tyulyandina1, 2, A. A. Rumyantsev¹, E. R. Israelyan¹, T. V. Kekeeva3, O. V. Vedro-va4, M. L. Filipenko5, L. N. Lyubchenko6, I. A. Demidova7, E. N. Imyanitov8, S. Y. Andreev4, S. V. Khokhlova9, V. V. Saevets10, G. B. Statsenko11, L. A. Kolomiets12, S. A. Tkachenko13, I. A. Koroleva14, A. S. Lisyanskaya15, O. A. Bakashvili16, L. I. Krikunova17, E. P. Solovieva18, D. M. Ponomarenko19, L. Y. Vladimirova20, S. E. Krasil-nikov21, V. B. Shirinkin22, D. D. Sakaeva23, E. A. Rumyantseva24, S. A. Emeliyanov25, D. L. Stroyakovskiy7, E. G. Novikova26, E. A. Ronina27, V. I. Vladimirov28, O. Y. Novikova29, L. S. Zagumennova30, V. V. Gorobtsova31, E. V. Cherepanova32, E. N. Pashkova33, V. M. Moiseyenko34, F. G. Ivanova35, D. P. Udovitsa36, V. V. Karaseva37, S. A. Tyulyandin¹
-
‘ N. N. Blokhin National Medical Research Center of Oncology, Moscow, Russia
-
" I. M. Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
-
‘ Research Centre for Medical Genetics, Moscow, Russia
-
4 AstraZeneca Pharmaceuticals, Moscow, Russia
-
5 Institute of Chemical Biology and Fundamental Medicine, Novosibirsk, Russia
-
6 National Medical Research Center of Radiology, Obninsk, Russia
-
7 Moscow City Oncological Hospital №. 62, Moscow, Russia
-
8 National Medical Research Center of Oncology named after N. N. Petrov, Saint Petersburg, Russia
-
9 National Medical Research Center of Obstetrics, Gynecology and Perinatology named after. Academician V.I. Kulakova10 Chelyabinsk Regional Clinical Center of Oncology and Nuclear Medicine, Chelyabinsk, Russia
-
11 Budgetary healthcare institution of the Omsk region “Clinical Oncology Dispensary”, Omsk, Russia
-
12 Research Institute of Oncology, Tomsk National Research Medical Center of the Russian Academy of Sciences, Tomsk, Russia
-
13 State Budgetary Healthcare Institution of the Kaluga Region "Kaluga Regional Clinical Oncology Dispensary"
-
14 Clinic "Reaviz", Samara, Russia
-
15 National Medical Research Center named after V. A. Almazov, St. Petersburg, Russia
-
16 Tver Regional Clinical Oncology Dispensary, Tver, Russia
-
17 Medical Radiological Research Center named after. A.F. Tsyba - branch of the Federal State Budgetary Institution "National Medical Research Center of Radiology" of the Ministry of Health of Russia, Obninsk, Russia
-
18 Arkhangelsk Clinical Oncology Dispensary, Arkhangelsk, Russia
-
19 Irkutsk Regional Oncology Center, Irkutsk, Russia
-
20 Rostov Research Oncology Institute, Ministry of Health of Russia, Rostov-on-Don, Russia
-
21 National Medical Research Center named after Academician E.N. Meshalkin Ministry of Health of Russia, Novosibirsk, Russia
-
22 Orenburg Regional Clinical Oncology Dispensary, Orenburg, Russia
-
23 Clinical Hospital "Mother and Child", Ufa, Russia
-
24 Regional Clinical Oncology Dispensary, Vladimir, Russia
-
25 Republican Clinical Oncology Dispensary named after. S. G. Primushko Ministry of Health of the Udmurt Republic, Izhevsk, Russia
-
26 Moscow Research Oncology Institute named after P.A. Herzen - branch of the Federal State Budgetary Institution "National Medical Research Center of Radiology" of the Ministry of Health of Russia, Moscow, Russia
-
27 Research Institute of Urology and Interventional Radiology named after N.A. Lopatkina – branch of the Federal State Budgetary Institution “National Medical Research Center of Radiology” of the Ministry of Health of Russia, Moscow, Russia
-
28 Pyatigorsk Interdistrict Oncology Center, Pyatigorsk, Russia
-
29 Regional Clinical Oncology Center of the Ministry of Health of the Khabarovsk Territory, Khabarovsk, Russia
-
30 Perm Regional Oncology Dispensary, Perm, Russia
-
31 Rostov Regional Oncology dispensary, Rostov-on-Don, Russia
-
32 Moscow Regional Oncology Dispensary, Balashikha, Russia
-
33 Sverdlovsk Regional Oncology Center, Ekaterinburg, Russia
-
34 St. Petersburg Clinical Scientific and Practical Center for Specialized Types of Medical Care (Oncology) named after N.P. Napalkova, St. Petersburg, Russia
-
35 Yakut Republican Oncology Dispensary, Yakutsk, Russia
-
36 Oncological dispensary No. 2 of the Ministry of Health of the Krasnodar Territory, Sochi, Russia
-
37 Russian Society of Clinical Oncology, Moscow, Russia
Purpose: To evaluate the proportion of BRCA1 / 2 mutations in patients with serous and endometrioid cancer of the ovary, fallopian tube, and peritoneum in Russia, to evaluate the percentage of germinal and somatic mutations, to identify the spectrum of mutations in BRCA1 / 2 genes, to evaluate clinical and morphological features of the BRCA-associated ovarian cancer (OC).
Patients and methods: The study enrolled patients of 18 years and older with newly diagnosed serous and endometrioid cancer of the ovary, fallopian tube, and peritoneum. Biological material (blood, tumor tissue) was collected, followed by molecular genetic analysis. The method of mutations detecting in the blood were: allele-specific PCR, high-resolution melting (HRM), Sanger sequencing method. Advanced genetic testing included the use of generation sequencing (NGS) and multiplex amplification of ligated probes (MLPA). The collection of clinical data, family history, clinical and morphological characteristics of the tumor was performed.
Results: 500 patients were included in the study, the evaluation of BRCA1 / 2 mutations was performed in 496 patients (99,2 %). The frequency of BRCA1 / 2 mutations in the Russian patient population was 28,4 % (n = 141 / 496). The incidence of germinal mutations was 23,5 % (n = 117 / 141), and somatic — 4,8 % (n = 24 / 141). Frequent mutations in the Russian population were identified in 50 % of cases. When analyzing the ethnicity of patients in the Russian Federation BRCA-associated OC was most common in Russian (83,6 %, n = 118 / 141), Ukrainian (4,2 %, n = 6 / 141) and Tatar (3,5 %, n = 5 / 141) women. A family history of cancer was detected in 44 % of patients (n = 62 / 141) with BRCA1 / 2 mutations.
Conclusions: Due to the high frequency of germinal and somatic BRCA1 / 2 mutations in the Russian patients it is recommended to conduct the advanced testing methods not only in blood samples but also in tumor tissue.
Список литературы Brca-ассоциированный рак яичников в российской популяции пациенток. Анализ неинтервенционного исследования OVATAR
- International Agency for Research on Cancer Global Cancer Observatory : Cancer Today. [(accessed on 5 June 2022)] ; Available online: https://gco.iarc.fr/today/online-analysis-table [Ref list].
- American Cancer Society Key Statistics for Ovarian Cancer. [(accessed on 5 June 2022)]. Available online: https://www.cancer.org/cancer/ovarian-cancer/about/key-statistics.html [Ref list].
- Ghose A, Bolina A, Mahajan I, Raza SA, Clarke M, Pal A, et al. Hereditary Ovarian Cancer : Towards a Cost-Effective Prevention Strategy. Int J Environ Res Public Health. 2022 Sep 23 ; 19 (19) : 12057. https://doi.org/10.3390/ijerph191912057. PMID : 36231355 ; PMCID : PMC9565024.
- Hinchcliff E.M., Bednar E., Lu K.H., Rauh-Hain J.A. Disparities in gynecologic cancer genetics evaluation. Gynecol. Oncol. 2019 ; 153 : 184-191. https://doi.org/10.1016/j.ygyno.2019.01.024.
- Kanchi K.L., Johnson K.J., Lu C., McLellan M.D., Leiserson M.D.M., Wendl M.C., et al. Integrated analysis of germline and somatic variants in ovarian cancer. Nat. Commun. 2014 ; 5 : 3156. https://doi.org/10.1038/ncomms4156.
- Biglia N., Sgandurra P., Bounous V.E., Maggiorotto F., Piva E., Pivetta E., et al. Ovarian cancer in BRCA1 and BRCA2 gene mutation carriers : Analysis of prognostic factors and survival. Ecancermedicalscience. 2016 ; 10 : 639. https://doi.org/10.3332/ecancer.2016.639.
- Hunn J., Rodriguez G.C. Ovarian cancer : Etiology, risk factors, and epidemiology. Clin. Obstet. Gynecol. 2012 ; 55 : 3-23. https://doi.org/10.1097/GRF.0b013e31824b4611.
- Andrews L, Mutch DG. Hereditary Ovarian Cancer and Risk Reduction. Best Pract Res Clin Obstet Gynaecol. 2017 May ; 41 : 31-48. https://doi.org/10.1016/j.bpobgyn.2016.10.017. Epub 2017 Jan 17. PMID : 28254144.
- Любченко Л. Н., Батенева Е. И. Медико-генетическое консультирование и ДНК-диагностика при наследственной предрасположенности к раку молочной железы и раку яичников .- м. : иг РОНЦ, 2014.
- Alsop K, Fereday S, Meldrum C, deFazio A, Emmanuel C, George J, et al. BRCA mutation frequency and patterns of treatment response in BRCA mutation-positive women with ovarian cancer : a report from the Australian Ovarian Cancer Study Group. [Erratum appears in J Clin Oncol. 2012 Nov 20 ; 30 (33) : 4180]. Journal of Clinical Oncology 2012.30 (21) : 2654-63.
- Bolton KL, Chenevix-Trench G, Goh C, Sadetzki S, Ramus SJ, Karlan BY, et al. Association between BRCA1 and BRCA2 mutations and survival in women with invasive epithelial ovarian cancer. JAMA 2012.307 (4) : 382-90.
- Patch AM, Christie EL, Etemadmoghadam D, Garsed DW, George J, Fereday S, et al. Wholegenome characterization of chemoresistant ovarian cancer. Nature 2015.521 (7553) : 489-94.


