Бронхиальная астма и хроническая обструктивная болезнь лёгких: диагностические возможности в практике врача
Автор: Михайловичева А. И., Смирнов В. В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 т.14, 2024 года.
Бесплатный доступ
В статье рассматриваются возможности функциональной диагностики респираторной функции лёгких у пациентов с бронхиальной астмой и хронической обструктивной болезнью лёгких. Такие функциональные методы диагностики, как капнометрия, спирометрия, оценка диффузионной способности лёгких и вымывание азота при множественном дыхании, могут использоваться не только для оценки дисфункции дыхательных путей, но и для наблюдения за течением заболевания. Необходимо дальнейшее развитие методов по изучению респираторной функции лёгких и, по возможности, их внедрение в повседневную клиническую практику. Целью данного обзора явились возможности диагностических тестов для оценки вентиляционной и газообменной функции лёгких у пациентов с бронхиальной астмой и хронической обструктивной болезнью лёгких.
Капнометрия, спирометрия, функциональная диагностика, вымывание азота, диффузионная способность лёгких, бронхиальная астма, хроническая обструктивная болезнь лёгких
Короткий адрес: https://sciup.org/143182254
IDR: 143182254 | УДК: 616.248+616.24-008.4 | DOI: 10.20340/vmi-rvz.2024.1.CLIN.6
Текст обзорной статьи Бронхиальная астма и хроническая обструктивная болезнь лёгких: диагностические возможности в практике врача
Бронхиальная астма (БА) является гетерогенным заболеванием, характеризующимся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируют по времени и интенсивности и проявляются вместе с вариабельной обструкцией дыхательных путей [1]. Бронхиальная астма является наиболее распространённым хроническим заболеванием лёгких среди людей во всем мире. Это одно из наиболее часто встречающихся респираторных заболеваний, характеризующееся полной или значительной обратимой обструкцией дыхательных путей.
Известно, что астма - это гетерогенное воспалительное заболевание дыхательных путей, от которого страдают до 300 миллионов человек по всему миру [2]. Приступы часто вызываются эмоциями, пылью и/или воздействием аллергенов, а также физическими нагрузками [2-4]. Помимо этих респираторных симптомов, пациенты часто жалуются на пониженную способность к выполнению физической нагрузки, одышку при физической нагрузке, утомляемость и ограничение активности [2, 3, 5], проявления которых связаны с ухудшением качества жизни и часто указывают на пациентов с более тяжёлым или неконтролируемым течением заболевания [6].
Основное лечение астмы включает в себя брон-ходилататоры и кортикостероиды. Однако из-за атипичных клинических проявлений часто ошибочно диагностируют бронхит и назначают неадекватное лечение, что может привести к постепенному снижению функции и снижению физической активности [7].
Вторым значимым заболеванием лёгких наравне с БА является хроническая обструктивная болезнь лёгких (ХОБЛ). ХОБЛ вызывается воздействием вдыхаемых вредных частиц, особенно табачного дыма и загрязняющих веществ. В последнее время всё чаще признается широкий спектр факторов, повышающих риск развития и прогрессирования ХОБЛ на протяжении всей жизни.
Традиционно считалось, что причиной хронической обструктивной болезни лёгких является курение табака. Тем не менее, признание важности факторов риска ХОБЛ, связанных с отсутствием курения, возросло за последнее десятилетие благодаря полученным данным о факторах риска и клинических проявлениях ХОБЛ у никогда не куривших. Около половины всех случаев ХОБЛ во всем мире сопряжено с факторами риска, не связанными с употреблением табака, которые могут различаться от географического расположения. Эти факторы включают загрязнение воздуха, профессиональные воздействия, плохо контролируемую астму, табач- ный дым в окружающей среде, инфекционные заболевания и низкий социально-экономический статус. Нарушение развития и формирования лёгких в детском возрасте, вызванное рядом воздействий неблагоприятных условий, связано с повышенным риском ХОБЛ. Потенциальные механизмы патогенеза ХОБЛ у никогда не курящих включают воспаление, окислительный стресс, ремоделирование дыхательных путей и ускоренное старение лёгких. По сравнению с курильщиками, у которых развивается ХОБЛ, никогда не курившие с ХОБЛ имеют относительно лёгкие хронические респираторные симптомы, небольшую эмфизему или её отсутствие, более лёгкое ограничение воздушного потока и меньшее количество сопутствующих заболеваний; однако обострения заболеваний могут быть частыми [8].
Таким образом целью данного обзора явились возможности диагностических тестов для оценки вентиляционной и газообменной функции лёгких у пациентов с бронхиальной астмой и хронической обструктивной бользнью лёгких.
Спирометрия, как основной метод диагностики патологии верхних дыхательных путей
Основным доказанным параметром при диагностических исследованиях является соотношение объёма форсированного выдоха за 1 с (ОФВ1) и форсированной жизненной емкости лёгких (ФЖЕЛ) -ОФВ1/ФЖЕЛ<0,70 [9], но ОФВ1 отражает преимущественно дисфункцию крупных дыхательных путей и может пропустить активное поражение мелких (диаметром менее 2 мм) дыхательных путей. В дальнейшем это может привести рано или поздно к диагнозу, когда структурные изменения в лёгком могут быть необратимым. В любом случае возможности ранней терапии или вторичная профилактика (включая прекращение курения) могут снизить прогресс заболевания [10, 11], что подчеркивает потребность в выявлении ранних маркеров данного заболевания [12]. У пожилых пациентов может наблюдаться обратное, когда ОФВ1/ФЖЕЛ<0,70 используется в качестве диагностического критерия, что приводит гипердиагностике и ненужному лечению. Ещё одной проблемой является стратификация. ОФВ1 остается основным средством классификации тяжести ХОБЛ и является прогностическим параметром смертельных исходов на популяционном уровне. Однако его корреляция с симптомами и ключевыми клиническими исходами не всегда отражает способность спирометрии зафиксировать или адекватно различить гетерогенные фоновые патологии, например, бронхит, эмфизему лёгких или прогрессирование бронхиальной астмы. Наконец, в настоящее время широко признано, что фиксированная обструкция дыхательных путей в более позднем взрослом возрасте может быть результатом снижения функции лёгких [13].
Кроме этого, важной, но недооцененной особенностью астмы является несоответствие между показателями функции лёгких и клиническими маркерами контроля заболевания, включая симптомы, частоту обострений и ответ на лечение. Исходный ОФВ1, например, плохо коррелирует с тяжестью симптомов и качеством жизни, а также может быть отделён от маркеров воспаления дыхательных путей, что, возможно, отражает низкую чувствительность спирометрии при патологии в мелких дыхательных путях.
Таким образом, точная диагностика и своевременное лечение важны для пациентов с этими бронхолёгочными заболеваниями.
Как было описано выше, для подтверждения диагноза требуется проведение спирометрии. Тем не менее, спирометрия является тестом, требующим адекватного сотрудничества со стороны пациента. Исследование функции лёгких с помощью спирометра считается золотым стандартом для оценки астмы и хронической обструктивной болезни лёгких [14, 15]. Два важных значения, измеряемых спирометром: значение объема форсированного выдоха за 1 с (ОФВ1) и отношение ОФВ1 к форсированной жизненной емкости лёгких (ФЖЕЛ) используются для оценки тяжести обструкции дыхательных путей. Измеренные ОФВ1 и ФЖЕЛ нормализуются по прогнозируемым значениям ОФВ1 и ФЖЕЛ, которые зависят от возраста, роста, пола и этнических особенностей исследуемого, следовательно, обозначаются как процент прогнозируемых ОФВ1 (%ОФВ1) и ФЖЕЛ [16].
Спирометрия используется для диагностики гиперреактивности дыхательных путей. Однако спирометрия требует громоздкого оборудования, сотрудничества с пациентом и опыта технического персонала, вследствие этого постоянно ведётся поиск методов оценки функции лёгких, не зависящих от качества сотрудничества с пациентом и снижающих вариабельность повторных тестов. Одним из таких методов является капнометрия.
Капнометрия как метод диагностики лёгочной патологии
Капнометрия представляет собой графическое отображение концентрации СО 2 (рис. 1). Концентрацию CO 2 часто измеряют у интубированных пациентов для подтверждения положения интубационной трубки, а также для оценки вентиляции пациента [17–19]. Капнометрия также может быть измерена у неинтубированных пациентов с помощью капнометрии бокового потока; пока пациент дышит в канюлю, выдыхаемый воздух отбирается и передается через длинную трубку на обработку.
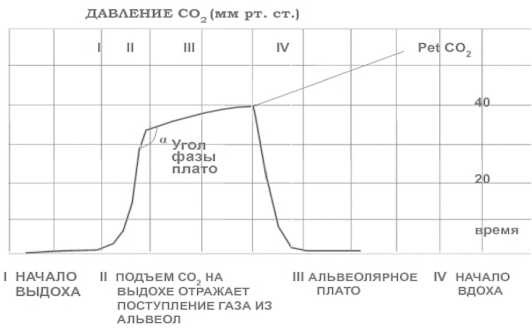
Рисунок 1. Нормальная капнограмма [17]
Figure 1. Normal capnogram [17]
Несмотря на то, что капнометрия в настоящее время используется для мониторинга частоты дыхания, кривая CO 2 также содержит важную информацию о физиологических характеристиках дыхательной системы. Несколько исследований, в которых изучалось различное использование формы волны капнометрии, показали корреляцию между формой волны капнографической кривой и несоответствием вентиляции/перфузии, диаметром дыхательных путей и уровнем обструкции дыхательных путей.
Фаза I отражает вентиляцию мертвого пространства.
Фаза II отражает поступление газа из респираторных бронхиол и альвеол. В этих отделах дыхательной системы происходит газовая диффузия кислорода и СО 2 ; следовательно, концентрация CO 2 в форме волны возрастает.
Фаза III отражает альвеолярное плато, поступление газа, богатого СО 2 , из альвеол. Конец альвеолярного плато представляет собой конец выдоха CO 2 (EtCO 2 ) и начало вдоха вниз.
Хотя в настоящий момент отсутствуют клинические рекомендации относительно проведения данного метода, тем не менее есть большое количество отечественной и зарубежной литературы, где подробно описывается данный метод диагностики [20].
Из последних интересных исследований метода капнометрии была научная работа группы учёных из Израиля, целью которой являлась разработка модели прогнозирования на основе капнометрии, которая будет использоваться в качестве инструмента для оценки уровня обструкции дыхательных путей у пациентов с астмой и ХОБЛ. Был разработан автоматизированный метод оценки ОФВ1 у пациентов с астмой и ХОБЛ, основанный на кривых капнометрии. Достигнута хорошая корреляция между результатами модели и фактическим % ОФВ1. Кроме того, использование демографических характери- стик, таких как возраст, пол и рост, предоставило дополнительную информацию и улучшило прогнозирование и эффективность модели. Кроме этого, несколько предыдущих исследований показали корреляцию между формой волны CO2 и наличием, тяжестью обструктивного заболевания. Резюмируя результаты исследования можно сказать, что эта модель имеет несколько практических медицинских применений. Во-первых, оценку капнометрии можно проводить, не полагаясь на сотрудничество с пациентом. Во-вторых, требуемым оборудованием являются назальная канюля и совместимый мониторинг, в отличие от спирометрии, для которой требуется более громоздкое оборудование и опытный техник. Более того, поскольку результаты не зависят от сотрудничества с пациентом, они будут повторяемыми, и ими нельзя будет манипулировать. В-третьих, эта прогностическая модель позволяет вести непрерывный мониторинг и, таким образом, внимательно следить за госпитализированными пациентами с тяжелым обострением, что, возможно, позволит сократить сроки госпитализации и раннее выявление ухудшения состояния пациентов. Таким образом в этом исследовании разработали модель для оценки ОФВ1 у пациентов с астмой и ХОБЛ. Используя данную модель в качестве инструмента для оказания медицинской помощи, можно оценить уровень обструкции дыхательных путей, не полагаясь на сотрудничество пациента. Кроме того, непрерывный мониторинг ОФВ1 может выявить колебания заболевания, реакцию на лечение и скорректировать терапию [21].
Ещё одним примером из недавнего применения метода капнометрии было исследования учёных из Китая, которое являлось двойным слепым поперечным исследованием. Обследовали пациентов с хроническим кашлем и наличием астмы, а также без неё. Определяли количественные изменения и диагностическое значение капнометрии у пациентов с кашлевым вариантом бронхиальной астмы. В результате выявлено, что динамические изменения мертвого пространства дыхательных путей были более значимы у пациентов с кашлевым вариантом астмы по сравнению с пациентами с наличием хронического кашля. Параметры капнометрии, такие как наклон фазы III и соотношение наклона фазы III и фазы II, могут быть использованы для диагностики кашлевого варианта астмы [22].
Таким образом использование капнометрии имеет большие перспективы для исследований у пациентов с бронхолёгочной патологией, что может увеличивать процент выявления скрытой патологии, а это, в свою очередь, улучшать диагностику заболеваний.
Диффузионная способность лёгких
Прошло более 100 лет с тех пор, как Мари Крог разработала метод измерения поглощения монооксида углерода в лёгких методом одиночного вдоха [23]. Её эксперимент был разработан, чтобы показать, что пассивная диффузия может объяснить перенос кислорода из альвеолярного газа в лёгочную капиллярную кровь, но в последствии этот эксперимент стал основой теста, который сейчас широко используется повсеместно; в Северной Америке перенос называется диффузионной способностью лёгких, а в Европе более корректно – трансфер фактором. Аббревиатура коэффициента переноса или диффузионной способности лёгких для монооксида углерода — DLCO, хотя термин TLCO является столь же допустимым. Стандартизированный клинический метод определения диффузионной способности лёгких по монооксиду углерода был описан Ogilvie и соавт. [24] в 1957 г. с использованием индикаторного газа для определения как альвеолярного объёма, так и альвеолярной концентрации монооксида углерода в начале задержки дыхания. Способность лёгкого к газообмену через альвеолярно-капиллярную границу определяется его структурными и функциональными свойствами [25].
К структурным свойствам относятся следующие: объем лёгочного газа; длина пути для диффузии в газовой фазе; толщина и площадь альвеолярнокапиллярной мембраны; любые последствия закрытия дыхательных путей; объём гемоглобина (Hb) в капиллярах, снабжающих вентилируемые альвеолы. К функциональным свойствам относятся: абсолютные уровни вентиляции и перфузии; равномерность распределения вентиляции относительно распределения перфузии; состав альвеолярного газа; диффузионные характеристики мембраны; концентрация и связывающие свойства Hb в альвеолярных капиллярах; напряжение оксида углерода и кислорода в альвеолярных капиллярах в той части лёгочного сосудистого русла, которая обменивается газом с альвеолами.
Процесс переноса оксида углерода из окружающей среды в лёгочную капиллярную кровь включает шесть стадий: 1) объёмная доставка оксида углерода в дыхательные пути и альвеолярные пространства; 2) перемешивание и диффузия оксида углерода в альвеолярных ходах, воздушных мешочках и альвеолах; 3) перенос оксида углерода через газожидкостную поверхность альвеолярной мембраны; 4) смешение и диффузия оксида углерода в лёгочной паренхиме и альвеолярно-капиллярной плазме; 5) диффузия через мембрану эритроцита и внутрь эритроцита; 6) химическая реакция с составляющими крови Hb.
Процесс поглощения моноксида углерода можно упростить до двух передаточных свойств: 1) мембранная проводимость (DM), отражающая диффузионные свойства альвеолярно-капиллярной мембраны и 2) связывание монооксида углерода и Hb [25, 26].
Так как процесс дыхания состоит из нескольких этапов, при этом газообмен через альвеолярнокапиллярную мембрану является ключевым моментом для обеспечения тканевого метаболизма, исследование диффузионной способности лёгких – это один из наиболее важных и часто используемых в клинической практике тестов. Но оценка транспорта кислорода через альвеолярно-капиллярную мембрану технически крайне трудна. Это обусловлено тем, что в венозной крови определяются достаточно большие концентрации кислорода и углекислого газа. В свою очередь, оценка переноса оксида углерода (DLCO) гораздо легче и при этом точно отражает транспорт кислорода, поскольку сродство гемоглобина к СО в 210 раз выше, чем к кислороду, концентрация СО в венозной крови ничтожна, а его захват в меньшей степени зависит от сердечного выброса [27]. Существует несколько методик определения диффузионной способности лёгких. Метод однократного вдоха с задержкой дыхания является наиболее предпочтительным тестом, рекомендуемым Американским торакальным обществом (ATS) и Европейским респираторным обществом (ERS) [28].
Учитывая такую заинтересованность и относительную доступность метода в специализированных клинических центрах, в последнее время большое количество исследователей изучали диффузионную способность лёгких у пациентов с бронхообструктивными заболеваниями. Одним из последних таких исследований было ретроспективное исследование случай-контроль у пациентов с БА, проведённое учёными из Южной Кореи. Была изучена диффузионная способность в результате поражения лёгких, связанного с дезинфицирующим средством, которое в последствии может представлять собой тяжелую форму токсического ингаляционное поражения лёгочной паренхимы, обнаруженное у жителей Южной Кореи из-за воздействие определенных соединений на основе гуанидина, присутствующих в дезинфицирующих средствах (ДС). В этом исследовании диффузионную способность лёгких по монооксиду углерода (DLCO) изучали у людей с ассоциированной БА и сравнивали с уже существующей астмой без воздействия ДС. Ретроспективно сравнили данные, включая значения DLCO, 70 пациентов с HDA с 79 пациентами с ранее существовавшей астмой без какого-либо известного воздействия. Был проведён множественный линейный регресси- онный анализ и логистический регрессионный анализ, чтобы подтвердить связь между воздействием ДС и DLCO. Корреляция между DLCO и несколькими показателями, связанными с воздействием ДС, была оценена у пациентов с БА, ассоциированной с ДС. Результат: среднее значение DLCO было значительно ниже в группе с БА, ассоциированной с ДС, чем в контрольной группе (81,9% против 88,6%; р = 0,021). Среднее значение DLCO у пациентов с астмой с определённым воздействием ДС был значительно ниже, чем у пациентов с астмой с меньшим воздействием (p = 0,002). Анализ показал, что воздействие ДС напрямую влияет на значения DLCO и косвенно влияет на её измерение через снижение форсированной жизненной емкости лёгких. Корреляционный анализ указал на значительную обратную корреляцию между DLCO% и накопительным временным воздействием ДС. Резюмируя вышеизложенное, можно сделать вывод, что DLCO была ниже у пациентов с ассоциированной БА, чем у больных астмой без воздействия ДС; снижение ФЖЕЛ частично опосредовало этот эффект. Таким образом, мониторинг DLCO может быть полезен для ранней диагностики БА у пациентов с симптомами астмы и анамнезом различных токсических воздействий [29].
Известно, что Глобальная инициатива по обструктивным заболеваниям лёгких (GOLD) не продвигает значения диффузионной способности монооксида углерода (DLCO) при оценке ХОБЛ. Клиническое и прогностическое влияние низкого значения DLCO было исследовано у пациентов с ХОБЛ 1 стадии по данным спирометрии. Этот вопрос заинтересовал группу испанских учёных, они решили проследить взаимосвязь между значением DLCO<60% и повышенным риском смерти с различной клинической картиной у этих пациентов. В исследование вошли 360 пациентов со сроком наблюдения 109±50 месяцев. Учитывались возраст, пол, длительность ХОБЛ в анамнезе, одышка, измерения ФВД, переносимость физической нагрузки и история обострений. А пороговое значение DLCO было определено для смертности от всех причин, а клинические и физиологические характеристики пациентов выше и ниже порога в сравнении. По результатам исследования ученые сделали вывод, что у пациентов с ХОБЛ по шкале GOLD I DLCO<60% от должного связано с повышенным риском смерти и ухудшением клинической картины. Каковы причины этой ассоциации и можно ли их лечить – остаётся открытым вопросом [30].
Исследования, оценивающие DLCO как предиктор смертности противоречивы, а результаты зависят от степени ограничения воздушного потока и эмфиземы [31]. Некоторые небольшие исследова- ния предполагают связь между снижением значения трансфер-фактора и частых обострений [32]. Хотя DLCO даёт представление о физиологии дыхания сверх того, что может показать спирометрия, имеется мало информации о клинической значимости DLCO для прогнозирования результатов независимо от спирометрии, это даёт идеальную возможность проанализировать взаимосвязь между DLCO и заболеваемостью ХОБЛ независимо от ОФВ1 и количественных показателей КТ. Это и явилось целью одного из последних исследований диффузионной способности лёгких у пациентов с ХОБЛ. В исследовании приняли участие 1806 респондентов с ХОБЛ, были проанализированы 5-летние визиты, включая исследование ФВД, качество жизни, симптомы, работоспособность и частота обострений. После обработки результатов тяжёлая степень только DLCO или только ОФВ1, или обоих показателей DLCO и ОФВ1, были связаны с значительным ухудшением заболеваемости по сравнению с контрольной группой (p < 0,05 для всех исходов).
Метод вымывания азота при множественном дыхании
Для более полной оценки лёгочной функции, помимо исследования газообмена, является оценка неравномерности лёгочной вентиляции. Её можно определить методами вымывания азота как при одиночном вдохе кислорода, так и при множественном дыхании (МД). Техника была разработана более 60 лет назад, но не была широко распространена в течение многих десятилетий. Технические усовершенствования, простые протоколы и более высокая чувствительность, по сравнению со стандартными тестами функции лёгких, в некоторых группах заболеваний привели к недавнему возрождению интереса к методу вымывания азота при множественном дыхании (ВМД). Индекс лёгочного клиренса (LCI) является общепринятым показателем, полученным из тестов. ВМД дополняет полученную информацию о лёгочной патологии после проведения обычных лёгочных функциональных тестов, таких как спирометрия. LCI измеряет общую степень неоднородности лёгочной вентиляции. Существуют и другие производные от ВМД параметры, которые описывают более региональную вентиляцию дыхательных путей и получают конкретную информацию альвеолярной неоднородности вентиляции. Как это конкретное распределение вентиляции точно связано к различными патологическими процессам – до конца ещё не изучено. Измерения ВМД выполняются во время спокойного дыхания, что делает эту технику привлекательной для маленьких детей. На протяжении десятилетий традиционная спирометрия была стандартным методом оценки степени обструкции дыхательных путей при большинстве хронических заболеваний лёгких. Однако появляется всё больше свидетельств того, что спирометрия нечувствительна для оценки поражения периферических дыхательных путей и для оценки распределения вентиляции. Это привело к повышенному интересу к методам разбавления газа, особенно к методу ВМД для оценки функции мелких дыхательных путей, т.е. эффективное, однородное распределение вентиляции. ВМД был впервые описан более 60 лет назад Уордом. С. Фаулером [33]. В своей новаторской работе 1952 года он сравнил клиренс азота между здоровыми лицами и пациентами с сердечно-лёгочными заболеваниями для оценки степени неравномерного лёгочной вентиляции [33]. Однако эта техника мало ценилась до тех пор, пока газовые анализаторы и компьютерное оснащение не получили дальнейшее развитие для улучшения автоматизированного анализа газовых и объёмных сигналов при измерениях. Сегодня интерес к проведению этого метода возвращается к своим истокам.
Основная функция лёгких человека заключается в однородном вентилировании лёгких, обеспечивая эффективный газообмен. Во время развития лёгких плода, они растут от проксимальных к дистальным отделам с непрерывным разделением дыхательных путей, которые позднее формируют уникальную структуру бронхиального дерева. Бронхиальное дерево состоит в среднем из 23 бронхиальных генераций, но газообмен происходит только в последних 9 поколениях. Бронхиальное дерево представляет собой самоподобную так называемую фрактальную структуру, обеспечивающую эффективный транспорт газов. Нормальное распределение вентиляции происходит за счёт проводимости и диффузия. В настоящее время известны три основных механизма вентиляционной неоднородности: 1) конвекционно-зависимый; неоднородность в зоне проводящих дыхательных путей (более проксимальные дыхательные пути); 2) неоднородность, связанная с ограничением диффузии в диффузионно-зависимой зоне дыхательных путей (дистальные дыхательные пути, ацинусы); 3) взаимодействие между проводимостью и диффузией в промежуточной зоне на уровне диффузионно-конвективного фронта, которая предположительно возникает на входе в ацинус [34]. Альвеолярный отдел разделён тонким слоем ткани из капиллярной сети и образует большую поверхность для эффективного газообмена кислорода и углекислого газа.
Помимо самого аппарата, в тесте ВМД требуется только правильно выбранная лицевая маска или мундштук и спокойное дыхание, что делает этот ме- тод применимым во всех возрастных группах, даже в младенчестве. У детей старшего возраста и взрослых измерения обычно выполняется в положении сидя с мундштуком и носовым зажимом. Поскольку время для трёхкратного тестирования может быть ограничено из-за занятости в амбулаторных клиниках или из-за кинических особенностей заболевания у пациентов с прогрессирующим поражением лёгких, то были предложены перспективные сокращённые протоколы.
Существуют два разных способа выполнения ВМД в зависимости от газа, используемого для теста:
-
1. При инертном постороннем газе (4% гексафторида серы; 20% гелия) газовая смесь вдыхается до тех пор, пока достигается равновесие; фаза вымывания (вдыхание комнатного воздуха) начинается с этой точки равновесия.
-
2. Для инертного собственного газа (азота) формальная промывка не требуется. Для вымывания дыхательных путей азотом обычно используют 100% кислород. Независимо от используемого газа вымывание прекращается, когда тестовый газ достигает 1/40 (или 2,5% от начального пускового концентрация установлена на 100%) от начальной концентрации газа [34].
По результатам теста МВД анализируются три основных параметра: функциональная остаточная ёмкость (ФОЕ или FRC), LCI и коэффициенты моментов (MR). ФОЕ – объём воздуха, находящегося в лёгких после спокойного выдоха в вентилируемых отделах лёгких; LCI и MR являются показателями глобальной вентиляционной неоднородности. LCI это объёмный коэффициент, CEV включает все газовые фракции: LCI = CEV/FRC. Можно сделать предположение, что повышенная неоднородность вентиляции привела бы к большему количеству дыхательных циклов (большому числу дыхательных движений). МR также позволяет количественно оценить неоднородность вентиляции, но обычно используются в меньшей степени. Преимущество MR перед LCI заключается в том, что они могут быть взвешены для определённых частей изгиба вымывания.
В настоящее время имеется не менее трёх приборов, сильно различающихся по используемым инертным газам, газоанализаторам, алгоритмам анализа и возрастным группам, для которых рекомендуется данное тестирование. Выбор собственного газа (азота) для ВМД имеет преимущество в том, что кислород, необходимый для вымывания, широко доступен. Ещё одним преимуществом является то, что азот присутствует во всех отделах лёгкого, и, следовательно, этот газ обладает большей чувствительностью к обнаружению аномалий по сравнению с посторонними газами. Калибровка комнатным воздухом (без использования плотного мундштука) делает его применение намного проще.
Нормативный параметр для LCI у здоровых лиц при использовании метода ВМД с зависимыми показателями от возраста испытуемых и факторов (газ, оборудование, мёртвое пространство, программное обеспечение) составляет обычно значение ниже 8,5. Однако нормативные данные по измерению ВМД в разных возрастных группах немногочисленны [35]. Было предпринято много усилий для улучшения стандартизации протоколов и анализов ВМД, но есть нерешённые вопросы. Преодоление этих пробелов кажется трудным, учитывая временами плохую прозрачность программного обеспечения [36]. Помимо программного обеспечения есть и другие аспекты, которые могут изменить индекс LCI. Имеются данные, указывающие на чёткую связь с инфекционным агентом, структурной патологией дыхательных путей или обострением лёгочной патологии, при этом изменение LCI должно побудить клиницистов проявить интерес. Что касается измерения большинства исходных параметров функции лёгких, положительный эффект от регулярного измерения LCI в клинических наблюдениях по исходу заболевания ещё не оценивали [37].
При ВМД и неравномерном распределении вентиляции происходит характерный излом кривой вымывания азота. При этом также существенно увеличивается время исследования. Метод вымывания азота при множественном дыхании (МД) становится популярным методом диагностики. Как было описано ранее, для наиболее полной оценки вентиляционной функции лёгких необходимо исследовать структуру общей емкости лёгких (ОЕЛ), а для этого следует определить функциональную остаточную емкость лёгких (ФОЕ). Функциональная остаточная емкость лёгких может быть измерена при помощи различных тестов. Традиционным стандартизированным методом измерения ФОЕ является бодиплетизмография. Метод вымывания азота при множественном дыхании является альтернативным тестом для определения ФОЕ. Функциональная остаточная емкость лёгких, измеренная с помощью ВМД, представляет собой вентилируемый объём газа, т.е. объём газа, находящегося в вентилируемых участках лёгких при спокойном дыхании. Поэтому у здоровых людей нет существенной разницы между ФОЕ, измеренной разными методами, в то время как у лиц с обструктивными заболеваниями лёгких ФОЕ, измеренная с помощью ВМД, довольно часто бывает заметно меньше, чем при определении с помощью бодиплетизмографии [38]. В последние десятилетия тест ВМД чаще используют для оценки неравномерности лёгочной вентиляции и состояния мелких дыхательных путей (МДП), что имеет большое клиническое значение в ранней диагностике респираторных заболеваний. При патологии органов дыхания неравномерность вентиляции возрастает. Это приводит к увеличению числа дыхательных манёвров и количества времени, которые требуются для вымывания азота. При проведении теста ВМД пациент дышит спокойно и непрерывно в течение определённого времени, и не требуется выполнения каких-либо форсированных или специальных манёвров. Поэтому при выполнении данного теста нет необходимости в высокой кооперации и координации действий между врачом и пациентом, что является несомненным преимуществом для функционального теста [39].
Всё вышеперечисленные и описанные методы диагностики послужили основанием для проведения сравнительной оценки функции лёгочной ткани при комплексном исследовании.
Заключение
Таким образом, обструктивные заболевания (БА и ХОБЛ) являются широко распространёнными во всем мире, вместе с тем характеризуются высокой инвалидизацией, тенденцией к хронизиции, высокой смертностью. Кроме того, в последние годы наблюдается рост заболеваемости, в т.ч. по причине и на фоне новой коронавирусной инфекции. Это обуславливает необходимость своевременной диагностики. Однако существующие на сегодняшний день методы диагностики хоть и являются чувствительными, тем не менее требуются дополнительные и альтернативные методы исследования, что собственно и делает актуальной проблему поиска новых методов диагностики. В литературе есть описания применения новых методов диагностики при заболеваниях лёгких. Можно полагать, что именно комплексный подход к анализу пациентов поможет улучшить диагностику и коррекцию имеющейся лёгочной патологии.


