Брыжеечные лимфатические узлы при моделировании рака прямой кишки и в условиях химиотерапии
Автор: Исакова Н.Б., Старкова Е.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 (58), 2013 года.
Бесплатный доступ
Цель исследования – выявление характерных морфофункциональных преобразований в брыжеечных лимфатических узлах при моделировании рака прямой кишки экспериментальным животным (крысы Вистар) и цитостатической терапии внутрибрюшинным путем (5-фторурацил и лейковарин). Спустя 11 мес после инстилляции химического канцерогена в стенке прямой кишки выявлена злокачественная эпителиальная опухоль – диморфный рак. В условиях роста злокачественной опухоли прямой кишки в брыжеечных лимфатических узлах выявлены признаки значительных изменений структурно-клеточной организации, активации процессов пролиферации и бласттрансформации в зонах, ответственных за клеточное и гуморальное звенья иммунитета. Подобные преобразования имели место на фоне внутриузлового перераспределения лимфы в корковые промежуточные синусы, что и повлияло на изменения цитоархитеконики в зонах органа, ответственных за процессы детоксикации и противоопухолевую резистентность. В условиях внутрибрюшинного способа введения химиопрепаратов наблюдалось сохранение активности процессов пролиферации и бласттрансфомации в герминативных центрах и паракортикальной зоне, что, однако, сопровождалось признаками подавления иммунологических процессов в мозговых тяжах. Имела место активация непрямого пути тока лимфы, перераспределение ее в корковые промежуточные и мозговые синусы. Отмечается неравномерность структурно-клеточных преобразований в 1-м и 2-м брыжеечных лимфатических узлах, связанная с разными регионами сбора лимфы. Транспортная функция брыжеечных лимфатических узлов увеличилась
Экспериментальный рак прямой кишки, химиотерапия, внутрибрюшинное введение, брыжеечные лимфатические узлы, морфология
Короткий адрес: https://sciup.org/14056352
IDR: 14056352 | УДК: 616.351-006.6.001.6:611.383:616.428:615.28
Текст научной статьи Брыжеечные лимфатические узлы при моделировании рака прямой кишки и в условиях химиотерапии
В структуре заболеваемости и смертности среди злокачественных новообразований рак прямой кишки занимает ведущие позиции. Отмечается прирост абсолютного числа заболевших колоректальным раком за последние годы. Соответственно росту заболеваемости увеличивается и смертность, что указывает на высокую социальную значимость проблем диагностики и лечения рака прямой кишки [3].
При местнораспространенном раке прямой кишки проводится комбинированное лечение, которое включает радикальную операцию и лучевую терапию в сочетании с полихимиотерапией [1, 4], что позволяет добиться улучшения показателей выживаемости. Как правило, цитостатические препараты вводят внутривенно, что сопряжено с появлением побочных эффектов, связанных с их общим влиянием на организм, повреждением быстро обновляющихся клеточных систем [6].
В экспериментах на животных аналогом внутривенного введения является внутрибрюшинный. Химиопрепараты, попадающие в брюшную полость, всасываются сосудистыми сплетениями серозных оболочек и поступают в общий лимфо- и кровоток. Структурно-функциональные изменения брыжеечных лимфатических узлов являются проявлением системного ответа лимфатической системы на цитостатическую терапию, а также реакцией на массированное всасывание химиопрепаратов через серозные оболочки, попадающие в регион лимфос-бора брыжеечных лимфатических узлов. Изучение структурно-клеточной организации регионарных лимфатических узлов при моделируемом раке прямой кишки в условиях проведения системной химиотерапии позволяет оценить влияние такого воздействия на состояние звеньев лимфатической системы в целом и способности сохранения барьерно-детоксикационной функции, обеспечивающей их противоопухолевую резистентность и предотвращающей генерализацию эндотоксикоза.
Цель исследования – выявить характерные особенности структурной организации брыжеечных лимфатических узлов в условиях моделируемой злокачественной опухоли прямой кишки при внутрибрюшинном способе введения химиопрепаратов.
Материал и методы
Исследование проведено на 30 экспериментальных животных – крысах-самцах популяции
Wistar с массой 300–400 г (НИИ клинической и экспериментальной лимфологии СО РАМН, Новосибирск). Все эксперименты выполнены в соответствии с «Правилами проведения работ с использованием экспериментальных животных». У крыс-самцов индуцировали экспериментальную опухоль толстой кишки путем интраректальных инстилляций химического канцерогена N-метил-N-нитрозомочевины (МНМ). Вводили по 4 мг МНМ в 0,5 мл изотонического раствора натрия хлорида один раз в неделю в течение 4 нед (всего 4 инстилляции) [7].
Определены экспериментальные группы: 1. Интактные животные (n=10). 2. Животные с индуцированной опухолью прямой кишки, без лечения (n=10); 3. Животные с индуцированной опухолью прямой кишки, леченные по схеме Мейо, внутрибрюшинное введение (n=10).
Химиотерапию экспериментальным животным проводили по схеме Мейо (5-фторурацил и лейкова-рин) спустя 11 мес после инстилляции МНМ в дозе, рассчитанной на кг веса животного. Внутрибрюшинное введение цитостатиков осуществлялось 3 курсами (3 дня каждую неделю) в дозе 0,1мг лейковарина и 0,1 мг фторурацила.
Забор материала у животных проводился спустя 11 мес после инстилляции канцерогена, верификации роста опухоли и окончания курсов химиотерапии под эфирным наркозом. Для гистологического исследования забирали ткань опухоли, краниальные брыжеечные лимфатические узлы, расположенные вдоль краниальной брыжеечной артерии и ее ветвей, их делили на центральные (проксимальные и дистальные) и периферические [5]. Забирали околоободочные брыжеечные лимфатические узлы (центральные дистальные), залегающие в вентральном (№ 1) и дорзальном (№ 2) концах корневого тела в общем корне брыжейки восходящей и тонкой кишки.
По стандартной гистологической методике выполняли проводку материала, заливали объекты исследования в парафиновые блоки, с которых делали гистологические срезы толщиной 5–7 мкм. Срезы окрашивали гематоксилином и эозином, а также азур II и эозином. Гистологические препараты изучали на световых микроскопах NIKON (Япония), МБС-10 при увеличении 32, 400 и 1000 раз, с помощью окулярной тестовой системы производили морфометрию срезов и подсчет клеточных
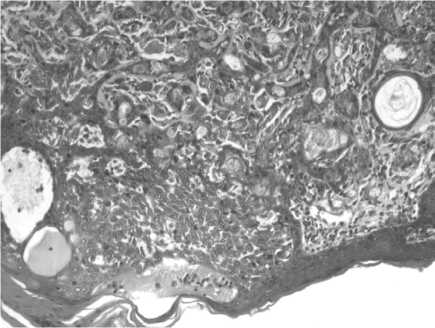
Рис. 1. Микрофото. Ткань опухоли в стенке прямой кишки у крыс. Окраска гематоксилином и эозином, ув. 10×40
элементов в опухоли и отдельных структурнофункциональных зонах лимфатических узлов.
Статистическую обработку данных проводили с помощью t-критерия Стьюдента для зависимых выборок и определяли значимость различий (р – стандартная ошибка среднего). Критический уровень значимости в данном исследовании принимался р < 0,05.
Результаты и обсуждение
У всех экспериментальных животных спустя 11 мес после инстилляции химического канцерогена N-метил-N-нитрозомочевины в стенке прямой кишки выявлена злокачественная эпителиальная опухоль: сочетание умеренно дифференцированной аденокарциномы и плоскоклеточного ороговевающего рака (диморфный рак) с преобладанием железистого компонента. Макроскопически опухоль была представлена экзофитным бугристым образованием на широком основании. В некоторых случаях – это была опухоль язвенноинфильтративного характера, с распространением на кожу вокруг ануса. Микроскопически опухоль построена из укрупненных округлых клеток типа эпителиальных с эксцентрично расположенными гиперхромными ядрами, вакуолизацией цитоплазмы. Имелись участки опухоли с плоскоклеточной дифференцировкой, встречаются «луковицы» ороговения и роговые кисты. Отмечался инфильтрирующий рост за пределы слизистой прямой кишки в подслизистый и мышечный слои, а иногда – в окружающую жировую клетчатку (рис. 1).
В условиях внутрибрюшинного способа введения химиопрепаратов структура ткани опухоли преимущественно сохранялась, однако признаки лечебного патоморфоза наблюдались как в эпителиальном, так и в стромальном компонентах опухоли. Эпителиальные клетки, составляющие паренхиму опухоли, изменились, что выражалось в некотором увеличении размеров самих клеток и их ядер, ослаблении интенсивности окраски ядер, обильной вакуолизации цитоплазмы, появлении «размытости» контуров отдельных клеток, в наличии признаков кариопикноза и кариорексиса в части клеток. Железистые структуры часто «разорваны», содержимое желез слизистое с примесью большого количества нейтрофильных лейкоцитов. В строме опухоли определялась очаговая воспалительная реакция с примесью лимфоидных клеток различной степени зрелости, макрофагов, нейтрофильных лейкоцитов. Встречались фокусы некрозов и кровоизлияний. В участках погибшей паренхимы отмечались очаги созревающей грануляционной ткани. Исследование лечебного патоморфоза опухоли выявило наличие 2 способов гибели раковых клеток – некроза и апоптоза.
В условиях роста экспериментальной злокачественной опухоли прямой кишки в брыжеечных лимфатических узлах отмечались признаки фолликулярной гиперплазии с увеличением доли герминативных центров (на 56,42 %,– в 1-м органе (р<0,001) и на 61,74 % – во 2-м органе (р<0,001)) и зоны мантии (на 64,34 % – в 1-м органе (р<0,001) и на 61,02 % – во 2-м органе (р<0,001)) (табл. 1). В клеточной популяции герминативных центров первого и второго органов статистически значимо возросла доля митозов, лимфобластов и средних лимфоцитов. При этом число зрелых лимфоцитов сократилось (табл. 2). Подобные изменения свидетельствуют об активации процессов клеточной пролиферации и бласттрансформации в условиях антигенной стимуляции в герминативных центрах. Число макрофагов оказалось ниже контрольных значений на 22,96 % во 2-м органе (р<0,01).
Внутрибюшинное введение химиопрепаратов не привело к изменению относительной площади вторичных лимфоидных узелков в целом, однако отмечался рост доли герминативных центров, наиболее выраженный во втором органе – на 22,22 % (р<0,001). Размеры мантийной зоны статистически значимо сократились по сравнению с таковой в 1-й группе животных: на 25,63 % в первом лимфатическом узле (р<0,05) и на 20,04 % – во втором (р<0,2)
(табл. 1) Увеличение доли герминативных центров сопровождалось ростом числа низкодифференцированных и промежуточных форм лимфоидных клеток – лимфобластов и средних лимфоцитов, что указывает на активацию процессов бласттранс-формации в этой структурной зоне. В пользу этого факта свидетельствует и увеличение ретикулярных клеток, как антигенпрезентирующих – на 19,86 % (р<0,02) и на 19,16 % (р<0,02) соответственно (табл. 2). Снижение митотической активности в герминативных центрах первого брыжеечного лимфоузла (на 16,09 %, р<0,05) может свидетельствовать о том, что стимуляция к пролиферации в герминативных центрах первого органа начинается раньше – по мере продвижения лимфы, насыщенной антигенным материалом, по лимфатическим путям и падения концентрации последних в момент попадания в следующий орган, а также с разными регионами сбора лимфы для первого и второго лимфоузлов. В пользу этого факта свидетельству-
Таблица 1
относительные площади структурно-функциональных зон брыжеечных лимфатических узлов в условиях роста экспериментальной злокачественной опухоли прямой кишки
|
Структурно-функциональные зоны |
1-я группа животных, первый и второй брыжеечные л.у. |
2-я группа животных, первый и второй брыжеечные л.у. |
3-я группа животных, первый и второй брыжеечные л.у. |
|
Герминативный центр |
2,07 ± 0,16 % 1,5 ± 0,17 % |
4,75 ± 0,46 %* 3,92 ± 0,22 %* |
5,23 ± 0,37 % 5,04 ± 0,29 %** |
|
Мантийная зона |
1,99 ± 0,14 % 2,14 ± 0,11 % |
5,58 ± 0,62 %* 5,49 ± 0,58 %* |
4,15 ± 0,26 %** 4,39 ± 0,43 %** |
|
Вторичные лимфоидные узелки |
4,05 ± 0,16 % 3,64 ± 0,16 % |
10,33 ± 0,69 %* 9,42 ± 0,9 %* |
9,39 ± 0,5 % 9,44 ± 0,67 % |
|
Первичные лимфоидные узелки |
7,87 ± 0,29 % 8,23 ± 0,32 % |
4,81 ± 1,21 %* 2,72 ± 0,26 %* |
1,25 ± 0,16 %** 2,25 ± 0,19 % |
|
Межузелковая зона |
2,78 ± 0,08 % 2,69 ± 0,15 % |
6,23 ± 0,71 %* 5,36 ± 0,53 %* |
4,97 ± 0,32 % 5,77 ± 0,42 % |
|
Паракортикальная зона |
25,99 ± 1,15 % 22,55 ± 0,99 % |
37,48 ± 2,86 %* 26,42 ± 2,54 % |
20,42 ± 1,57 %** 33,07 ± 2,88 % |
|
Мозговые тяжи |
22,81 ± 0,71 % 24,21 ± 1,59 % |
16,05 ± 1,56 %* 25,21 ± 4,33 % |
25,82 ± 1,27 %** 20,52 ± 2,53 % |
|
Мозговые синусы |
29,41 ± 2,18 % 29,83 ± 1,37 % |
16,05 ± 1,62 %* 23,49 ± 3,17 % |
27,85 ± 2,99 %** 19,33 ± 2,37 % |
|
Краевой синус |
2,62 ± 0,13 % 3,64 ± 0,21 % |
3,72 ± 0,1 %* 3,05 ± 0,42 % |
3,81 ± 0,37 % 3,76 ± 0,39 % |
|
Корковый промежуточный синус |
1,03 ± 0,14 % 1,5 ± 0,09 % |
1,93 ± 0,23 %* 1,71 ± 0,2 % |
3,07 ± 0,43 %** 2,29 ± 0,32 %** |
|
Капсула и трабекулы |
3,41 ± 0,17 % 3,72 ± 0,12 % |
3,4 ± 0,15 % 2,62 ± 0,25 %* |
3,42 ± 0,29 % 3,57 ± 0,25 % |
|
Корковое вещество |
40,69 ± 1,86 % 37,1 ± 1,62 % |
58,86 ± 3,58 %* 43,92 ± 3,99 % |
36,03 ± 2,22 %** 50,53 ± 4,51 % |
|
Мозговое вещество |
52,23 ± 1,78 % 54,04 ± 1,62 % |
32,09 ± 2,02 %* 48,71 ± 7,42 % |
53,68 ± 3,49 %** 39,85 ± 4,36 % |
|
В-зависимая зона |
37,52 ± 2,09 % 38,77 ± 2,09 % |
37,42 ± 3,5 % 42,71 ± 5,66 % |
41,44 ± 3,03 % 37,98 ± 4,84 % |
|
Т-зависимая зона |
28,72 ± 1,17 % 25,24 ± 0,94 % |
44,07 ± 3,72 %* 31,78 ± 3,03 %* |
25,39 ± 1,85 %** 38,85 ± 3,26 % |
|
Корково/мозговой индекс |
0,78 ± 0,02 % 0,69 ± 0,02 % |
1,83 ± 0,09 % 0,9 ± 0,01 % |
0,67 ± 0,01 % 1,27 ± 0,02 % |
Примечание: * - отличия статистически значимы по сравнению с 1-й группой животных (р < 0,05); ** - отличия статистически значимы по сравнению со 2-й группой животных (р < 0,05).
Таблица 2
Цитоархитектоника структурно-функциональных зон брыжеечных лимфатических узлов самцов крыс линии вистар в условиях роста экспериментальной злокачественной опухолипрямой кишки
|
Клеточные элементы |
1-я группа животных, первый и второй брыжеечные л.у. |
2-я группа животных, первый и второй брыжеечные л.у. |
3-я группа животных. первый и второй брыжеечные л.у. |
|
Герминативный центр вторичных лимфоидных узелков |
|||
|
Иммунобласты |
6,36 ± 0,29 % 7,46 ± 0,41 % |
11,24 ± 0,29 %* 9,86 ± 0,27 %* |
11,43 ± 0,33 % 11,24 ± 0,46 %** |
|
Средние лимфоциты |
15,79 ± 0,52 % 13,65 ± 0,55 % |
21,43 ± 0,68 %* 18,98 ± 0,63 %* |
24,1 ± 0,54 %** 19,68 ± 0,67 % |
|
Малые лимфоциты |
67,25 ± 1,48 % 69,72 ± 1,22 % |
56,09 ± 1,18 %* 61,55 ± 1,79 %* |
53,58 ± 0,93 % 58,43 ± 1,33 % |
|
Макрофаги |
4,43 ± 0,31 % 4,05 ± 0,26 % |
3,84 ± 0,21 % 3,12 ± 0,15 %* |
3,31 ± 0,24 % 3,4 ± 0,24 % |
|
Ретикулярные клетки |
3,08 ± 0,3 % 2,77 ± 0,34 % |
3,31 ± 0,25 % 2,87 ± 0,15 % |
4,13 ± 0,17 %** 3,55 ± 0,21 %** |
|
Клетки с фигурами митозов |
3,08 ± 0,3 % 2,35 ± 0,34 % |
4,1 ± 0,16 %* 3,62 ± 0,15 %* |
3,44 ± 0,22 %** 3,69 ± 0,18 % |
|
Паракортикальная зона |
|||
|
Иммунобласты |
1,86 ± 0,11 % 1,19 ± 0,15 % |
2,86 ± 0,12 %* 3,48 ± 0,15 %* |
3,16 ± 0,18 % 4,71 ± 0,25 %** |
|
Средние лимфоциты |
5,01 ± 0,26 % 4,49 ± 0,18 % |
9,57 ± 0,37 %* 11,06 ± 0,47 %* |
11,93 ± 0,42 %** 9,42 ± 0,34 %** |
|
Малые лимфоциты |
87,85 ± 1,29 % 89,27 ± 1,1 % |
82,09 ± 0,93 %* 80,17 ± 1,2 %* |
79,47 ± 1,08 % 79,81 ± 1,02 % |
|
Макрофаги |
1,76 ± 0,2 % 2,02 ± 0,16 % |
2,55 ± 0,14 %* 2,13 ± 0,12 % |
2,72 ± 0,11 % 2,59 ± 0,14 %** |
|
Ретикулярные клетки |
2,51 ± 0,22 % 2,48 ± 0,21 % |
2,47 ± 0,09 % 2,53 ± 0,09 % |
2,19 ± 0,17 % 2,79 ± 0,12 % |
|
Тучные клетки |
1,02 ± 0,18 % 0,55 ± 0,12 % |
0,46 ± 0,09 %* 0,63 ± 0,09 % |
0,53 ± 0,11 % 0,67 ± 0,12 % |
|
Мозговые тяжи |
|||
|
Средние лимфоциты |
2,53 ± 0,19 % 2,69 ± 0,15 % |
3,84 ± 0,25 %* 3,64 ± 0,19 %* |
5,01 ± 0,28 %** 3,05 ± 0,14 %** |
|
Малые лимфоциты |
23,79 ± 0,65 % 25,53 ± 0,71 % |
22,09 ± 0,91 % 21,51 ± 0,78 %* |
25,6 ± 0,64 %** 25,79 ± 1,05 %** |
|
Иммунобласты |
3,05 ± 0,13 % 3,63 ± 0,22 % |
3,67 ± 0,17 %* 3,73 ± 0,17 % |
3,99 ± 0,12 % 3,24 ± 0,19 % |
|
Незрелые плазмоциты |
15,37 ± 0,54 % 13,93 ± 0,49 % |
16,59 ± 0,55 % 19,78 ± 0,46 %* |
14,47 ± 0,59 %** 18,85 ± 0,45 % |
|
Зрелые плазмоциты |
49,68 ± 0,82 % 48,36 ± 0,94 % |
45,42 ± 0,94 %* 43,45 ± 0,71 %* |
43,69 ± 0,72 % 41,22 ± 0,74 %** |
|
Макрофаги |
1,16 ± 0,17 % 1,52 ± 0,22 % |
2,71 ± 0,11 %* 2,6 ± 0,11 % |
2,59 ± 0,15 % 2,77 ± 0,12 % |
|
Ретикулярные клетки |
2,84 ± 0,19 % 2,93 ± 0,22 % |
2,88 ± 0,09 % 2,78 ± 0,14 % |
2,41 ± 0,13 %** 2,59 ± 0,15 % |
|
Клетки с фигурами митозов |
1,58 ± 0,16 % 1,41 ± 0,21 % |
2,79 ± 0,1 %* 2,52 ± 0,11 %* |
2,23 ± 0,16 %** 2,49 ± 0,17 % |
Продолжение таблицы 2
|
Мозговые синусы |
|||
|
Средние лимфоциты |
3,76 ± 0,33 % 4,51 ± 0,22 % |
4,82 ± 0,14 %* 5,19 ± 0,21 %* |
4,53 ± 0,17 % 5,0 ± 0,2 % |
|
Малые лимфоциты |
54,01 ± 1,74 % 52,94 ± 1,16 % |
46,19 ± 0,96 %* 41,91 ± 0,75 %* |
47,15 ± 0,79 % 45,42 ± 0,81 %** |
|
Иммунобласты |
1,38 ± 0,2 % 1,38 ± 0,16 % |
2,45 ± 0,1 %* 2,52 ± 0,16 %* |
1,77 ± 0,24 %** 2,55 ± 0,17 % |
|
Незрелые плазмоциты |
2,76 ± 0,22 % 3,0 ± 0,26 % |
6,57 ± 0,22 %* 6,2 ± 0,24 %* |
7,28 ± 0,19 %** 6,61 ± 0,32 % |
|
Зрелые плазмоциты |
31,7 ± 0,85 % 32,67 ± 0,69 % |
34,01 ± 0,85 % 38,56 ± 1,05 %* |
33,27 ± 0,75 % 34,75 ± 0,78 %** |
|
Макрофаги |
1,38 ± 0,16 % 1,75 ± 0,22 % |
2,28 ± 0,12 %* 2,09 ± 0,16 % |
2,36 ± 0,18 % 1,98 ± 0,14 % |
|
Ретикулярные клетки |
3,76 ± 0,24 % 3,0 ± 0,22 % |
2,89 ± 0,13 %* 2,77 ± 0,17 % |
2,66 ± 0,15 % 3,12 ± 0,14 % |
|
Тучные клетки |
1,25 ± 0,12 % 0,75 ± 0,16 % |
0,79 ± 0,13 %* 0,75 ± 0,13 % |
0,98 ± 0,17 % 0,57 ± 0,12 % |
Примечание: * - отличия статистически значимы по сравнению с 1-й группой животных (р < 0,05); ** - отличия статистически значимы по сравнению со 2-й группой животных (р < 0,05).
ют и более выраженные размеры герминативных центров во втором органе.
Развитие злокачественной опухоли прямой кишки привело к увеличению удельных размеров межфолликулярной зоны в обоих брыжеечных лимфатических узлах. Морфометрические показатели паракортикальной зоны первого органа статистически значимо выросли (на 30,66 %, р<0,001), во втором органе наблюдалась тенденция к увеличению. Паракортикальная гиперплазия сопровождалась увеличением числа лимфобластов и средних лимфоцитов и сокращением числа зрелых лимфоцитов (табл. 2). Такие преобразования свидетельствуют об активации процессов бласттрансформации в этой зоне брыжеечных лимфатических узлов. Увеличение макрофагеальной активности в первом органе служит доказательством вышесказанного.
При внутрибрюшинном введении цитостатиков наблюдалось сокращение доли паракортикальной зоны в первом органе, что, однако, сопровождалось ростом числа средних лимфоцитов на 19,78 % (р<0,001). Во 2-м органе отмечалось увеличение относительного количества лимфобластов на 26,12 %, (р<0,05), при отсутствии изменений размеров паракортикальной зоны. Такие преобразования указывают на сохранение активности процессов бластрансформации в исследуемой структурной зоне первого и второго органов. Увеличение содер- жания моноцитарных макрофагов во втором органе на 17,76 %, (р<0,02), как антигенпрезентирующих клеток служит доказательством вышесказанного (рис. 2).
Развитие злокачественной опухоли прямой кишки привело в первом брыжеечном лимфатическом узле к сокращению относительной площади мозговых тяжей на 29,64 % (р<0,001), что, однако, сопровождалось статистически значимым увеличением числа средних лимфоцитов, плазмобластов, незрелых плазмоцитов и макрофагов (табл. 1, 2). Во
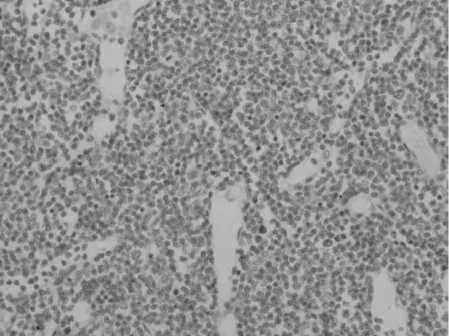
Рис. 2. Микрофото. Брыжеечный лимфатический узел. Паракорти-кальная гиперплазия. Окраска гематоксилином и эозином, ув. 10×40
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 4 (58)
втором органе, в отсутствие изменений размеров изучаемой зоны, имело место увеличение числа средних лимфоцитов и незрелых плазмоцитов. В мозговых тяжах обоих брыжеечных лимфатических узлов отмечается рост пролиферативной активности клеток (на 43,37 % – в 1-м органе (р<0,001) и на 44,08 % – во 2-м (р<0,001)). Увеличение числа низкодифференцированных и промежуточных форм плазматических клеток сопровождалось сокращением числа зрелых плазмоцитов.
Внутрибрюшинное введение цитостатиков привело к увеличению доли мозговых тяжей в первом органе (на 37,84 %, р<0,001), что сопровождалось ростом числа средних (на 23,35 %, р<0,01) и малых лимфоцитов (на 13,71 %, р<0,01). Однако имело место сокращение числа незрелых плазмоцитов (на 12,78 %, р<0,02), как промежуточных форм на пути образования плазматических клеток, а также ретикулярных клеток (на 16,32 %, р<0,01), как антигенпрезентирующих клеток и клеток на стадии митотического деления (на 20,07 %, р<0,01), что указывает на подавление активности гуморальных иммунологических процессов в этой зоне первого органа [2] в условиях введения цитостатических препаратов (табл. 1, 2).
Во втором лимфатическом узле размеры мозговых тяжей имели тенденцию к сокращению, что сопровождалось уменьшением числа средних лимфоцитов (на 13,46 %, р<0,05) и увеличением числа зрелых лимфоцитов (на 16,59 %, р<0,01). Внутрибрюшинный способ введения химиопрепаратов не повлиял на количественные изменения низкодифференцированных форм клеток плазматического ряда в мозговых тяжах второго органа, но число зрелых плазматических клеток несколько сократилось (на 5,13 %, р<0,05).
В условиях роста злокачественной опухоли прямой кишки относительные размеры мозговых синусов в первом брыжеечном лимфатическом узле сократились на 45,43 % (или в 1,83 раза, р<0,001), а краевого и коркового промежуточного синусов увеличились (на 29,57 % (р<0,001) и 46,63 % (р<0,001) соответственно). Такие изменения свидетельствуют об активном прямом пути транспорта лимфы, однако более выраженном лимфонаполнении корковых промежуточных синусов, что, вероятно, и повлияло на изменения цитоархитеконики в этой и других структурных зонах органа. Во втором брыжеечном лимфатическом узле наблюдалась тенденция к уменьшению размеров мозговых синусов, в отсутствие изменений со стороны краевого и коркового промежуточного синусов.
В мозговых синусах отмечаются признаки ци-тоза: увеличение процентного содержания средних лимфоцитов, всех форм плазматических клеток, макрофагов. Доля ретикулярных и тучных клеток в мозговых синусах первого брыжеечного лимфатического узла значимо сократилась. В обоих органах уменьшилось число зрелых лимфоцитов (табл. 2).
Внутрибрюшинное введение химиопрепаратов привело к увеличению площади мозговых (на 42,37 %, р<0,001) и корковых промежуточных синусов (на 37,13 %, р<0,05) в первом брыжеечном лимфатическом узле (табл. 1), что указывает на активацию непрямого пути тока лимфы и способности к депонированию лимфы в органе. В цитологическом составе имело место уменьшение числа плазмобластов (на 27,76 %, р<0,02) и увеличение числа незрелых плазмоцитов (на 9,75 %, р<0,05).
Во втором органе, в отсутствие изменений размеров мозговых синусов, отмечалась тенденция к увеличению доли корковых промежуточных синусов (на 25,33 %, р<0,2), что указывает на внутри-узловое перераспределение лимфы, включающее корковые промежуточные синусы, при этом – замедление лимфотока, более значительное его лимфонаполнение, чем во 2-й группе, однако менее выраженное, чем в первом органе. Увеличилось число малых лимфоцитов (на 7,73 %, р<0,01) и зрелых плазматических клеток (на 9,88 %, р<0,01).
Структурные изменения обоих брыжеечных лимфатических узлов в условиях развития злокачественной опухоли прямой кишки привели к увеличению доли коркового вещества и сокращению доли мозгового вещества (в первом органе эти изменения являются статистически значимыми). Относительные размеры зоны, населенной преимущественно В-лимфоцитами, не изменились, а размеры зоны, ответственной за рост и дифференцировку Т-лимфоцитов, значимо увеличились (табл. 1).
Преобразования микроанатомической организации брыжеечных лимфатических узлов при внутрибрюшинном введении химиопрепаратов в первом лимфатическом узле привели к статистически значимому сокращению относительной площади коркового вещества (на 38,79 %, р<0,001)
и увеличению мозгового вещества (на 40,22 %, р<0,001). Во 2-м брыжеечном лимфоузле значимых изменений не произошло (табл. 1). Размеры зоны, населенной преимущественно В-лимфоцитами, не претерпели достоверно значимых изменений. Совокупная площадь Т-зависимой зоны в первом брыжеечном лимфатическом узле сократилась (на 42,39 %, р<0,001). Во втором органе этот показатель не изменился.
В условиях развития рака прямой кишки корково-мозговой индекс для первого брыжеечного лимфатического узла составил 1,83, соответственно, по морфотипу с фрагментированного (в группе интактных животных) он меняется на компактный. Второй брыжеечный лимфатический узел остался узлом фрагментированного морфотипа. В группе с внутрибрюшинным введением цитостатиков корково-мозговой индекс для первого лимфатического узла составил 0,67, а для второго – 1,27.
Заключение
В условиях роста злокачественной опухоли прямой кишки в брыжеечных лимфатических узлах выявлены признаки значительных изменений структурно-клеточной организации, активации процессов пролиферации и бласттрансформации в зонах, ответственных за клеточное и гуморальное звенья иммунитета, признаки плазматизации мозговых тяжей, выраженного синусного цитоза. Подобные преобразования имели место на фоне внутриузлового перераспределения лимфы в корковые промежуточные синусы, что и повлияло на изменения цитоархитектоники в зонах органа, ответственных за процессы детоксикации и противоопухолевую резистентность.
При внутрибрюшинном введении химиопрепаратов наблюдалось сохранение активности процессов пролиферации и бласттрансфомации в герминативных центрах и паракортикальной зоне, что, однако, сопровождалось признаками подавления иммунологических процессов в мозговых тяжах. Выявлена активация непрямого пути тока лимфы, перераспределение ее в корковые промежуточные и мозговые синусы. Отмечается неравномерность структурно-клеточных преобразований в 1-м и 2-м брыжеечных лимфатических узлах, связанная с разными регионами сбора лимфы. Транспортная функция брыжеечных лимфатических узлов увеличилась.


