Целесообразность, безопасность и эффективность интраоперационной лучевой терапии в комбинированном лечении рака головки поджелудочной железы
Автор: Тавобилов М.М., Карпов А.А., Шабунин А.В.
Журнал: Московский хирургический журнал @mossj
Статья в выпуске: 4 (50), 2016 года.
Бесплатный доступ
Введение. Интраоперационная лучевая терапия (ИОЛТ) может служить дополнительной методикой в комбинированном лечении больных с протоковой аденокарциномой головки поджелудочной железы. Материалы и методы. В условиях Городской клинической больницы им. С.П. Боткина проведено проспективное клиническое исследование, в котором пациентам с протоковой аденокарциномой головки поджелудочной железы после выполненного резекционного этапа операции проводится ИОЛТ ложа удаленной опухоли. Результаты. За период с января 2013 года по январь 2016 года было выполнено 58 радикальных оперативных вмешательств по поводу рака головки поджелудочной железы, 33 из которых были с применением ИОЛТ. Выводы. Хирургическое вмешательство, дополненное проведением интраоперационной лучевой терапии, является безопасным и современным методом комбинированного лечения рака головки поджелудочной железы, эффективно влияющим на ткани и позволяющим увеличить послеоперационный безрецидивный период.
Рак поджелудочной железы, интраоперационная лучевая терапия, панкреатодуоденальная резекция
Короткий адрес: https://sciup.org/142211276
IDR: 142211276
Текст научной статьи Целесообразность, безопасность и эффективность интраоперационной лучевой терапии в комбинированном лечении рака головки поджелудочной железы
Рак поджелудочной железы является четвертой наиболее частой причиной онкологически-ассоциированной смерти больных у мужчин (после рака легкого, простаты, колоректального рака) и у женщин (рак легкого, молочной железы, колоректальный рак) [1, 2]. Рак данной локализации - один из наиболее сложных в плане диагностики и лечения онкологических заболеваний [3]. Отличительной особенностью его является увеличение заболеваемости и низкая продолжительность жизни этих пациентов. В 2014 году диагностировано до 200 000 больных раком поджелудочной железы во всем мире, две трети из которых зафиксированы в развитых странах [4].
Радикальное оперативное вмешательство возможно лишь у 15-20% пациентов [5]. Низкая резектабельность и относительно короткий безрецидивный период у больных с протоковой аденокарциномой головки поджелудочной железы являются актуальными проблемами клинической онкологии [6, 7]. Одной из причин неудовлетворительных отдаленных результатов оперативного лечения является «нерадикальность» выполненной операции [8]. Степень радикальности определяется отсутствием в границах резекции поджелудочной железы опухолевых клеток, так называемая R0 резекция [9]. По данным многих зарубежных и отечественных авторов большинство - до 76% пан-креатогастродуоденальных резекций (ПГДР), выполняются нерадикально [10]. В ходе проведённых морфологических исследований, получены данные о высоком проценте распространения опухолевых клеток в задний и нижний (зона крючковидного отростка головки поджелудочной железы) края резекции головки поджелудочной железы [11]. Также не менее важным считаем данные о наличие вовлечения в опухолевый процесс сразу нескольких краёв резекции [12].
Для улучшения результатов лечения больных применяется комбинация различных видов терапии в сочетании с радикальным оперативным лечением. Один из таких видов является интраоперационная лучевая терапия (ИОЛТ).
Интраоперационная лучевая терапия уже многие годы является дополнительной методикой в комбинированном лечении опухолей различной локализации [13]. Еще в 1905 году Comas и Prio при оперативном лечении рака эндометрия применили рентгеновские лучи, а Abe из универ- ситета г. Киото в 60-х годах XX века стал применять ИОЛТ гамма-лучами во время различных хирургических вмешательств [14].
Во многих хирургических центрах, в том числе японских, в последние годы, всё чаще стали применять ИОЛТ у больных с раком головки поджелудочной железы (РПЖ) [15]. Количество осложнений при использовании только хирургического способа лечения и в сочетании с ИОЛТ (в том числе панкреатических свищей, кровотечений) находится на одном уровне [16].
Таким образом, учитывая, что только лишь небольшой процент больных может быть радикально прооперирован, а большинству из этих пациентов выполняется нерадикальная операция, воздействие лучевой терапии на ложе удаленной опухоли может повысить радикальность оперативного вмешательства.
При анализе литературы, нами не было найдено данных о применении ИОЛТ рентгеновскими лучами при раке головки поджелудочной железы в ходе радикального оперативного вмешательства [17, 18]. Наше исследование направлено на изучение безопасности и эффективности данного способа лечения в комбинации с хирургическим лечением. Для этого нами проведено изучение морфологических изменений тканей, на которые была проведена лучевая терапия, а также проанализированы сроки безрецидивной и общей продолжительности жизни пациентов с протоковой аденокарциномой головки поджелудочной железы.
Материалы и методы
В условиях специализированного отделения хирургии печени и поджелудочной железы Городской клинической больницы им. С.П. Боткина проведено проспективное клиническое исследование, в котором пациентам с опухолевым поражением головки поджелудочной железы после выполненного резекционного этапа ПГДР, проводится ИОЛТ с использованием системы IntraBeam® CarlZeiss.
За период с июня 2013 года по январь 2016 года в исследование включено 58 пациентов с протоковой аденокарциномой головки поджелудочной железы. Всем больным по показаниям было выполнено радикальное оперативное вмешательство – панкреатогастродуоденальная резекция.
В основной группе больных выполнено 33 процедуры ИОЛТ аппаратом IntraBeam® CarlZeiss PRS 500. Возраст больных составил 63,2±6,1 года (от 39 до 73 лет), соотношение мужчин и женщин –13:20. Разделение на стадию опухолевого процесса по классификации ТNM было следующим: Т1 – двое (6,1%) больных, Т2 – 12 (36,4%) пациентов, Т3 – 19 (57,6%).
Показатели контрольной группы были следующими: общее число пациентов составило 25, возраст больных – 65,7±5,3 года (от 44 до 71 года), соотношение мужчин и женщин –11:14. Разделение на стадию опухолевого процесса по классификации ТNM было следующим: Т1 – трое (12%) больных, Т2 – 10 (40%) пациентов, Т3 – 12 (48%). Панкреа-тогастродуоденальная резекция выполнялась всем пациентам по стандартной методике с лимфодиссекцией в объёме D2 в двух модификациях либо с сохранением привратника, либо с выполнением антрум-резекции желудка.
Аппарат ИОЛТ IntraBeam® CarlZeiss представляет собой линейный ускоритель электронов, направленный пучок которых «попадает» в золотую мишень толщиной 1 мкм, что приводит к генерации рентгеновских лучей низкой энергии. Прилегающие к месту облучения ткани защищаются благодаря быстрому падению дозы этого типа излучения по мере его проникновения в глубину. Безопасность медицинского персонала и пациентов обеспечивает полный набор средств радиологической защиты.
В комплектацию системы входят сферичные съемные аппликаторы различного диаметра: от 1.5 до 5 см, обеспечивающие равномерное облучение по всей поверхности. Время терапии составляет от 5 до 60 минут (при использовании аппликаторов большого размера).
Интраоперационно, после выполнения резекционного этапа хирургического лечения, врачом-радиологом и физиком индивидуально определяется доза облучения, исходя из размера опухоли и требуемого аппликатора, после чего система автоматически рассчитывает время облучения (рис. 1, 2, 3). По рекомендациям международного общества интраоперационной лучевой терапии (ISIORT) однократной дозой при ИОЛТ выбран показатель, не превышающий 20 Гр [13, 14]. Исходя из опыта нескольких крупных исследований, учитывая близкое расположение сосудистых структур, полых органов, высокий риск лучевых осложнений, однократной дозой облучения нами использовались дозы от 15 до 20 Гр на поверхности аппликатора. В свою очередь, в зависимости от размера опухоли и ложа удалённой головки поджелудочной железы и в соответствии с этим выбранного размера аппликатора время процедуры составило от 20 до 35 минут.
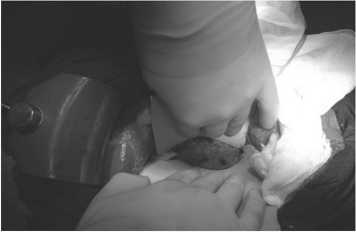
Рис. 1. Интраоперационное применение системы IntraBeam® CarlZeiss
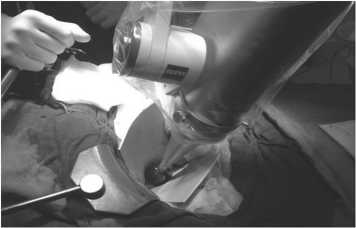
Рис. 2. Интраоперационное применение системы IntraBeam® CarlZeiss
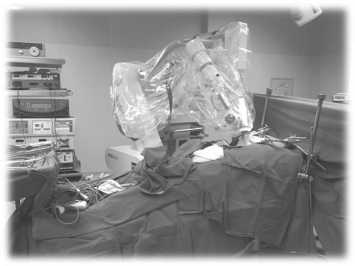
Рис. 3. Интраоперационное применение системы IntraBeam® CarlZeiss
По окончании сеанса ИОЛТ хирургическая бригада приступает к реконструктивному этапу операции.
Для изучения влияния рентгеновских лучей на ткани и оценки эффективности проведенной терапии проводится гистологическое и электронно-микроскопическое исследование ткани из области ложа удаленной головки поджелудочной железы до облучения и послойно после ИОЛТ. На свето-микроскопическом и электронно-микроскопическом уровнях исследованы 13 образцов тканей после проведенных сеансов ИОЛТ. Для гистологического исследования материал фиксировали в 10% забуференном растворе формалина, затем заливали в парафин по обычной методике. Для проведения электронно-микроскопического исследования вырезали кусочки нефиксированной ткани размером приблизительно 1 мм3, фиксировали в 2,5% растворе глутарового альдегида и 1% растворе четырехокиси осмия. Затем материал обезвоживали в спиртах возрастающей концентрации (50, 70, 96 и 100%), после чего пропитывали в смеси окись пропилен-аралдитовой смолы. Ультратонкие срезы толщиной 100-200 нм получали на ультрамикротоме фирмы LKBV (Швеция). Ультраструктурное изучение препаратов проводили при помощи электронного микроскопа JEOLJEM 100-CX (Япония) в трансмиссионном режиме при ускоряющем напряжении 80КВ.
Результаты
В нашем исследовании проведена оценка послеоперационных осложнений. Проанализированы, как общие (по классификации Clavien-Dindo), так и специфические хирургические осложнения — это панкреатическая фистула, гастростаз и геморрагические осложнения по классификации ISGPS.
В основной группе больных в 11 (33,3%) случаях отмечен послеоперационный панкреатический свищ. Класс «А» был у 6 (54,5%), класс «В» – у четырех (36,4%), класс «С» – у одного (9%) больного. Явления гастростаза выявлены у 9 (27,3%) пациентов. У 6 (66,7%) больных – класс «А», у трех (33,3%) – класс «В». Геморрагических осложнений не было. Послеоперационный койко-день составил 12,4 дня. В группе сравнения 8 (32%) случаях отмечен послеоперационный панкреатический свищ. Класс «А» был у трех (37,5%), класс «В» – у двух (25%), класс «С» – у трех (37,5%) больных. Явления гастростаза выявлены у 7 (28%) пациентов. У четырех (57,1%) больных – класс «А», у двух (28,5%) – класс «В», класс «С» - у одного (14,2%). Послеоперационный койкодень составил 11,7 дня.
Необходимо отметить, что количество осложнений (1-4 класс по Clavien-Dindo) в послеоперационном периоде и его длительность у больных, перенесших ИОЛТ, не превышало показатели после стандартной операции в клинике. Осложнение класса 5 (летальный исход) было отмечено в одном случае у пациента из контрольной группы.
В исследовании были изучены морфологические изменения ткани ложа удаленной опухоли головки поджелудочной железы, а также оценены такие показатели как послеоперационные осложнения (общие и специфические), общая выживаемость больных и время развития местного рецидива.
При сравнительном гистологическом исследовании био-птатов из ложа удаленной головки поджелудочной железы до и после облучения были отмечены следующие изменения.
До облучения, а также в группе сравнения - гистологические изменения отсутствовали. После облучения - в более поверхностном биоптате отмечался коагуляционный некроз липоцитов и фиброзных прослоек, очаговый асептический некроз, рассеянная круглоклеточная инфильтрация с примесью нейтрофилов (рис. 4, рис. 5), а в биоптате из более глубоких слоев парапанкреатическая жировая ткань полностью сохраняла свою структуру, отмечалась слабая гомогенезация стенки капилляров (рис. 6, рис. 7).
При электронно-микроскопическом исследовании ложа опухоли поджелудочной железы до ИОЛТ адипоциты имели крупные размеры, прилегали друг к другу посредством тонких соединительнотканных перегородок. Большая часть липидов, находившихся в жировой капле, растворялись спиртами, в результате чего, адипоцит приобретал вид пустого пузырька с одним утолщённым краем (рис. 8). В некоторых
адипоцитах жировые капли были сохранны. В соединительнотканных перегородках между жировыми клетками обнаруживали сосуды. Эндотелий капилляров был несколько отечен, однако, при этом сохранялась организация клеточных органелл (рис. 9). Выраженных деструктивных изменений в клетках отмечено не было.
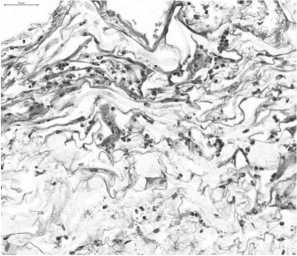
Рис. 4. Поверхностный слой через три часа после ИОЛТ
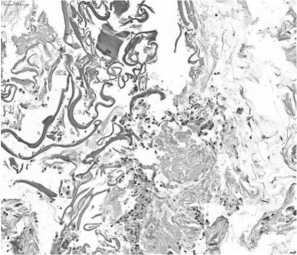
Рис. 5. Поверхностный слой через три часа после ИОЛТ
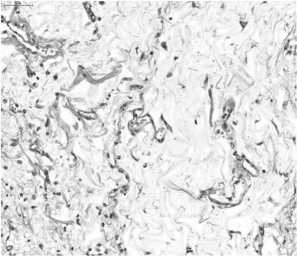
Рис. 6. Глубокий слой жировой клетчатки из ложа головки поджелудочной железы
При электронно-микроскопическом исследовании поверхности ложа опухоли поджелудочной железы после ИОЛТ отмечали “летальное” поражение жировых клеток. В более глубоких слоях парапанкреатическая жировая ткань при светооптическом исследовании полностью сохраняла свою структуру, однако, при электронно-микроскопическом исследовании отмечали выраженные в разной степени вну- триклеточные деструктивные изменения. Эндотелиальные клетки капилляров были деструктивно изменены вплоть до полного разрушения. Цитоплазма клеток электронно плотная, вакуолизированная, клеточные органеллы не определялись, что указывает на необратимые процессы в клетках (рис. 10). Отмечалась десквамация эндотелия (рис. 11). В адипоцитах жировая капля растворена, нарушена целостность плазмолеммы некоторых адипоцитов (рис. 12).
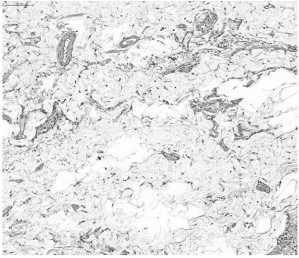
Рис. 7. Глубокий слой жировой клетчатки из ложа головки поджелудочной железы
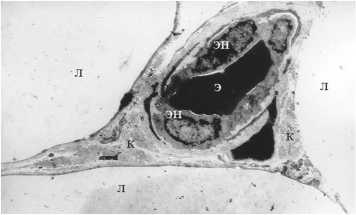
Рис. 8. Капилляры до ИОЛТ
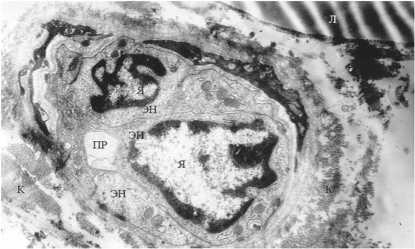
Рис. 9. Капилляры до ИОЛТ
Для повышения достоверности исследования, нами была изучена однолетняя безрецидивная и общая выживаемость пациентов, которым была применена ИОЛТ. Для этого мы проводили динамическое наблюдение за данной группой пациентов, которым каждый 3 месяца выполняли СКТ брюшной полости с болюсным контрастированием, а также за такой же промежуток времени оценивался уровень онкомаркеров крови – СА 19-9, РЭА.
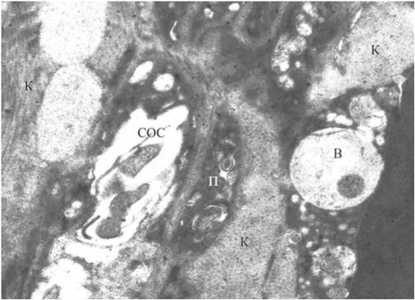
Рис. 10. Капилляры после ИОЛТ
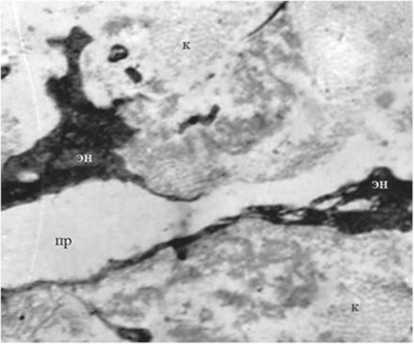
Рис. 11. Капилляры после ИОЛТ
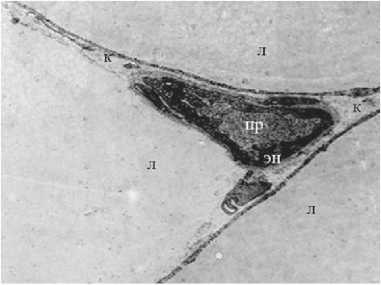
Рис. 12. Капилляры после ИОЛТ
Признаками наличия местного рецидива опухоли являлось появление тканевого образования в ложе ранее удаленной головки поджелудочной железы, а также повышение уровня онкомаркера крови СА 19-9 в 10 и более раз. Гистологическую верификацию местного рецидива, выявленного по результатам контрольной СКТ брюшной полости не выполняли, из-за её технической невозможности (отсутствие эхоокна для прохождения пункционной иглы).
В основной группе частота местных рецидивов была значимо ниже, чем в группе сравнения (15,4% по сравнению с 31,3%). При этом хотелось бы отметить, что при стандартизированном гистологическом исследовании, оценивавшем весь операционный материал группы были сравнимы по показателям наличия периневральной инвазии, метастатического поражения лимфатических узлов и присутствия анапластического компонента в опухоли.
Общая выживаемость больных, в свою очередь, за один год составила в основной группе - 84,6%, а в группе сравнения – 78,2%.
Всем пациентам, как в основной группе, так и в контрольной группе проводилась химиотерапия по стандартным схемам в адъювантном режиме.
Обсуждение
Неудовлетворительные результаты хирургического лечения рака головки поджелудочной железы, небольшой без-рецидивный период, а также низкая выживаемость требуют поиска путей улучшения этих показателей. Одним из таких способов является интраоперационное использование лучевой терапии. В нашем исследовании убедительно было показано влияние ИОЛТ на облучаемые ткани. Несмотря на то, что гистологические изменения носили неспецифический характер, ранний ультраструктурный патоморфоз тканей по данным электронной микроскопии после ИОЛТ в области ложа удалённой головки поджелудочной железы, проявившийся, как деструкцией адипоцитов, так и клеток стенок капилляров, гипотетически препятствует имплантации и/или гемодинамическому распространению опухолевых клеток в послеоперационном периоде по микроцир-куляторному руслу. С учетом незначительного увеличения времени операции, необходимого для проведения облучения, отсутствия увеличения количества послеоперационных осложнений, проведение ИОЛТ системой IntraBeam® CarlZeiss является эффективной методикой для проведения комбинированного лечения рака головки поджелудочной железы.
Выводы
Полученный первый опыт применения ИОЛТ системой IntraBeam® CarlZeiss в комбинированном лечении протоковой аденокарциномы головки поджелудочной железы позволяет сделать вывод о том, что она является эффективной методикой. Гистологически подтверждено, что точкой приложения излучения при ИОЛТ являются ткани, которые наиболее часто могут быть вовлечены в местное опухолевое распространение рака головки поджелудочной железы, и, тем самым, увеличивают вероятность выполнения нерадикального оперативного вмешательства, так называемой R1 резекции. Применение ИОЛТ безопасно для пациента. Воздействие ИОЛТ положительно влияет на снижение количества местных рецидивов заболевания, улучшение по-
казателя общей выживаемости при отсутствии негативного влияния на течение послеоперационного периода.
Список литературы Целесообразность, безопасность и эффективность интраоперационной лучевой терапии в комбинированном лечении рака головки поджелудочной железы
- Gong J. Meta-analyses of treatment standards for pancreatic cancer./J. Gong, R. Tuli, A., AE. Mol.//Clin Oncol. 2016 Mar;4(3):315-325;
- Sinn M. Perioperative treatment options in resectable pancreatic cancer -how to improve long-term survival./M. Sinn, M. Bahra,T. Denecke, S. Travis, U. Pelzer, H. Riess.//World J Gastrointest Oncol. 2016 Mar 15;8(3):248-57 DOI: 10.4251/wjgo.v8.i3.248
- Ansari D. Update on the management of pancreatic cancer: surgery is not enough./D. Ansari, A. Gustafsson, R. Andersson. World J Gastroenterol. 2015 Mar 21;21(11):3157-65. i11.3157 DOI: 10.3748/wjg.v21
- Li D. Adjuvant and Neoadjuvant Therapy for Pancreatic Cancer/D. Li, E.M. O’Reilly.//Surg Oncol Clin N Am. 2016 Apr;25(2):311-26. ; DOI: 10.1016/j.soc.2015.11.010
- Kang MJ. Surgical resection of pancreatic head cancer: What is the optimal extent of surgery?/M.J. Kang, J.Y. Jang, S.W Kim.//Cancer Lett. 2016 Jan 29. pii: S0304-3835(16)30014-3. doi: 10.1016/j. canlet.2016.01.042;
- Giovinazzo F. Meta-analysis of benefits of portal-superior mesenteric vein resection in pancreatic resection for ductal adenocarcinoma./F. Giovinazzo, G. Turri, M.H. Katz, N3 Heaton, I. Ahmed.//Br J Surg. 2016 Feb;103(3):179-91. Epub 2015 Dec 10; DOI: 10.1002/bjs.9969
- Hackert T. Current State of Vascular Resections in Pancreatic Cancer Surgery./T. Hackert, L. Schneider, M.W. Buchler.//Gastroenterol Res Pract. 2015;2015:120207. ; DOI: 10.1155/2015/120207
- Takahashi S. Extra-tumor perineural invasion predicts postoperative development of peritoneal dissemination in pancreatic ductal adenocarcinoma./S. Takahashi, T. Hasebe, T. Oda, S. Sasaki, T. Kinoshita, M. Konishi, T. Ueda, T. Ochiai, A. Ochiai//Anticancer Res. 2001 Mar-Apr;21(2B):1407-12;
- Clark C.J. Clinical characteristics and overall survival in patients with anaplastic pancreatic cancer./C.J. Clark, J.S. Arun, R.P. Graham, L. Zhang, M. Farnell, K.M. Reid-Lombardo.//TAm Surg. 2014 Feb;80(2):117-23;
- Verbeke C.S. Resection margins and R1 rates in pancreatic cancer -are we there yet?/C.S.Verbeke//Histopathology. 2008 52:787-796;
- Verbeke C.S.Redefining the R1 resection in pancreatic cancer./D. Leitch, K.V. Menon, M.J. McMahon, PJ. Guillou, A. Anthoney.//Br J Surg. 2006 93:1232-1237.
- Esposito I. Most pancreatic cancer resections are R1 resections./I. EspositoJ. Kleeff, F. Bergmann, C. Reiser, E. Herpel, H. Friess.//Ann Surg Oncol. 2008 15:1651-1660.
- Calvo F. Intraoperative radiotherapy with electrons: fundamentals, results, and innovation. // F. Calvo, C. Sole, R. Herranz, M. Lopez-Bote, J. Pascau, A. Santos, A. Munoz-Calero, C. Ferrer, J. Garcia-Sabrido J. // Ecancermedicalscience. 2013 Aug 15;7:339 DOI: 10.3332/ecancer.2013.339
- Martinez-Noguera A. Radiologic history exhibit. Cesar Comas and Agusti Prio: pioneers and martyrs of Spanish radiology./A. Martinez-Noguera, E. Montserrat, T. Garcia, R. Larrosa, M. Clotet.//Radiographics. 1996 Sep;16(5):1215-20.
- Abe M. Intraoperative radiation therapy for gastric cancer./M. Abe, Y. Nishimura, Y. Shibamoto.//World J Surg. 1995 Jul-Aug;19(4):544-7.
- Krengli M. Clinical and technical characteristics ofintraoperative radiotherapy. Analysis of the ISIORT-Europe database./M. Krengli, F.A. Calvo, F. Sedlmayer, C.V. Sole, G. Fastner, M. Alessandro, S. Maluta, R. Corvo, E. Sperk, M. Litoborski, C. Pisani, C. Fillini, F. Fusconi, M.F. Osti, L. Tomio, H. Marsiglia, A. Ciabattoni, W. Polkowski, A. Di Grazia, A. Gava, A. Kuten, C. Iotti, C. Gonzalez, M. Sallabanda, J.B. Dubois, G. Catalano, V Valentini.//Strahlenther Onkol. 2013 Sep;189(9):729-37. Epub 2013 Jul 12 DOI: 10.1007/s00066-013-0395-1
- Jingu K. Intraoperative radiotherapy for pancreatic cancer: 30-year experience in a single institution in Japan./K. Jingu, T. Tanabe, K. Nemoto, H. Ariga, R. Umezawa, Y. Ogawa, K. Takeda, M. Koto, T. Sugawara, M. Kubozono, E. Shimizu, K. Abe, S. Yamada.//Int J Radiat Oncol Biol Phys. 2012 Jul 15;83(4):e507-11. doi: 10.1016/j. ijrobp.2012.01.024. Epub 2012 Mar 22.
- Vujaskovic Z.J. Structural and physiological properties of peripheral nerves after intraoperative irradiation./Z. Vujaskovic.//Peripher Nerv Syst. 1997;2(4):343-9.


