Целлюлолитические бактерии и ассоциация эффективных микроорганизмов для биоконтроля корневых гнилей сахарной свеклы (Beta vulgaris L.)
Автор: Смирнова И.Э., Саданов А.К.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биопрепараты и биозащита
Статья в выпуске: 5 т.54, 2019 года.
Бесплатный доступ
В настоящее время многие хозяйства, производящие сахарную свеклу ( Beta vulgaris L.), сокращают применение удобрений и не используют севообороты, что приводит к истощению почв, оскудению их микробоценоза и накоплению фитопатогенов, в частности грибов Fusarium Lk.:Fr. и Alternaria (Fr.) Keissi. Использование химических фунгицидов приводит к развитию устойчивости к ним у грибов, требующей увеличения дозы препаратов. В этой связи поиск микроорганизмов и разработка на их основе биопрепаратов для борьбы с патогенами растений становится все более актуальным. В представленной работе мы изучили антифунгальные свойства нового штамма целлюлолитических бактерий Bacillus sр. С-82/3 и создали с этим штаммом эффективную ассоциацию азотфиксирующих и фосфатмобилизующих бактерий, которая оказывает положительное действие на развитие и продуктивность растений сахарной свеклы. Нашей целью было выявление антифунгальных свойств целлюлолитических бактерий штамма Bacillus sр. С-82/3, его включение в состав ассоциации эффективных микроорганизмов (ЭМ-ассоциация) - Azotobacter chroococcum и Bacillus megaterium , оценка ростостимулирующей активности этой ЭМ-ассоциации и возможности ее применения для биоконтроля корневых гнилей и повышения продуктивности сахарной свеклы в полевых условиях. Штамм целлюлолитических бактерий Bacillus sр. С-82/3 был выделен из ризосферы здоровых растений сахарной свеклы на юго-востоке Казахстана (Жамбылская обл.). Антифунгальные свойства штамма С-82/3 изучали методом агаровых блоков в отношении основных возбудителей корневых гнилей сахарной свеклы: Alternaria alternata (Fr.) Keissl, Fusarium solani (Mart.) Sacc. и Fusarium oxysporum Schlecht. Штамм выращивали на среде Гетчинсона (К2НРО4 - 1,0 г/л, CaCl2 - 0,1 г/л, MgS04 - 0,3 г/л, NaNO3 - 2,5 г/л, NaCl - 1,0 г/л, FеСl3 - 0,01 г/л, пшеничная солома - 20,0 г/л, дрожжевой экстракт - 5,0 г/л, агар -20,0 г/л, pH 7,0) в течение 5 сут при температуре 28 °С, затем вырезали агаровые блоки, переносили на чашки Петри, предварительно засеянные культурами грибов, и инкубировали при 28 °С в течение 3 сут. Об антифунгальной активности судили по диаметру зоны подавления роста грибов. Для изучения стимуляции роста растений семена сахарной свеклы сорта Айсултан обрабатывали суспензией бактерий (штамм С-82/3 или ЭМ-ассоциация, содержащая этот штамм) с титром 1×107 кл/мл при температуре 23 °С в течение 2 ч. Через 30 сут выращивания в климатической камере (Constant Сlimate Сhamber HPP750, «Memmert GmbH + Co. KG», Германия) у проростков измеряли длину стеблей и корней и сравнивали их с контролем (вода). Полевые опыты проводили в фермерском хозяйстве «Кайынды» (Жамбылская обл., Республика Казахстан) в 2017-2018 годах. Антифунгальная активность нового штамма С-82/3 в отношении грибов F. ox-ysporum составляла 28,9±0,2 мм, F. solani - 38,2±0,3 мм, A. alternata - 46,6±0,9 мм. Показана его биосовместимость со штаммами азотфиксирующих и фосфатмобилизующих бактерий, что позволило создать новую ЭМ-ассоциацию, обладающую антифунгальной активностью и положительно влияющую на продуктивность сахарной свеклы. Как штамм С-82/3, так и ЭМ-ассоциация, состоящая из трех штаммов бактерий ( Bacillus megaterium, Azotobacter chroococcum и Bacillus sр. С-82/3), обладали высокой ростостимулирующей активностью: при выращивании в климатической камере всхожесть семян увеличивалась на 7-16 %, длина стеблей - в 1,2-1,5 раза, корней - в 1,1-2,0 раза по сравнению с контролем (р ≤ 0,05). В полевых опытах при обработке семян тестируемой бактериальной суспензией пораженность всходов сахарной свеклы коревыми гнилями снижалась в 2,3 раза, корнеплодов - в 3,0 раза, урожайность возрастала на 34,0±2,3 ц/га по сравнению с контролем (р ≤ 0,05). Таким образом, нами установлена высокая антифунгальная активность нового штамма Bacillus sр. С-82/3 и впервые показана возможность использования ЭМ-ассоциации с этим штаммом для биоконтроля возбудителей корневых гнилей сахарной свеклы и повышения ее урожайности в полевых условиях.
Сахарная свекла, биологический контроль, целлюлолитические бактерии, эм-ассоциация, антифунгальная активность, ростостимулирующая активность, фитопатогенные грибы, корневая гниль
Короткий адрес: https://sciup.org/142226254
IDR: 142226254 | УДК: 633.11:632.4:632.9:579.64 | DOI: 10.15389/agrobiology.2019.5.1041rus
Текст научной статьи Целлюлолитические бактерии и ассоциация эффективных микроорганизмов для биоконтроля корневых гнилей сахарной свеклы (Beta vulgaris L.)
Сахарная свекла (Beta vulgaris L.) — одна из основных технических культур. В мировом земледелии она занимает 7,913 млн га. В наибольшем
Исследования проведены при финансовой поддержке Министерства образования и науки Республики Казахстан (грантовый проект ¹ АР05131526).
количестве сахарная свекла производится в России, за которой следуют Франция и США (1, 2). В то же время выращивание сахарной свеклы наносит существенный урон почвам, поскольку с урожаем выносится значительное количество питательных элементов, что вызывает сокращение почвенной микробной массы и ее биоразнообразия (3-5). Кроме того, многие свеклосеющие хозяйства не применяют ротацию культур: высевают сахарную свеклу на одних и тех же полях в течение 5-7 лет (6, 7). Все это приводит к накоплению фитопатогенов, вызывающих болезни, в основном корневые гнили (8-10). Потери урожая культуры из-за поражения корневыми гнилями в России достигают 30 %, в Казахстане — 20-40 %, в Киргизии — 50 % (11-14). В других странах корневые гнили также наносят существенной урон (30-35 %) (15-17).
Современное сельское хозяйство характеризуется высокой степенью использования фунгицидов. Применение химических средств защиты растений создает определенные проблемы, причем негативное влияние фунгицидов со временем возрастает. Развивается устойчивость грибов к фунгицидам, требующая увеличения дозы препаратов (18-20). Из-за экологических нарушений все более острым становится вопрос о сокращении применения химических пестицидов. В качестве альтернативы выступают биологические методы защиты растений. Актуален поиск микроорганизмов и разработка на их основе биопрепаратов для борьбы с фитопатогенами растений (21-24).
В последнее время все чаще применяют ассоциации эффективных микроорганизмов (ЭМ-ассоциации), характеризующиеся более широким спектром биологической активности по сравнению с монокультурами микроорганизмов (25-27). В состав ЭМ-ассоциаций входят азотфиксиру-ющие, фосфатмобилизующие, целлюлолитические, силикатные и другие микроорганизмы, которые обладают защитно-стимулирующим действием: синтезируют и поставляют растениям необходимые вещества (ферменты, витамины, аминокислоты), улучшают азотное и фосфорное питание, что приводит к повышению урожайности и улучшению качества продукции (28, 29). При этом значительно сокращается применение минеральных удобрений и химических средств защиты растений, конечная продукция становится экологически чистой и безопасной для человека (30-32).
Ранее нами была создана ассоциация микроорганизмов, состоящая из штаммов азотфиксирующих бактерий Azotobacter chroococcum и фосфат-мобилизующих бактерий Bacillus megaterium , которая положительно влияла на продуктивность сахарной свеклы за счет улучшения азотного и фосфорного питания растений, но не обладала антифунгальной активностью.
Целлюлоза составляет основную массу растительных остатков в почве, в связи с чем целлюлолитические микроорганизмы относятся к важным компонентам микробоценозов и играют значительную роль в почвенных процессах (33, 34). Их содержание в почве служит показателем ее плодородия и экологического состояния (35). Способность целлюлолитических бактерий развиваться в ризосфере растений, синтезировать витамины группы В, аминокислоты и ферменты обеспечивает их высокую эффективность для биоконтроля патогенов растений (36, 37). Также среди целлюлолитических бактерий обнаружены активные антагонисты фитопа-тогенных грибов, вызывающих корневые гнили агрокультур (38, 39). В связи с этим представлялось перспективным включить в состав ЭМ-ассоциации целлюлолитические бактерии.
В представленной работе были изучены антифунгальные свойства нового штамма целлюлолитических бактерий Bacillus sр. С-82/3 и впервые создана ЭМ-ассоциация азотфиксирующих и фосфатмобилизующих бактерий с этим штаммом. Было показано, что ЭМ-ассоциация улучшает азотное и фосфорное питание растений, характеризуется антифунгальной активностью и продуцирует биологически активные вещества, что оказывает положительное действие на развитие и продуктивность растений сахарной свеклы.
Нашей целью была оценка антифунгальных свойств целлюлолитического штамма Bacillus sр. С-82/3, его включение в состав ассоциации эффективных микроорганизмов, определение ростостимулирующей активности ЭМ-ассоциации и возможности ее применения для биоконтроля корневых гнилей и повышения продуктивности сахарной свеклы в полевых условиях.
Методика . Штамм целлюлолитических бактерий Bacillus sр. С-82/3 был выделен из ризосферы здоровых растений сахарной свеклы на юго-востоке Казахстана (Жамбылская обл.). Штамм выращивали на среде Гетчинсона, следующего состава: К2НРО4 (1,0 г/л), CaCl2 (0,1 г/л), MgS04 (0,3 г/л), NaNO3 (2,5 г/л), NaCl (1,0 г/л), FеС1з (0,01 г/л), пшеничная солома (20,0 г/л), дрожжевой экстракт (5,0), вода водопроводная (1 л). В качестве тест-культур при оценке антифунгальной активности Bacillus sр. С-82/3 использовали три штамма фитопатогенных грибов — Alternaria al-ternata (Fr.) Keissl, Fusarium solani (Mart.) Sacc. и Fusarium oxysporum Schlecht, вызывающих корневые гнили сахарной свеклы (штаммы были любезно предоставлены сотрудниками ТОО НПЦ микробиологии и вирусологии). Эти грибы были проверены согласно принципам триады Коха и характеризовались высокой патогенностью.
Грибы культивировали на картофельно-декстрозном агаре (КДA) («Himedia», Индия) в течение 10 сут при 25 ° C и хранили при 4 ° C. Анти-фунгальные свойства штамма определяли методом агаровых блоков (40). В расплавленную и остуженную до 40 ° С среду КДА вносили суспензию конидий фитопатогенных грибов (108 КОЕ/мл) из расчета 1 мл/100 мл среды и разливали в чашки Петри. Целлюлолитические бактерии выращивали на среде Гетчинсона в течение 5 сут при 28 ° С, затем из растущей культуры буром (диаметр 7 мм) вырезали блоки, переносили их на чашки Петри, предварительно засеянные культурами фитопатогенных грибов, и оставляли на 72 ч при 28 ° С. Контролем служили блоки, вырезанные из чистых сред. Об антифунгальной активности судили по диаметру зоны подавления роста грибов.
Биосовместимость штаммов ЭМ-ассоциации изучали методом перпендикулярных штрихов (41).
Для оценки ростостимулирующей способности разработанной ЭМ-ассоциации входящие в нее штаммы бактерий выращивали отдельно на элективных средах: целлюлолитические бактерии С-82/3 — на среде Гетчинсона, азотфиксирующие — на среде Эшби, фосфатмобилизующие — на среде Муромцева (28 ° С, на шейкере при 180 об/мин). После этого полученные суспензии бактерий с титром 1 x 10 7 кл/мл смешивали в соотношении 1:1:1. Семена сахарной свеклы сорта Айсултан инокулировали штаммом С-82/3 или ЭМ-ассоциацией, содержащей все три штамма. Титр суспензий штамма и ассоциации составлял 1 x 10 7 кл/мл, обработка семян проводилась в течение 2 ч при 23 ° С. Затем семена высевали в сосуды с 300 г почвы. Отрицательным контролем были семена, обработанные стерильной водой (42).
Субстратом для выращивания сахарной свеклы служила почва, собранная на полях фермерского хозяйства «Кайынды» (Жамбылская обл.,
Республика Казахстан). Тип почвы — серозем обыкновенный с содержанием гумуса 1,2 %, легкогидролизуемого азота — 36,6 мг/кг, подвижного фосфора — 16,4 мг/кг, подвижного калия — 342,5 мг/кг почвы. Через 30 сут измеряли длину стеблей и корней у растений. Эксперименты проводили в климатической камере для выращивания растений (Constant Сlimate Сham-ber HPP750, «Memmert GmbH + Co. KG», Германия). Дневной режим — 12 ч, температура 24-26 ° С, холодный белый свет 6500 К, теплый свет 2700 К; ночной режим — 11 ч, 17-19 ° С; автоматическая регулировка влажности (от 60 до 75 %). Повторность опытов 3-кратная (по 10 растений на повторность).
В полевых условиях ЭМ-ассоциацию, состоящую из трех штаммов бактерий ( Bacillus megaterium , Azotobacter chroococcum и Bacillus sр. С-82/3), тестировали в течение 2 лет (2017-2018 годы) на полях фермерского хозяйства «Кайынды». Почва — серозем обыкновенный с содержанием гумуса 1,2-1,5 %, легкогидролизуемого азота — 34,6 мг/кг почвы, подвижного фосфора — 14,0 мг/кг, подвижного калия — 350 мг/кг почвы. Предшественник — сахарная свекла. Повторность опытов 3-кратная, размещение вариантов систематическое. Семена обрабатывали ЭМ-ассоциацией с титром бактериальной суспензии 1 x 10 7 кл/мл из расчета 50 мл суспензии на 1 кг семян с увлажнением (расход воды 1 л/кг). Длительность обработки составляла 2 ч. Положительным контролем служили семена, обработанные химическими препаратами ТМТД 80 % («Август», Россия) и Скор® (Score®, «Syngenta AG», Швейцария) в количестве соответственно 6,0 кг/т и 0,4 л/га (эти фунгициды рекомендованы к применению в Казахстане для защиты сахарной свеклы от семенных и почвенных грибных инфекций). Отрицательным контролем служили необработанные семена. В опытах применяли общепринятую для указанной зоны земледелия агротехнику выращивания свеклы. Все опыты проводили в 3-5-кратной повторности. Всхожесть, пораженность корневыми инфекциями, урожайность, сахаристость и сбор сахара оценивали общепринятыми методами.
Статистическую обработку результатов осуществляли с использованием пакета программ STATISTICA 10.0 (StatSoft Inc.», США) (43). В таблицах и на рисунках представлены средние значения ( M ) и их стандартные отклонения (±SD) при р < 0,05.
Результаты . Бактерии рода Bacillus обитают в ризосфере растений (44) и известны как продуценты различных метаболитов. Наиболее важные биологически активные вещества, синтезируемые этими бактериями, — пептиды, липопептиды, поликетидные соединения, бактериоцины и сидерофоры (45). Также представители рода Bacillus характеризуются антагонистической активностью в отношении патогенов растений (46, 47) и оказывают ростостимулирующее влияние на сельскохозяйственные культуры (38, 48). Исследуемый штамм бактерий С-82/3 был отнесен к роду Bacillus , и предполагалось, что он обладает свойствами, присущими этому роду. Кроме того, целлюлолитические бактерии проявляют высокую антифун-гальную активность по отношению к грибным фитопатогенам, вызывающим болезни агрокультур (49, 50). В наших опытах при лабораторной оценке антифунгальной активности штамма С-82/3 диаметр зоны подавления роста тест-культур составил 28,9±0,2 мм для F. oxysporum , 38,2±0,3 мм для F. solani и 46,6±0,9 мм для A. alternata . Такая видовая специфичность влияния бактерий на фитопатогенные грибы согласуется с результатами, полученными другими авторами (22, 24).
Созданная нами ранее ассоциация, состоящая из штаммов азот- фиксирующих бактерий Az. chroococcum и фосфатмобилизующих бактерий B. megaterium, влияла на урожайность сахарной свеклы в полевых условиях. Это связано с тем, что штаммы, входящие в состав ассоциации улучшают азотное и фосфорное питание растений (данные не приведены). Однако ассоциация не обладала антифунгальной активностью по отношению к возбудителям корневых гнилей. Для биоконтроля фитопатогенов в состав ассоциации необходимо было включить бактерии-антагонисты.
Эффективность ассоциации определяется совокупностью биологических свойств штаммов, входящих в ее состав (51, 52). При разработке ЭМ-ассоциаций очень важно учитывать возможность сочетания в них штаммов. Главным показателем при создании ассоциации становится био- совместимость, то есть наличие или отсутствие антагонизма между штам-
А Б
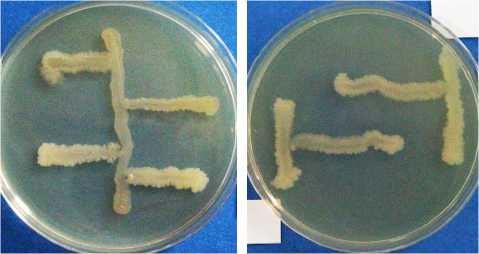
Рис. 1. Биосовместимость штаммов фосфатмобилизую-щих бактерий Bacillus megaterium (А; горизонтальные штрихи) , азотфиксирующих бактерий Azotobacter chroo-coccum (Б; горизонтальные штрихи) , входящих в состав ассоциации агрономически эффективных микроорганизмов, предназначенной для применения на сахарной свекле, и целлюлолитических бактерий Bacillus sр. С-82/3 (А, Б; вертикальные штрихи) .
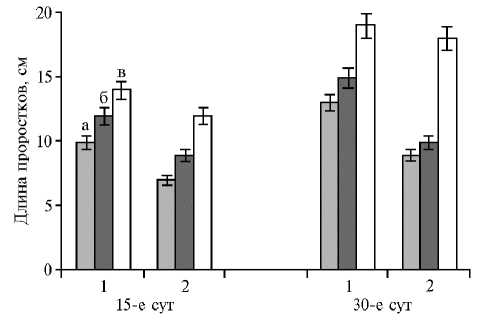
Рис. 2. Развитие стеблей (1) и корней (2) у проростков сахарной свеклы ( Beta vulgaris L.) сорта Айсултан при выращивании в условиях климатической камеры в зависимости от предпосевной обработки семян: а — контроль (без обработки), б — обработка Bacillus sр. С-82/3, в — обработка ЭМ-ассоциацией, состоящей из штаммов Bacillus megaterium , Azotobacter chroococcum и Bacillus sр. С-82/3.
мами-партнерами.
Для оценки биосовместимости штаммов, входящих в состав ассоциации, и штамма С-82/3, мы использовали метод перпендикулярных штрихов (41). Было установлено, что штаммы азотфиксирую-щих, фосфатмобилизующих и целлюлолитических бактерий С-82/3 не подавляли рост и развитие друг друга (рис. 1), то есть взаимоотношение между ними характеризовались отсутствием антагонизма. Полученный результат свидетельствовал о возможности включения штамма С-82/3 в состав ЭМ-ассоциации. Наличие биосовместимости между исследованными штаммами бактерий можно объяснить тем, что при сосуществовании в почве эти физиологические группы не конкурируют за источники питания (53). В природных условиях они не становятся антагонистами, то есть не синтезируют вторичных метаболитов, используя которые могут отрицательно влиять на рост и развитие друг друга (54).
Хорошо известно, что представители рода Bacillus доминируют в ризосфере растений (44). Они обладают высокой устойчивостью к внешним факторам среды и спо собностью к синтезу биологически активных веществ (28, 29). В ряде работ указывается, что за счет биосинтеза этих веществ бактерии рода Bacillus способны стимулировать развитие растений (55, 56).
В климатической камере при выращивании растений свеклы из семян, обработанных штаммом С-82/3 и ЭМ-ассоциацией, включающей три штамма бактерий, было установлено, что они обладали ростостимулирующими свойствами (рис. 2). Так, средняя длина стеблей при обработке штаммом С-82/3 увеличилась в 1,2±0,1, корней — в 1,1±0,1 раза по сравнению с контролем (р ≤ 0,05); при применении ЭМ-ассоциации показатели увеличивались соответственно в 1,5±0,1 и 2,0±0,3 раза (р ≤ 0,05). Предпосевная обработка семян штаммом С-82/3 и ЭМ-ассоциацией также повышала их всхожесть соответственно до 86±1,5 и 93±1,7 % (р ≤ 0,05); в контроле всхожесть семян составляла 80±1,3 % (р ≤ 0,05). В лабораторных тестах мы использовали семена сахарной свеклы сорта Айсултан, рекомендованного к возделыванию в юго-восточном регионе Казахстана.
Как уже отмечалось, ростостимулирующая способность ЭМ-ассоциации была обусловлена тем, что входящие в ее состав штаммы азот-фиксирующих бактерий Az. chroococcum и фосфатмобилизующих бактерий B. megaterium улучшают азотное и фосфорное питание растений; штамм Bacillus sр. С-82/3, возможно, синтезирует витамины, аминокислоты и фитогормоны. Способность бациллярного штамма С-82/3 синтезировать вторичные метаболиты, стимулирующие рост растений, согласуется с данными литературы (28, 55, 56). Кроме того, штамм С-82/3 образует ферменты целлюлазы, которые могут частично разрушать твердую оболочку семян и за счет этого повышать их всхожесть (39).
Полевые испытания показали высокую эффективность ЭМ-ассоциации, состоящей из штаммов B. megaterium , Az. chroococcum и Bacillus sр. С-82/3, в качестве агента биоконтроля фитопатогенных грибов родов Fusarium и Alternaria , вызывающих корневые гнили сахарной свеклы. Фитопатогены поражали растения в течение всего вегетационного периода, начиная с фазы 1-й пары листьев и до уборки корнеплодов. Первые признаки корневой гнили появлялись уже в конце мая—начале июня, их распространение достигало максимума к сбору урожая (конец сентября— начало октября). Применение ЭМ-ассоциации снижало пораженность всходов сахарной свеклы в 2,3 раза, корнеплодов — в 3,0 раза по сравнению с контролем (табл. 1).
1. Всхожесть и пораженность корневыми инфекциями у проростков сахарной свеклы ( Beta vulgaris L.) сорта Айсултан в полевых условиях в зависимости от предпосевной обработки семян ( M ±SD, фермерское хозяйство «Кайын-ды», Жамбылская обл., Республика Казахстан, 2017-2018 годы)
|
Вариант |
Густота всходов, шт/м2 |
Корневые инфекции, % |
|
|
«черная ножка» проростков |
фузариозные гнили корней |
||
|
ЭМ-ассоциация |
74,3±2,4* |
17,2±1,1* |
7,1±0,9* |
|
ТМТД + Скор® (эталон) |
72,7±2,1* |
18,5±1,4* |
10,0±0,8 |
|
Контроль (без обработки) |
68,2±1,9 |
40,3±2,3 |
21,6±1,3 |
П р и м еч а ни е. В состав ЭМ-ассоциации входили бактерии Bacillus megaterium , Azotobacter chroococcum и Bacillus sр. С-82/3. В варианте с химическими обработками применяли препараты ТМТД 80 % («Август», Россия) и Скор® (Score®, «Syngenta AG», Швейцария) в дозе соответственно 6,0 кг/т и 0,4 л/га.
* Различия с контролем статистически значимы при р < 0,05.
Также микроорганизмы положительно влияли на продуктивность и качественные показатели корнеплодов (табл. 2). При применении ЭМ-ассоциации урожайность сахарной свеклы по сравнению с контролем увеличилась на 34±2,3 ц/га, или на 12,6±1,1 % (р ≤ 0,05), сахаристость корнеплодов — на 4,0 %, сбор сахара — на 9,0 ц/га. Следует отметить, что обработка семян ассоциацией существенно не влияла на биомассу надземной части сахарной свеклы (данные не приведены), что особенно важно для культур, у которых для производственных целей используется корневая часть растений (21).
2. Урожайность и качественные показатели корнеплодов у сахарной свеклы ( Beta vulgaris L.) сорта Айсултан в полевых условиях в зависимости от предпосевной обработки семян ( M ±SD, фермерское хозяйство «Кайынды», Жам-былская обл., Республика Казахстан, 2017-2018 годы)
|
Вариант |
Урожайность, ц/га |
Прибавка к контролю ц/га 1 % |
Сахаристость, % |
Сбор сахара, ц/га |
ЭМ-ассоциация 304,0±10,4* 34,0±2,3* 12,6±1,1* 14,9±1,1 58,0±2,1*
ТМТД + Скор® (эталон) 282,0±9,8* 12,0±0,9* 7,1±0,2 13,5±0,8* 54,7±1,9*
Контроль (без обработки) 270,0±7,9 11,2±0,5 48,9±1,5
П р и м е ч а н и е. В состав ЭМ-ассоциации входили бактерии Bacillus megaterium , Azotobacter chroococcum и Bacillus sр. С-82/3. В варианте с химическими обработками применяли препараты ТМТД 80 % («Август», Россия) и Скор® (Score®, «Syngenta AG», Швейцария) в дозе соответственно 6,0 кг/т и 0,4 л/га. * Различия с контролем статистически значимы при р < 0,05.
Полученные результаты согласуются с исследованиями, в которых отмечается повышение продуктивности сельскохозяйственных культур при использовании эффективных микроорганизмов (57, 58). Во многих работах была установлена их ростостимулирующая активность (27, 48, 59). Однако ранее эффективные микроорганизмы применялись только для биоконтроля грибных патогенов (46, 60) либо стимуляции роста культур (42, 55). Также использовалась способность этих микроорганизмов синтезировать биологически активные метаболиты (47, 61). Созданная нами ЭМ-ассоциация характеризуется комплексным действием: улучшает азотное и фосфорное питание растений, обладает антифунгальной активностью, продуцирует биологически активные вещества, стимулирует рост и развитие растений сахарной свеклы, что способствует повышению ее продуктивности и сахаристости корнеплодов.
Таким образом, установлена высокая антифунгальная активность нового штамма целлюлолитических бактерий Bacillus sр. С-82/3 по отношению к фитопатогенным грибам, вызывающим корневые гнили сахарной свеклы. Показана его биосовместимость со штаммами азотфиксирующих и фосфатмобилизующих бактерий, что позволило создать новую ассоциацию эффективных микроорганизмов (ЭМ-ассоциацию), обладающую антифун-гальной активностью и положительно влияющую на показатели продуктивности и качества у сахарной свеклы. В условиях климатической камеры доказана способность штамма и ЭМ-ассоциации повышать всхожесть семян и стимулировать развитие растений сахарной свеклы. Проведенные 2-летние полевые испытания ЭМ-ассоциации на юго-востоке Казахстана показали возможность ее интродукции в почвенные биоценозы с целью биоконтроля корневых гнилей, вызванных грибами родов Fusarium и Al-ternaria . Применение ЭМ-ассоциации снизило пораженность всходов грибными инфекциями в 2,3 раза, уменьшило гниль корнеплодов в 3,0 раза, при этом урожайность возросла на 12,6 %, а сбор сахара — на 9,0 %. Кроме положительного влияния на урожайность сахарной свеклы, ЭМ-ассоциация обеспечила получение корнеплодов с повышенным содержанием сахарозы. Доказанная высокая эффективность ЭМ-ассоциации свидетельствует о целесообразности ее использования в качестве агента биоконтроля в растениеводстве России, Казахстана и других сопредельных стран со схожими природно-климатическими условиями.
Список литературы Целлюлолитические бактерии и ассоциация эффективных микроорганизмов для биоконтроля корневых гнилей сахарной свеклы (Beta vulgaris L.)
- Solomon S., Quirk R.G., Shukla S.K. Green management for sustainable sugar industry. Sugar Tech., 2019, 21(2): 183-185 ( ). DOI: 10.1007/s12355-019-00711-2
- Терещенкова И.А. Тенденции развития мирового рынка сахара. Вестник Белорусской государственной сельскохозяйственной академии, 2015, 4: 11-14.
- Кириллов Н.А., Волков А.И., Прохорова Л.H. Приемы повышения урожайности корнеплодов на дерново-подзолистых почвах Чувашии. Сахарная свекла, 2013, 1: 23-27.
- Paramasivan M., Chandrasekaran A., Mohan S., Muthukrishnan N. Ecological management of tropical sugar beet (TSB) root rot by rhizosphere Trichoderma species. Archives of Phytopathology and Plant Protection, 2014, 47(13): 1629-1644 ( ). DOI: 10.1080/03235408.2013.853460
- Mahmoud A.F. Suppression of sugar beet damping-off caused by Rhizoctonia solani using bacterial and fungal antagonists. Archives of Phytopathology and Plant Protection, 2016, 49(19-20): 575-585 ( ). DOI: 10.1080/03235408.2016.1245052
- Мауи А.А. Влияние предшественников на снижение вредоносности фузариозной гнили сахарной свеклы. Новости науки Казахстана, 2014, 2(120): 63-70.
- Мерзалиев К., Кулькеев Е.Е., Альдеков Н.А., Аманова К.С. Эффективность использования иностранных гибридов и сортов сахарной свеклы в луговых и сероземных почвах юга Казахстана. Вестник сельскохозяйственных наук Казахстана, 2016, 1-2: 21-25.
- Abd-El-Khair H., Abd-El-Fattah A.I., El-Nagdi W.M.A. Evaluation of five sugar beet varieties for root-knot nematode and root-rot fungal infection. Arch. Phytopath. Plant Prot., 2013, 46(18): 2163-2173 ( ).
- DOI: 10.1080/03235408.2013.785660
- Mahmoud A.F. Occurrence of Fusarium wilt on summer squash caused by Fusarium oxysporum in Assiut, Egypt. Journal of Phytopathology and Pest Management, 2016, 3(1): 34-45.
- Mahmoud A.F. Evaluation of certain antagonistic fungal species for biological control of faba bean wilt disease incited by Fusarium oxysporum. Journal of Phytopathology and Pest Management, 2016, 3(2): 1-14.
- Мауи А.А., Исмухамбетов Ж.Д. Комплексная система защиты посевов сахарной свеклы от вредителей, болезней и сорняков для условий юга и юго-востока Казахстана. Алматы, 2012.
- Селиванова Г.А. Болезни сахарной свеклы при интенсификации технологии выращивания культуры. Земледелие, 2013, 4: 31-37.
- Стогниенко О.И., Шамин А.А. Влияние агротехники на почвенную и ризосферную биоту и распространенность микозов сахарной свеклы. Защита и карантин растений, 2014, 8: 12-15.
- Шамин А.А., Стогниенко О.И., Боротов О.К. Влияние элементов агротехники на формирование фитопатогенного комплекса возбудителей и развитие микозов корневой системы сахарной свеклы. Земледелие, 2013, 4: 35-38.
- Strausbaugh C.A., Gillen A.M. Sugar beet root rot at harvest in the US Intermountain West. Canadian Journal of Plant Pathology, 2009, 31(2): 232-240 ( ).
- DOI: 10.1080/07060660909507596
- Karimi E., Sadeghi A., Dahaji P.A., Dalvand Y., Omidvari M., Nezhad М.К. Biocontrol activity of salt tolerant Streptomyces isolates against phytopathogens causing root rot of sugar beet. Biocontrol Science and Technology, 2012, 22(3): 333-349 ( ).
- DOI: 10.1080/09583157.2012.658552
- Webb K.M., Brenner T., Jacobsen B.J. Temperature effects on the interactions of sugar beet with Fusarium yellows caused by Fusarium oxysporum f. sp. betae. Canadian Journal of Plant Pathology, 2015, 37(3): 353-362 ( ).
- DOI: 10.1080/07060661.2015.1071283
- Gossen B.D., Carisse O., Kawchuk L.M., van der Heyden H., McDonald M.R. Recent changes in fungicide use and the fungicide insensitivity of plant pathogens in Canada. Canadian Journal of Plant Pathology, 2014, 36(3): 327-340 ( ).
- DOI: 10.1080/07060661.2014.925506
- Prior R., Mittelbach M., Begerow D. Impact of three different fungicides on fungal epi- and endophytic communities of common bean (Phaseolus vulgaris) and broad bean (Vicia faba). Journal of Environmental Science and Health, Part B, 2017, 52(6): 376-386 ( ).
- DOI: 10.1080/03601234.2017.1292093
- Wedge D.E., Сurry J.K., Kreiser B., Curry A., Abril M., Smith B.J. Fungicide resistance profiles for 13 Botrytis cinerea isolates from strawberry in Southeastern Louisiana. International Journal of Fruit Science, 2013, 13(4): 413-429 ( ).
- DOI: 10.1080/15538362.2013.789253
- Шабаев В.П. Отзывчивость растений сахарной свеклы на инокуляцию не фиксирующими азот и азотфиксирующими бактериями рода Pseudomonas на черноземе выщелоченном. Сельскохозяйственная биология, 2005, 3: 55-61.
- Треножникова Л.П., Балгимбаева А.С., Ултанбекова Г.Д., Галимбаева Р.Ш. Антифунгальная активность против патогенов зерновых культур и изучение антибиотика штамма Streptomyces sp. К-541, выделенного из экстремальных экосистем Казахстана. Сельскохозяйственная биология, 2018, 53(1): 96-102 ( ).
- DOI: 10.15389/agrobiology.2018.1.96rus
- Abeer H., Asma A.H., Allah A., Qarawi A., Shalawi A., Dilfuza E. Impact of plant growth-promoting Bacillus subtilis on growth and physiological parameters of Bassia indica (Indian Bassia) grown under salt stress. Pakistan Journal of Botany, 2015, 47(5): 1735-1741.
- Bjelić D., Marinković J., Tintor B., Mrkovački N. Antifungal and plant growth promoting activities of indigenous rhizobacteria isolated from maize (Zea mays L.) rhizosphere. Communications in Soil Science and Plant Analysis, 2018, 49(1): 88-98 ( ).
- DOI: 10.1080/00103624.2017.1421650
- Talaat N.B. Effective microorganisms improve growth performance and modulate the ROS-scavenging system in common bean (Phaseolus vulgaris L.) plants exposed to salinity stress. J. Plant Growth Regul., 2015, 34(1): 35-46 ( ).
- DOI: 10.1007/s00344-014-9440-2
- Bzdyk R.M., Olchowik J., Studnicki M., Oszako T., Sikora K., Szmidla H., Hilszczańska D. The impact of effective microorganisms (EM) and organic and mineral fertilizers on the growth and mycorrhizal colonization of Fagus sylvatica and Quercus robur seedlings in a bare-root nursery experiment. Forests, 2018, 9: 597-610 ( ).
- DOI: 10.3390/f9100597
- Hu C., Qi Y. Long-term effective microorganisms application promote growth and increase yields and nutrition of wheat in China. European Journal of Agronomy, 2013, 46: 63-67 ( ).
- DOI: 10.1016/j.eja.2012.12.003
- Ndona R.K., Friede J.K., Spornberger A., Jezik K. Effective microorganisms (EM): an effective plant strengthening agent for tomatoes in protected cultivation. Biological Agriculture & Horticulture, 2011, 27(2): 189-204 ( ).
- DOI: 10.1080/01448765.2011.9756647
- Mayer J., Scheid S., Widmer F., Fliebach A., Oberholzer H.-R. How effective are effective microorganisms (EM). Results from a field study in temperate climate. Applied Soil Ecology, 2010, 46(2): 230-239 ( ).
- DOI: 10.1016/j.apsoil.2010.08.007
- Kleiber T., Starzyk J., Bosiacki M. Effect of nutrient solution, effective microorganisms (EM-A), and assimilation illumination of plants on the induction of the growth of lettuce (Lactuca sativa L.) in hydroponic cultivation. Acta Agrobot., 2013, 66(1): 27-38 ( ).
- DOI: 10.5586/aa.2013.004
- Chudasama K.S., Thaker V.S. Screening of potential antimicrobial compounds against Xanthomonas campestris from 100 essential oils of aromatic plants used in India: an ecofriendly approach. Archives of Phytopathology and Plant Protection, 2012, 45(7): 783-795 ( ).
- DOI: 10.1080/03235408.2011.595967
- Zameer M., Zahid H., Tabassum B., Ali Q., Nasir I.A., Saleem M., Butt S.J. PGPR potentially improve growth of tomato plants in salt-stressed environment. Turkish Journal of Agriculture - Food Science and Technology, 2016, 4(6): 455-463 ( ).
- DOI: 10.24925/turjaf.v4i6.455-463.614
- Saini J.K., Saini R., Tewari L. Simultaneous isolation and screening of cellulolytic bacteria: selection of efficient medium. Journal of Pure and Applied Microbiology, 2012, 6(3): 1339-1344.
- Zhao Y.-N., Zhang Y.-Q., Du H.-X., Wang Y.-H., Zhang L.-M., Shi X.-J. Carbon sequestration and soil microbes in purple paddy soil as affected by long-term fertilization. Toxicological & Environmental Chemistry, 2015, 97(3-4): 464-476 ( ).
- DOI: 10.1080/02772248.2015.1050200
- Шмидт К.Н., Худайгулов Г.Г. Выделение новых штаммов-деструкторов целлюлозы, их роль в снижении антропогенной нагрузки на экосистему. Вестник ЮУрГУ. Серия Пищевые и биотехнологии, 2016, 4(4): 54-63.
- Наплекова Н.Н. Метаболиты аэробных целлюлозолитических микроорганизмов и их роль в почвах. Новосибирск, 2010.
- Ang S.K., Yahya A., Aziz S.A., Salleh M.M. Isolation, screening, and identification of potential cellulolytic and xylanolytic producers for biodegradation of untreated oil palm trunk and its application in saccharification of lemongrass leaves. Preparative Biochemistry and Biotechnology, 2015, 45(3): 279-305 ( ).
- DOI: 10.1080/10826068.2014.923443
- Смирнова И.Э. Целлюлолитические бактерии в защите сельскохозяйственных растений от фитопатогенных грибов. Микология и фитопатология, 2004, 38(2): 89-93.
- Smirnova I.E., Sadanov A.K., Galimbaeva R.Sh. Biological method for improving germinating and productivity of melilot. In: Recent trends in PGPR research for sustainable crop productivity /M.S. Reddy, R.I. Ilao, P.S. Faylon (eds). Jodhpur-Delhi-Germany, 2016: 21-28.
- Егоров Н.С. Основы учения об антибиотиках. М., 2004.
- Семенов А.В., Сгибнев А.В., Черкасов С.В., Бухарин О.В. Бактериальная регуляция антагонистической активности бактерий. Бюллетень экспериментальной биологии и медицины, 2007, 144: 702-705.
- Vessey J.K. Plant growth promoting rhizobacteria as biofertilizers. Plant Soil, 2003, 255(2): 571-586 (doi: 10.1023/A:1026037216893).
- Боровиков В.П. Популярное введение в современный анализ данных в системе STATISTICA. М., 2013.
- Felske A.D.M. Ecology of Bacillus species in soil. In: Bacterial spore formers: probiotics and emerging applications /E. Ricca, A.O. Henriques, S.M. Cutting (eds.). Horizon Bioscience, Norfolk, 2004: 35-44.
- Fira D., Dimkić I., Berić T., Lozo J., Stanković S. Biological control of plant pathogens by Bacillus species. Journal of Biotechnology, 2018, 285: 44-55 ( ).
- DOI: 10.1016/j.jbiotec.2018.07.044
- Cao Y., Xu Z., Ling N., Yuan Y., Yang X., Chen L., Shen B., Shen Q. Isolation and identification of lipopeptides produced by B. subtilis SQR 9 for suppressing Fusarium wilt of cucumber. Scientia Horticulturae, 2012, 135: 32-39 ( ).
- DOI: 10.1016/j.scienta.2011.12.002
- Guo Q., Dong W., Li S., Lu X., Wang P., Zhang X., Wang Y., Ma P. Fengycin produced by Bacillus subtilis NCD-2 plays a major role in biocontrol of cotton seedling damping-off disease. Microbiological Research, 2014, 169(7-8): 533-540 ( ).
- DOI: 10.1016/j.micres.2013.12.001
- Pérez-García A., Romero D., de Vicente A. Plant protection and growth stimulation by microorganisms: biotechnological applications of Bacilli in agriculture. Current Opinion in Biotechnology, 2011, 22(2): 187-193 ( ).
- DOI: 10.1016/j.copbio.2010.12.003
- Hinarejos E., Castellano M., Rodrigo I., Bellés J.M., Conejero V., López-Gresa M.P., Lisón P. Bacillus subtilis IAB/BS03 as a potential biological control agent. Eur. J. Plant Pathol., 2016, 146(3): 597-608 ( ).
- DOI: 10.1007/s10658-016-0945-3
- Смирнова И.Э., Койшибаев М.К., Талип Ж.Ш. Биологическая защита сельскохозяйственных растений от фитопатогенных грибов. Новости науки Казахстана, 2008, 2: 124-126.
- Dardanelli M.S., De Córdoba F.J.F., Espuny M.R., Carvajal M.A.R., Díaz M.E.S., Serrano A.M.G., Okon Y., Megías M. Effect of Azospirillum brasilense coinoculated with Rhizobium on Phaseolus vulgaris flavonoids and Nod factor production under salt stress. Soil Biology and Biochemistry, 2008, 40(11): 2713-2721 ( ).
- DOI: 10.1016/j.soilbio.2008.06.016
- Askary M., Mostajeran A., Amooaghaei R., Mostajeran M. Influence of the coinoculation Azospirillum brasilense and Rhizobium meliloti plus 2,4-D on grain yield and N, P, K content of Triticum aestivum (cv. Baccros and Mahdavi). American-Eurasian J. Agric. Environ. Sci., 2009, 5(3): 296-307.
- Packialakshmi N., Yasotha C. Role of effective microorganism in unfertile soil. Int. J. Phytopharm., 2014, 4(1): 25-27.
- Gobbetti M., Cagno R.D., De Angelis M. Functional microorganisms for functional food quality. Critical Reviews in Food Science and Nutrition, 2010, 50(8): 716-727 ( ).
- DOI: 10.1080/10408398.2010.499770
- Коптева Т.С., Ерина Н.В. Заикина И.А. Ростостимулирующая активность некоторых представителей рода Bacillus филлоплана древесных растений г. Ставрополя. Научный журнал КубГАУ, 2015, 114(10): 1-10.
- Nautiyal C.S., Srivastava S., Chauhan P.S., Seem K., Mishra A., Sopory S.K. Plant growth-promoting bacteria Bacillus amyloliquefaciens NBRISN13 modulates gene expression profile of leaf and rhizosphere community in rice during salt stress. Plant Physiology and Biochemistry, 2013, 66: 1-9 ( ).
- DOI: 10.1016/j.plaphy.2013.01.020
- Iriti M., Scarafoni A., Pierce S., Castorina G., Vitalini S. Soil application of Effective Microorganisms (EM) maintains leaf photosynthetic efficiency, increases seed yield and quality traits of bean (Phaseolus vulgaris L.) plants grown on different substrates. International Journal of Molecular Sciences, 2019, 20(9): 2327-2335 ( ).
- DOI: 10.3390/ijms20092327
- Ncube L., Minkeni P.N.S., Brutsch O. Agronomic suitability of effective microorganisms for tomato production. African Journal of Agricultural Research, 2011, 6(3): 650-654.
- Souza R., Ambrosini A., Passaglia L.M.P. Plant growth-promoting bacteria as inoculants in agricultural soils. Genetics and Molecular Biology, 2015, 38(4): 401-419 ( ).
- DOI: 10.1590/S1415-475738420150053
- Patkowska E., Konopiński M. Antagonistic activity of selected bacteria occurring in the soil after root chicory cultivation. Plant, Soil and Environment, 2018, 60(7): 320-324 ( ).
- DOI: 10.17221/283/2014-PSE
- Singh R., Kumar M, Mittal A., Mehta Р.К. Microbial metabolites in nutrition, healthcare and agriculture. 3 Biotech, 2017, 7(1): 4-14 ( ).
- DOI: 10.1007/s13205-016-0586-4


