Центрально-опосредованные желудочно-кишечные болевые расстройства: обзор основных положений IV Римского консенсуса
Автор: Лысов Н.А., Осадчук М.М., Осадчук А.М.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 (25), 2017 года.
Бесплатный доступ
Критический обзор основных положений IV Римского консенсуса по вопросам центрально-опосредованных желудочно-кишечных расстройств. Показано, что учение о центрально опосредованном желудочно-кишечном болевом расстройстве претерпело значительное изменение после выхода в свет Римского консенсуса IV. Причинными факторами несостоятельности регуляторных взаимоотношений оси «мозг - ЖКТ» называются комбинированные морфологические и физиологические отклонения, связанные с нарушениями моторики ЖКТ, слизистого барьера, иммунной функции, кишечной микробиотой, висцеральной гиперчувствительностью, а также расстройствами ЦНС. Все это послужило поводом исключения из названия ряда описываемых Римским консенсусом расстройств слова «функциональные». Также диагноз «функциональный абдоминальный болевой синдром» изменен на синдром центрально-индуцированной абдоминальной боли (СЦИАБ), как в большей степени соответствующий патогенезу этого расстройства и отражающий современную информацию о взаимодействии ЖКТ и ЦНС. Выделение наркотического кишечного синдрома (НКС) в отдельное функциональное расстройство, на первый взгляд, представляется нелогичным, так как данная патология индуцируется известным этиологическим фактором. С другой стороны, применение опиоидов изменяет взаимодействие между ЦНС и энтеральной нервной системы, что может сопровождаться развитием НКС. Таким образом, дефиниция НКС в рамках функциональной патологии не противоречит главным положениям принятого в 2016 году IV Римского консенсуса.
Центрально-опосредованные желудочно-кишечные болевые расстройства, римский консенсус iv
Короткий адрес: https://sciup.org/14344255
IDR: 14344255 | УДК: 616.381-009.7-085
Текст научной статьи Центрально-опосредованные желудочно-кишечные болевые расстройства: обзор основных положений IV Римского консенсуса
В IV Римском консенсусе описываются 2 расстройства, входящих в категорию D – центрально-опосредованных желудочно-кишечных болевых расстройств: D1 – синдром центрально-индуцированной абдоминальной боли (СЦИАБ) , ранее известный как синдром функциональной абдоминальной боли и новое расстройство – D2 – наркотический кишечный синдром (НКС)/синдром гастроинтестинальной гипералгезии, индуцированной опиоидами . СЦИАБ является более редким синдромом по сравнению с другими функциональными нарушениями желудочно-кишечного тракта (ЖКТ) такими, как функциональная изжога, функциональная диспепсия (ФД) или синдром раздраженного кишечника (СРК). Его распространенность составляет 0,5–2,1 %. СЦИАБ в 1,5–2 раза чаще регистрируется у женщин. Пик распространенности приходится на 35–44 года, а затем уменьшается. Приблизительно 80 % 36
пациентов со СЦИАБ консультировалось у врача, и половина из них посещают врача 1–3 раз в год. Эти показатели в 4 раза превышают таковые у лиц без СЦИАБ. Статистические исследования, проведенные в США, показали, что больные со СЦИАБ, в среднем, имели 11,8 дней нетрудоспособности за предшествующий год, что в 3 раза превосходило показатели у лиц без СЦИАБ. В момент текущего обследования 11,2 % лиц со СЦИАБ чувствовали себя слишком нездоровыми, чтобы идти на работу, что также в 3 раза превышало значение аналогичного показателя у лиц без функциональных расстройств ЖКТ [3]. Эпидемиология НКС неизвестна. Большинство врачей, имеющих отношение к пациентам, получающих опиоиды, с болью в животе направляют таких пациентов к гастроэнтерологу. Поэтому такие пациенты, как правило, встречаются только в гастроэнтерологической практике. Необходимо отметить, что в настоящее время определяется рост распространенности центрально-опосредованных желудочно-кишечных болевых расстройств, связанный с повышением случаев использования опиоидов в целях обезболивания и увеличением выживаемости больных при хронической патологии. Это определяет актуальность дальнейшего изучения центральноопосредованных желудочно-кишечных болевых расстройств.
Цель. Критический обзор основных положений IV Римского консенсуса по вопросам центрально-опосредованных желудочно-кишечных расстройств.
D1. Синдром центрально-индуцированной абдоминальной боли.
СЦИАБ характеризуется постоянной, практически постоянной или часто рецидивирующей интенсивной болью в области живота, только в редких случаях связанной с кишечной дисфункцией в течение, по крайней мере, 6 месяцев до постановки диагноза. СЦИАБ ассоциируется с утратами ряда сторон полноценной жизни, в том числе, в работе, сексуальной или семейной жизни, социальном положении, досуге, потерей возможности полноценно выполнять самообслуживание и заботиться об окружающих.
Как и другие функциональные расстройства, СЦИАБ не может быть объяснен структурными или метаболическими нарушениями с использованием современных методов диагностики.
Боль в животе может быть следствием заболеваний органов мочевыделительной системы, гинекологических проблем. Таким образом, перед диагностикой СЦИАБ заболевания мочевыделительной системы и женской половой системы должны исключаться. Значительная часть пациентов, страдающих СЦИАБ, подвергаются хирургическому вмешательству, направленному на устранение проблем, связанных с болью. При этом врачи предполагают связь абдоминальной боли с развитием спаечной болезни. Необходимо отметить, что спайки могут вызвать острую или подострую кишечную непроходимость, но нет доказательств их роли в возникновении хронической интенсивной абдоминальной боли.
Боли, связанные со СЦИАБ, так же, как и при СРК, имеют колющий характер, но, как правило, являются более продолжительными и распространенными. Другой вариант СЦИАБ считается довольно распространенным и сопровождается жгучими болями и, как правило, возникает после предшествующей операции и особенно сложен для лечения. Со СЦИАБ могут быть связаны фибромиалгия и синдром хронической усталости. При различности диагностических критериев синдромов, сопровождающихся продолжительной болью, общим для них является формирование так называемого «болевого поведения», доминирующего в жизни больного.
Диагностические критерииа СЦИАБb должны включать все признаки [11]:
-
• Постоянные или почти постоянные боли в животе.
-
• Нет или только случайная связь боли в животе с различными физиологическими событиями (например, прием пищи, дефекация или менструация)с.
-
• Боль ограничивает некоторые аспекты повседневной деятельностиd.
-
• Боль не должна симулироваться
-
• Боль не объясняется другим структурным или функциональным расстройством ЖКТ или другой медицинской проблемой.
-
а Критерии должны соблюдаться 3 последних месяца с началом проявлений не менее 6 месяцев до постановки диагноза.
-
b СЦИАБ, как правило, ассоциируется с психиатрической коморбидностью, но при этом нет конкретных оснований для постановки психиатрического диагноза.
-
с Одновременно могут определяться небольшие нарушения со стороны ЖКТ.
-
d Повседневная активность может быть изменена и включает: проблемы в профессиональной деятельности, сексуальной / семейной жизни, социальном положении, досуге, потерю трудоспособности, уход за родственником.
Патогенетические аспекты СЦИАБ. При СЦИАБ происходит изменение центральной сенсорной обработки болевых импульсов. Мозг получает интероцептивные импульсы из брюшной полости, которые затем анализируются в передней части островка, наряду с познавательной, эмоциональной и другой сенсорной информацией. Нейровизуализационные исследования, выполненные у пациентов с СРК, обнаруживают патологию, связанную с функциональными и структурными нарушениями, центров обработки болевых импульсов, находящихся в середине поясной извилины, островка и соматосенсорной коры головного мозга и таламусе, центрах эмоционального возбуждения (передняя поясная кора, миндалина), модуляторном регионе префронтальной коры головного мозга. Модуляция эфферентных болевых импульсов в стволе головного мозга с помощью перечисленных областей коры может привести к увеличению чувствительности как патологическим, так и физиологическим стимулам. Данную точку зрения поддерживает обнаружение паттернов активации головного мозга при ожидании экспериментальной боли при СРК и ФД, что не выявлялось у здоровых лиц [14]. Дискутабельным остается вопрос о том, что является первичным: структурные изменения центральной нервной системы (ЦНС), предопределяющие развитие хронической боли или же хроническая боль индуцирует развитие перечисленных изменений ЦНС. При наличии тяжелой хронической боли у пациентов со СЦИАБ вероятность существования структурных изменений мозга высока. Клинические и доклинические данные свидетельствуют о том, что существует сильная ассоциация негативных событий раннего этапа жизни и некоторых видов психосоциальных стрессовых факторов со снижением порога болевого восприятия и изменением функции мозга у пациентов с функциональными кишечными расстройствами [15]. Сочетание генетических, поведенческих факторов, неблагоприятных ранних событий жизни, стресс во взрослом возрасте могут обусловить изменение эндогенной регуляции боли и, тем самым, предопределить развитие СЦИАБ.
Диагностика СЦИАБ. Боль в животе может быть симптомом многих заболеваний. Большое значение имеет продолжительность боли, определяющая различный диагностический подход к пациенту с острой и хронической болью в животе. При обследовании больного оценивают клиническое состояние, психосоциальный статус, проводят оценку поведения, осуществляют физикальное обследование. У пациентов, отвечающих диагностическим критериям СЦИАБ, предъявляющих жалобы на длительную боль в животе, имеющих соответствующий психосоциальный коррелят без каких-либо признаков «тревоги», клинические исследования, как правило, не в состоянии выявить другие причины боли и в соответствии с 38
этим могут быть ограничены [4]. В ряде случаев, дополнительное обследование может выявить патологию, имеющую неопределенное отношение к хронической абдоминальной боли (например, кисты печени и/или почек, камни в желчном пузыре). Ряд клинических и поведенческих особенностей являются типичными для СЦИАБ, но они не специфичны. При этом их определение может помочь в планировании диагностического и лечебного алгоритма.
СЦИАБ может сосуществовать с различными органическими заболеваниями или функциональной патологией. Иногда органическая или функциональная патология предшествует развитию СЦИАБ. Но при развитии СЦИАБ боль становится постоянной. Часть пациентов со СЦИАБ может предъявлять жалобы на нарушенную функцию кишечника, но не связывает ее с постоянной и сильной болью. У пациентов с органической патологией со временем может развиваться состояние, похожее на СЦИАБ, когда боль становится постоянной и интенсивной, нечувствительной к существующим методам лечения. У многих пациентов со СЦИ-АБ выполняются критерии для психиатрических диагнозов: тревога, депрессия, соматизация. Но в отличие от больных, имеющий нарушенный психический профиль, пациенты со СЦИ-АБ не хотят признавать вклад психических расстройств в клиническую картину их заболевания. Психотравмирующая ситуация, имеющая место у больных, может помочь в диагностике СЦИАБ, но их наличие не может подтверждать диагноз СЦИАБ.
Физикальное обследование не позволяет установить диагноз СЦИАБ, и лишь в редких случаях выявляет другие этиологические факторы у пациентов с хронической болью. Тем не менее, нет никакой альтернативы физикальному и рентгенологическому исследованию для объективизации симптомов, имеющихся у больного. Если больной ранее не обследовался, то физикальное исследование может выявить некоторую патологию (например, боли в брюшной стенке) и, соответственно, определить правильное направление дальнейшего диагностического поиска.
Методы исследования, направленные на исключение различных диагнозов, в обязательном порядке должны применяться только при наличии симптомов «тревоги», свидетельствующих об органическом заболевании. Минимальное диагностическое обследование должно включать набор стандартных лабораторных тестов с целью исключения воспаления и желудочно-кишечного кровотечения (анемия, фекальные потери крови). Если симптомы «тревоги» верифицируются в результате сбора анамнеза, физикальном или лабораторном скрининговом обследованиях, врач обязан провести комплекс диагностических мероприятий для установления причин боли в животе. При соблюдении диагностических критериев и отсутствии симптомов «тревоги» диагноз СЦИАБ становится весьма вероятным. Алгоритм обследования при СЦИАБ представлен на рисунке 1.
Лечение. Лечение СЦИАБ основывается на создании оптимального взаимоотношения «врач-пациент». Комбинация средств лечения СЦИАБ включает фармакологические и / или психологические методы лечения.
Пациенты и врачи должны нести ответственность за исход лечения. Например, пациенты должны иметь реалистичные представления по поводу терапии, а врач должен скорректировать ожидания об исходах терапии через вопросы типа: «Как вы считаете, я могу Вам помочь?» Пациенты должны быть готовы вступать в отношения с врачом. При этом фокус взаимоотношений «врач-пациент» должен смещаться со стороны обследования в сторону облегчения адаптации к постоянным симптомам. И, наконец, пациенты должны быть готовы взять на себя ответственность за процесс лечения и педантично исполнять назначения врача. Такой подход ассоциируется с улучшением клинических исходов.
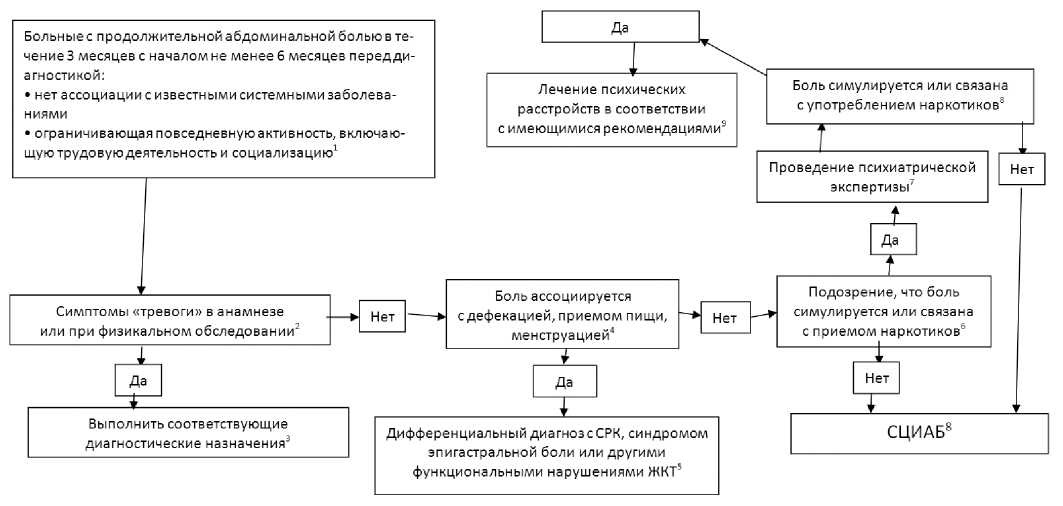
Рис. 1. Дифференциальный диагноз при хронической боли в животе. Цифрами отмечена последовательность действий
Обоюдная польза для врача и больного извлекается в том случае, если врач внимательно слушает больного, сопереживает, принимает СЦИАБ в качестве истинного заболевания, использует неограниченный временем опрос для анализа чувств пациента с использованием вопросов, позволяющих раскрыть язык тела, если врач может установить реалистичные цели лечения, представить адекватную для больного информацию о природе заболевания и о его состоянии, успокоить пациента и провести совместный выбор схемы лечения с учетом временных рамок и имеющихся возможностей.
Некоторые дополнительные принципы, которые следует рассмотреть:
-
• Выбор терапии проводится на основе оценки тяжести симптомов и степени инвалидности. Если боль отличается интенсивностью и постоянством или, если пациент не хочет участвовать в психологическом вмешательстве, то необходимо назначение антидепрессантов (например, трициклических антидепрессантов (ТЦА) и ингибиторов обратного захвата серотонина) с целью достижения обезболивающего эффекта [11].
-
• Врач должен быть осведомлен о том, когда требуется обратиться к специалисту в области психического здоровья. Это широкая группа специалистов, включающая психиатров, медицинских психологов, консультантов по охране психического здоровья, фармацевтов и др. Должен быть разработан алгоритм психологического вмешательства, позволяющий помочь пациенту управлять болью и уменьшить эмоциональное напряжение, связанного с болью. Медицинская помощь должна продолжаться параллельно с психологической поддержкой.
-
• Лечение больного со СЦИАБ целесообразно осуществлять в многопрофильном гастроэнтерологическом центре или в центре по лечению боли. Это связано с тем, что многопрофильный гастроэнтерологический центр и центр по лечению боли могут обеспечить комплексную оценку и лечение. Необходимо соблюдать осторожность, чтобы избежать центров по лечению боли, ориентированных на терапию опиоидной зависимости, что противопоказано, так как повышает риск возникновения наркотического кишечного синдрома.
Медикаментозная терапия. Медикаментозная терапия СЦИАБ применяется наряду с немедикаментозными, выше описанными методами лечения. Медикаментозное лечение яв- 40
ляется наиболее эффективным в контексте хорошо развитого взаимодействия врач-пациент [6] и всеобъемлющего хорошо спланированного биопсихосоциального лечения.
ТЦА наиболее широко используются в качестве средств лечения боли, связанной с органической патологией (например, постгерпетическая невралгия, диабетическая невропатия) и функциональной боли (например, фибромиалгия) [13]. Их обезболивающий эффект, вероятно, не связан с антидепрессивным действием, поскольку эти препараты эффективны при различных болевых синдромах, при которых психопатология менее заметна или отсутствует, а также потому, что антидепрессанты назначаются в низких «субпсихиатрических» дозах. Так, например, уменьшение боли при назначении дезипрамина при СРК не связано с его концентрацией в крови или дозировкой препарата.
ТЦА (например, амитриптилин, имипрамин, дезипрамин, доксепин, тримипрамин) уменьшают боль и выраженность симптомов у пациентов со среднетяжелым и тяжелым течением СРК. Наиболее распространенные побочные эффекты ТЦА включают седацию, возбуждение, гипотонию, запоры, задержку мочи, сухость во рту и нарушение сна (бессонница, кошмары).
Селективные ингибиторы обратного захвата серотонина (СИОЗА) обладают меньшей анальгетической активностью по сравнению с ТЦА, что связывается с отсутствием эффекта на норадреналиновые синапсы. СИОЗА (циталопрам) по сравнению с амитриптилином показал меньшую эффективность в отношении терапии боли у пациентов с ФД. При этом СИОЗА показывали значительную эффективность в устранении симптомов тревоги и улучшении общего состояния у пациентов с ФД. Побочные эффекты при применении СИОЗА включают тошноту, диарею; сексуальную дисфункцию со снижением либидо [12], нарушение оргазма; и неврологические/психиатрические симптомы, такие как беспокойство, легкая возбудимость, тремор, бессонница и ночные кошмары.
Ингибиторы обратного захвата серотонина и норадреналина (например, дулоксетин, венлафаксин, десвенлафаксин и милнаципран) находят применение для терапии депрессии, однако в настоящее время все чаще применяются для лечения хронической боли. Их двойное действие (обезболивающее и антидепрессивное) создает привлекательность их использования у пациентов с депрессией и хронической болью. При этом эффективность данной группы препаратов при СЦИАБ является не доказанной.
Решение по использованию антидепрессантов зависит от соотношения их эффекта по устранению боли и наличия побочных эффектов.
Атипичные антипсихотические препараты . Кветиапин положительно зарекомендовал себя при использовании в низких дозах для терапии терапевтических пациентов с хронической болью (фибромиалгия) с одновременным наличием тревоги и расстройствами сна. Его применение может быть также эффективным при лечении хронической боли в животе за счет снижения тревоги, восстановления нормальной модели сна, и, возможно, путем прямого обезболивающего эффекта [8]. Данный антидепрессант можно назначать у пациентов с недостаточной эффективностью ТЦА и СИОЗА.
Разные психотропные препараты. ТЦА антидепрессант миртазапин, увеличивающий активность центральной норадренергической и серотонинергической передачи. Данный препарат оказывается эффективным в качестве противорвотного средства, стимулятора аппетита при недостаточной массе тела [1]. Буспирон является небензодиазепиновым анксиолитиком, способным усиливать эффект антидепрессантов и также уменьшать восприятие боли [14].
Противосудорожные средства. Противосудорожные средства, такие как карбамазепин, ламотриджин, и, недавно разработанный, лиганд а2Л-агент, габапентин и прегабалин, были оценены в плане лечения некоторых хронических болевых синдромов, но их действие при СЦИАБ не исследовалось. Исследования с нейровизуализацией показали, что прегабалин снижает функциональную связанность в центрах головного мозга, ответственных за восприятие боли [9].
Аналгетики. Большинство анальгетиков (например, аспирин и нестероидные противовоспалительные лекарственные средства) являются неэффективными, так как воздействуют на периферические аспекты восприятия боли. Назначение наркотических анальгетиков следует избегать из-за вероятности развития зависимости, возможности возникновения наркотического кишечного синдрома и других побочных эффектов со стороны ЖКТ.
Потенцирующая терапия. При СЦИАБ требуется постепенное увеличение дозы одного из препаратов, если другое средство оказывает недостаточный эффект или индуцирует возникновение побочных эффектов. Потенцирующая терапия подразумевает использование двух или большего количества препаратов, действующих на различные рецепторные поля или участки мозга при использовании низких доз каждого из них. Потенцирующую терапию с использованием нескольких психотропных средств рекомендуется после консультации психиатра, психофармаколога или терапевта, прошедшего повышение квалификации в области использования данных средств.
Психотерапия и антидепрессанты. Эффективная потенцирующая терапия связана с сочетанием лечения антидепрессантами и психотерапии. Антидепрессанты могут уменьшить боль и вегетативные проявления депрессии, в то время как психологические методы лечения позволяют повысить уровень функционирования головного мозга и справиться с когнитивной дезадаптацией, связанной с предыдущими утратами в жизни пациента и психологической травмой. Психологическое лечение может улучшить приверженность пациента к лечению и, соответственно, улучшить исходы терапии.
Исследования показали, что антидепрессанты работают в подкорковых областях, таких как передняя часть поясной извилины и островка, и улучшают связь с префронтальной и другими областями коры, тогда как психологические методы лечения влияют на префронтальную или когнитивные области головного мозга [7]. Эффективность комбинированной терапии может быть на 50 % выше, чем только монотерапия. В настоящее время существует 4 класса психотерапии, использование которых является эффективным в лечении СЦИАБ: когнитивно-поведенческая терапия, психодинамическая межличностная терапия, психотерапия на основе осознания психотерапия принятия, гипнотерапии. Они выполняются медицинским психологом или другим специалистом в области психического здоровья, знакомых с физиологией ЖКТ, но всегда в сочетании с медикаментозным лечением.
D2. НКС/ синдром гастроинтестинальной гипералгезии, индуцированной опиоидами .
НКС характеризуется развитием болевого синдрома в животе или увеличением его интенсивности, связанным с продолжительным использованием или увеличением доз опиоидов. НКС может возникнуть у больных с функциональными расстройствами ЖКТ или хроническими органическими заболеваниями ЖКТ (например, воспалительные заболевания кишечника, хронический панкреатит), больных со злокачественными или доброкачественными новообразованиями и даже у лиц, получающих высокие дозы наркотиков после оперативного вмешательства [5]. Больные с НКС будут иметь значительное улучшение состояния или значительное облегчение симптомов боли после прекращения приема опиоидов.
Диагностические критерии а НКС/опиат-индуцированная гастроинтестинальная гиперал-гезия должны включать все признаки [11]:
-
1. Хроническая или часто повторяющаяся боль в животеь, которая ассоциируется с приемом высоких доз наркотиков или их длительным приемом.
-
2. Характер и интенсивность боли не объясняется имеющимся или предшествующим заболеванием пищеварительного трактас.
-
3. Два или более из следующих признаков:
-
• боль усиливается или не полностью облегчается в результате увеличения дозы или продолжающегося приема наркотических средств;
-
• усиление боли возникает при уменьшении дозы наркотических препаратов и уменьшение - при повторном назначении (эффект взлета и падения);
-
• существует прогрессия частоты, продолжительности и интенсивности эпизодов боли.
-
а Критерии выполняются в течение последних 3-х месяцев с возникновением симптомов за 6 месяцев до установления диагноза.
-
b Боль должна беспокоить большинство дней.
-
с Пациент может иметь структурный диагноз (например, воспалительные заболевания кишечника, хронический панкреатит), но характер или активность патологического процесса не является достаточным для объяснения боли.
Патогенез. Существует несколько теорий объясняющих гипералгезирующий эффект опиоидов, но наиболее обоснованной считается их способность активировать глиальные клетки в задних рогах спинного мозга, регулирующих передачу афферентных ноцицептивных импульсов. При активации астроцитов и микроглии происходит продукция провоспалительных цитокинов, оксида азота, возбуждающих аминокислот, что сопровождается центральной гипе-ралгезией. Активация глиальных клеток может происходить при воспалении, инфекции, воздействии лекарственных средств, например, морфина, эндогенного хемокина (фракталкин), травме, других активированных клеток глии или даже в ответ на сигналы от ЦНС.
Диагностика. Пациенты с НКС наиболее часто сообщают об умеренной до тяжелой коликообразной или постоянной плохо локализующейся боли в животе. Они могут быть связаны с терапией опиоидами внутрибрюшной патологии (например, хронический панкреатит, воспалительные заболевания кишечника, СЦИАБ) или внебрюшной патологии (например, ортопедические боли, фибромиалгии, головная мигренозная боль) или даже при терапии опиоидами послеоперационной боли. Хотя первоначально прием опиоидов связан с терапией приступообразной боли, у больных развивается толерантность и тахифилаксия, что требует наращивания дозы препарата для достижения клинического эффекта. В конце концов безболевые периоды уменьшаются. При этом боль в животе становится тяжелой и постоянной, несмотря на продолжающееся лечение опиоидами.
Пациенты многократно обследуются. При этом результаты лабораторных исследований обычно не содержат патологии, рентгенологическое исследование может показать задержку стула в ободочной кишке. Поперечная томография должна проводиться для исключения панкреатита, воспалительных поражений, ишемии кишечника или другой внутрибрюшной патологии. Данные исследования в дополнение к целенаправленному опросу и физикальному обследованию при наличии соответствующих диагностических критериев, могут быть вполне достаточными для постановки диагноза НКС. В сложных диагностических случаях нет никаких других рекомендаций, кроме проведения полноценного клинического обследования, необходимого для выявления активности других сопутствующих соматических заболеваний. Диагноз НКС может быть особенно сложным, если пациент страдает активным заболеванием кишечника и получает опиоиды для терапии боли в животе. Проведение детоксикационной терапии в данном случае может помочь выявлению НКС. Не существует особых временных рамок и доз опиоидов, связанных с развитием НКС. НКС может развиваться в течение нескольких недель и с различными дозировками опиоидных препаратов. Проведенные исследования показывают, что развитие НКС связано с употреблением препаратов опиоидов эквивалентных дозе перорального морфина, начиная с 75 мг [5].
Необходимо помнить, что пациенты с болью в животе, принимающие опиоиды, могут иметь опиоидное расстройство. Эти пациенты принимают опиоиды в большем количестве, чем это предполагалось при назначении, с постоянным желанием продолжать их прием и не в состоянии выполнить обычные обязанности по работе, в школе или дома. Больные с такими симптомами следует отнести к пациентам, злоупотребляющими опиоидами. При этом вероятность успешного ведения таких пациентов крайне мала [10].
Лечение. Большинство пациентов хотят лечиться, но не связывают перспективны терапии НКС со снижением дозы опиоидов. Больные считают, что опиоиды необходимы для снижения боли и испытывают страх при их отмене. Больные также считают себя оскорбленными теми людьми, которые считают, что они имеют зависимость от наркотиков или психиатрическую проблему.
Доверительное отношение между врачом и пациентом является необходимым условием для лечения больного с НКС. Врач должен чувствовать приверженность больного к назначенной им терапии и понимать возможные негативные чувства больных, воспринимающих трудности на пути достижения цели.
В достижении цели важным является процесс образования. После достижения компла-ентности необходимо обсудить варианты лечения НКС, в том числе опиатной детоксикации. Определение тяжести злоупотребления опиоидами и необходимость детоксикации целесообразно проводить по текущему протоколу неправильного использования опиоидов [2]. Протокол лечения НКС включает только детоксикацию, так как только проведение полной детоксикации является клинически доказанным методом терапии НКС даже при продолжающимся приеме опиоидов [5]. Создание протокола лечения требует взаимного доверия и вовлечение больного в лечебный процесс. Реализация плана лечения может быть облегчено через сопереживание, выявление проблем здоровья, оценку и подтверждение реальности боли и ее влияния на жизнь пациента, открытый диалог о механизме возникновения НКС и обоснования рекомендованного лечения, включая специфику опиоидной дезинтоксикации. Если пациент считает, что опиоиды являются единственным эффективным способом лечения, то врач должен объяснить больному, что, несмотря на использование высоких доз опиоидов, 44
оно не достигает желаемого результата и описать значение более эффективных методов лечения боли (например, назначение ТЦА, СИОЗА или центральных анксиолитиков). Чтобы использовать данные препараты во время и после детоксикации; объясняется, что при начале выполнения программы детоксикации, протокол уменьшения доз опиатов не изменится, но при этом могут использоваться альтернативные средства для купирования боли и тревоги. В процессе лечения необходимо обеспечить реалистичные цели для уменьшения боли (не обязательно достичь полного разрешения боли) в течение нескольких месяцев. При этом целесообразно заручиться поддержкой друзей и родственников больного для обеспечения терапевтического процесса, предотвращении рецидивов. Необходимо объяснить больному роль других специалистов в области лечения боли (например, психологов или психиатров, врача первичной медико-санитарной помощи, или помощника врача), подтвердить их готовность помогать в осуществлении лечебного процесса и уходе вне зависимости от результата лечения.
Проведенные исследования по оценке исходов терапии НКС показало, что через 7 дней стационарной детоксикационной терапии у 63,6 % лиц определяется улучшение клинического состояния, тогда как у 10,8 % пациентов верифицировано ухудшение боли [5]. Считается, что стационарные программы обеспечивают гораздо больший контроль над выполнением детоксикации, занимающей 1 неделю, в отличие от амбулаторных программ, требующих нескольких недель.
Заключение. Учение о центрально-опосредованном желудочно-кишечном болевом расстройстве претерпело значительное изменение после выхода в свет Римского консенсуса IV. Это связано с тем, что новый Римский консенсус свидетельствует о том, что в основе развития функциональной патологии ЖКТ лежит «нарушение церебро-интестинального взаимодействия». Причинными факторами несостоятельности регуляторных взаимоотношений оси «мозг – ЖКТ» называются комбинированные морфологические и физиологические отклонения, связанные с нарушениями моторики ЖКТ, слизистого барьера, иммунной функции, кишечной микробиотой, висцеральной гиперчувствительностью, а также расстройствами ЦНС. Все это послужило поводом исключения из названия ряда описываемых Римским консенсусом расстройств слова «функциональные». Также диагноз «функциональный абдоминальный болевой синдром» изменен на «СЦИАБ», как в большей степени соответствующий патогенезу этого расстройства и отражающий современную информацию о взаимодействии ЖКТ и ЦНС. Выделение НКС в отдельное функциональное расстройство, на первый взгляд, представляется нелогичным, так как данная патология индуцируется известным этиологическим фактором. С другой стороны, применение опиоидов изменяет взаимодействие между ЦНС и энтеральной нервной системы, что может сопровождаться развитием НКС. Таким образом, дефиниция НКС в рамках функциональной патологии не противоречит главным положениям принятого в 2016 году IV Римского консенсуса.
Список литературы Центрально-опосредованные желудочно-кишечные болевые расстройства: обзор основных положений IV Римского консенсуса
- Aderka I.M., McLean C.P., Huppert J.D. et al. Fear, avoidance and physiological symptoms during cognitivebeha-vioral therapy for social anxiety disorder//Behav Res Ther. -2013. -Vol. 51. -Р. 352-358.
- Butler S.F., Budman S.H., Fernandez K.C. et al. Development and validation of the Current Opioid Misuse Measure//Pain. -2007. -Vol. 130. -Р. 144-156.
- Drossman D.A., Li Z., Andruzzi E., et al. US householder survey of functional gastrointestinal disorders. Prevalence, sociodemography, and health impact//Dig Dis Sci. -1993. -Vol.38. -Р. 1569-1580.
- Drossman D.A. Functional abdominal pain syndrome//Clin Gastroenterol Hepatol. -2004. -Vol. 2. -Р. 353-365.
- Drossman D.A., Morris C.B., Wrennall C.E. et al. Diagnosis, characterization, and 3-month outcome after detoxification of 39 patients with narcotic bowel syndrome//Am J Gastroenterol. -2012. -Vol. 107. -Р. 1426-1440.
- Drossman D.A. 2012 David Sun Lecture: helping your patient by helping yourself: How to improve the patientphy-sician relationship by optimizing communication skills//Am J Gastroenterol. -2013. -Р. 521-528.
- Goldapple K., Segal Z., Garson C. et al. Modulation of cortical-limbic pathways in major depression: treatmentspe-cific effects of cognitive behavior therapy//Arch Gen Psychiatry. -2004. -Vol. 61. -Р. 34-41.
- Grover M., Dorn S.D., Weinland S.R. et al. Atypical antipsychotic Quetiapine in the management of severe, refractory functional gastrointestinal disorders//Dig Dis Sci 2009. -Vol. 54. -Р. 1284-1291.
- Harris R.E., Napadow V., Huggins J.P. et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients//Anesthesiol. -2013. -Vol. 119. -Р. 1453-1464.
- Hasin D.S., O’Brien C.P., Auriacombe M. et al. DSM-5 criteria for substance use disorders: recommendations and rationale//Am J Psychiatry. -2013. -Vol. 170. -Р. 834-851.
- Keefer L., Drossman D.A., Guthrie E. et al. Centrally Mediated Disorders of Gastrointestinal Pain//Gastroenterology. -2016. -Vol. 150. -Р. 1408-1419.
- Locke G.R., Bouras E.P., Howden C.W. et al. The Functional Dyspepsia Treatment Trial (FDTT) key results//Gastroenterology. -2013. -Р. 144:S140.
- Mic J.A., Ardid D., Berrocoso E. et al. Antidepressants and pain//Trends Pharmacol Sci. -2006. -Vol. 27. -Р. 348-354.
- Rosoff H, John RS, Prager F. Flu, risks, and videotape: escalating fear and avoidance. Risk Anal 2012; 32:729-743.
- Van Oudenhove L, Vandenberghe J, Dupont P, et al. Regional brain activity in functional dyspepsia: a H(2)(15) O-PET study on the role of gastric sensitivity and abuse history. Gastroenterology 2010; 139:36-47.


