Церебральная малярия от патофизиологии к клиническим проявлениям и лечению
Автор: Мбанзани Р.Л., Фасфоус Язан Ф.А.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Медицинские науки
Статья в выпуске: 5-1 (104), 2025 года.
Бесплатный доступ
Малярия по-прежнему остаётся одной из основных инфекционных причин смерти в эндемичных регионах Африки, в 2023 году от малярии умерло около 579 414 человек. Большинство случаев смерти после тяжёлых форм малярии связаны с Plasmodium falciparum и её тенденцией к поражению центральной нервной системы, сопровождающееся неврологическими нарушениями и полиорганной недостаточностью. Церебральная малярия очень распространена в тропических регионах Африки, обычно у 47% пациентов заканчивается летальным исходом из-за её быстрого прогрессирования при отсутствии адекватного лечения и поздней постановки диагноза. В статье мы сосредоточимся на анализе и интерпретации последних данных за 5 предыдущих лет, касающихся патофизиологических, клинических и терапевтических аспектов церебральной малярии в странах Африки.
Малярия, церебральная малярия, глазное дно, церебральная визуализация, отёк мозга, кома, судороги, анемия, внутривенный артесунат
Короткий адрес: https://sciup.org/170209282
IDR: 170209282 | DOI: 10.24412/2500-1000-2025-5-1-100-108
Текст научной статьи Церебральная малярия от патофизиологии к клиническим проявлениям и лечению
По данным ВОЗ, в 2023 году число случаев заболевания малярией в государствах-членах Африканского союза оценивается в 251 миллион (95% от общего числа зарегистрированных случаев в мире), а смертность от неё – в 579 414 случаев (97% от общего числа зарегистрированных случаев в мире). Семьдесят шесть процентов случаев смерти приходится на детей в возрасте до 5 лет. На континенте 1,3 миллиарда человек подвергаются риску заражения малярией. Среди этой группы населения было зафиксировано 192 случая на 1000 человек и 44 случая смерти на 100 000 человек. По сравнению с 2000 годом это означает снижение заболеваемости на 34% и снижение смертности от малярии на 61%. В наши дни такие высокие показатели смертности являются всего лишь результатом плохого лечения пациентов с тяжёлыми формами малярии, такими как церебральная малярия.
Патофизиология церебральной маля-рии/Секвестрация
Секвестрация в церебральных капиллярах является преобладающим механизмом церебральной малярии. Схематически его можно разбить на несколько явлений: цитоадгезия, образование розеток, опосредованное тромбоцитами слипание и аутоагглютинация (рис. 1). Цитоадгерентность соответствует адгезии паразитированных эритроцитов к эндотелиальным клеткам. Способность паразити-рованных эритроцитов связывать непаразити-рованные эритроциты приводит к образованию розеток. Способность паразитирующих эритроцитов связывать тромбоциты через рецепторы CD36 или P-селектин приводит к скоплению тромбоцитов. Розетки, подобные скоплениям тромбоцитов, не обнаруживаются в кровотоке и поэтому остаются изолированными. цитоадгезия происходит в основном в капиллярах глубокого микроциркуляторного русла, особенно в головном мозге. Тяжесть церебральной малярии частично связана с интенсивностью секвестрации. Фактически, скопления паразитированных или непарази-тированных эритроцитов снижают или даже блокируют мозговой кровоток. Это явление усугубляется снижением деформируемости паразитированных эритроцитов. Секвестрация сама по себе не объясняет патофизиологию церебральной малярии, но она тесно связана с иммунным ответом [2].
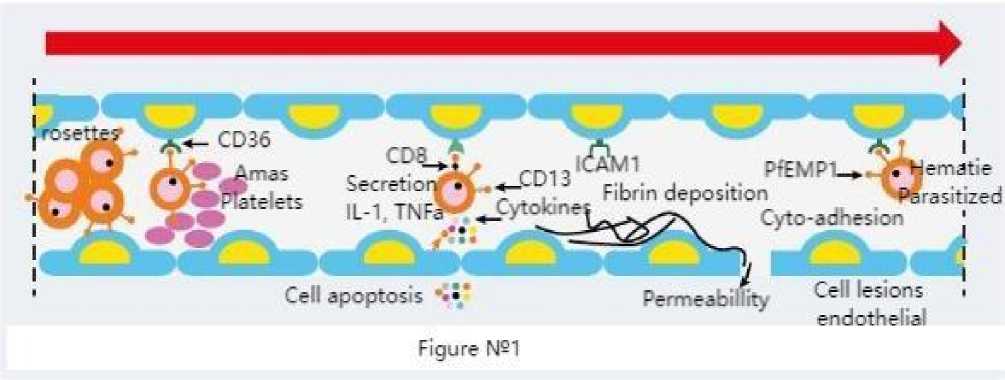
Рис. 1. Краткое изложение основных механизмов церебральной малярии
Эндотелиальная дисфункция
Цитоадгерентность подразумевает множественные взаимодействия между лигандами паразитированных эритроцитов и лигандами эндотелия, и интенсивные исследования направлены на идентификацию этих эндотелиальных рецепторов и лигандов паразитов. Основным лигандом паразитированной стенки эритроцитов является белок 1 мембраны эритроцитов Plasmodium falciparum (PfEMP 1). Существуют и другие белки, такие как RIFIN или CLAG. Основные эндотелиальные лиганды являются либо частью суперсемейства иммуноглобулинов (ICAM 1, VCAM 1, PECAM 1), либо гликопротеинами (CD36, E-селектин, NCAM, CD31). Связывание лиганда с рецептором приводит к усилению секвестрации паразитированных эритроцитов, а также к провоспалительному каскаду и прокоагулянтному ответу. PfEMP1 экспрессируется на поверхности паразитированных эритроцитов, и этот белок кодируется примерно 60 генами var. Вероятно, PfEMP1 способен воздействовать на различные рецепторы, экспрессия которых варьируется в зависимости от органа, что может объяснить, почему у некоторых пациентов с малярией развиваются органоспецифические повреждения. Недавно было показано, что определённый вариант
PfEMP1, экспрессирующий кассетные домены 8 и 13, способен связываться с рецептором эндотелиального белка C (EPCR) (рис. 1) [3]. Обычно уровень EPCR в микрососудах головного мозга низкий. При нейромалярии эти уровни ещё ниже, с потерей EPCR и тромбомодулина в зонах секвестрации паразитиро-ванных эритроцитов. Однако присутствие EPCR, а также тромбомодулина необходимо для активации протеина С и, таким образом, поддержания текучести крови и функции эндотелиальной цитопротекторной защиты. Это открытие связывает специфическую церебральную секвестрацию паразита через лиганд EPCR и потерю антикоагулянтной и эндотелиальной защитной функций протеина С (рис. 2) [4]. Этот механизм связан с другими. Каждое связывание эндотелиального лиганда с рецептором приводит к активации эндотелия и тромбоцитов, что приводит к нарушению регуляции коагуляции, каскаду провос-палительных цитокинов, блокаде противовоспалительного ответа, что может привести к очаговым поражениям эндотелия и явлениям апоптоза клеток (рис. 1) [5]. Обратите внимание, что эндотелиальная дисфункция также возникает при тяжёлой инфекции Plasmodium vivax и Plasmodium knowlesi.
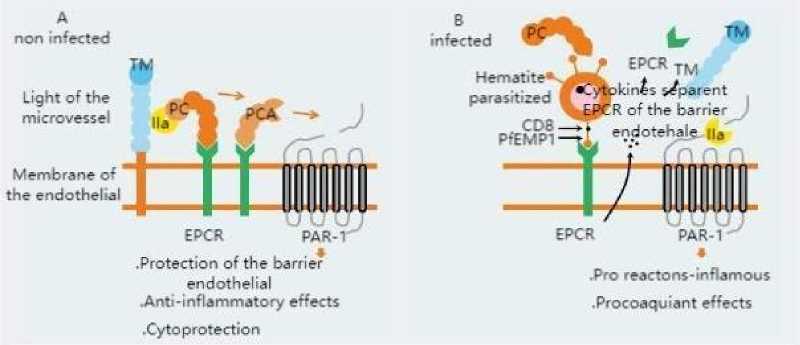
Рис. 2. Влияние инфекции Plasmodium falciparum на систему белка C [4]
-
A. Функциональная система белка C схематически представлена связыванием тромбомодулина (TM) с тромбином (IIa), который, в свою очередь, связывается с белком C, закреплённым в эндотелиальных клетках через рецептор эндотелиального белка C (EPCR). Это связывание активирует белок C (PCA), который расщепляет белок PAR-1 (рецептор, активируемый протеазой 1), что вызывает противовоспалительную реакцию, цитопротекцию и защиту эндотелиального барьера.
-
B. Во время заражения Plasmodium falciparum инфицированные эритроциты связываются с EPCR через лиганд PfEMP1, несущий кассетные домены 8 и/или 13, и активируют эндотелиальные клетки. Активация этих эндотелиальных клеток приводит к высвобождению провоспалительных цитокинов. Эти цитокины отделяют EPCR от эндотелиального барьера. Эти изменения предотвращают образование ПКА, что приводит к порочному кругу прокоагулянтных эффектов и провоспалительных реакций, которые ухудшают эндотелиальную дисфункцию и усиливают провоспалительные эффекты ПАР-1 посредством связывания с тромбином, что увеличивает проницаемость эндотелиального барьера.
Обновление глазного дна: клиническое отражение патофизиологии
В эндемичных регионах диагностировать церебральную малярию в соответствии с определением ВОЗ непросто, поскольку нередки случаи бессимптомной паразитемии [8]. Поскольку остальные признаки церебральной малярии неспецифичны, возможны диагностические ошибки. Ввиду общего эмбрионального происхождения васкуляризация сет- чатки достаточно хорошо отражает состояние мозговой микроциркуляции. Исследование глазного дна позволит выявить специфические нарушения в нарушении микроциркуляции головного мозга и тем самым будет способствовать диагностике церебральной малярии. У африканских детей с тяжёлой церебральной малярией была продемонстрирована чёткая связь между тяжестью ретинопатии, тяжестью малярии, смертностью и продолжительностью комы [9]. Наблюдаемые отклонения включают побеление сетчатки, кровоизлияния, изменение цвета сосудов, отёк сосочков, а иногда и ватообразные пятна и ретинальные экссудаты [10]. Побеление сетчатки и сосудистые изменения, по-видимому, характерны для малярии, поскольку считается, что они отражают секвестрацию паразитиро-ванных эритроцитов, которая происходит в микроциркуляторном русле сетчатки таким же образом, как и в мозге (рис. 3) [11]. Наконец, количество кровоизлияний в сетчатку коррелирует с количеством кровоизлияний в мозг. Примерно у двух третей пациентов с церебральной малярией наблюдается ретинопатия, однако у некоторых людей с нетяжелой формой малярии также может быть ретинопатия. Таким образом, хотя тяжесть ретинопатии связана с тяжестью малярии, она не всегда специфична для нейромалярии. Поэтому это простое обследование следует проводить регулярно во время завозной малярии, даже если диагностировать церебральную малярию проще, чем в эндемичных районах. Осмотр глазного дна также позволяет выявить внутричерепную гипертензию, выявляя двусторонний отёк сосочков глаза.
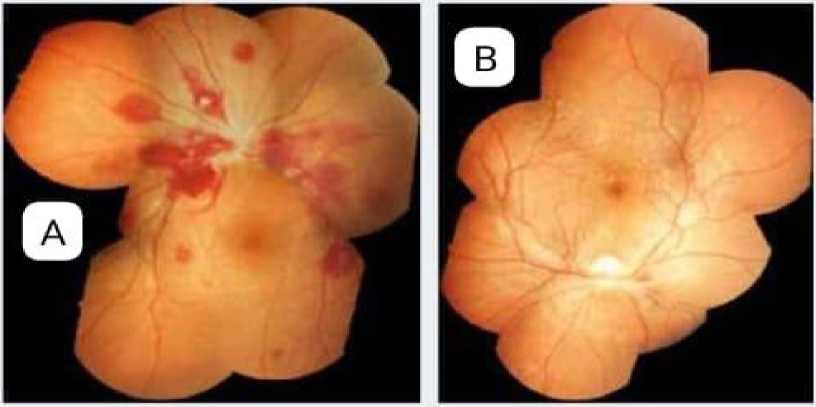
Рис. 3. Аномалии глазного дна при церебральной малярии [11]
А. Правая сетчатка 25-летней женщины с тяжёлой формой малярии, проявляющейся глубокой анемией и спутанностью сознания. Видны множественные кровоизлияния, сосредоточенные на белых участках, и значительный отёк сосочков.
Б. Мозаичное побеление сетчатки, охватывающее всю макулу и обширные участки периферической сетчатки у 24-летнего мужчины с церебральной малярией.
Клиника и визуализация мозга
ВОЗ определяет церебральную малярию как тяжёлую форму малярии, сопровождающуюся комой, которая определяется по шкале комы Глазго (GCS) с показателем менее 11.
Определение завезённой взрослой церебральной малярии шире и включает (таблица): угнетение или спутанность сознания, сонливость, прострацию; кома с баллом по шкале комы Глазго менее 11; судороги. После коррекции возможной гипогликемии и без других причин эти неврологические признаки следует связывать с наличием циркулирующих бесполых форм Plasmodium falciparum. При наличии одного или нескольких из этих неврологических признаков пациент должен быть госпитализирован в отделение реанимации или в отделение непрерывного мониторинга (ОПМ) в соответствии с первоначальной оценкой специалиста по реанимации [13].
Таблица. Критерии тяжёлой завозной малярии у взрослых, вызванной P. falciparum a, b [12]
|
Неврологические нарушения, в том числе: – оцепенение, спутанность, сознания, сонливость, прострация – кома с баллом по шкале комы Глазго <11 – судороги, отёк мозга |
Дыхательная недостаточность, в том числе: – при ИВЛ или НИВЛ: PaO2/FiO2 < 300 мм рт. ст. – при отсутствии вентиляции: PaO2 < 60 мм рт. ст. и/или SpO2 < 92% при дыхании воздухом помещения и/или ЧДД > 30/мин – рентгенологические признаки: интерстициальные и/или альвеолярные изображения |
Кардиоциркуляторная недостаточность, в том числе: – САД < 80 мм.рт. ст. и/или наличие периферических признаков недостаточности кровообращения – потребность в вазопрессорных препаратах* и лактатах > 2 ммоль/л. Кровотечение Желтуха: клинический или общий билирубин > 50 мкмоль/л |
|
Тяжёлая анемия: гемоглобин <70 г/л, гематокрит <20% Гипогликемия: уровень сахара в крови <2,2 ммоль/л. |
Ацидоз: бикарбонаты плазмы <15 ммоль/л или ацидемия с pH < 7,35 (пристальный мониторинг, как только бикарбонаты станут <18 ммоль/л) |
Гиперлактатемия: >2 ммоль/л (особенно если >5 ммоль/л) Гиперпаразитемия: > 4% Почечная недостаточность: креатинин сыворотки > 265 мкмоль/л или мочевина > 20 ммоль/л |
* ИВЛ: искусственная вентиляция лёгких; НИВЛ: неинвазивная вентиляция лёгких; ЧД: частота дыхания; САД: систолическое артериальное давление
Норадреналин или адреналин, a если
Plasmodium vivax: те же критерии без парази- темии >4% (потому что редко >2%), частота анемии и желтухи, некоторые случаи острого респираторного дистресс-синдрома, редкость неврологических нарушений и ацидоза.
Если Plasmodium knowlesi: те же критерии, но гиперпаразитемия сразу же >2%, частота поражения печени и почек, очень редко неврологические поражения.
Клинические признаки церебральной малярии
Кома
Обычно это не связано с очаговыми признаками. Часто это происходит внезапно и может следовать за генерализованным судорожным припадком, что затрудняет диагностику. Зрачки нормальные, реакция на свет сохранена; остальные пары черепных мозговых нервов не повреждены. С другой стороны, расхождение взгляда и бруксизм являются обычным явлением. Костно-сухожильные рефлексы изменчивы, иногда очень выражены, в исключительных случаях отсутствуют. Кожно-подошвенные рефлексы могут быть разгибательными [13].
Судороги
У взрослых они встречаются реже, чем у детей, и их заболеваемость, по-видимому, выше в эндемичных районах, около 30%, тогда как при завозной церебральной малярии она ниже, около 6%. В новом определении тяжёлой завозной малярии у взрослых логично и для простоты критерий тяжести «повторные судороги» был включён в критерий «неврологическая недостаточность» [14].
Головные боли
Головные боли от 30 до 80% случаев малярии присутствуют и обычно они выражены, но не являются специфическими для церебральной малярии.
Другие неврологические признаки
Могут отмечаться сонливость, упадок сил, спутанность сознания, нарушения поведения (возбуждение) или памяти, скованность шеи, а иногда и очаговые симптомы. Часто им требуется визуализация головного мозга и другие дополнительные обследования в зависимости от контекста (люмбальная пункция) для поиска другой этиологии, которая могла бы объяснить расстройства.
Отёк головного мозга при церебральной малярии
Отёк мозга наблюдается более чем у 50% больных церебральной малярией, что подтверждено в ряде исследований. Причина это- го отёка, который в наиболее тяжёлых случаях может привести к поражению мозга и смерти, до конца не ясна. Некоторые аргументы предполагают, что секвестрация ответственна за изменения в гематоэнцефалическом барьере. Адгезия инфицированных эритроцитов к эндотелию запускает каскад воспалительных событий, в частности, посредством секреции ИЛ-1 и ФНОα, что приводит к активации эндотелия, что, среди прочего, приводит к апоптозу клеток гематоэнцефалического барьера (рис. 1). С другой стороны, взаимодействие инфицированных эритроцитов и тромбоцитов вызывает повреждение эндотелия за счёт прямого цитотоксического эффекта [5]. В то же время восстановление эндотелия нарушено. Например, потеря EPCR может привести к хрупкости или даже разрыву эндотелиального барьера, что может вызвать вазогенный отёк (рис. 2) [4]. Однако гипотеза о разрыве гематоэнцефалического барьера, подтверждаемая геморрагическими поражениями, выявленными при осмотре глазного дна (см. ниже), остаётся спорной. В некоторых исследованиях не обнаружено никаких изменений в гематоэнцефалическом барьере или наблюдаются лишь очень очаговые поражения, которые не объясняют кому [6]. Кроме того, возможен цитотоксический отёк, возникающий в результате неспособности клеток мозговой ткани поддерживать свой мембранный потенциал после блокады насоса NA/K-АТФазы, вызванной клеточной гипоксией. Это приведёт к перераспределению воды из внеклеточного сектора во внутриклеточный, что в конечном итоге приведёт к гибели клеток и повреждению тканей. Ишемические или гипоксические поражения, связанные с механическими эффектами секвестрации, а также с недостатком питательных веществ, «украденных» локально паразитарным метаболизмом, также могут приводить к цитотоксическому отёку [2]. Увеличение объёма внутримозговой крови также может быть связано со значением секвестрированной биомассы паразита, вызывая более выраженную компенсаторную вазодилатацию, чем истинный отёк мозга [7]. В конечном счёте, эти механизмы не могут быть взаимоисключающими. Для прояснения этих вопросов проводятся радиологические исследования с использова- нием магнитно-резонансной томографии
(МРТ).
Неврологические последствия церебральной малярии
Хотя после церебральной малярии выздоровление часто происходит полностью, у некоторых пациентов могут наблюдаться побочные эффекты. Они чаще встречаются и лучше изучены у детей, у которых мы обнаруживаем от 11 до 25% последствий (спастичность, атаксия, гемиплегия, нарушения речи, слепота, когнитивные расстройства, эпилепсия). У взрослых, по данным исследований, показатели варьируются от 0 до 10%. В исследовании SEAQUAMAT, в котором приняли участие 1461 пациент, в том числе 202 детей, только 0,67% пациентов были выписаны из больницы с неврологическими последствиями (психоз, нарушения памяти, мозжечковая атаксия, гемиплегия, экстрапирамидная ригидность) [15]. Постмалярийный неврологический синдром (ПМНС), классифицируемый как осложнение, имеет неопределённую патофизиологию и чаще встречается у взрослых. Максимальная частота ПМНС составляет 1,2/1000 [16]. Это соответствует появлению неврологических или психиатрических симптомов, возникающих в течение 2 месяцев после излечения инфекции P. falciparum. В этом смысле ПМНС отличается от неврологических последствий в строгом смысле слова, ко- торые осложняют течение тяжёлой малярии неврологическими нарушениями, но без свободного интервала.
Визуализация мозга
Теперь даже в эндемичных регионах Африки визуализация головного мозга становится доступной, и есть некоторые исследования, хотя и с противоречивыми результатами. Первые представляли собой скорее отдельные тематические исследования или небольшие серии. Среди наблюдаемых поражений отёк мозга наблюдался не более чем в 63% случаев [17]. Кроме того, были зарегистрированы ишемические, геморрагические, битала-мические поражения, поражения белого вещества и неспецифические поражения. В 2014 году Р.Дж. Мод и др. [18] в проспективном исследовании с участием 43 взрослых, 72% из которых находились в коме и 28% умерли, были выявлены отклонения от нормы на МРТ в 79% случаев, в основном минимальные изменения, затрагивающие многие анатомические области, без какой-либо разницы между пациентами с церебральной малярией и пациентами с тяжёлой малярией без нейромалярии, а также без какой-либо разницы между живыми и умершими пациентами. Аномалии, обнаруженные в 51% случаев, представляли собой отёк мозга, умеренный и диффузный, чаще всего невазогенный и без повышения внутричерепного давления.
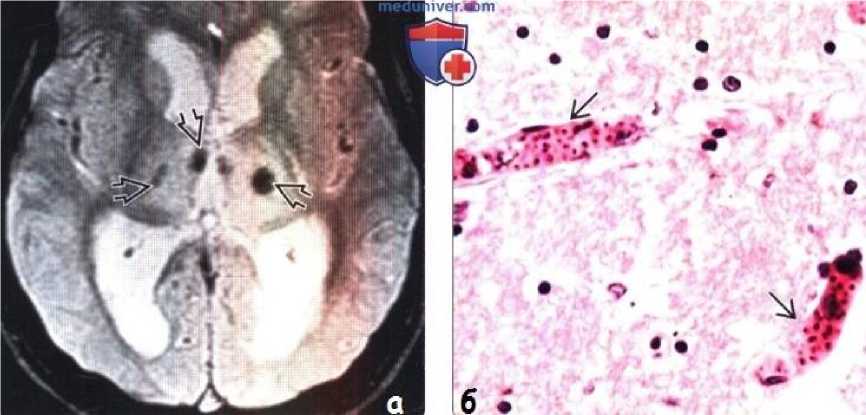
Рис. 4
Гиперсигналы FLAIR также были обнаружены в 26% случаев. Исследование, проведённое на 168 африканских детях с церебральной малярией, напротив, выявило тяжё- лый отёк мозга у 84% умерших детей по сравнению с 27% выживших детей [19], что позволяет предположить, что отёк мозга встречается чаще и более выражен у африкан- ских детей, чем у взрослых азиатского происхождения [18]. При завозной нейромалярии отклонения в мозговой картине встречаются довольно часто и разнообразно: ишемические нарушения, отёк мозга, кровоизлияния [20]. Эти данные подтверждают эффективность визуализации головного мозга, в идеале с помощью МРТ, у взрослых пациентов с тяжёлой формой завозной малярии с наличием неврологических признаков.
Терапевтическая поддержка
Поскольку церебральная малярия, вызванная Plasmodium falciparum, является чрезвычайной ситуацией, лечение необходимо начинать немедленно. В настоящее время он основан на внутривенном введении артесуната взрослым, беременным женщинам и детям [15, 21].
Лечение нетяжелых случаев малярии
Для взрослых с неосложнённой малярией, вызванной P. falciparum, комбинированная терапия на основе:
-
1) Артемизинин (ACT) рекомендуется применять в течение 3 дней. Выбор CTA основан на местном профиле резистентности паразитов:
-
- Артеметер 80 мг + Люмефантрин 480 мг 2 раза в день в течение 3 дней.
-
- Артесунат 200 мг + Амодиахин 540 мг (ASAQ) один раз в день в течение 3 дней.
-
- Артесунат 200 мг + Мефлохин 440 мг, один раз в день в течение 3 дней.
-
2) Дигидроартемизинина + Пиперахин
-
- Если 60-80 кг: дигидроартемизинин 160 мг + пиперахин 1280 мг, один раз в день в течение 3 дней.
-
- Если 80+ кг: дигидроартемизинин 200 мг + пиперахин 1600 мг, один раз в день в течение 3 дней.
Внутривенное лечение артесунатом
Обоснование: эффективность и переносимость. На патофизиологическом уровне арте-сунат посредством своего активного метаболита дигидроартемизинина (ДГК) действует на стадии молодых циркулирующих паразитов, предотвращая их развитие (быстрый и мощный паразитицид), а также подавляя явления секвестрации в течение нескольких часов. Кроме того, этот препарат лучше переносится, имеет меньше побочных эффектов, чем хинин, и его по-прежнему можно применять в случаях печёночной или почечной недоста- точности без коррекции дозы. Поэтому внутривенное введение артесуната теперь рекомендуется повсеместно в качестве терапии первой линии при тяжёлой форме малярии [12].
Рекомендуемая доза составляет 2,4 мг/кг в H0, H12, H24, затем каждые 24 часа в течение максимум 7 дней. Внутривенное лечение следует продолжать по крайней мере в течение первых 3 доз или до тех пор, пока не будут изменены критерии тяжести. Таким образом, если пероральный путь введения функционирует, мы можем перейти к АСТ (комбинированной терапии артемизинином), сочетанию производного артемизинина и другого противомалярийного препарата, для полного трёхдневного лечения. Артесунат доступен во Франции в форме временного разрешения на использование (ATU) с отложенным подтверждением. Учитывая срочность терапевтического вмешательства, лекарственные препараты необходимо заказывать заранее и заранее размещать в аптеке, отделении неотложной помощи или интенсивной терапии, чтобы они были быстро доступны. Хинин больше не является препаратом первой линии. Его применение допускается лишь в некоторых ситуациях: при недоступности артесуната или при известной аллергии на артемизинин. Если лечение хинином начато из-за недоступности артесуната, переход на артесунат остаётся желательным в течение первых 24 часов, но, вероятно, не принесёт никакой пользы после этого [12].
Адъювантное и симптоматическое лечение
На сегодняшний день не существует адъювантного лечения, эффективность которого была бы доказана клинически при тяжёлой форме малярии (экскровотрансфузия, антитела к ФНОα, хелаторы железа, пентоксифиллин, циклоспорин А, N-ацетилцистеин, эритропоэтин, левамизол, иммуномодуляторы, ингаляционный оксид азота, L-аргинин). Симптоматическое лечение основано на поражении основных органов. Наполнение должно быть умеренным и определяться гемодинамикой. С неврологической точки зрения лечение комы включает скрининг на гипогликемию, раннюю оротрахеальную интубацию, профилактику отёка мозга и вторичных инсультов, в частности, путём коррекции гипонатриемии. Рутинное профилактическое противосудорожное лечение не рекомендуется. Лечение осмотерапией также не рекомендуется, за исключением случаев экстренной меры при наличии признаков поражения головного мозга (болюс 20% маннитола или гипертонического раствора хлорида натрия). При церебральной малярии целесообразно проводить визуализацию головного мозга (МРТ или КТ), учитывая частоту встречающихся отклонений, если транспортировка не представляет опасности для пациента. Электроэнцефалографию следует проводить в случаях судорог или плохо объяснимой комы для выявления возможных субклинических припадков. Косвенная оценка внутричерепного давления с помощью транскраниальной допплерографии или путём измерения отёка сосочкового нерва может представлять интерес, особенно в наиболее тяжёлых случаях церебральной малярии. Установка инвазивного датчика внутричерепного давления не рекомендуется, учитывая частоту тромбоза поло- вого члена и риск кровотечения, но может обсуждаться в некоторых особых случаях. Наконец, следует предложить исследование глазного дна, которое является простым и минимально инвазивным исследованием, для подтверждения его корреляции с тяжестью церебральной малярии при тяжёлой завозной малярии.
Заключение
Малярия по сей день остаётся серьёзной проблемой общественного здравоохранения. При тяжёлой форме малярии, и особенно в нашем случае при завозной малярии, неврологические нарушения встречаются часто и тесно связаны со смертностью, а выжившие пациенты довольно часто страдают от последствий. Поэтому церебральная малярия является приоритетной темой исследований, как фундаментальных, так и клинических, с целью лучшего понимания её патофизиологии, улучшения диагностики и клинического описания и, в конечном итоге, достижения прогресса на терапевтическом уровне.


