Цервикальный спинальный стеноз - современные подходы к диагностике и лечению
Автор: Евграфов Д.П., Яриков А.В., Вишневский А.А., Фраерман А.П., Перльмуттер О.А., Гунькин И.В., Корнакова О.С., Истрелов А.К., Цыбусов С.Н., Котельников А.О., Хомченков М.В., Волков И.В., Павлова Е.А., Соснин А.Г., Туткин А.В., Паркаев М.В., Симонов А.Е.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 9 т.10, 2024 года.
Бесплатный доступ
В статье подробно проанализированы научная литература по этиологии, классификации, диагностике, клинической картины и лечению стеноза позвоночного канала на шейном отделе позвоночника. Особое внимание на клинической картине, диагностике и проведению дифференциальной диагностики причин цервикальной миелопатии. Далее в работе представлены все современные способы лечения цервикального спинального стеноза. Исследователи разделили способы на вентральные и дорзальные. Описаны достоинства и недостатки каждого вида операции. В заключении авторы обобщили показания и противопоказаний к каждому виду хирургического пособия.
Эндоскопическая декомпрессия, эндоскопическая дискэктомия, миелопатия, шейный стеноз, стеноз позвоночного канала, ламинопластика
Короткий адрес: https://sciup.org/14131063
IDR: 14131063 | УДК: 616.8-089 | DOI: 10.33619/2414-2948/106/27
Текст научной статьи Цервикальный спинальный стеноз - современные подходы к диагностике и лечению
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.8-089
Стеноз позвоночного канала (СПК) — это клинико-морфологическое понятие, включающее в себя сужение границ позвоночного канала, вызывающее компрессию его содержимого и/или развитие неврологических расстройств [1]. СПК шейного отдела позвоночника (ШОП), обусловленный дегенеративно-дистрофическим заболеванием позвоночника, является одной из наиболее частых причин, приводящих к инвалидизации людей старше 50 лет [2-4]. Частота распространения СПК ШОП составляет 3,5 случаев на 1000 населения и имеет пик заболеваемости в возрасте 50-59 лет [5, 6].
Этиология. Развитие СПК ШОП может быть обусловлено передними, задними и боковыми факторами компрессии и/или их сочетанием [7, 8]. К передним факторам компрессии можно отнести остеофиты, оссифицированную заднюю продольную связку, грыжи межпозвонковых дисков (МПД) [9, 10]. Гипертрофия желтой связки, спондилоартроз вызывает компрессию спинного мозга (СМ) сзади, а также унковертебральных суставов сбоку от него [11, 12]. Прогрессирующий СПК канала может приводить к развитию ишемии СМ и появлению миелопатии [5]. Доказано, что снижение высоты МПД на 1 мм. обусловливает уменьшение размеров межпозвонкового отверстия на 25–30%, а на 3 мм. вызывает уменьшение площади межпозвонкового отверстия до 50%. Показано, что утолщение задней продольной связки на 2-5 мм. приводит к уменьшению переднезаднего размера позвоночного канала на 3-7 мм. [1, 13].
Известно, что у жителей Юго-Восточной Азии заболеваемость с развитием синдрома шейной миелопатии, обусловленной оссификацией задней продольной связки (болезнь Цукимото, OPLL — ossification posterior longitudinal ligament), почти в 1000 раз выше, чем у европейцев [14, 15].
OPLL чаще происходит в области гипермобильного позвоночно-двигательного сегмента (ПДС) как средство динамической компенсации трансляции (переднезаднего смещения) позвонка или над областью скомпрометированного фиброзного кольца. Классификация СПК ШОП представлена в Таблице 1.
Таблица 1
КЛАССИФИКАЦИЯ СПК ШОП [16-18]
|
По этиологии: |
-врожденный -приобретенный (дегенеративный, посттравматический, ятрогенный) -комбинированный (сочетание врожденного и приобретенного) |
|
По локализации: |
-центральный -латеральный -комбинированный |
|
От наличия миелопатии |
- с миелопатией -без миелопатии |
|
По наличию клинической картины: |
-симптомный -асимптомный |
|
По функциональному состоянию ПДС: |
-стабильный -нестабильный |
|
По количеству пораженных ПДС: |
-моносегментарный (поражение одного ПДС) -полисегментарный (2-х и более) |
|
В зависимости от поражения других отделов |
-тандемный (комбинированный, одновременный, |
|
позвоночника |
параллельный) -изолированный |
Клиническая картина. В результате развивается несоответствие размера костнофиброзного футляра ШОП содержащимся в нем нервно-сосудистым образованиям, с нарушением крово- и ликворообращения, а также с механическим воздействием на СМ и/или его корешки, с формированием миелопатии [19, 20].
Уменьшение переднезаднего размера позвоночного канала с уровня С1 до С2 с 14 до 13 мм. и ниже С2 до 12 мм. в норме, при средней толщине дурального мешка на этом уровне 10 мм., увеличивает риски компрессии СМ [1].
По мнению Epsteinetal., в 2% случаев СПК наблюдается на уровне С3-4, в 17% — на уровне С4-5, в 27% — С5-6, в 17% — С6-7, в 5% — С7-Тh1 [21].
Клиническая картина СПК ШОП включает в себя [22-24]: двигательные расстройства (снижение силы в кистях и ногах, повышение тонуса и спастичности в ногах, атаксия, нарушение походки, мышечная атрофия, фасцикуляции мышц, «миелопатическая рука» и др.); чувствительные нарушения (снижение/нарушение болевой и суставно-мышечной чувствительности и др.); болевой синдром (корешковый, вертебральный, нейропатический и др.); тазовые нарушения (нарушение мочеиспускания, дефекации); рефлекторные нарушения (повышение сухожильных рефлексов с ног, снижение сухожильных рефлексов в руках, повышение сухожильных рефлексов в руках при вовлечении уровня выше C4, патологические стопные и кистевые знаки: Бабинского, Россолимо, Гоффмана и Вартенберга).
Можно выделить несколько ведущих вариантов развития и течения миелопатии [25-27]: синдром пирамидной недостаточности; сирингомиелитический синдром; полиомиелитический синдром; синдром Броун – Секара; заднестолбовой синдром; синдром бокового амиотрофического склероза (БАС).
Атипичная клиническая картина миелопатии, затрудняет постановку точного диагноза и приводит к выбору неверной тактики ведения и оперативного лечения пациента [28].
При обследовании пациента с клинической картиной миелопатии необходимы тщательный сбор анамнеза, проведение физикального соматического и неврологического обследования [29]
Особое внимание надо обращать на следующие анамнестические данные: предшествующие эпизоды развития очаговой неврологической симптоматики, в том числе регрессировавшие без лечения (характерно для рассеянного склероза); предшествующие эпизоды одно- или двустороннего снижения зрения (характерно для рассеянного склероза и оптикомиелита, в последнем случае снижение зрения, как правило, двустороннее, полный регресс нехарактерен даже после проведения патогенетической терапии); признаки неспецифической респираторной или гастроинтестинальной инфекции за несколько недель или месяцев до развития заболевания (может наблюдаться при идиопатическом/постинфекционном миелите, остром рассеянном энцефаломиелите, реже при рассеянном склерозе и оптикомиелите); эпизоды беспричинной рвоты, тошноты, икоты при исключении патологии желудочно-кишечного тракта – могут наблюдаться за несколько месяцев и лет до развития миелита/оптического неврита при оптикомиелите; наличие лихорадки, кашля, кожных высыпаний и других признаков инфекционного заболевания незадолго или совместно с появлением признаков поражения СМ (характерно для миелитов инфекционной этиологии); признаки, позволяющие подозревать системное аутоиммунное заболевание (кожные высыпания, артралгии, увеит, поражение почек, легких, анемия или тромбоцитопения, рецидивирующие язвы на слизистой оболочке ротовой полости и гениталий, рецидивирующие тромбозы, повторные выкидыши и т.п.); указания на травму, онкологическое заболевание в анамнезе; продолжительность развития и прогрессирования симптомов (для воспалительных миелопатий характерно острое/подострое развитие с нарастанием симптоматики в течение нескольких дней или недель).
Необходимо оценить скорость развития неврологической симптоматики (Таблица 2)
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ МИЕЛОПАТИЙ
|
Скорость нарастания |
Группа заболеваний |
|
симптоматики |
Таблица 2
|
До 4 часов |
Сосудистые миелопатии |
|
От 4 часов до 21 дня |
Миелиты |
|
Более 21 дня |
Компрессионная миелопатия, миелопатия на фоне АВМ, метаболическая миелопатия |
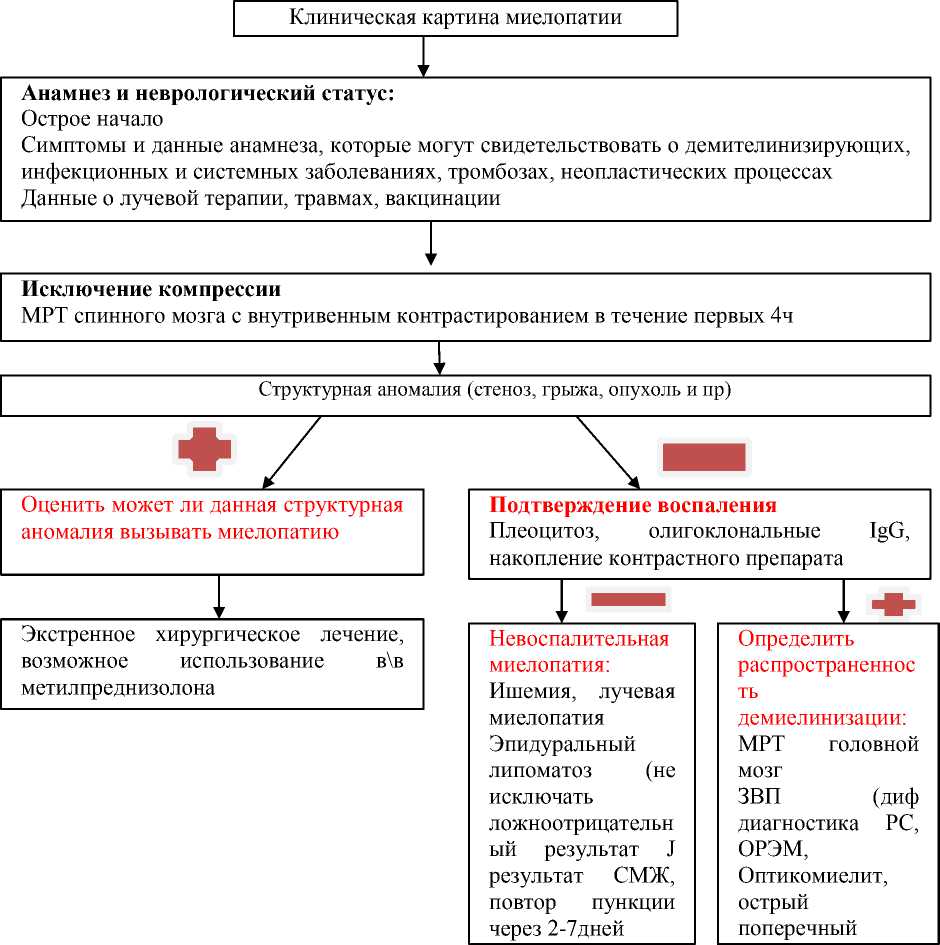
При проведении физикального обследования необходимо обращать внимание на наличие таких признаков, как лихорадка, лимфаденопатия, кожные высыпания, признаки поражения легких и сердца. Всем пациентам выполняются общеклинические анализы крови и мочи, биохимическое исследование крови (включая определение содержания витамина B12 и фолиевой кислоты). В схеме 1 представлен алгоритм диагностики миелопатий
Схема 1. Дифференциальный диагноз миелопатий/миелитов
Интенсивность болей в ШОП и верхних конечностях оценивается по визуальноаналоговой шкале боли (ВАШ), цифровой оценочной шкале (NRS), вербальной оценочной шкале (VRS) [30-33]. Индекс ограничения жизнедеятельности из-за боли в ШОП по NDI (Neck disability index), а выраженность миелопатии по Nurick (Nurick grade), Европейской миелопатической шкале (EMS), шкале Japanese Orthopaedic Association (JOA) и для количественной оценки — тесты с оценкой ходьбы (тест ходьбы на 30 м.) [34-36].
Дифференциальный диагноз СПК ШОП проводят со: спондилоартрозом ШОП, нарушением спинального кровообращения, демиелинизирующими заболеваниями (рассеянный склероз, оптикомиелит Девика, идиопатический поперечный миелит), воспалительными заболеваниями (системная красная волчанка, синдром Шегрена, саркоидоз), инфекционными поражениями ЦНС (ВИЧ, нейросифилис, болезнь Лайма, спинальная интрамедуллярная туберкулема, острый инфекционный миелит), сирингомиелией, БАС, туннельными синдромами, брахиоплескопатией, вторичными поражениями СМ при онкологических заболеваниях (особенно лейкоз и лимфома), сосудистыми заболеваниями СМ (АВМ, гемангиобластомами), интрамедуллярными опухолями СМ [37-39].
При подтверждении очагового поражения СМ воспалительной природы в отечественной литературе принят термин «миелит». В ряде случаев, например, при травме, лучевом воздействии, отсутствует однозначная трактовка этих двух понятий, и допустимы оба диагноза (миелопатия, миелит). Клинически и радиологически миелиты подразделяют на «поперечный» и «продольно-распространенный». Если патологический очаг захватывает больше половины поперечника СМ и клинически проявляется парезом различной степени выраженности, проводниковыми чувствительными расстройствами с четкой поперечной границей, вегетативными нарушениями, то речь идет о поперечном миелите [40].
Многие патологические процессы в ЦНС не самостоятельны, а являются следствием различных изменений, происходящих в других органах и тканях, или воздействия экзогенных факторов, установить которые достаточно сложно. К таким факторам можно отнести и миелит (миелопатию).
По данным C. Marsel, в группе из 33 пациентов (г. Страсбург, Франция) с миелопатией в 27% был верифицирован рассеянный склероз, в 18% — спинальный инсульт, в 9% — параинфекционный миелит, в 6% — острый рассеянный энцефаломиелит, в 3% — оптикомиелит Девика, в 3% — системная красная волчанка, и 15% составил миелит неясной этиологии [41].
Клиника компрессионной, токсической, неопластической, паранеопластической, метаболической, сосудистой, постлучевой и миелопатии иной этиологии не имеет патогномоничных симптомов для каждого из вариантов и требует проведения дифференциально-диагностических мероприятий (Таблица 3). В Таблице 4 представлены дифференциальный ряд миелопатий.
Таблица 3
ГРУППА МИЕЛОПАТИЙ/МИЕЛИТОВ В ЗАВИСИМОСТИ ОТ ЭТИОЛОГИИ
|
Группа |
Заболевание |
|
Аутоиммунные |
• Идиопатический миелит |
|
воспалительные и |
• Острый рассеянный энцефаломиелит |
|
демиелинизирующие |
• Оптикомиелит (болезнь Девика) |
|
заболевания нервной системы |
• Острая трансверсивная миелопатия при рассеянном склерозе |
Инфекционные, постинфекционные и поствакцинальные заболевания
• Бактериальные (Borrelia burgdorferi, Treponema pallidum, Mycobacterium tuberculosis, Brucella melitensis, Mycoplasma pneumoniae, Salmonella spp., Bartonella henselae, Listeria monocytogenes, Tropheryma whipplei, Coxiella burnetii и др.)
• Вирусные (HTLV-1, ВИЧ, энтеровирусы, герпес-вирусы, парамиксовирусы, ортомиксовирусы, пикорнавирусы, флавивирусы и др.) • Паразитарные (Schistosoma, Toxocara canis, Echinococcus, Taenia solius, Trichinella spiralis, Plasmodium и др.)
• Грибковые (Actinomyces, Coccidioides, Aspergillus, Blastomyces dermatitidis, Cladophialophora bantiana, Cryptococcus и др.)
Бюллетень науки и практики / Bulletin of Science and Practice Т. 10. №9 2024
|
Группа |
Заболевание |
|
Системные заболевания соединительной ткани и аутоиммунные заболевания |
|
|
Паранеопластические миелопатии |
• Некротическая миелопатия с антителами к амфифизину или anti-Ri (ANNA-2) |
Таблица 4
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ МИЕЛОПАТИЙ
|
канала)
|
|
|
Наследственные/ нейродегенеративные заболевания |
|
|
Неопластические |
|
|
Сосудистые |
|
|
Другие |
|
При отсутствии данных в пользу компрессионной миелопатии необходимо подтвердить воспалительный характер поражения СМ на основании накопления очагом контрастного вещества или выявления плеоцитоза в ликворе. Плеоцитоз (более 10 клеток/мм3) при миелите наблюдается в 85% случаев, в то время как при острых нарушениях спинального кровообращения этот признак не регистрируется. При идиопатическом миелите и оптикомиелите цитоз в ликворе может превышать 50 клеток/мм3, а его клеточный состав может быть представлен не только лимфоцитами, но и нейтрофилами и эозинофилами. В редких случаях при оптикомиелите плеоцитоз достигает 1000 клеток/мм3 и более, при этом обязательно требуется исключение инфекционного генеза заболевания путем проведения серологических проб и полимеразной цепной реакции (ПЦР). При рассеянном склерозе, напротив, в большинстве случаев выявляется лимфоцитарный плеоцитоз, не превышающий 50 клеток/мм3. Во всех случаях целесообразно исключение инфекционного генеза миелита путем проведения серологических проб и ПЦР. Перечень предполагаемых возбудителей определяется в зависимости от клинической картины, общих симптомов, изменений в ликворе и эпидемиологических данных.
При подтверждении воспалительного генеза заболевания и исключении его инфекционной этиологии следующий этап обследования включает [29]:
выявление диссеминации патологического процесса в пространстве — проведение МРТ головного мозга, в некоторых случаях – мультимодальных вызванных потенциалов;
анализ ликвора и сыворотки крови на олигоклональные антитела;
исследование содержания аутоантител-маркеров системных аутоиммунных заболеваний в сыворотке крови;
исследование сыворотки крови на антитела к аквапорину-4 (при продольнораспространенном миелите);
исследование сыворотки крови на содержание антинейрональных антител и проведение онкологического поиска при подозрении на паранеопластический генез миелопатии.
Совокупный анализ результатов указанных выше исследований, а также характеристики очага поражения CМ по данным нейровизуализации позволяют в большинстве случаев поставить правильный диагноз. Следует отметить, что миелит является неотложным состоянием с высоким риском развития стойкого инвалидизирующего неврологического дефицита. В связи с этим лечение необходимо начинать сразу после исключения компрессионной, сосудистой и инфекционной этиологии заболевания, не дожидаясь результатов дополнительных исследований.
Диагностика. МРТ является методом выбора, поскольку позволяет хорошо визуализировать нервные, костные структуры и связочный аппарат, а также проводить дифференциальную диагностику миелопатии и других заболеваний или выявить иную причину миелопатии (Рисунок 1) [42-44].
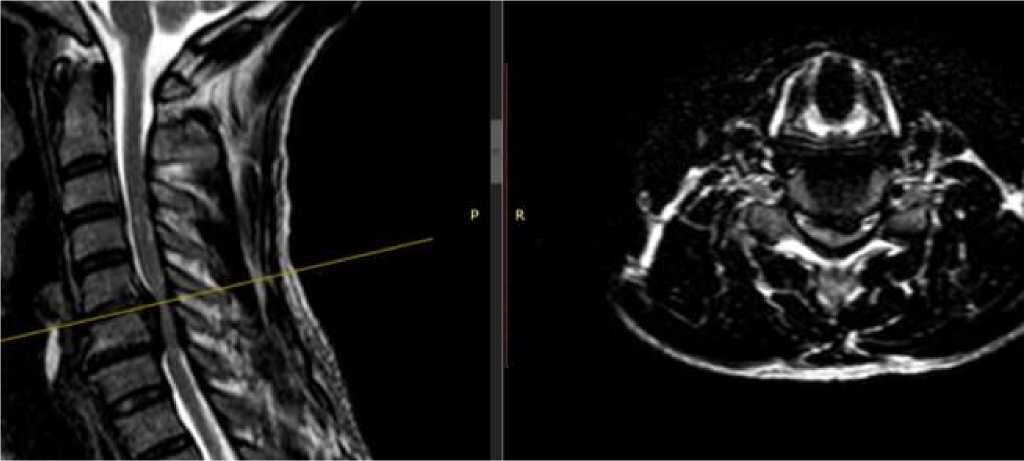
Рисунок 1. МРТ ШОП. Т2-ВИ. СПК на уровне С6
(ос) CD
На МРТ ШОП миелопатия проявляется гиперинтенсивным сигналом в Т2-, FLAIR-и STIR-режиме[45, 46]. Очаги в данном случае располагаются в центральной части СМ (Схема 1). На схеме 2 представлены дифференциальный ряд миелопатий в зависимости от расположения очага миелопатии в СМ на МРТ.
Схема 2. Дифференциальный диагноз воспалительных миелопатий по МРТ


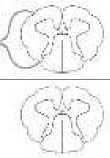
Периферический менее 2 сегментов РС
Центральный более 3 сегментов: идиопатический, параинфекционный , ОНМ, мальформация, ишемия
Задние столбы: В12 дефицитные состояния
Латеральные и задние столбы: Human T-cell Lymphotropic virus 1
Вакуольная ВИЧ-миелопатия
Передние рога. Picornaviruses: Poliovirus, Enterovirus , Coxsackie virus, Echovirus. Flavivuruses: Western Nile virus
Инфекционный патогенез: Borrelia burgdorferi (Lyme), ЦМВ ВЭБ, Varicella zoster virus, Schistosomiasis, СГБ
Туберкулез, саркоидоз, сифилис, ВПГ ЦМВ ВЭБ, Schistosomiasis, Neurocysticercosis
МР-трактография — это метод диагностики, который помогает оценить состояние моторных трактов и перспективы восстановления в послеоперационном периоде. У больных с цервикальной миелопатией показатели фракционной анизотропии (FA) были снижены, а показатели коэффициента диффузии (ADC) повышены по МРТ-трактографии, что говорит о возможности выявить «невидимую» зону повреждения нервной ткани на рутинных МРТ [28]. При 3D реконструкции у пациентов с демиелинизирующим процессом, проводящие пути СМ на уровне и ниже очага поражения не визуализируются, при этом у пациентов с миелопатией проводящие пути визуализируются без видимых изменений и деформаций. МР-трактография является вспомогательным методом [47].
Амплитуда движений ПДС оценивается по функциональных спондилограмм ШОП (Рисунок 2) [48].
При необходимости проводится МСКТ для определения оссификации структур ШОП (Рисунок 3).
В 3D-реконструкции выявить все патологических костных разрастаний как в зоне позвоночного канала, так и на уровне межпозвонкового канала, состояние суставных отростков, наличие кальцинированных связок [49].
Необходимость использования измерений показателей сагиттального баланса ШОП на этапе предоперационного планирования, и их влияние на результаты хирургического лечения дегенеративной патологии подчеркивается многими современными исследованиями. Одним из рентгенологических параметров выбора метода оперативного лечения при СПК ШОП является оценка K-line (Рисунок 4).
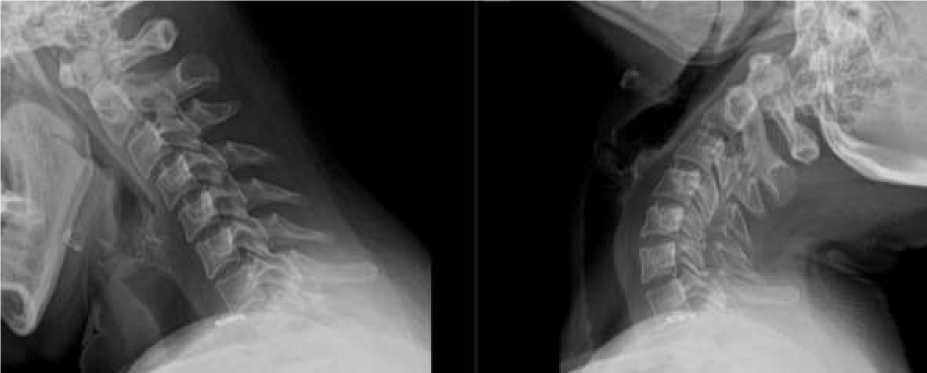
Рисунок 2. Функциональная рентгенография ШОП. Нестабильность в ПДС С3-4
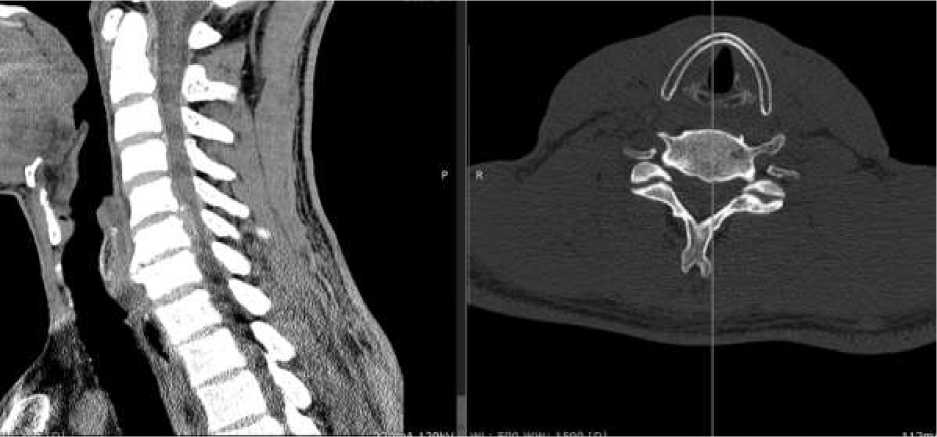
Рисунок 3. МРТ ШОП. СПК на уровне С6 за счет мягкотканого компонента
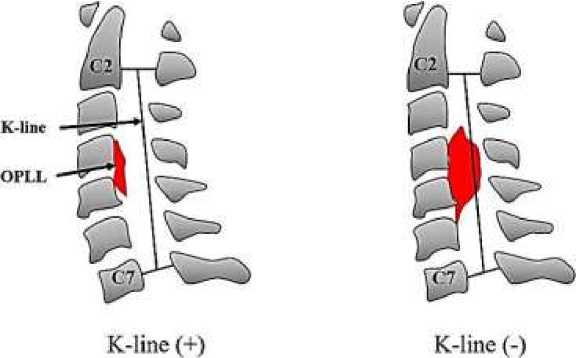
Рисунок 4. Схематичное измерения К-line. К-line - это линия, проведённая в середине позвоночного канала на уровне С2 и С7 на боковых рентгенограммах ШОП. Если задняя продольная связка не пересекает K-line, то K-line обозначается знаком (+), если пересекает, то K-line (-)
Fujiyoshi T. et. al. (2008) пришли к выводу, что в группе пациентов с K-line (-) после ляминопластики отмечались неудовлетворительные результаты, в то время как в группе с Kline (+) после лямнопластики результаты хирургического лечения были хорошими. Таким образом, K-line — это простой и практичный инструмент для принятия решений выбора метода хирургического лечения у пациентов с OPLL [50].
Лечение. В консервативной терапии используют нестероидные противовоспалителные вещества, анальгетики, антиконвульсанты, миорелаксанты, витамины группы В, антидепрессанты, антиоксиданты, вазоактивные препараты, наружную иммобилизацию ШОП (воротника Шанца или Филадельфия) [38, 51].
Для восстановления полноценной функции сегментарного аппарата и мотонейронов СМ в лечебной практике активно применяют ЛФК, массаж, физиотерапию (электростимуляция, электрофорез, диатермия, гальванизация, УВЧ, парафинотерапия, СМТ паретичных мышц, водолечение) и иглорефлексотерапию [52, 53].
При глубоких парезах ЛФК состоит в выполнении пассивных упражнений и механотерапии. Улучшение состояния пациентов при консервативной терапии наступает в 36-50% наблюдений, в то время как при хирургическом лечении — у 68-95% больных [5].
В случае легкой шейной миелопатии (≥13 баллов по шкале JOA значительной разницы в исходах консервативного и хирургического лечения в период до 3 лет не наблюдается [42]Оперативное лечение. Показаниями к операции являются [54]: отсутствие эффекта от консервативной терапии с сохраняющимися жалобами, корешковая боль; наличие неврологической симптоматики (чувствительные и/или двигательные нарушения, шейная миелопатия); MPT-признаки миелопатии; признаки нестабильности с гипермобильностью при динамической рентгенографии, признаки сдавления невральных структур.
Выбор тактики хирургического вмешательства зависит от локализации и протяженности субстрата компрессии СМ, биомеханических параметров ШОП (лордоза, кифоза, наличия нестабильности) [55].
Все операции в зависимости от доступа можно разделить на: передние, задние и комбинированные [56].
К передним доступам можно отнести: дискэктомию со спондилодезом (ACDF), дискэктомию со спондилодезом (ACDF) с применением тубулярного ретрактора, корпэктомию со спондилодезом (ACCF), артропластику и переднюю эндоскопическую фораминотомию (Рисунок 5) [57-60].
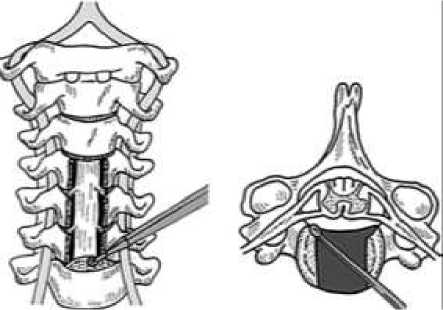
Рисунок 5. Вентральная корпэктомия с последующим спондилодезом (Anterior cervical corpectomy and fusion-АССF)
К дорсальным относятся: изолированная декомпрессия (задняя фораминотомия, гемиляминэктомия, ламинэктомия), декомпрессивно-пластические (ламинопластика) и декомпрессивно-стабилизирующие (фиксация за боковые массы, транспедикулярная стабилизация) вмешательства [61, 62]. «Золотым стандартом» в хирургическом лечении одно- и двухуровневых СПК ШОП с наличием миелопатии является передняя декомпрессия и спондилодез (ACDF и ACCF) [63, 64, 65].
Передняя декомпрессия и спондилодез (ACDF и ACCF). Выполнение ACDF возможно за счет протезирования МПД кейджем (Ахиллес, Матрикс, Церфикс, HRC, Solis Anchor, Эндокарбон), аутокостью, титановым сетчатым протезом с или без фиксации вентральной пластиной (Конмет, Остеомед, Галактика, Osmium, Медбиотех, Reflex Hybrid, Trauson). Для ACDF в настоящее время возможно применение индивидуальных кейджей, изготовленных методом 3D печати (Конмет, FUSION, Ортоинвест) [66, 67, 68, 69, 70]. Протезирование тела при ACСF возможно с помощью аутокости, титанового сетчатого протеза (Атлант, Медбиотех, Анатомика), дистракционным кейждем с обязательной фиксацией пластиной или одним дистракционным кейджем со стабилизатором (Остеомед, ADD, Теллур).
При передней декомпрессии и спондилодезе, на место удаленного МПД, может быть установлен аутотрасплантат, чаще всего для этого используется фрагмент гребня подвздошной кости. При сравнении использования ауто- и аллотрансплантата, количество случаев формирования псевдоартроза ниже в группе с аутотрансплантатами [71].
Большинство исследований подтверждают 95-100% частоту сращения при использовании аутотрансплантата гребня подвздошной кости для выполнения одноуровневой ACDF. Использование аутотрансплантата при одноуровневой ACDF экономически более выгодно. Целесообразно использование пластины, за счет чего снижается риск вентрального выпячивания трансплантата и повышается частота межтелового сращения [72, 73].
Хотя стоимость трансплантата значительно ниже, взятие аутокости ассоциировано с более длительным пребыванием в клинике, увеличением длительности оперативного вмешательства. В определенных случаях имеет место длительный болевой синдром в месте взятия аутокости, что влечет за собой снижение качества жизни, необходимость повторный обращений за медицинской помощью, дополнительные затраты на медикаментозное лечение [74]. Результаты ACDF представлены в Таблице 5
Таблица 5
ДАННЫЕ ИСПОЛЬЗОВАНИЕ МЕТОДИКИ ACDF
|
Автор, год |
Отличный, хороший исход, шкала абс., % |
ВАШ до/после |
NDI до/ после |
Осложнения абс. (%) |
|
Chang H. etal., 2015. [75] |
н/д |
69 мм /29 мм - в ШОП |
34,9%/11,6 % |
н/д |
|
Li Z. etal., 2017. [76] |
н/д |
60±17 мм /17±6 мм. в ШОП |
16,9±3,0 %/10,7±2,1 % |
1 (1,5%) эпидуральная гематома; 3 (4,4%) дисфония; 5 (7,4%) дисфагия; 1 (1,5%) боль в ШОП; 12 (9,8%) проседание кейджа |
|
Калинин А.А. и соавт., 2019 [77] |
Macnab: 96 (92%) |
47 мм /22 мм – в ШОП; 58 мм /23 мм - в верхних конечностях |
64 %/ 18% |
3 (3%) инфекционные осложнения; 2 (1,5%) межмышечная гематомы |
Однако методика спондилодеза ассоциирована с развитием ряда нежелательных явлений, что связано с ограничением амплитуды движений оперированного ПДС и развитием дегенеративного заболевания смежных ПДС. Многоуровневая ACCF при протяженных СПК связана с высоким риском развития таких осложнений, как несостоятельность металлоконструкций, вывихивание и перелом костных аутотрансплантатов, несращение и псевдоартроз, частота которых достигает 70%. Это стало побудительным мотивом к разработке более безопасных методов хирургического лечения протяженных СПК ШОП [78, 79].
Одним из них стала «skip corpectomy» или «перескакивающая корпорэктомия», описанная Ashkenazi et al. для передней декомпрессии многоуровневых CПК, которая заключается в удалении тел С4 и С6 позвонков с резекцией задних остеофитов смежных с ними позвонков, что позволяет уменьшить количество резецируемых позвонков и избежать осложнений, связанных с нестабильностью (Рисунок 6) [80].
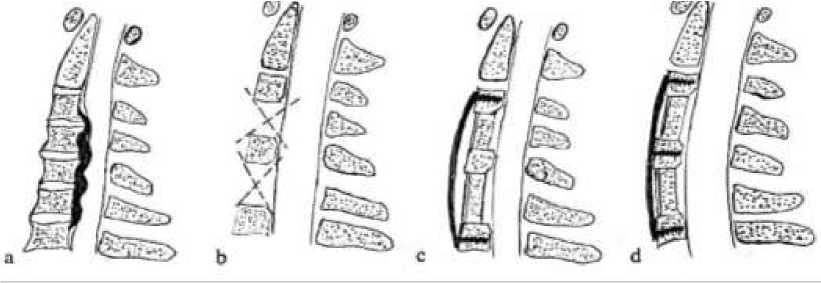
Рисунок 6. Схема выполнения “skip corpectomy”. а — многоуровневый СПК, обусловленный вентрально расположенным компремирующим субстратом; b — ACCF С4 и С6 позвонков с резекцией задних остеофитов смежных тел позвонков; c — импакция в межтеловые промежутки блоков аутокости и фиксация к телам С3 и С7 позвонков пластины с небольшим зазором между ней и телом С5 позвонка; d — «подтягивание» тела С5 позвонка кпереди при фиксации его винтами к пластине
Расширение использования методик малоинвазивной хирургии в лечении патологий позвоночника в последние годы привело к внедрению тубулярных (трубчатых) ретракторов. Для ACDF уже применяются как трубчатая ретракторная система MetrX (Medtronic), так и трубчатая ретракторная система EasyGO (Туттинген). В литературе представлен опыт использования EasyGo — трубчатой ретракторной системы для ACDF, обеспечивающей достаточное пространство для методик под операционным микроскопом [81].
Артропластика. Альтернативой ригидной фиксации является методика передней динамической фиксации ПДС с использованием различных протезов МПД [82, 83]. На сегодняшний день в клинической практике наибольшее распространение и признание система динамической стабилизации следующими видами имплантов: M6-С, LinkSpineGroup, Charite, DePuyAcroMed, AcroFlex, ProDisc, Maverick, Brayan, Flexicore, Kineflex и Эндокарбон [84, 85]. Методика тотальной артропластики МПД, позволяет сохранить нормальную биомеханику ШОП и тем самым предотвратить развитие дегенерации смежных ПДС[86].
Глухих Д. Л. (2007) провел исследование, сравнивающих артропластику и ACDF. 31 пациенту имплантировано 37 протезов МПД Bryan (1 группа). ACDF проведен 47 пациентам (2 группа). Уменьшение боли в руке по ВАШ в 1 группе на 62,37%, в ШОП — на 65,02%; во 2 группе — в руке на 38,75%, в ШОП — на 35,59%.
Качество жизни в 1 группе улучшилось на 53,18%, во 2 — на 30,34%. Дегенеративные изменения смежных ПДС в начальной стадии за 24 мес. замечены у 5,30% пациентов 1
группы, у 55,00% — 2; проседаний и смещений протезов не было. Во 2 группе у 35,00% больных выявлены проседания и несращения имплантатов с позвонками в оперированном ПДС. Лучшие клинические и рентгенологические результаты в ближайшем и отдаленном послеоперационных периодах достигнуты при использовании артропластики [87].
Бывальцев В. А. и соавт. (2019) провели сравнительный анализ отдаленных результатов применения методик тотальной артропластики и ACDF в лечении пациентов с одноуровневыми поражениями ШОП. В исследование включены 186 пациентов 21–60 лет. Выполнена независимая последовательная рандомизация (1:1) 173 пациентов с помощью программного обеспечения. В группе с ACDF в 83 (93,3%) случаях верифицировали полноценный костный блок. Выявлена достоверно большая степень дегенеративного заболевания в вышележащих МПД в группе ACDF (p<0,01), при этом в нижележащих МПД значительных дегенеративных изменений в динамике не зарегистрировали (p>0,05). Число интраоперационных и ранних послеоперационных осложнений не имело статистически значимой межгрупповой разницы (p>0,05). Симптоматическая дегенерация смежных ПДС верифицирована у 2 (2,4%) респондентов из группы тотальной артропластики и у 8 (9,0%) — из группы ACDF (p<0,001). Симптоматические неблагоприятные последствия выявлены у 3 (3,6%) пациентов с артропластикой в виде гетеротопической оссификации и у 6 (6,7 %) - с ACDF в виде псевдоартроза. У пациентов с тотальной артропластикой отмечали достоверно лучшие клинические результаты в сравнении с группой ACDF. Артропластика позволила сохранить нормальную биомеханику ШОП и предотвратить развитие дегенеративного заболевания смежных ПДС (Рисунок 7) [48].
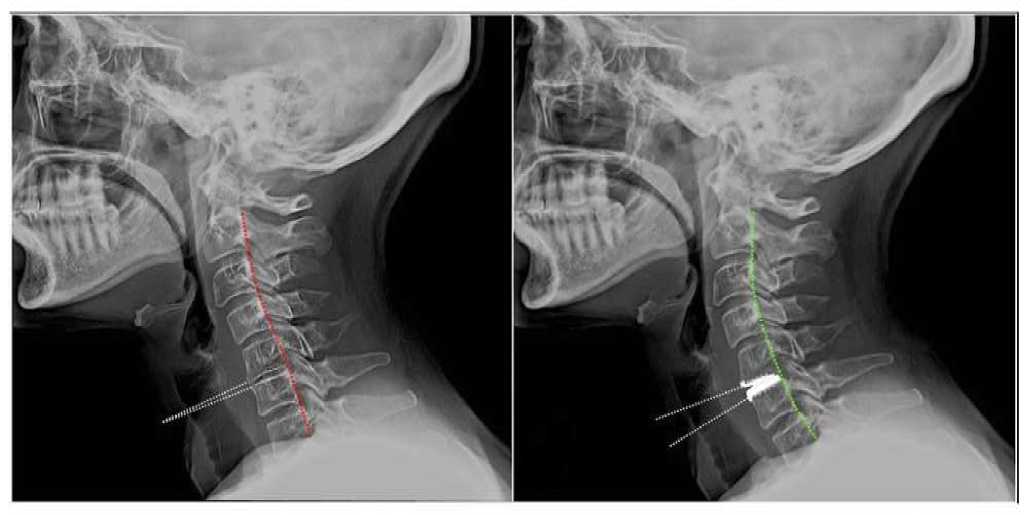
Рисунок 7. K-line до ( А) и после эндопротезирования МПД на уровне С5-6
Относительные противопоказаниями к артропластике являются: возраст > 70 лет. минеральная плотность костной ткани с Т-критерием <1,5, остеопоротический перелом позвоночника, бедра или запястья в анамнезе, активная системная инфекция, боли от межпозвонковых суставов, миелопатия, прогрессирующие дегенеративные изменение ШОП на уровне вмешательства (остеофиты срастающиеся, средний объем движения менее 4°, высота МПД<25%, смещение > 3 мм), деформирующее заболевания ШОП (анкилозирующий спондилоартрит и др.).
Исходя из вышесказанного, артропластика при лечении СПК ШОП имеет ряд противопоказаний и применяется редко. Однако биомеханические исследования искусственных МПД показали, что динамические имплантаты не являются истинным заменителем МПД. Диапазон движения на имплантированном ПДС часто оказывался большим, чем нормальное физиологическое движение, а диапазон движения смежного ПДС уменьшался. Позже было сообщено и о других проблемах, связанных с тотальным протезированием МПД ШОП, таких как гетеротопическая оссификация, блокирование имплантата и спонтанный спондилодез. Ещё одним из существенных недостатков искусственных МПД является их высокая стоимость. Все вышеперечисленные исследования свидетельствую о преимуществе артропластики перед спондилодезом.
Эндоскопические передние методы. Стремление специалистов к минимизации хирургической агрессии повлияло на эволюцию эндоскопического оборудования. Эндоскопические методы имеют преимущество в связи с малой травматизацией мышц и снижением послеоперационных рубцово-спаечных процессов (Рисунок 8).
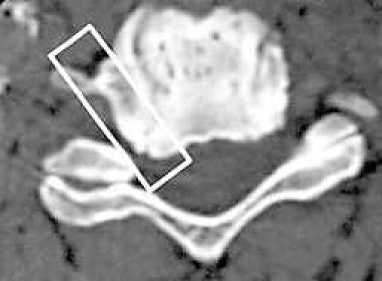
Рисунок 8. Зона резекции позвонка при вентральном эндоскопическом доступе
Выделяют вентральный эндоскопический доступ и дорзальный [85]. При вентральном эндоскопическом доступе существует ряд недостатков, связанных с 2D эндоскопическим изображением операционного поля и сложностью контроля гемостаза. Эндоскопические методы противопоказаны при кифотической деформации, грыжах и остеофитах центральной и парацентральной локализации; высоте МПД<5 мм (учитывая 4 мм. диаметр эндоскопа, достаточно хрупкого), нестабильности в оперируемом ПДС [88].
Дорсальные доступы. Задний доступ (в виде ламинопластики или ламинэктомии с фиксацией и без нее) показан при наличии протяженной (три ПДС) и предпочтительно задней компрессии с сохраненным лордозом и/или выявлении OPLL [14, 89, 90]. При сочетании кифоза и внедрении вентральных костных оссификатов в дуральный мешок > чем на 5 мм. рекомендуется комбинированный доступ — задний, а затем передний [91, 92].
Ляминэктомия в хирургическом лечение СПК ШОП в настоящее время применяется редко из-за большого количества нежелательным явлений (развитие кифоза ШОП, нестабильности в ПДС и др.). В настоящее время ляминэктомия часто сочетается с фиксаций винтами (Конмет, Остеомед) в боковые массы или транспедикулярной фиксацией. Установку винтов в боковые массы выполняют по Magerl, Anderson, An, Roy-Camille, Louis [15].
По данным Singrakhia M.D. et. al. (2017) при проведении ламинэктомии с фиксацией в боковые массы среднее улучшение по шкале mJOA составило с 8,56 до 13,57, по шкале Nurick с 2,59 до 0,66, изменения по шкале Cooper с 1,75 до 0,31 для верхних конечностей и с 2,14 до 0,56 для нижних конечностей [93].
Ламинопластика — это метод хирургического лечения, основанный на декомпрессии СМ, с сохранением большей части объема движения в ШОП, без создания спондилодеза. Известно несколько способов ламинопластики: по Hirabayashi, Itoh, Koyama, Lin, Nakano, Tomita, Shikaya, Nakashima и Kurokawa (рисунок 9) [2, 92, 93].
Условиями для выполнения данного оперативного вмешательства является наличие лордоза, или по крайней мере, нейтрального сагиттального баланса (<4° ангуляции в сторону кифоза или лордоза) [5].
Абсолютным противопоказанием для выполнения ламинопластики является наличие кифотической деформации ШОП. При ламинопластике происходит формирование дополнительного заднего эпидурального резервного пространства и смещение дорсально СМ, что невозможно при наличии кифоза.
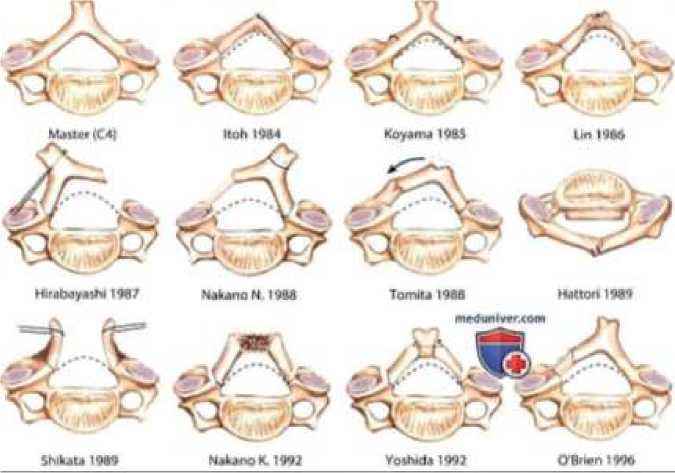
Рисунок 9. Варианты ламинопластики
Sani’set. al, проведя мета-анализ исходов 71 серии, включающий более чем 2000 пациентов после ламинопластики, выявили, что частота развития послеоперационного болей в ШОП составляет от 6 до 60% и не зависит от техники ламинопластики [95].
Бывальцев В.А. и соавт. (2019 г.) провели проспективное нерандомизированное исследование с 104 пациентами со СПК ШОП на 2 и >уровнях. Выделено 2 группы исследования: I группа (n=47) — пациенты были оперированы с использованием ляминопластики; во II группе (n=57) выполнялась ляминэктомии и фиксации в боковые массы. Отмечен больший объем кровопотери (p=0,03) и времени интраоперационного облучения (p=0,01) в группе II. В отдаленном послеоперационном периоде зарегистрированы лучшие клинические исходы в группе 1 по сравнению с группой 2: по ВАШ в ШОП (p=0,00008) и верхних конечностях (p=0,006), по NDI (p=0,0001), по шкалам Macnab(p=0,003) и Nurick (p=0,007). Общее число осложнений было сопоставимым в I группе 7 (14,9%), во II группе 12 (21,1%) (p=0,07). Через 24 месяца после операции отмечена физиологическая лордотическая конфигурации ШОП у 63,8% после группе 1 (n=30) и у 50,9% (n=29) после группы 2. В двух группах верифицировано статистически значимое восстановление лордоза ШОП (p=0,002 и p=0,009 соответственно), при отсутствии межгрупповой разницы (p=0,28). Ламинопластика и ляминэктомия с фиксацией при многоуровневых дегенеративных заболеваниях ШОП позволили значительно снизить дооперационный уровень болей, улучшить функциональное состояние пациентов и восстановить пространственные взаимоотношения в оперированных ПДС. Установлены преимущества группе 1 по сравнению с группой 2 по отдаленным клиническим параметрам, частоте дегенерации ПДС и количеству повторных оперативных вмешательств [14].
Многие исследования указывают на эффективность ламинопластики в лечении многоуровневого СПК ШОП с наличием миелопатии. Малоэффективна ламинопластика при протяженности СПК — 3 уровней, так как не происходит создания достаточного пространства для смешения СМ кзади и необходимой декомпрессии. Признаки нестабильности, выявленные по данным нейровизуализации, и связанная с ними клиническая симптоматика могут нарастать после ламинопластики. В настоящее время нет доказательств превосходства одного способа ламинопластики над другой, у каждой есть свои положительные и отрицательные стороны. При исследовании биомеханики ШОП установлено, что винтовая фиксация за боковые массы обладает большей стабильностью при сгибании, разгибании и ротации по сравнению с ламинопластикой и ляминэктомией [14].
Также имеются указания на больший объем возможной декомпрессии при ляминэктомии в противоположность ламинопластики. Но при этом ляминэктомия с фиксацией является более травматичной хирургической методикой по сравнению с ламинопластикой, потому что требуется широкое скелетирование мышц до боковых масс [96].
Задняя цервикальная фораминотомия имеет некоторые преимущества перед ACDF, обусловленные сохранением собственного МПД, поддержанием естественной биомеханики ШОП и снижением рисков, обусловленных имплантацией инородных тел в межтеловой промежуток, таких как синдром ускоренной дегенерации смежного ПДС [97].
Возможно проведения задней цервикальной фораминотомии с помощью эндоскопических методов. S. Ruetten et. al. (2007) сообщили об опыте лечения 87 пациентов с латеральным СПК ШОП методом чрескожной эндоскопической задней фораминотомии 6,9 мм. эндоскопом через рабочую канюлю, наружный диаметр которой составлял 7,9 мм. Оперативное вмешательство осуществлялось посредством пункционного доступа к задним структурам ШОП. У 87,4% пациентов отметился полный регресс корешковой симптоматики; не было отмечено серьезных периоперационных осложнений; продолжительность болей в проекции ШОП, связанных с операцией, не превышала 5 дней; за 2-х летний период наблюдения частота рецидивов грыж не превысила 3,4 %; в повторном оперативном лечении нуждались 5,7% пациентов [98].
Осложнения и факторы риска декомпрессивно-стабилизирующих операций на ШОП. Факторами, ассоциированными с негативным исходом хирургического лечения СПК ШОП, являются более длительный анамнез заболевания, большая протяженность очага миелопатии, высокая степень тяжести неврологической симптоматики и пожилой возраст [41].
Большая продолжительность операции, а также 2-этапная операция связана с повышенным риском серьезных осложнений. Основными причинами нарастания неврологической симптоматики в послеоперационном периоде являются: травма невральных структур, артериальная гипотония, нарушение спинального кровообращения.
Заключение
Проведя анализ литературы можно разделить хирургические методы лечения СПК ШОП на декомпрессивные (в том числе эндоскопические), стабилизирующие и артропластики [99, 100]. Исходя из вышеизложенного, можно представить показания и противопоказания к каждому из методов оперативного лечения СПК ШОП (Таблица 6).
Таблица 6
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К КАЖДОМУ ВИДУ РЕКОНСТРУКЦИИ ШОП
|
Вид операции |
Показания Противопоказания |
|
ACDF/ACCF |
-кифотическая деформация ШОП -гиперлордоз ШОП -нестабильность в ПДС -локальная боль в ШОП -центральный, комбинированный и латеральный СПК |
|
Артропластика |
-дегенерация МПД от C3–4 до C6–7 (по -остеопороз Pfirrmann I–II ст.), -нестабильность в ПДС
дугоотростчатых суставов (по Fujiwara I– II -остеофиты срастающиеся, ст. ) средний объем движения < 4°,
вышележащего) -миелопатия |
|
Ламинэктомия |
-гиперлордоз ШОП -кифотическая деформация ШОП -многоуровневый СПК (3 уровня и более) -нестабильность ПДС -центральный, комбинированный и -локальная боль в ШОП латеральный СПК -преимущественно задний источник компрессии (гипертрофия желтой связки, спондилоартроз) -трудность выполнения переднего доступа (короткая шея, ожирение и т.д.) |
|
Ламинопластика |
-многоуровневый СПК (3 уровня и более) -кифотическая деформация ШОП -центральный, комбинированный и -нестабильность ПДС латеральный СПК -локальная боль в ШОП -преимущественно задний источник компрессии -трудность выполнения переднего доступа |
|
Ламинэктомия с фиксацией |
-многоуровневый СПК (3 уровня и более) -кифотическая деформация ШОП -гиперлордоз ШОП -нестабильность ПДС -центральный, комбинированный и латеральный СПК -преимущественно задний источник компрессии -трудность выполнения переднего доступа |
|
Задняя цервикальная фораминотомия |
-латеральный и одноуровневый СПК -нестабильность ПДС -кифоз ШОП -центральный, комбинированный и многоуровневый СПК |
Список литературы Цервикальный спинальный стеноз - современные подходы к диагностике и лечению
- Бывальцев В. А., Шепелев В. В., Никифоров С. Б., Калинин А. А.Изолированные и сочетанные дегенеративные тандем-стенозы позвоночного канала шейного и поясничного отделов позвоночника: обзор литературы // Хирургия позвоночника. 2016. Т. 13. №2. С. 52-61.
- Суфианов А. А., Набиев Д. Н., Калинин И. В., Суфианов Р. А., Шапкин А. Г., Зайцев М. К., Черкасов А. В., Сагдиев Р. Х. Билатеральная костно-пластическая декомпрессивная ламинопластика с одномоментной фораминотомией как способ лечения многоуровневого стеноза позвоночного канала в шейном отделе позвоночника // Хирургия позвоночника. 2021. Т. 18. №2. С. 54-63.
- Шепелев В. В., Бывальцев В. А., Калинин А. А., Сороковиков В. А., Крутько А. В. Анализ результатов этапных декомпрессивно-стабилизирующих вмешательств при лечении пациентов с тандем-стенозами позвоночного канала в шейном и поясничном отделах позвоночника // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2016. Т. 1. № 4(110). С. 85-90.
- Яриков А. В., Перльмуттер О. А., Смирнов И. И., Гунькин И. В., Отдельнов Л. А. Осложнения в вентральной фиксации шейного отдела позвоночника на субаксиальном уровне: диагностика, тактика лечения и профилактика // Забайкальский медицинский вестник. 2019. №3. С. 82-94.
- Зуев А. А., Лебедев В. Б., Епифанов Д. С. Роль ламинопластики в лечении многоуровневого стеноза шейного отдела позвоночника с наличием миелопатии // Нейрохирургия. 2017. №2. С. 72-77.
- Бывальцев В. А., Калинин А. А., Шепелев В. В., Степанов И. А. Редкий случай успешного этапного хирургического лечения пациента с тандем-стенозом позвоночного канала в шейном, грудном и поясничном отделах позвоночника // Инновационная медицина Кубани. 2018. №1(9). С. 23-31.
- Ипполитова Е. Г., Дамдинов Б. Б., Кошкарева З. В., Верхозина Т. К. Электронейромиографические показатели у больных со стенозирующим процессом позвоночного канала на шейном уровне // Acta Biomedica Scientifica (East Siberian Biomedical Journal). 2020. Т. 5. №5. С. 68-72. https://doi.org/10.29413/ABS.2020-5.5.9
- Бондаренко Г. Ю., Луцик А. А., Раткин И. К. Комплексное нейрохирургическое лечение больных с сочетанием рефлекторных и компрессионных синдромов шейного остеохондроза // Хирургия позвоночника. 2004. №4. С. 34-39.
- Степанов И. А., Белобородов В. А., Сороковиков В. А., Животенко А. П., Кошкарева З. В., Очкал С. В., Дамдинов Б. Б., Глотов С. Д. Клинико-рентгенологическая эффективность применения операции корпэктомии и передней стабилизации сетчатыми титановыми имплантатами у пациентов с миелопатическим синдромом на фоне дегенеративных заболеваний шейного отдела позвоночника // Acta Biomedica Scientifica (East Siberian Biomedical Journal). 2022. Т. 7. №1. С. 48-58. https://doi.org/10.29413/ABS.2022-7.1.6
- Захматова Т. В., Щедренок В. В., Могучая О. В. Дегенеративные заболевания и повреждения шейного отдела позвоночника: значение результатов лучевой диагностики при планировании хирургического лечения // Радиология - практика. 2015. №6 (54). С. 25-34.
- Бывальцев В. А., Калинин А. А., Алиев М. А., Шепелев В. В., Юсупов Б. Р., Аглаков Б. М. Разработка дифференцированной хирургической тактики при лечении пациентов с многоуровневыми дегенеративными заболеваниями шейного отдела позвоночника // Инновационная медицина Кубани. 2019. №4 (16). С. 47-54. https://doi.org/10.35401/2500-0268- 2019-16-4-47-54
- Магомедов Ш. Ш., Татаринцев А. П., Сысоев К. В., Докиш М. Ю. Значение растяжения спинного мозга в формировании спондилогенной цервикальной миелопатии на фоне кифотической деформации позвоночника // Вопросы нейрохирургии им. Н.Н. Бурденко. 2018. Т. 82. №5. С. 62-68. https://doi.org/10.17116/neiro20188205162
- Пелеганчук А. В., Крутько А. В., Рабинович С. С., Народов А. А. Хирургическое лечение при тандем-стенозе шейного, грудного и поясничного отдела позвоночника: клинический случай // Современные проблемы науки и образования. 2017. №5. С. 135.
- Бывальцев В. А., Калинин А. А., Алиев М. А., Шепелев В. В., Юсупов Б. Р., Аглаков Б. М. Сравнительный анализ результатов ламинопластики и ламинэктомии с фиксацией за боковые массы при лечении пациентов с многоуровневыми дегенеративными заболеваниями шейного отдела позвоночника // Современные проблемы науки и образования. 2019. №2. С. 135.
- Бывальцев В. А., Калинин А. А., Алиев М. А., Юсупов Б. Р. Результаты ламинэктомии с фиксацией за боковые массы при лечении многоуровневых дегенеративных заболеваний шейного отдела // Сибирское медицинское обозрение. 2019. №5 (119). С. 52-58. https://doi.org/10.20333/2500136-2019-5-52-58
- Дамдинов Б. Б., Сороковиков В. А., Селиверстов П. В., Малаханов В. А., Кошкарева З. В., Скляренко О. В., Животенко А. П. Морфометрические показатели при стенозирующих процессах позвоночного канала дегенеративного генеза на шейном уровне // Современное состояние вопроса (обзор литературы) // Радиология - практика. 2019. №4 (76). С. 58-68.
- Потапов В. Э., Кошкарева З. В., Сороковиков В. А., Ларионов С. Н., Скляренко О. В., Животенко А. П., Горбунов А. В., Глотов С. Д. Хирургическое лечение посттравматического стеноза позвоночного канала и дурального мешка на краниовертебральном переходе // Acta Biomedica Scientifica (East Siberian Biomedical Journal). 2018. Т. 3. № 6. С. 69-76. https://doi.org/10.29413/ABS.2018-3.6.9
- Бывальцев В. А., Калинин А. А., Шепелев В. В. Комплексная оценка динамики клинической симптоматики после этапных хирургических вмешательств у пациентов с тандем-стенозами шейного и поясничного отделов позвоночника // Неврологический вестник. 2018. Т. 50. №2. С. 27-36.
- Гуща А. О., Корепина О. С., Древаль М. Д., Киреева Н. С. Случай хирургического лечения многоуровневой шейной миелопатии на фоне дегенеративной компрессии // Нервные болезни. 2013. №3. С. 39-43.
- Островский В. В., Щаницын И. Н. Персонализированный подход к диагностике и лечению пациентов с посттравматическими и дегенеративными поражениями шейного отдела позвоночника // Саратовский научно-медицинский журнал. 2018. Т. 14. №2. С. 244-250.
- Epstein N. E., Epstein J. A., Carras R., Murthy V. S., Hyman R. A. Coexisting cervical and lumbar spinal stenosis: diagnosis and management // Neurosurgery. 1984. V. 15. №4. P. 489-496. https://doi.org/10.1227/00006123-198410000-00003
- Фениксов В. М., Зеленков П. В. Тандемный спинальный стеноз: клиника, диагностика и хирургическая тактика // Нейрохирургия. 2021. Т. 23. №1. С. 146-153. https://doi.org/10.17650/1683-3295-2021-23-1-146-153
- Древаль М. Д., Гуща А. О., Арестов С. О., Корепина О. С. Хирургическое лечение тяжелой спондилогенной шейной миелопатии методом ламинопластики // Вопросы нейрохирургии им. Н.Н. Бурденко. 2015. Т. 79. №6. С. 77-84.
- Луцик А. А., Карпенко В. С., Бондаренко Г. Ю., Пеганова М. А. Клинико-патогенетические варианты и оперативное лечение шейной миелопатии // Нейрохирургия. 2014. №4. С. 44-50.
- Завгородняя Е. Б., Давыдов Е. А., Иванова Н. Е., Себелев К. И., Коллеров М. Ю. Клинические и анатомо-физиологические обоснования применения эластичных нитиноловых фиксаторов при хирургическом лечении осложненных дегенеративно- дистрофических заболеваний шейного отдела позвоночника // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2016. Т. 8. №2. С. 25-32.
- Луцик А. А., Казанцев В. В., Бондаренко Г. Ю., Пеганов А. И. Сосудистая миелопатия, обусловленная компрессией или стенозом аномальной позвоночной артерии, кровоснабжающей шейное утолщение // Медицина в Кузбассе. 2014. Т. 13. №2. С. 55-62.
- Гуща А. О., Древаль М. Д., Киреева Н. С., Корепина О. С. Лечение спондилогенной шейной миелопатии // Анналы клинической и экспериментальной неврологии. 2015. Т. 9. №3. С. 34-41.
- Басков А. В., Байгильдина И. Ф., Басков В. А., Ширяев Г. А., Ким В. Э. Использование диффузионно тензорной магнитно-резонансной томографии при дифференциальной диагностике миелопатии на шейном уровне // Российский нейрохирургический журнал им. проф. А.Л. Поленова. 2023. Т. 15. №4. С. 28–34.
- Бакулин И. С., Васильев А. В., Брюхов В. В., Стойда Н. И., Захарова М. Н. Дифференциальная диагностика миелитов при демиелинизирующих заболеваниях // Нервные болезни. 2015. №4. С. 9-17.
- Гуща А. О., Юсупова А. Р. Оценка исходов хирургического лечения дегенеративно-дистрофических заболеваний позвоночника // Хирургия позвоночника. 2017. Т. 14. №4. С. 85-94.
- Бывальцев В. А., Крутько А. В., Шепелев В. В., Калинин А. А. Результаты этапного хирургического лечения пациентов с тандем-стенозами шейного и пояснично-крестцового отделов позвоночника // Хирургия позвоночника. 2017. Т. 14. №2. С. 50-62.
- Бывальцев В. А., Калинин А. А., Шепелев В. В., Крутько А. В., Пестряков Ю. Я. Мультицентровый анализ результатов хирургического лечения пациентов с симптоматичным тандем-стенозом шейного и поясничного отделов позвоночника на основе дифференцированного клинико-инструментального алгоритма // Травматология и ортопедия России. 2018. Т. 24. №1. С. 53-64.
- Олейник Е. А., Олейник А. А., Беляков Ю. В., Олейник А. А., Орлов А. Ю., Иванова Н. Е. Количественное локационное отражение интенсивности болевого синдрома при шейном остеохондрозе // Российский нейрохирургический журнал имени профессора А.Л. Поленова. 2022. Т. 14. № 2. С. 105-107.
- Бывальцев В. А., Калинин А. А., Алиев М. А., Аглаков Б. М., Юсупов Б. Р., Шепелев
- Б. Р. Клиническая эффективность ламинопластики при лечении пациентов с многоуровневыми дегенеративными заболеваниями шейного отдела позвоночника // Практическая медицина. 2018. №9. С. 82-86.
- Древаль М. Д., Арестов С. О., Петросян Д. В., Кащеев А. А., Вершинин А. В., Полторако Е. Н., Гуща А. О. Ламинопластика и корпорэктомия в лечении спондилогенной шейной миелопатии // Анналы клинической и экспериментальной неврологии. 2017. Т. 11. №4. С. 36-44.
- Бывальцев В. А., Калинин А. А., Шепелев В. В. Комплексная оценка динамики клинической симптоматики после этапных хирургических вмешательств у пациентов с тандем-стенозами шейного и поясничного отделов позвоночника // Неврологический вестник. 2018. Т. 50. №2. С. 27-36.
- Луцик А. А., Череватенко Е. В., Трегуб И. С., Бондаренко Г. Ю., Пеганов А. И. Ошибки диагностики и лечения вертеброгенного шейного корешкового компрессионного синдрома и псевдорадикулярныхбрахиалгий // Хирургия позвоночника. 2014. №2. С. 49-59.
- Рудницкий А. Б., Авсейцева Т. Ю., Иволгин А. Ф., Мануковский В. А., Иванов И. И. Опыт лечения компрессионно-ишемической миелопатии // Госпитальная медицина: наука и практика. 2020. Т. 1. №3. С. 15-20. https://doi.org/10.34852/GM3CVKG.2020.56.70.003
- Гончарова З. А., Ярош Н. М., Погребнова Ю. Ю., Корганова И. Н. Трудности диагностики постлучевой миелопатии // Сибирское медицинское обозрение. 2017. №1 (103). С. 74-77.
- Scott T. F., Frohman E. M., De Seze J., Gronseth G. S., Weinshenker B. G. Evidencebased guideline: Clinical evaluation and treatment of transverse myelitis: [RETIRED] Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology // Neurology. 2011. V. 77. №24. P. 2128-2134. https://doi.org/10.1212/wnl.0b013e31823dc535
- Сигалева Т. В., Дмуховский Д. В., Гуща А. О., Бакулин И. С., Пойдашева А. Г., Супонева Н. А., Пирадов М. А. Дегенеративная шейная миелопатия: способы клинической оценки и алгоритм выбора лечения // Нервные болезни. 2020. №4. С. 3-11. https://doi.org/10.24412/2226-0757-2020-12238
- Jarius S., Wildemann B., Paul F. Neuromyelitis optica: clinical features, immunopathogenesis and treatment // Clinical & Experimental Immunology. 2014. V. 176. №2. P. 149-164. https://doi.org/10.1111/cei.12271
- Викторова И. А., Акимова М. А., Гришечкина И. А., Клинышков И. А. Поперечный миелит в дебюте системной красной волчанки (клиническое наблюдение) // Медицинский вестник Северного Кавказа. 2017. Т. 12. №1. С. 102-105.
- Белова А. Н., Шаленков И. В. Дифференциальная диагностика очаговых некомпрессионных поражений спинного мозга шейно-грудной локализации // Практическая медицина. 2013. №1(66). С. 31-37.
- Гуща А. О., Древаль М. Д., Арестов С. О., Кащеев А. А.Ламинопластика в лечении спондилогенной шейной миелопатии // Системный анализ и управление в биомедицинских системах. 2016. Т. 15. №4. С. 552-559.
- Говенько Ф. С., Бурак А. С. Гемангиобластома Нижнегрудного отдела спинного мозга, осложнившаяся обширной сирингомиелией, на фоне шейной миелопатии // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2017. Т. 9. №3. С. 41-44.
- Гуща А. О., Древаль М. Д., Юсупова А. Р., Арестов С. О., Петросян Д. В. Шейная спондилогенная миелопатия: 10 летний опыт лечения // Анналы клинической и экспериментальной неврологии. 2021. Т. 15. № 2. С. 21-28.
- Бывальцев В. А., Степанов И. А., Калинин А. А., Алиев М. А., Аглаков Б. М., Юсупов Б. Р., Шепелев В. В. Тотальная артропластика и передняя шейная дискэктомия с фиксацией: отдаленные результаты рандомизированного клинического исследования // Хирургия позвоночника. 2019. Т. 16. №1. С. 48-56.
- Хамидуллин Ф. Г., Ермолаев Ю. Ф., Петров С. И., Середа Э. В., Джумабаев А. Х., Карпов Т. А. Выбор методов стабилизации и показания к хирургическому лечению при дегенеративных процессах шейного отдела позвоночника // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2011. №1-2 (77). С. 94-99.
- Fujiyoshi T., Yamazaki M., Kawabe J., Endo T., Furuya T., Koda M., Konishi H. A new concept for making decisions regarding the surgical approach for cervical ossification of the posterior longitudinal ligament: the K-line // Spine. 2008. V. 33. №26. P. E990-E993. https://doi.org/10.1097/BRS.0b013e318188b300
- Киреева Н. С., Гуща А. О., Вершинин А. В., Шахпаронова Н. В., Корепина О. С. Эффективность комплексного лечения спондилогенной шейной миелопатии // Клиническая неврология. 2015. №2. С. 40-44.
- Чехонацкий А. А., Комлева Н. Е., Чехонацкий В. А., Бубашвили А. И. Некоторые особенности патогенеза течения, диагностики и лечения радикуло- и миелопатический синдромов остеохондроза шейного отдела позвоночника (обзор) // Саратовский научно-медицинский журнал. 2020. Т. 16. №1. С. 64-68.
- Хить М. А., Гуща А. О., Щекутьев Г. А., Никитин С. С. Шейная спондилогенная миелопатия: диагностика, лечение, прогноз // Вопросы нейрохирургии им. Н.Н. Бурденко.2012. Т. 76. №3. С. 75-80.
- Олейник Е. А., Олейник А. А., Олейник А. А., Иванова Н. Е., Орлов А. Ю. Клинико- цифровые параметры определения показаний к хирургическому лечению шейного остеохондроза // Российский нейрохирургический журнал имени профессора А.Л. Поленова. 2023. Т. 15. № 1. С. 46-51. https://doi.org/10.56618/2071–2693_2023_15_1_46
- Крутько А. В., Ахметьянов Ш. А. Хирургическое лечение миелопатии на уровне шейного отдела позвоночника на фоне полисегментарного дегенеративного стеноза позвоночного канала // Хирургия позвоночника. 2014. №4. С. 124-127.
- Яриков А. В., Перльмуттер О. А., Фраерман А. П., Смирнов И. И., Соснин А. Г., Мухин А. С., Симонов А. Е., Калинкин А. А., Котельников А. О., Хомченков М. В., Гарипов И. И. Осложнения хирургического лечения травм и заболеваний шейного отдела позвоночника на субаксиальном уровне // Врач. 2021. Т. 32. №12. С. 28-37. https://doi.org/10.29296/25877305-2021-12-04
- Бывальцев В. А., Сороковиков В. А., Калинин А. А., Белых Е. Г. Анализ результатов переднего шейного спондилодеза с использованием гибридного кейджа РСВ EVOLUTION за двухлетний период // Вопросы нейрохирургии им. Н.Н. Бурденко. 2013. Т. 77. №1. С. 37-45.
- Яриков Д. Е., Басков А. В. Передний доступ для стабилизации шейного отдела позвоночника // Нейрохирургия. 2000. №1-2. С. 32-39.
- Бывальцев В. А., Калинин А. А., Алиев М. А., Аглаков Б. М., Шепелев В. В., Кухарев А. В., Аджибеков Н. О., Сатардинова Э. Е., Комогорцев И. Е. Разработка персонифицированной нейрохирургической тактики при лечении пациентов с двухуровневым дегенеративным заболеванием шейных межпозвонковых дисков // Инновационная медицина Кубани. 2023. Т. 8. №1. С. 29-37. https://doi.org/10.35401/2541-9897-2023-26-1-29-37
- Хачикян А. Ф., Бывальцев В. А., Калинин А. А., Шепелев В. В., Белых Е. Г., Сороковиков В. А., Егоров А. А., Будаев А. Э. Анализ результатов хирургического лечения стеноза позвоночного канала шейного отдела позвоночника у пациентов с цервикальной миелопатией при использовании дистракционных тело замещающих протезов за трехлетний период // Материалы II съезда дорожных нейрохирургов с международным участием и научно-практической школы молодых ученых. 2015. С. 102-104.
- Кравцов М. Н., Люлин С. В., Кузнецов М. В., Гайдар Б. В., Свистов Д. В. Чрескожная Видеоэндоскопическая задняя цервикальная фораминотомия и дискэктомия при латеральных грыжах межпозвонковых дисков (обзор литературы и результаты собственных исследований) // Гений ортопедии. 2018. Т. 24. № 2. С. 240-251.
- Луцик А. А., Казанцев В. В. Хирургическое лечение пациентов с шейным остеохондрозом // Хирургия позвоночника. 2008. №4. С. 24-29.
- Бывальцев В. А., Степанов И. А., Алиев М. А., Аглаков Б. М., Юсупов Б. Р., Шепелев В. В. Комбинация тотальной артропластики и переднего шейного спондилодеза в хирургическом лечении двухуровневого дегенеративного заболевания шейных межпозвонковых дисков // Практическая медицина. 2018. №9. С. 69-73.
- Тилов А. Ж., Карабаев И. Ш., Поярков К. А., Хлебов В. В., Паликовский А. А. Влияние изменений шейного субаксиального лордоза на болевой синдром после одно-двухуровневых ACDF, при дегенеративно-дистрофических заболеваниях позвоночника // Журнал Неотложная хирургия им. И.И. Джанелидзе. 2022. №1 (6). С. 17-21.
- Бывальцев В. А., Калинин А. А., Белых Е. Г., Сороковиков В. А., Григорьев Е. Г. Анализ результатов хирургического лечения стеноза позвоночного канала шейного отдела у пациентов с цервикальной миелопатией за трехлетний период // Вертебрология в России: итоги и перспективы развития: Сборник тезисов V съезда хирургов-вертебрологов России. 2014. С. 40-42.
- Яриков А. В., Горбатов Р. О., Денисов А. А., Смирнов И. И., Фраерман А. П., Соснин А.Г., Перльмуттер О.А., Калинкин А.А. Применение аддитивных технологий 3D-печати в нейрохирургии, вертебрологии, травматологии и ортопедии // Клиническая практика. 2021. Т. 12. №1. С. 90-104.
- Яриков А. В., Горбатов Р. О., Перльмуттер О. А., Фраерман А. П., Соснин А. Г., Пардаев С. Н., Павлинов С. Е., Столяров И. И., Ежов И. Ю., Ким Е. Р., Мухин А. С., Синегуб А. В., Искровский С. В., Калинкин А. А., Гунькин И. В., Туткин А. В., Котельников А. О., Гарипов И. И., Хомченков М.В. Использование лазерных технологий 3D-печати в вертебрологии и нейрохирургии (анализ литературы и собственные результаты) // Научный медицинский вестник Югры. 2022. Т. 33. №3. С. 8-20.
- Яриков А. В., Горбатов Р. О., Шпагин М. В., Столяров И. И., Денисов А. А., Кабардаев Р. М., Фраерман А. П., Перльмуттер О. А., Мухин А. С. Применение трехмерного прототипирования и печати в реконструктивной нейрохирургии и вертебрологии (обзор литературы и собственные результаты) // Вестник неврологии, психиатрии и нейрохирургии. 2021. № 7. С. 534-556. https://doi.org/10.33920/med-01-2107-05
- Яриков А. В., Шпагин М. В., Горбатов Р. О., Соснин А. Г., Перльмуттер О. А., Фраерман А. П., Синегуб А. В., Искровский С. В., Столяров И. И., Цыбусов С. Н., Преснов Д. В. Применение лазерных методов 3D-печати в нейрохирургии // Бюллетень науки и практики. 2022. Т. 8. № 3. С. 174-190. https://doi.org/10.33619/2414-2948/76/19
- Яриков А. В., Горбатов Р. О., Столяров И. И., Смирнов И. И., Фраерман А. П., Соснин А. Г., Перльмуттер О. А. Применение аддитивных технологий 3D-печати в травматологии-ортопедии и нейрохирургии // Врач. 2021. Т. 32, №10. С. 8-16.
- Floyd T. A meta-analysis of autograft versus allograft in anterior cervical fusion // European Spine Journal. 2000. V. 9. P. 398-403. https://doi.org/10.1007/s005860000160
- Epstein N. E. Iliac crest autograft versus alternative constructs for anterior cervical spine surgery: Pros, cons, and costs // Surgical neurology international. 2012. V. 3. №Suppl 3. P. S143. https://doi.org/10.4103%2F2152-7806.98575
- Miller L. E., Block J. E. Safety and effectiveness of bone allografts in anterior cervical discectomy and fusion surgery // Spine. 2011. V. 36. №24. P. 2045-2050. https://doi.org/10.1097/BRS.0b013e3181ff37eb
- Ouro-Rodrigues E. et al. Allograft versus autograft in anterior cervical discectomy and fusion: A propensity-matched analysis // Cureus. 2022. V. 14. №2. https://doi.org/10.7759%2Fcureus.22497
- Chang H., Baek D. H., Choi B. W. Efficacy of zero-profile implant in anterior fusion to treat degenerative cervical spine disease: comparison with techniques using bone graft and anterior plating // Journal of Neurological Surgery Part A: Central European Neurosurgery. 2015. V. 76. №04. P. 268-273. https://doi.org/10.1055/s-0034-1389091
- Li Z., Zhao Y., Tang J., Ren D., Guo J., Wang H., Hou S. A comparison of a new zeroprofile, stand-alone Fidji cervical cage and anterior cervical plate for single and multilevel ACDF: a minimum 2-year follow-up study // European Spine Journal. 2017. V. 26. P. 1129-1139. https://doi.org/10.1007/s00586-016-4739-2
- Калинин А. А., Санжин Б. Б., Алиев М. А., Юсупов Б. Р., Аглаков Б. М., Шепелев В. В. Анализ результатов лечения пациентов с диско-радикулярным конфликтом шейного отдела позвоночника методом дискэктомии и переднего спондилодеза за четырехлетний период // Сибирский медицинский журнал (Иркутск). 2019. Т. 157. №2. С. 17-23.
- Лисицкий И. Ю., Лычагин А. В., Заров А. Ю., Коркунов А. Л., Черепанов В. Г., Вязанкин И. А. Первый опыт использования метода “skip corpectomy” при хирургическом лечении цервикальной спондилогенной миелопатии // Российский нейрохирургический журнал имени профессора А.Л. Поленова. 2022. Т. 14. №4. С. 52-56.
- Лисицкий И. Ю., Лычагин А. В., Заров А. Ю., Коркунов А. Л., Черепанов В. Г., Вязанкин И. А. Метод "skip corpectomy" при хирургическом лечении цервикальной спондилогенной миелопатии // Вопросы нейрохирургии им. Н.Н. Бурденко. 2023. Т. 87. №2. С. 41-47.
- Ashkenazi E., Smorgick Y., Rand N., Millgram M. A., Mirovsky Y., Floman Y. Anterior decompression combined with corpectomies and discectomies in the management of multilevel cervical myelopathy: a hybrid decompression and fixation technique // Journal of Neurosurgery: Spine. 2005. V. 3. №3. P. 205-209. https://doi.org/10.3171/spi.2005.3.3.0205
- Балязин-Парфенов И. В., Басанкин И. В., Балязин В. А., Балязина Е. В., Абу Авимер Р. Ш., Багаудинов А. Б., Гюльзатян А. А., Тулендинов Г. Р., Золотых Г. П., Халявкин Н. Н., Ефанов В. Г. Экспериментальная модель тубулярных ретракторов для передней чрескожной цервикальной дискэктомии (краткий обзор литературы и собственные исследования с кадаверным экспериментом) // Российский нейрохирургический журнал им. проф. А.Л. Поленова. 2023. Т. 15. №3. С. 7-12. https://doi.org/10.56618/2071-2693_2023_15_3_7
- Бывальцев В. А., Калинин А. А., Степанов И. А., Пестряков Ю. Я., Шепелев В. В. Анализ результатов применения тотальной артропластики межпозвонкового диска шейного отдела позвоночника протезом М6-С: мультицентровое исследование // Вопросы нейрохирургии им. Н.Н. Бурденко. 2017. Т. 81. №5. С. 46-55.
- Тома А. И., Абельцев В. П., Дорохов Д. С., Тома И. А. Возможности отечественных инновационных устройств и имплантатов в хирургии позвоночника. Опыт использования отечественного протеза межпозвонковых дисков "Эндокарбон" // Кремлевская медицина. Клинический вестник. 2018. №3. С. 106-116.
- Елисеев А. С., Боков А. Е., Млявых С. Г. Параметры сагиттального баланса после передней шейной дискэктомии со спондилодезом и артропластики эндопротезом «Эндокарбон»: результаты рандомизированного исследования // Современные технологии в медицине. 2022. Т. 14. №4. С. 50-59. https://doi.org/10.17691/stm2022.14.4.06
- Елисеев А. С., Млявых С. Г., Боков А. Е. Параметры сагиттального профиля и подвижность шейного отдела позвоночника после артропластики и их влияние на ограничение жизнедеятельности из-за боли в шее: промежуточные результаты исследования // Современные проблемы науки и образования. 2022. №2. С. 116. https://doi.org/10.17513/spno.31622
- Мереджи А. М., Орлов А. Ю., Назаров А. С., Беляков Ю. В. Перкутанная полностью эндоскопическая задняя цервикальная фораминотомия и дискэктомия при латеральных грыжах и стенозах // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2021. Т. 13. №S1. С. 22.
- Климов В. С., Рзаев Д. А., Летягин В. Г., Евсюков А. В., Лопарев Е. А. Оценка эффективности передней цервикальной фораминотомии в лечении пациентов с монорадикулярным синдромом // Нейрохирургия. 2017. №2. С. 12-20.
- Гуща А. О., Хить М. А., Арестов С. О. Дифференцированное хирургическое лечение шейной спондилогенной миелопатии // Нервные болезни. 2012. № 1. С. 39-43.
- Магомедов Ш. Ш., Мытыга П. Г. Повторная ламинопластика шейного отдела позвоночника при прогрессирующей оссификации задней продольной связки: клинический случай // Вопросы нейрохирургии им. Н.Н. Бурденко. 2023. Т. 87. №1. С. 90-95.
- Гуща А. О., Шевелев И. Н., Шахнович А. Р., Сафронов В. А., Арестов С.О.Дифференцированное хирургическое лечение стенозов позвоночного канала на шейном уровне // Хирургия позвоночника. 2006. №4. С. 47-54.
- Лисицкий И. Ю., Лычагин А. В., Заров А. Ю., Коркунов А. Л., Черепанов В. Г., Вязанкин И. А. Успешное хирургическое лечение пациента с цервикальной миелопатией на фоне оссификации задней продольной связки: редкое клиническое наблюдение и обзор литературы // Вопросы нейрохирургии им. Н.Н. Бурденко. 2021. Т. 85. № 4. С. 69-76.
- Singrakhia M. D., Malewar N. R., Singrakhia S. M., Deshmukh S. S. Cervical Laminectomy with Lateral Mass Screw Fixation in Cervical Spondylotic Myelopathy // Indian journal of orthopaedics. 2017. V. 51. P. 658-665. https://doi.org/10.4103/ortho.IJOrtho_266_16
- Древаль М. Д., Гуща А. О. Хирургическое лечение шейной спондилогенноймиелопатии методом ламинопластики: обзор литературы // Хирургия позвоночника. 2015. Т. 12. №2. С. 44-50.
- Суфианов А. А., Бурцев А. В., Набиев Д. Н., Магомедова А. Ш., Суфианов Р. А., Карсанова М. Т., Питеров В. А. Отдаленные результаты лечения многоуровневого стеноза позвоночного канала в шейном отделе позвоночника методом билатеральной костно-пластической декомпрессивной ламинопластики с одномоментной фораминотомией // Гений ортопедии. 2023. Т. 29. №3. С. 285-292. https://doi.org/10.18019/1028-4427-2023-29-3-285-292
- Sani S., Ratliff J. K., Cooper P. R. A critical review of cervical laminoplasty // Neurosurgery Quarterly. 2004. V. 14. №1. P. 5-16.
- Бывальцев В. А., Калинин А. А., Алиев М. А., Шепелев В. В., Юсупов Б. Р., Аглаков Б. М. Мета Анализ Проспективных исследований, сравнивающих результаты использования ламинопластики и ламинэктомии с инструментальной фиксацией при хирургическом лечении пациентов с многоуровневыми дегенеративными заболеваниями шейного отдела позвоночника // Вестник Российской академии медицинских наук. 2020. Т. 75. №1. С. 54-68. https://doi.org/10.15690/vramn1160
- Григорян Ю. А., Степанян М. А., Онопченко Е. В., Кадин Л. А., Химочко Е. Б., Лунина Е. С. Микрохирургическая передняя фораминотомия при спондилогенной цервикальной радикулопатии // Вопросы нейрохирургии им. Н.Н. Бурденко. 2008. №2. С. 31-35.
- Ruetten S., Komp M., Merk H., Godolias G. A new full-endoscopic technique for cervical posterior foraminotomy in the treatment of lateral disc herniations using 6.9-mm endoscopes: prospective 2-year results of 87 patients // min-Minimally Invasive Neurosurgery. 2007. V. 50. №04. P. 219-226. https://doi.org/10.1055/s-2007-985860
- Елисеев А. С., Боков А. Е., Млявых С. Г. Дегенеративные изменения межпозвонковых суставов шейного отдела позвоночника после переднего межтелового спондилодеза и эндопротезирования межпозвонкового диска // Хирургия позвоночника. 2023. Т. 20. №3. С. 72-78. https://doi.org/10.14531/ss2023.3.72-78
- Яриков А. В., Павлинов С. Е., Гарипов И. И., Логутов А. О., Фраерман А. П., Перльмуттер О. А., Калинкин А. А., Павлова Е. А., Соснин А. Г., Волков И. В., Симонов А. Е., Котельников А. О. Спинальный стеноз на шейном уровне: клиника, диагностика и лечение // Врач. 2024. Т. 35. №8. С. 22-29.


